Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Boletín de la Sociedad Argentina de Botánica
On-line version ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.48 no.2 Córdoba Aug. 2013
ANATOMÍA Y MORFOLOGÍA VEGETAL
Indumento, nectarios extraflorales y anatomía foliar en Bignoniáceas de la Argentina
Ana M. Gonzalez1
Investigadora CONICET, Instituto de Botánica del Nordeste, CC 209, Corrientes, Argentina, e-mail: anitama39@gmail.com
Resumen: La presente contribución comprende el estudio comparativo de la anatomía foliar de 50 especies de Bignoniaceae que crecen en Argentina. El objetivo es analizar las variaciones anatómicas a fn de contribuir en la identifcación de las especies y evaluar los caracteres en la taxonomía de la familia. Las hojas fueron estudiadas en vista superfcial y en cortes seriados, transversales y paradermales, por medio de microscopía óptica y electrónica de barrido. Entre las características que se destacan por su valor diagnóstico se describen: posición y estructura anatómica de los nectarios extraforales, complemento tricomático, número de capas de la epidermis, tipo de mesóflo y la composición del margen de la hoja. Estas características, solas o en combinación pueden ser útiles en la identifcación de especies. Los resultados proporcionan un juego completo de caracteres foliares típicos de la familia.
Palabras clave: Anatomía, Bignoniaceae, Tricomas, Nectarios extraforales, Paraveinal.
Summary: Indument, extraforal nectaries and foliar anatomy in Bignoniaceae from Argentine. A comparative anatomical study was undertaken on the leaves of 50 Argentinean Bignoniaceae species in order to investigate anatomical variations which may be useful in species identifcation and to evaluate their signifcance in the taxonomy of the family. Leaves were analyzed on surface view and in serial sections, cross and paradermal, using optical and scanning electron microscopy. Among the features that stand out for their diagnostic value are: position and anatomical structure of the extraforal nectaries, trichome complement, number of layers of epidermis, mesophyll type and composition of leaf margin. These characteristic, alone or in combination may be useful in species identifcation. The results provide a comprehensive leaf anatomical character-set typical for the family.
Key words: Anatomy, Bignoniaceae, Trichomes, Extraforal nectaries, Mesophyll, Paraveinal.
Introducción
Bignoniaceae es una familia de plantas de distribución subtropical a tropical, con algunos representantes en climas templados. Consta de 827 especies en 82 géneros (Lohmann & Ulloa Ulloa, 2007). En la fora argentina se encuentran representados 24 géneros con 57 especies (Arbo, 1999), incluyendo árboles, arbustos y lianas; además existen 7 especies exóticas adventicias o cultivadas como ornamentales (Fabris, 1959; Hurrell et al., 2012).
Gentry (1980) menciona diversos caracteres vegetativos de importancia en la taxonomía de esta familia. Entre los caracteres foliares señala el tipo de hoja, la presencia de zarcillo terminal, la consistencia del margen foliar y especialmente el tipo de tricoma. Recientemente, Grose & Olmstead (2007) realizando flogenia molecular reestructuraron el género Tabebuia Gomes ex DC., restableciendo el género Handroanthus Mattos, y proponiendo una nueva clasifcación; en la clave provista el indumento es uno de los caracteres de mayor peso.
A pesar que no existe ningún trabajo que trate de manera inclusiva los caracteres anatómicos en la familia, muchos estudios taxonómicos los incluyen, por ejemplo Lohmann (2006) utiliza como sinapomorfías morfológicas la presencia de hojas pellucid-punctate o glándulas pelúcidas o inclusive la presencia de glándulas denominadas volcano shaped en fores y frutos.
Recientemente Zapater et al. (2009) revisaron las especies argentinas de Tabebuia y Handroanthus y utilizaron el indumento como uno de los caracteres de importancia taxonómica. Similar estudio fue realizado por Silva et al. (2009) en los ipés (lapachos) brasileros, destacando la dificultad del reconocimiento de estas especies al estado vegetativo.
Con respecto a las estructuras glandulares, Seibert (1948) enfatizó la importancia de este carácter y propuso una clasificación de las estructuras secretoras en la familia. Gentry (1980) señala la existencia de glándulas, pero sólo describe como nectario al disco que rodea la base del ovario. En la familia Bignoniaceae ha sido muy bien documentada la presencia y distribución de los nectarios forales, sin embargo el análisis de las estructuras secretoras que se encuentran en las hojas y otras partes vegetativas como tallo y pseudoestípulas sólo se realizó en algunas pocas especies (Elias & Prance, 1978; Rivera, 1996, 2000).
El presente estudio tiene como objetivos: 1) describir la anatomía foliar, 2) analizar el tipo de indumento presente, teniendo en consideración su ontogenia, 3) documentar la estructura de los nectarios presentes en las hojas, a fn de identifcar los caracteres de importancia taxonómica en las especies de Bignoniáceas que crecen en Argentina.
materIales y métodos
Para el presente trabajo se coleccionó material fresco de 50 especies, cuya procedencia se encuentra en el Anexo. De los 24 géneros y 57 especies citados por Arbo (1999) para la Argentina, no se incluyeron representantes de los géneros Argylia D. Don, Campsidium Seem., Eccremocarpus Ruiz & Pav. o Tanaecium Sw. en la presente contribución, ya que por su distribución no pudieron ser coleccionadas. Si se agregaron especies exóticas cultivadas como ornamentales: Handroanthus chrysotrichus, Tabebuia roseo-alba, Catalpa bignonioides, Pandorea jasminoides, y también especies naturalizadas como Tecoma capensis, Campsis radicans y Podranea ricasoliana (Hurrell et al., 2012). Para la delimitación taxonómica se sigue a Arbo (1999) en términos generales, aceptando la transferencia de algunas especies de Tabebuia a Handroanthus según los aportes flogenéticos de Grose & Olmstead (2007, 2007a) y la revisión taxonómica para el género Pithecoctenium realizada por Pool (2007).
Se coleccionaron hojas y yemas, fueron fjadas en FAA (alcohol 70º, ac. acético y formol, 90:5:5). El material fue incluido en parafna según técnica de Johansen (1940) modifcada por Gonzalez & Cristóbal (1997). Se realizaron cortes seriados, transversales, longitudinales y paradermales con micrótomo rotativo, con espesores de 10-12 µm. Se empleó doble tinción safranina – Azul de Astra (Luque et al. 1996). De cada especie se analizaron 5 hojas, para la anatomía foliar se utilizó siempre la zona media del folíolo. Las observaciones y fotografías se realizaron con microscopio óptico Leica DM LB2 equipado con módulo fotográfco digital. Material fresco fue sometido a pruebas histoquímicas con Sudan III para compuestos lipídicos y Lugol para la detección de almidón (Ruzin, 1999).
Para las observaciones con microscopio electrónico de barrido (MEB) el material fjado en FAA fue secado a punto crítico y metalizado con Oro-Paladio. Las observaciones se realizaron en un MEB Jeol LV 5800 a 20 kV del Servicio de Microscopía Electrónica de la Universidad Nacional del Nordeste, Corrientes.
Los aparatos estomáticos se identificaron siguiendo la clasifcación de Wilkinson (1979) y los tipos de tricomas de acuerdo a Payne (1978) y Theobald et al. (1979).
resultados
Las hojas son simples y agrupadas en braquiblastos en T. nodosa; en las restantes especies estudiadas son compuestas y se disponen opuestas; son palmadas en Tabebuia y Handroanthus, pinnadas con 2-3 folíolos en las lianas y 3-15 folíolos en Tecoma y bipinnadas en Jacaranda. En las hojas pinnadas de las lianas el folíolo terminal está transformado en zarcillo, pudiendo ser simple, trigarfado, tri-o multiflamentado o estar ausente en hojas jóvenes. Las pseudoestípulas pueden ser inconspicuas a foliosas. caracteres foliares correspondientes a la anatomía del mesoflo.
En la Tabla 1 se registran los datos del indumento y nectarios extraflorales, y en la Tabla 2 los caracteres foliares correspondientes a la anatomía del mesofilo.
Tabla 1: Indumento y NEFs.

Tabla 2: Anatomía foliar.

Indumento: Todas las especies presentan un complemento de tricomas formados por pelos glandulares y eglandulares.

Fig. 1. Tricomas. A: Arrabidaea selloi, tricoma glandular pedicelado. B-F: Tricomas glandulares sésiles; B Pithecoctenium carolinae; C: Cybistax antisyphillitica; D: Parabignonia chodatti; E: Pyrostegia venusta; F Handroanthus chrysotrichus; G: Handroanthus heptaphyllus, ontogenia de tricomas glandulares sésiles. H-I Tricomas bicelulares cortos; H: Cuspidaria convoluta; I: Jacaranda cuspidifolia. J-K: Tricomas bicelulares largos; J: Jacaranda micrantha; K: Jacaranda puberula. L-O: Tricomas pluricelulares uniseriados; L: Cuspidaria convoluta; M: Amphilophium vautheri. N-O: Cybistax antisyphillitica. Escalas: A, I-K, N-O: 50 µm; B-H, L-M: 25 µm.
Tricomas glandulares: están constituidos por un pie de 2-3 células situadas entre las células epidérmicas y un cuerpo compuesto por un pedículo que eleva una porción apical o cabezuela multicelular (Fig. 1 A-G). Reaccionan a la presencia de compuestos lipídicos en las células de la cabezuela. Se pueden diferenciar dos tipos de tricomas glandulares:
- Glandulares pedicelados: se caracterizan por poseer un pedículo de hasta 5 células (Fig. 1 A). Se caen antes de la madurez de la hoja, por lo que es más frecuente observarlos en hojas jóvenes y especialmente sobre las venas.
- Glandulares sésiles: son los más frecuentes y están presentes en hojas maduras. Pueden encontrarse a nivel de la epidermis o hundidos en una depresión de la misma (Fig. 1 B-D). El pedículo está formado por una sola célula de forma obcónica que soporta la cabezuela (Fig. 1 E-F). Esta célula posee paredes radiales engrosadas, el citoplasma frecuentemente presenta plasmólisis en banda. La cabezuela está constituida por 8-30 células dispuestas radialmente, poseen paredes delgadas y citoplasma denso, granular. Poseen una cutícula lisa, engrosada en la zona del pedículo. A la madurez del tricoma la cutícula que cubre la cabezuela se distiende, posiblemente como producto de la secreción (Fig. 1 F). Ontogenia: ambos tipos de tricomas glandulares presentan el mismo plan básico de desarrollo (Fig. 1 G), se originan a partir de una célula protodérmica que se divide periclinalmente, la célula inferior sufre una o dos divisiones anticlinales constituyendo el pie que se ubica entre las células epidérmicas. La célula apical sufre una mitosis dando dos células desiguales: una basal pequeña y una apical de mayor tamaño; la basal adquiere forma obcónica formando la célula que soporta la cabezuela, mientras que la apical se vuelve a dividir radialmente numerosas veces completando la formación de la cabezuela. En el caso de los tricomas pedicelados la célula inferior sufrirá divisiones periclinales para formar las células del pedículo.
Tricomas eglandulares: carecen de cabezuela secretora (Fig. 1 H-O). Se encuentran diversos tipos:
- Bicelulares: son tricomas formados por una célula basal de la misma altura que las epidémicas y una apical aguzada, la cual puede ser corta o larga. Los tricomas cortos son los más frecuentes (Fig. 1 H-I), siendo abundantes sobre las venas. Los tricomas largos se encontraron exclusivamente en especies de Jacaranda (Fig. 1 J-K). La cutícula puede ser lisa o suavemente estriada.
- Uniseriados: (Fig. 1 L-O) Tienen pie 1-2 seriado y cuerpo de 3-7 células dispuestas en una sola serie, la apical con extremo aguzado, paredes delgadas y citoplasma claro. Cutícula lisa o estriada.
- Dendroides: son tricomas que poseen un eje principal con ramifcaciones, pueden tener entre tres y hasta 15 células (Fig. 2 A-F). Cada célula presenta una porción basal que forma el cuerpo del tricoma y una porción distal que constituye el brazo, con ápice aguzado. Son células de paredes delgadas, citoplasma claro y están cubiertos por una cutícula lisa. Su densidad es notablemente alta en los primordios foliares, manteniéndose inclusive en hojas adultas de ciertas especies.

Fig. 2. Tricomas. A-B: Tricomas dendroides; A: Handroanthus impetiginosus; B: Pithecoctenium carolinae. C-D: Handroanthus chrysotrichus, C: tricoma estrellado, D: tricoma dendroide. E-F: Handroanthus albus, tricomas dendroides. G: Handroanthus ochraceus, tricoma porrecto-estrellado. H-N: Escamas peltadas; H-J: Tabebuia roseo-alba, H: vista superfcial, I: CT, J: CT de estadios ontogenéticos iniciales. K-M: Tabebuia aurea, K: vista superfcial de escamas jóvenes, L: hipoflo maduro, M: CT escamas jóvenes y maduras. N: Tabebuia nodosa. Escalas: A-B, K-N: 50 µm; C-G: 100 µm; H-J: 10 µm.
- Estrellados: son una variante de los tricomas dendroides, donde la porción basal de cada célula es muy breve, por lo que le otorga la apariencia de un tricoma estrellado (Fig. 2 C). En H. ochraceus el cuerpo del tricoma es breve y el brazo apical notablemente erecto, dando la apariencia de un tricoma porrecto-estrellado (Fig. 2 G).
- Escamas peltadas: (Fig. 2 H-N): son tricomas refringentes y cubren totalmente la superfcie foliar (Figs. 2 L; 4 I, K). Están constituidos por un pie de 1-6 células, una célula basal y cabezuela, pedicelo ausente o de hasta 2 células; las células de la cabezuela se disponen radialmente ubicándose en un solo plano, paralelas a la superfcie foliar (Fig. 2 I-J). Cada célula de la cabezuela presenta la pared distal aguzada, por lo que en vista superfcial el tricoma adquiere contorno estrellado (Fig. 2 H, N). Las células de la cabezuela presentan citoplasma claro, sin características secretoras (Fig. 2 I-J). El tricoma está cubierto por una cutícula lisa, que se observa distendida en tricomas maduros (Fig. 2 I). Ontogenia: estos tricomas poseen un plan de desarrollo inicial similar al de los tricomas glandulares, completan su desarrollo antes que los tejidos del mesoflo, formando un estrato protector de los primordios foliares (Figs. 2 J-K; 6 J). Al completar su formación, las células de la cabezuela colapsan (Fig. 2 M). No reaccionan a pruebas histoquímicas realizadas con Sudán III ni Lugol, por lo que se los considera eglandulares por la ausencia de características secretoras.
Nectarios Extraforales (NEFs): Están presentes en todas las especies estudiadas. Los NEFs se localizan en los folíolos, con predominancia en el tercio inferior de los mismos, en la zona cercana a la vena media, ya sea dispersos o agrupados en campos glandulares (Fig. 3 A-B); en el hipoflo de las pseudoestípulas (Fig. 3 C) o en los nudos donde forman campos glandulares interpeciolares, donde su número varía desde 7-8 a más de 50 glándulas (Fig. 3 D). En material fresco se observó una secreción clara, siendo muy visitados por hormigas que recorren las plantas en busca del néctar (Fig. 3 E).

Fig. 3. Nectarios extraforales. A-B: NEFs en hipoflo de folíolos; A: Macfadyena unguiscati; B: Handroanthus ochraceus. C: Adenocalymma marginatum, NEFs en pseudoestípulas. D: Dolichandra cynanchoides, nudo mostrando campo glandular interpeciolar. E: Handroanthus albus, hormiga libando néctar en NEFs de epiflo. Escalas: A: 1 cm; B-D: 1 mm, E: 0.5 mm.
Los NEFs son estructuras pateliformes, de contorno circular a discoide (Figs. 3 B; 4 A-G), o cupuliformes con los rebordes elevados (Fig. 4 H). Su diámetro varía entre 110-680 µm. Pueden estar ligeramente elevados de la superfcie o ubicarse en una depresión de la epidermis, quedando entonces la superfcie secretora al mismo nivel que la epidermis del órgano donde se localizan. Pueden encontrarse expuestos (Fig. 4 G-I) u ocultos, parcial o totalmente por el indumento (Fig. 4 J-L).
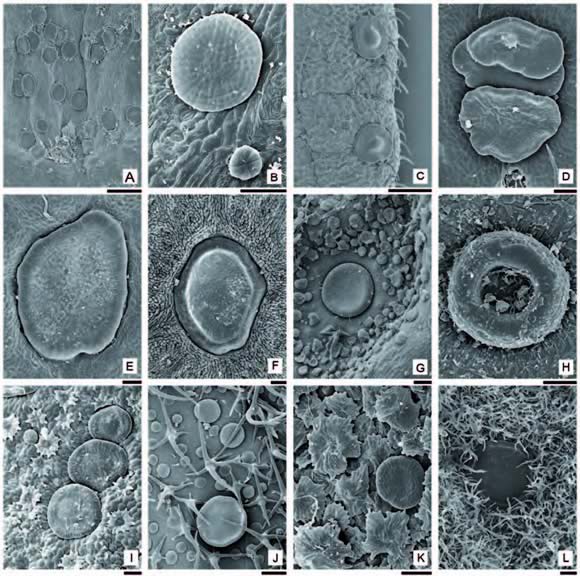
Fig. 4. Nectarios extraforales (MEB). A: Macfadyena dentata, NEFs de campo glandular interpeciolar. B-L: NEFs de láminas foliares; B: Jacaranda micrantha, NEF y tricoma glandular sésil en hipoflo; C: Jacaranda mimosifolia, epiflo; D: Handroanthus chrysotrichus, epiflo; E: Handroanthus heptaphyllus, epiflo; F-G: Handroanthus impetiginosus, F: epiflo, G: hipoflo; H: Campsis radicans, hipoflo; I: Tabebuia roseo-alba, NEFs y escamas peltadas en hipoflo; J: Handroanthus chrysotrichus, NEF y tricomas estrellados en hipoflo; K: Tabebuia aurea, NEF y escamas peltadas en hipoflo; L: Handroanthus albus, NEF y tricomas estrellados en hipoflo. Escalas: A: 0.25 mm; B: 50 µm C: 25 µm; D-I, K: 50 µm; J, L: 100 µm.
Independientemente de la posición que ocupan en la planta, comparten una estructura anatómica común: están constituidos por una epidermis secretora y un estrato nectarífero basal (Fig. 5). La epidermis secretora está formada por una empalizada de células columnares, de 45-(56)-91 µm de altura, con citoplasma denso y núcleo central (Fig. 5 I-L), se disponen apretadamente sin dejar espacios intercelulares (Fig. 5 F, P).
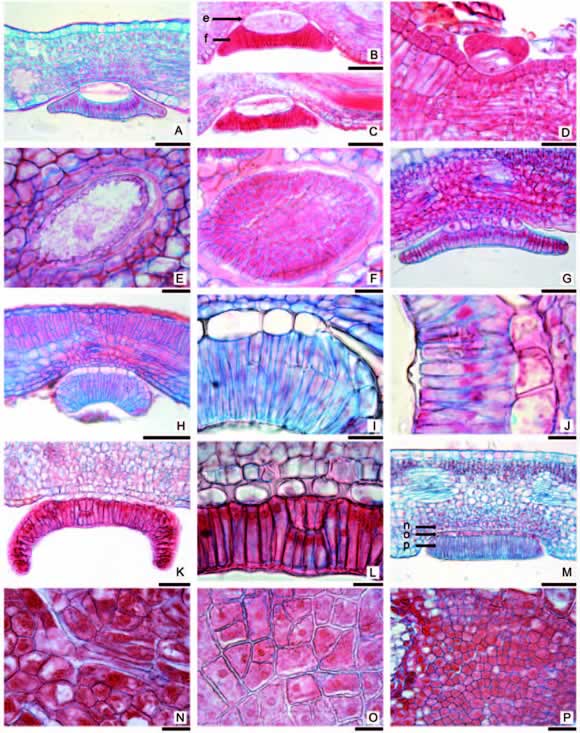
Fig. 5. Nectarios extraforales (microscopía óptica) en transcortes (CT) y cortes paradermales (CP). A: Pyrostegia venusta, CT. B-C: Dolichandra cynanchoides, CT. B: Célula basal turgente. C: Célula basal con plasmólisis en banda. D: Tabebuia aurea, CT con NEF en desarrollo. E-F: Dolichandra cynanchoides, CP a niveles indicados en foto B. E: Célula basal y F: Epidermis secretora. G: Jacaranda micrantha, CT. H-I: Campsis radicans, CT. J: Pithecoctenium carolinae, CT detalle de NEF. K-L: Handroanthus pulcherrimus, CT. M-P: Adenocalymma marginatum. M: CT NEF indicando niveles de CP mostrados en fotos N-P. Escalas: A-H, M: 50 µm; I-J, L, N-P: 10 µm; K: 20 µm.
De acuerdo al estrato nectarífero basal se distinguen NEFs simples y complejos. En el NEF simple el estrato nectarífero basal está formado por una única célula, aplanada tangencialmente (Fig. 5 A-D) y de forma subcircular en corte paradermal (Fig. 5 E). Posee citoplasma claro, una gran vacuola central y un núcleo conspicuo de 9-(11)-14 µm de diámetro (Fig. 5 B). Las paredes tangenciales son delgadas y las radiales poseen engrosamientos, con una fuerte impregnación de cutina, difícil de diferenciar de la pared celular. Es frecuente observar esta célula con plasmólisis en banda, donde la membrana celular queda adherida al engrosamiento de las paredes radiales (Fig. 5 C). En corte paradermal las paredes radiales presentan excrecencias conspicuas hacia el lumen celular (Fig. 5 E).
En los NEFs complejos el estrato basal es una capa pluricelular uniestrata, formada por células cuadrangulares a rectangulares, de citoplasma denso y granuloso y núcleo conspicuo (Fig. 5 G-M). En corte transversal de NEF, las paredes tangenciales son delgadas, mientras que las paredes radiales presentan la zona basal engrosada y lignifcada y la apical delgada (Fig. 5 I-J, L), no se aprecian comunicaciones intercelulares en esta zona engrosada. En corte paradermal estas células son poligonales y las paredes radiales se aprecian irregularmente engrosadas (Fig. 5 O).
Una cutícula delgada y lisa cubre toda la superfcie de la glándula. En glándulas de hojas viejas se observa la cutícula separada de las células secretoras en la zona central del NEF. No hay ruptura o adelgazamiento de la misma, ni poros evidentes para la salida del néctar (Fig. 5 J).
Independientemente de la estructura del mesoflo de la hoja, la zona donde se inserta el NEFs está formada por células más pequeñas y con citoplasma notablemente más denso que las del clorénquima, de naturaleza secretora (Fig. 5 A, H, M). En hojas con NEFs de gran tamaño, todo el mesoflo que soporta el NEF tiene dichas características, no presenta diferenciación en parénquima en empalizada y lagunoso (Fig. 5 G, K). Esta zona bajo el NEF presenta siempre un haz vascular, con ramifcaciones foemáticas hacia la base del nectario, fnalizando un par de capas debajo del estrato basal (Fig. 5 H, K, N).
Anatomía foliar: Epidermis: es uniestrata en la cara abaxial (Figs. 6, 8). En la mayoría de las especies la epidermis adaxial es uniestratifcada (Figs. 6 A; 8 A, E, I, Q; 9 J), en Pandorea jasminoides, T. roseo-alba (Fig. 6 G-I) y en todas las especies de Handroanthus la epidermis adaxial tiene 2-4 capas (Figs. 6 B-F; 8 M). En transcorte dichas capas no están claramente defnidas, están formadas por células irregulares, en algunos sectores sólo posee un estrato, especialmente en el sitio de inserción de los tricomas (Fig. 6 C, H). El análisis ontogenético permitió corroborar que se trata de una epidermis pluriestratifcada, formada a partir de divisiones periclinales de la protodermis (Fig. 6 C-I).

Fig. 6. Epidermis en transcorte de hoja. A: Catalpa bignonioides. B: Handroanthus ochraceus. C-K: diversos estadios ontogenéticos. C-F: Handroanthus heptaphyllus. G-l: Tabebuia roseo-alba. J-K: Tabebuia áurea. L: Amphilophium pannosum. Escalas: A-B, H-L: 50 µm; C-G: 20 µm.
En T. nodosa (Fig. 9 M) y T. aurea (Fig. 6 J-K) la epidermis adaxial también posee sectores con 2 a 3 capas, pero dichos estratos subepidérmicos son extensiones de células parenquimáticas de las vainas del haz, los cuales alcanzan las epidermis y pueden conectarse entre sí confundiéndose con una hipodermis o epidermis pluriestrata. En Amphilophium pannosum también hay sectores de la cara adaxial donde se observan 2-3 estratos subepidérmicos, ubicados en dirección a los haces vasculares (Fig. 6 L), siendo células colenquimáticas de la vaina del haz. El análisis ontogenético confrmó que en estas tres especies la epidermis es uniestratifcada (Fig. 6 J-K).
En vista superficial las células epidérmicas propiamente dichas presentan contorno recto, ondulado o con ondulaciones pronunciadas en forma de letra griega Ω, carácter que puede variar entre ambas caras de la lámina (Fig. 7 A-J). La cutícula varía en su diseño en las distintas especies, siendo lisa o estriada (Fig. 7 K-P).
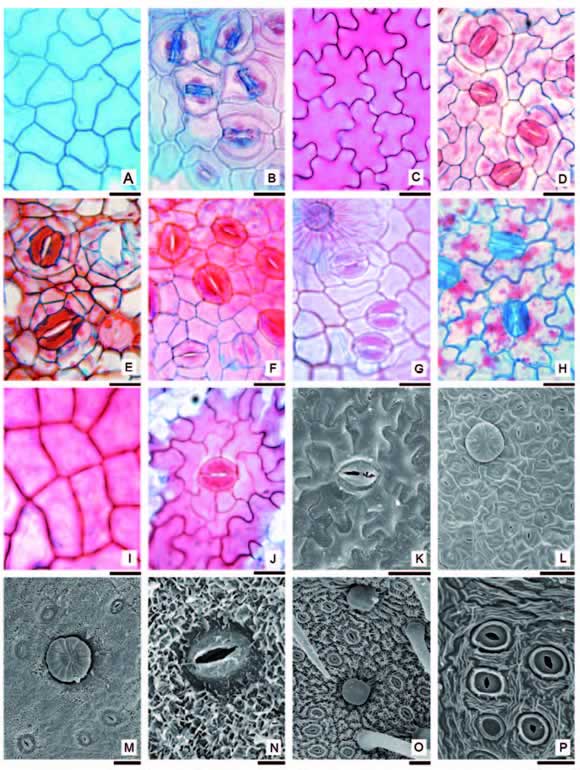
Fig. 7. Epidermis en vista superfcial. A-B: Adenocalymma marginatum. A: Epiflo. B: Hipoflo. C-D: Dolichandra cynanchoides. C: Epiflo. D: Hipoflo. E: Tabebuia aurea. F: Handroanthus heptaphyllus. G: Tabebuia nodosa. H: Arrabidaea corallina. I-J: Pyrostegia venusta. I: Epiflo. J: Hipoflo. K: Jacaranda micrantha. L: Adenocalymma marginatum, hipoflo con tricoma capitado sésil. M-N: Dolichandra cynanchoides. M: Hipoflo con tricoma capitado sésil. N: Detalle de estoma y cutícula. O: Jacaranda mimosifolia, hipoflo con tricomas bicelulares largos y capitado sésil. P: Jacaranda cuspidifolia. Escalas: A-K, O-P: 20 µm; L-M: 50 µm; N: 5 µm.
Los estomas están restringidos a la epidermis inferior, solo T. garrocha y H. ocraceaus (Fig. 6 B) tienen hojas anfestomáticas. Los estomas pueden estar al mismo nivel de la epidermis o elevados, siendo un carácter muy notable en A. pannosum (Fig. 6 L). Los estomas se encuentran dispersos en la lámina foliar; están formados por células oclusivas de contorno arriñonado, las células anexas presentan escasa diferenciación de las restantes células epidérmicas propiamente dichas (Fig. 7). El estoma predominante es el tipo anomocítico (Fig. 7 D-H, J-K), a pesar que hay especies donde se pueden observar estomas paracíticos (Fig. 7 B), anisocíticos o ciclocíticos, estos dos últimos siempre se encuentran en combinación con los de tipo anomocítico (Fig. 7 D).
El mesofilo varía en su organización entre las diversas especies. Predominan las especies con mesoflo dorsiventral (Figs. 6 A; 9 K), el parénquima en empalizada puede estar representado por una o dos capas de células alargadas dispuestas anticlinalmente con respecto a la epidermis (Fig. 8 A), o como ocurre en algunas especies estar formado por columnas de hasta cinco células cuadrangulares (Fig. 8 E). El parénquima esponjoso varía en el desarrollo alcanzado por los espacios intercelulares, se destaca A. marginatum que posee el parénquima esponjoso formando grandes cámaras de aire, coincidentes con los estomas (Fig. 8 E). También se encontraron especies con mesofilo isobilateral, con parénquima en empalizada en ambas caras, el ubicado en la cara adaxial es de mayor desarrollo, el situado hacia la cara abaxial presenta células tabulares con paredes provistas de papilas y mayor cantidad de espacios intercelulares (Figs. 6 F; 8 M, Q; 9 N).
Tecoma garrocha y D. cynanchoides presentan mesoflo homogéneo, formado por células cortas en empalizada (Fig. 8 U).
En numerosas especies de hábito arbóreo se encontró mesofilo paraveinal, el mismo se caracteriza por presentar un estrato medio formado por una sola capa de células de diferente forma y posición que las de los clorénquimas presentes en ambas caras, dichas células conectan los haces vasculares entre sí de modo paralelo a la lámina foliar. Tecoma capensis posee mesoflo dorsiventral y el estrato paraveinal está formado por una capa de grandes células isodiamétricas interpuesta entre el parénquima en empalizada y el lagunoso (Fig. 8 I-L). En hojas de mesoflo isobilateral como las especies de Handroantus y T. nodosa, el estrato paraveinal también está constituido por células de mayor tamaño que las de las empalizadas subepidérmicas (Fig. 8 M-T). La disposición del estrato paraveinal se aprecia perfectamente en los cortes paradermales de hoja, donde se puede ver la relación de tamaños celulares y espacios intercelulares en las diversas capas, tanto en hoja con mesoflo dorsiventral: parénquima empalizada/ parénquima paraveinal/ parénquima lagunoso (Fig. 8 J-L), como en hojas de mesoflo isobilateral: parénquima empalizada/parénquima paraveinal/ parénquima empalizada (Fig. 8 N-P, R-T).

Fig. 8. Mesoflo, las cinco primeras especies se muestran 1o en transcorte, 2o en corte paradermal (CP) de parénquima clorofliano de cara superior, 3o CP al nivel de haces vasculares y 4o CP de parénquima clorofliano de cara inferior. A-D: Arrabidaea triplinervia, mesoflo dorsiventral. E-H: Adenocalymma marginatum, mesoflo dorsiventral. I-L: Tecoma capensis, mesoflo dorsiventral. M-P: Handroanthus chrysotríchus, mesofilo isobilateral. Q-T: Tabebuia nodosa, mesofilo isobilateral. U: Dolichandra cynanchoides, mesoflo homogéneo, CT. En las fotos I, M, Q, el estrato paraveinal se indica con fecha. Escalas: 20 um.
La vena media se analizó siempre por transcorte de la mitad de la lámina, y varía entre las especies, pudiendo estar formada por un haz único en forma de arco (Fig. 9 A), un doble arco formado por haces vasculares colaterales dispuestos apretadamente (Fig. 9 B) o una eustela de haces colaterales, separados por estrechas bandas de parénquima fundamental (Fig. 9 C-G). Dado que frecuentemente hay desarrollo de cámbium y tejidos conductores secundarios, la vena media puede presentarse como una sifonoestela ectofoica (Fig. 9 H-I),

Fig. 9. Hoja en transcorte. A-l: Vena media, A: Jacaranda mimosifolia, B: Dolichandra cynanchoides, C: Handroanthus chrysotríchus. D-E: Tabebuia nodosa, D: CT, E: Detalle vena media. F-G: Tynanthus micranthus, F: CT, G: Detalle. H-l: Tecoma stans, H: CT, I: Detalle. J-L: Detalle de mesoflo con haces menores, J: Arrabidaea chica. K-L: Arrabidaea triplinervia. M-O: Detalles de márgenes foliares, M: Handroanthus ochraceus, N: Adenocalymma marginatum, O: Tabebuia nodosa. Escalas: A-B, E, G, I: 50 µm; C, H: 200 µm; D, F: 100 µm; J-O: 20 µm.
El sistema vascular de la vena media puede presentarse rodeado por parénquima fundamental (Fig. 9 A), poseer casquetes de fbras perifoemáticas (Fig. 9 B-G), en algunas especies también hay eslerénquima intraxilemático hacia la cara adaxial de la lámina (Fig. 9 F-G); también es frecuente la presencia de células con cristales, tanto prismáticos como drusas. Como tejido de sostén además hay colénquima en la zona de la vena media, preferentemente hacia la cara adaxial (Fig. 9 A-F, H).
Las venas menores (secundarias y terciarias) están formadas por haces colaterales cerrados, rodeados por vainas fasciculares que se presentan en distintas combinaciones: parenquimáticas, cristalíferas (con cristales prismáticos o rafdios cortos) y esclerificadas formadas por fibras y colénquima (Fig. 9 J-L). Pueden además poseer extensiones de las vainas hacia ambas epidermis, en su mayoría formadas por colénquima y/o fbras; dependiendo del tamaño del haz forman haces trabados o semitrabados (Figs. 6 I, K; 8 M; 9 M-N).
Los bordes de la hoja generalmente están formados por una continuación de la estructura de la lámina (Fig. 9 M), pero en algunas especies poseen diferente constitución: en C. antisyphillitica hay colénquima en el borde; D. cynanchoides y T. nodosa poseen prominentes casquetes de fbras (Fig. 9 N) y en A. marginatum están constituidos por parénquima incoloro sin vascularización, característica que da lugar al epíteto específco de este taxón (Fig. 9 O).
discusión
Indumento: Sin lugar a dudas el tipo de complemento tricomático permite defnir grupos que se corresponden con géneros de la familia, tal como lo aseveran autores que trabajaron en esta familia (Seibert, 1948; Gentry, 1980, 1997). Entre los tricomas tectores, los tricomas simples tipo bicelulares y uniseriados son los menos abundantes, están restringidos a las venas y los últimos también forman parte de los domacios (Gonzalez, 2011). Entre los bicelulares, el subtipo bicelular largo caracteriza a las especies de Jacaranda.
Los tricomas dendroides se encuentran en todas las especies de Handroanthus estudiadas, carácter ya destacado en la clave de géneros por Grose & Olmstead (2007) y confrmado en este estudio para las especies que crecen en Argentina. En este estudio también se encontraron tricomas dendroides en otras cuatro especies, tres de ellas arbóreas, pero en estos casos estos tricomas forman parte exclusivamente de los domacios, no están en toda la lámina. Una variante de tricomas dendroides son los estrellados, que caracterizan a H. chrysotrichus, H. ochraceus y H. pulcherrimus.
Las escamas peltadas o tricomas denominados incorrectamente escamas lepidotas por Grose & Olmstead (2007) o Zapater et al. (2009), solo se encuentran en las tres especies de Tabebuia estudiadas. Estas escamas se caracterizan por ser multicelulares y peltadas sobre la superfcie foliar, frecuentemente su presencia es la que otorga el adjetivo lepidoto a las hojas. Estas escamas se encuentran en diversas familias, y pueden ser glandulares como en Alnus y Betula, Betulaceae (Hardin & Bell, 1986), o en diversas Lamiaceae (Werker, 1993, 2000; Ascensão et al., 1997); lo más frecuente es que carezcan de secreción, por ej., en Rhododendron (Ericaceae, Hardin & Gensel, 1982); Croton (Webster et al., 1996), Bromeliaceae (Varadarajan & Gilmartin, 1987; Derwiduee & Gonzalez, 2010). Las escamas peltadas de Tabebuia no presentan evidencias de secreción, dando negativos los tests histoquímicos realizados. Las especies de Handroanthus se encontraban agrupadas bajo el género Tabebuia (Gentry, 1992); Grose & Olmstead (2007a) determinaron mediante estudios moleculares que este género es paraflético y lo separaron en tres clados, siendo el indumento uno de los caracteres morfológicos considerados; estos autores segregan Tabebuia en tres géneros: Tabebuia, con pelos simples, estrellados o dendroides, Roseodendron (sin representantes en Argentina) y Handroanthus con escamas peltadas. Los resultados de este trabajo avalan el mantenimiento de la delimitación entre ambos géneros, completando el estudio con la presencia y distribución de tricomas glandulares, los cuales no fueron considerados en trabajos previos.
En la bibliografía es frecuente asignar un rol protector a los tricomas no glandulares, especialmente contra la excesiva transpiración o como protectores contra el daño por radiación UV, hongos o insectos (Wagner, 1991; Mauricio & Rausher, 1997; Tattini et al., 2000; Werker, 2000). En las Bignoniaceae este rol está a cargo de las escamas peltadas en Tabebuia y los tricomas dendroides y estrellados de Handroanthus, que son los tipos de tricomas que presentan la mayor densidad, la cual se mantiene en hojas adultas.
Los tricomas glandulares son capitados, diferenciándose en la longitud del pedicelo: los pedicelados caen al expandirse las hojas, por lo que es poco frecuente encontrarlos en hojas adultas. Los capitados sésiles se caracterizan por su abundancia y encontrarse prácticamente en todas las especies estudiadas, sólo están ausentes en las especies de Tabebuia que poseen escamas peltadas. Anatómica y ontogenéticamente el desarrollo de los tricomas glandulares y las escamas peltadas es idéntico en sus etapas iniciales, solo diferen en la apoptosis de las células de la porción peltada y en la ausencia de secreción de las escamas. Esta similitud en el desarrollo inicial de tricomas glandulares y eglandulares ya fue citada por diversos autores (Uphof, 1962; Werker, 2000). En los estudios anatómicos y descripciones de esta familia es frecuente el uso alternativo de escamas peltadas y tricomas glandulares, por ejemplo Gonçalves Martins et al. (2008) denominan tricomas peltados a los tricomas glandulares capitados de Jacaranda puberula; situación similar se da en la utilización de tricomas peltados para describir los tricomas glandulares de Zeheria (Machado et al., 2006). Zapater et al. (2009) también utilizan el término escama tanto para los tricomas eglandulares peltados como para los glandulares. Los resultados aquí presentados, derivados del análisis ontogenético y anatómico, demuestran que se trata de estructuras diferentes y sus denominaciones no pueden ser utilizadas de modo indistinto, además su presencia es un carácter de importancia a nivel de género.
Nectarios extraforales: El trabajo más importante realizado en la familia es el de Seibert, quién en 1948 describió las glándulas de las Bignoniáceas y las clasifcó de acuerdo a su posición como glándulas interpeciolares, neuroaxilares, campos glandulares, glándulas dispersas y escamas glandulares. Todas las especies estudiadas presentan NEFs, y en el presente trabajo se reconocen NEFs solitarios y agrupados en campos glandulares, tanto foliares como interpeciolares, coincidentes con los descriptos por Seibert (1948).
Anatómicamente los NEFs consisten de una epidermis secretora en empalizada y un estrato basal que puede estar formado por una sola célula o por un estrato de células cuboides, que permite su clasifcación en simples y compuestos, términos propuestos por Rivera (2000) para los nectarios extranupciales de Bignoniaceae, ubicados en el cáliz y frutos y utilizados en el presente estudio. Esta estructura concuerda con la encontrada en nectarios descriptos en algunas especies de Bignoniaceae, tanto en NEFs ubicados en las hojas o nectarios extranupciales de cáliz y frutos (Elias & Gelband, 1976; Elias & Newcombe, 1979; Subramanian & Inamdar, 1989; Thomas & Dave, 1992; Rivera 2000). La presencia de NEFs simples o compuestos permite la identifcación de las especies al estado vegetativo.
En muchos casos los autores describen y confunden los NEFs de las hojas con tricomas glandulares (Grose & Olmestead, 2007, 2007a), tricomas escamosos (Díaz-Castelazo et al., 2005) o tricomas discoidales (Zapater et al., 2009). Machado et al. (2008) incluso describe los NEFs de Cybistax como tricomas peltados y en su trabajo presenta fotos con MEB de tricomas glandulares y verdaderos NEF en transcorte. En otros casos los NEFs pasan desapercibidos por estar ocultos por el indumento de tricomas tectores (Leonardi et al., 2002). Tal como lo destacara Rivera (2000) en el estudio realizado en los nectarios extranupciales del cáliz de las Bignoniaceae, esta confusión es frecuente; mas allá de las similitudes anatómicas entre los NEFS simples con una única célula basal y los tricomas glandulares capitados, la diferencia fundamental radica en su tamaño: menor a 40 µm para los tricomas y mayor a 100 µm para los NEFs, a pesar de la apariencia similar al microscopio de barrido. En el futuro sería conveniente complementar estos análisis anatómicos con estudios histoquímicos del producto de la secreción de los NEF y los tricomas glandulares en las Bignoniaceae.
Al estudiar la anatomía de los NEFs se destaca la presencia de engrosamientos de las paredes radiales del estrato nectarífero basal, tanto si este está constituido por una o por varias células. Estas células con engrosamientos radiales fueron denominados «barrier cells» y constituirían una barrera al transporte apoplástico, favoreciendo el flujo simplástico de la secreción, tanto en NEFs como en tricomas glandulares (Evert, 2006; Pacini & Nepi, 2007). En las Bignoniaceae este engrosamiento se comporta como una banda de Caspary, ya que provoca el fenómeno de plasmólisis en banda, comportamiento típico de las células endodérmicas (Evert, 2006). Este mismo fenómeno se observó en tricomas glandulares de Bignoniaceae, lo cual es evidencia de que este estrato se comporta como una verdadera barrera contra el transporte apoplástico.
Seibert (1948) destacó la importancia taxonómica de las glándulas, por ejemplo cita que la tribu Bignonieae se divide en dos grupos, de acuerdo a la presencia de glándulas interpeciolares en los nudos. Estos campos glandulares interpeciolares son los más utilizados en la clasifcación de la familia por diversos autores (Gentry, 1980, 1992, 1997; Arbo, 1999; Pool, 2007, 2008). Además de la posición de los NEFs extraforales en las plantas, en este estudio se pueden agrupar las especies de acuerdo a la estructura anatómica de los NEFs, permitiendo la separación de especies arbóreas principalmente, por ejemplo Tabebuia se distingue de Handroanthus por la presencia de NEFs simples. En Catalpa el campo de NEFs se aprecia a simple vista; su presencia fue descripta por Elias & Prance (1978), y la estructura anatómica aquí mencionada concuerda con la descriptas por esos autores.
Los NEFs ubicados en la lámina foliar están estrechamente asociados a los domacios, cuya asociación con las hormigas constituyen un mecanismo de defensa indirecta (Gonzalez, 2011). Esta asociación antiherbivoría ya fue citada en Catalpa por Ness (2003).
Anatomía foliar: La característica más destacable es la presencia de epidermis múltiple, lo cual ha sido confrmado por estudios de desarrollo. Caracteriza a las especies de Handroanthus, y aparece en dos especies exóticas T. roseo-alba y Pandorea jasminoides, carácter ya registrado en esta última especie por Metcalfe & Chalk (1957). En las restantes especies de Tabebuia y A. pannosum ciertas zonas de la hoja poseen más de un estrato dérmico, pero están formadas por extensiones de las vainas fasciculares, no se trata de epidermis pluriestratifcada o hipodermis. Abbade et al. (2009) describen a T. roseo-alba con epidermis uniestratifcada, a pesar de mostrar fotografías con la epidermis adaxial de hasta 3 capas de espesor. Souza & Oliveira (2004) observaron metáflos con hipodermis en plántulas de Tabebuia chrysotricha (= H. chrysotrichus) aclarando que se debería confrmar con un estudio ontogenético.
Los estomas están restringidos a la epidermis inferior como lo describieran Metcalfe & Chalk (1957), pero Tecoma garrocha y Handroanthus ochraceus presentan también estomas en la cara adaxial de la hoja.
Según Metcalfe & Chalk (1957) las hojas de Bignoniaceae son dorsiventrales, solo registran estructura isobilateral en el género Kigelia. En la presente contribución se observaron además numerosas especies con mesoflo isobilateral y homogéneo. Metcalfe & Chalk (1957) también citan la presencia de una capa celular caracterizada por un lumen amplio ubicada entre parénquima empalizada y lagunoso, presente en Campsis y Tecomaria (=Tecoma). Este estrato se reconoce como mesofilo paraveinal, siendo un estrato celular ubicado a nivel de los haces vasculares y cuya función es mediar en la transferencia entre los ambos clorénquimas y los haces vasculares (Fisher, 1967). Esta capa ha sido descripta en la bibliografía para la familia Fabaceae (Lackey, 1978; Franceschi & Giaquinta, 1983; Kevekordes, et al. 1988; Brubaker & Lersten, 1995). En este estudio se encontraron tanto en hojas con mesoflo isobilateral como la mayoría de las especies de Handroanthus y T. nodosa; y en T. capensis que posee mesofilo dorsiventral. La única especie descripta anteriormente con esta particularidad fue H. chrysotrichus por Silva et al. (2009).
Tanto en trabajos taxonómicos o en estudios actuales de la anatomía foliar, ya sea en especies africanas (Ogundipe & Wujek, 2004), o en lapachos brasileros -Handroanthus y Tabebuia - (Silva et al., 2009), o argentinos (Zapater et al., 2009), se destaca el uso de los caracteres foliares en la delimitación taxonómica en las Bignoniaceae. Los resultados de este estudio corroboran la importancia de la anatomía foliar en esta familia, registrando exhaustivamente dichas características para la gran mayoría de las especies nativas, cultivadas y naturalizadas que crecen en la Argentina. Varias características anatómicas en las hojas se destacan por su valor diagnóstico, entre ellas: posición y estructura anatómica de los NEFs, complemento tricomático, cantidad de estratos de la epidermis adaxial, tipo de mesoflo, composición de margen foliar; las cuales solas o de manera combinada permiten la identifcación de las especies, tal como se aprecia en las Tablas 1 y 2.
Agradecimientos
A la Dra. Maria Mercedes Arbo por las determinaciones del material y la sugerencia del tema. Para la realización de este trabajo se contó con un subsidio de la Agencia Nacional de Promoción Científca y Tecnológica (ANPCyT), PICTO-UNNE 96.
BiBliografía
- ABBADE, L. C., P. DUARTE DE OLIVEIRA PAIVA, R. PAIVA, E. M. DE CASTRO, A. RABELO CENTOFANTE & C. DE OLIVEIRA. 2009. Anatomía foliar de ipê-branco (Tabebuia roseo alba (Ridl.) Sand.) Bignoniaceae, proveniente do cultivo ex vitro e in vitro. Acta Sci. Biol. Sci. 31: 307-311.
- ARBO, M. M. 1999. Bignoniaceae. In: ZULOAGA F. O. & O. MORRONE (eds.), Catálogo de las Plantas Vasculares de la República Argentina II, pp. 361-374. Monogr. Syst. Bot. Mo. Bot. Gard. 74. Missouri Botanical Garden Press, St. Louis.
- ASCENSÃO, L., N. MARQUES & M. S. PAIS. 1997. Peltate glandular trichomes of Leonotis leonurus leaves: ultrastructure and histochemical characterization of secretions. Int. J. Plant. Sci. 158: 249-258.
- BRUBAKER, C. L. & N. R. LERSTEN. 1995. Paraveinal mesophyll: Review and survey of the subtribe Erythrininae (Phaseoleae, Papilionoideae, Leguminosae). Plant Syst. Evol. 196: 31-62.
- DERWIDUEÉ, F.S. & A. M. GONZALEZ. 2010. Anatomía foliar en Bromeliaceae del Nordeste argentino y Paraguay. Bonplandia 19: 153-173.
- DÍAZ-CASTELAZO, C., V. RICO-GRAY, F. ORTEGA & G. ÁNGELES. 2005. Morphological and secretory characterization of extraforal nectaries in plants of coastal Veracruz, México. Ann. Bot. 96: 1175-1189.
- ELIAS, T. S. & H. GELBAND. 1976. Morphology and anatomy of foral and extraforal nectaries in Campsis (Bignoniaceae). Amer. J. Bot. 63: 1349-1353.
- ELIAS, T. S. & L. F. NEWCOMBE. 1979. Foliar nectaries and glandular trichomes in Catalpa (Bignoniaceae). Acta Bot. Sin. 21: 215-224.
- ELIAS, T. S. & G. T. PRANCE. 1978. Nectaries on the fruit of Crescentia and other Bignoniaceae. Brittonia 39: 175-181.
- EVERT, R. F. 2006. Esau's Plant Anatomy: meristems, cells, and tissues of the plant body: their structure, function, and development. John Wiley & Sons, Hoboken, NJ, USA.
- FABRIS, H. A. 1959. Las plantas cultivadas de la Argentina: Bignoniaceae. Instituto de Botánica Agrícola 10: 1-57.
- FISHER, D. B. 1967. An unusual layer of cells in the mesophyll of the soybean leaf. Bot. Gaz. 128: 215-218.
- FRANCESCHI, V. R. & R. T. GIAQUINTA. 1983. Specialized cellular arrangements in legume leaves in relation to assimilate transport and compartmentation: comparison of the paraveinal mesophyll. Planta 159: 415-422.
- GENTRY, A. H. 1980. Bignoniaceae Part I (Crescentiae and Tourrettieae). Fl. Neotrop. Monogr. 25: 1-150. [ Links ]
- GENTRY, A. H. 1992. Bignoniaceae Part II (Tribe Tecomeae). Fl. Neotrop. Monogr. 25: 1-130. [ Links ]
- GENTRY, A. H. 1997. Bignoniaceae. In: BERRY, P. E., K. YATSKIEVYCH & B. K. HOLST (eds.). Flora of the Venezuelan Guayana, Vol. 3, Araliaceae-Cactaceae. Missouri Botanical Garden Press, St. Louis, MI, USA.
- GONÇALVES MARTINS, M. B., A. A. CASTRO & A. J. CAVALHEIRO. 2008. Caracterização anatômica e química de folhas de Jacaranda puberula (Bignoniaceae) presente na Mata Atlântica. Rev. Bras. Farmacogn. 18: 600-607.
- GONZALEZ, A.M. 2011. Domacios y nectarios extraflorales en Bignoniáceas: componentes vegetales de una interacción mutualística. Bol. Soc. Argent. Bot. 46: 271-288. [ Links ]
- GONZALEZ, A.M & C. L. CRISTÓBAL. 1997. Anatomía y ontogenia de semillas de Helicteres lhotzkyana (Sterculiaceae). Bonplandia 9: 287-294.
- GROSE, S. O & R. G. OLMSTEAD. 2007. Taxonomic revision in the polyphyletic genus Tabebuia s. l. (Bignoniaceae). Syst. Bot. 32: 660-670.
- GROSE, S. O. and R. G. OLMSTEAD. 2007a. Evolution of a charismatic neotropical tree: Molecular phylogeny of Tabebuia s. l. and allied genera (Bignoniaceae). Syst. Bot. 32: 650–659.
- HARDIN, J. W. & J. M. BELL. 1986. Atlas of foliar surface features in woody plants, IX. Betulaceae of eastern United States. Brittonia 38: 133-144.
- HARDIN, J. W. & W. H. GENSEL. 1982. Atlas of foliar surface features in woody plants, IV. Rhododendrons (Ericaceae) of eastern North America. Bull. Torrey Bot. Club 109: 189-198.
- HURRELL, J. A., P. A. CABANILLAS, F. BUET COSTANTINO & G. DELUCCHI. 2012. Bignoniaceae adventicias en la Argentina. Primera cita de Podranea ricasoliana y nuevos registros de Campsis radicans. Rev. Mus. Argent. Cienc. Nat. 14: 15-22.
- JOHANSEN, D. A. 1940. Plant Microtechnique. Mc Graw Hill Book Co. New York.
- KEVEKORDES, G., M. E. MCCULLY & M. J. CANNY 1988. The occurrence of an extended bundle sheath system (paraveinal mesophyll) in the legumes. Can. J. Bot. 66: 94-100.
- LACKEY, J. A. 1978. Leafet anatomy of Phaseoleae (Leguminosae: Papilionoideae) and its relation to taxonomy. Bot. Gaz. 139:436-446.
- LEONARDI, D., O. DI SAPIO, M. GATTUSO & S. GATTUSO. 2002. Caracteres morfoanatómicos de la corteza y hojas de Tabebuia impetiginosa y T. heptaphylla (Bignoniaceae). Bol. Soc. Argent. Bot. 37: 51-61.
- LOHMANN, L. G. 2006. Untangling the phylogeny of neotropical lianas (Bignonieae - Bignoniaceae). Am. J. Bot. 93: 304-318. [ Links ]
- LOHMANN, L.G. & C. ULLOA ULLOA. 2007. Bignoniaceae. In: iPlants prototype Checklist. The world's plants online. Missouri Botanical Garden, The New York Botanical Garden & The Board of Trustees of the Royal Botanic Gardens, Kew. Published on the Internet; http://www.iplants.org, accessed 30 May 2012 17:11 GMT.
- LUQUE, R., H. C. SOUSA & J. E. KRAUS. 1996. Métodos de coloração de Roeser (1972) - modifcado - e Kropp (1972) visando a substituição do azul de astra por azul de alcião 8 GS ou 8 GX. Acta Bot. Bras. 10: 199-212.
- MACHADO, S. R., E. A. GREGÓRIO & E. GUIMARÃES. 2006. Ovary peltate trichomes of Zeyheria montana (Bignoniaceae): developmental ultrastructure and secretion in relation to function. Ann. Bot. 97: 357-369.
- MACHADO S. R., L. P. C. MORELLATO; M. G. SAJO & P. S. OLIVEIRA. 2008. Morphological patterns of extraforal nectaries in woody plant species of the Brazilian cerrado. Plant Biol. 10:660-73.
- MAURICIO, R. & M. D. RAUSHER. 1997. Experimental manipulation of putative selective agents provides evidence for the role of natural enemies in the evolution of plant defense. Evolution 51: 1475–1444.
- METCALFE, C. R. & L. CHALK. 1957. Anatomy of the Dicotyledons II. Clarendon Press, Oxford.
- NESS, J. H. 2003. Catalpa bignonioides alters extraforal nectar production after herbivory and attracts ant bodyguards. Oecologia, 134, 210-218.
- OGUNDIPE, O. T. & D. E. WUJEK. 2004. Foliar anatomy on twelve genera of Bignoniaceae (Lamiales). Acta Bot. Hung. 46: 337-361.
- PACINI, E. & M. NEPI. 2007. Nectar production and presentation. In: NICOLSON, S. W., M. NEPI & E. PANINI (eds.). Nectaries and nectar, pp: 167-214. Springer, The Netherlands.
- PAYNE, W. W. 1978. A glossary of plant hair terminology. Brittonia 30: 239–255. [ Links ]
- POOL, A. 2007. A revision of the genus Pithecoctenium (Bignoniaceae). Ann. Missouri Bot. Gard. 94: 622-642.
- POOL, A. 2008. A review of the genus Pyrostegia (Bignoniaceae). Ann. Missouri Bot. Gard. 95: 495-510.
- RIVERA, G. L. 1996. Nectarios y tricomas forales en cuatro especies de Tecomeae (Bignoniaceae). Darwiniana 34: 19-26.
- RIVERA, G. L. 2000. Nuptial nectary structure of Bignoniaceae of Argentina. Darwiniana 38: 227– 239. [ Links ]
- RUZIN, S. E. 1999. Plant microtechnique and microscopy. Oxford University Press, New York, USA.
- SEIBERT, R. J. 1948. The use of glands in a taxonomic consideration of the family Bignoniaceae. Ann. Missouri Bot. Gard. 35: 123-137.
- SILVA DA, A., M. LUCHIARI, M. F. BORTOLIN COSTA, V. GONÇALVES LEITE, A. ALVES REZENDE & S. DE PÁDUA TEIXEIRA. 2009. Anatomia foliar com implicações taxonômicas em espécies de ipês. Hoehnea 36: 329-338.
- SOUZA, L. A. & J. H. G. OLIVEIRA. 2004. Morfologia e anatomia das plântulas de Tabebuia avellanedae Lor. ex Griseb e T. chrysotricha (Mart. ex Dc.) Standl. (Bignoniaceae). Acta Sci. Biol. Sci. 26: 217-226.
- SUBRAMANIAN, U. B. & J. A. INAMDAR. 1989. The structure, secretion and biology of nectaries in Tecomaria capensis Thunb. (Bignoniaceae). Phytomorphology 39: 69-74.
- TATTINI, M., E. GRAVANO, P. PINELLI, N. MULINACCI & A. ROMANI. 2000. Flavonoids accumulate in leaves and glandular trichomes of Phillyrea latifolia exposed to excess solar radiation. New Phytologist 148: 69-77.
- THEOBALD, W. L., J. L. KRAHULIK & R. C. ROLLINGS. 1979. Trichome description and classifcation. In: METCALFE, C. R. & L. CHALK (eds.). Anatomy of the Dicotyledons. Vol. I, pp. 40-53. Clarendon Press, Oxford.
- THOMAS, V. & Y. DAVE. 1992. Structure and biology of nectaries in Tabebuia serratifolia Nichols (Bignoniaceae). Bot. J. Linn. Soc. 109: 39-400.
- UPHOF, J. C. T. 1962. Plant Hairs. In: LINSBAUER K. (ed.) Handbuch der Pfanzenanatomie, Gebrüder Borntraeger, Berlin.
- VARADARAJAN G. S. & A. J. GILMARTIN.1987. Foliar scales of the subfamily Pitcairnioideae (Bromeliaceae). Syst. Bot. 12: 562-571 WAGNER, G. J. 1991.Secreting glandular trichomes: more than just hairs. Plant Physiol. 96: 675-679.
- WEBSTER, G. L.; M. J. DEL ARCO AGUILAR & B. A. SMITH. 1996. Systematic distribution of foliar trichome types in Croton (Euphorbiaceae). Bot. J. Linn. Soc. 121: 41-57.
- WERKER, E.1993. Function of essential oil-secreting glandular hairs in aromatic plants of the Lamiaceae. Flavor Fragr. J. 8: 249-255. [ Links ]
- WERKER, E. 2000. Trichome diversity and development. Adv. Bot. Res. 3: 1-35. WILKINSON, H. P. 1979. The plant surface (mainly leaf). In: METCALFE, C.R. & L. CHALK (eds.) Anatomy of the Dicotyledons, Vol. I, pp. 97-165. Clarendon Press, Oxford.
- ZAPATER, M. A., L. M. CALIFANO, E. M. DEL CASTILLO, M. A. QUIROGA & E. A. LOZANO. 2009. Las especies nativas y exóticas de Tabebuia y Handroanthus (Tecomeae, Bignoniaceae) en Argentina. Darwiniana 47: 185-220.
Recibido el 4 de junio de 2012, aceptado el 24 de octubre de 2012
ANEXO: Material estudiado, ejemplares testigo depositados en Herbario CTES, salvo se indique lo contrario; AMG: Ana M. Gonzalez, *: ejemplar herborizado.
Adenocalymma marginatum (Cham.) DC. Prov. Corrientes: Dpto. San Cosme, Paso de la Patria, camino viejo, 30-I-2006, AMG 78. Dpto. Sto. Tomé, Azara, balneario Ay. Chimiray, 2-XI-2007, AMG 121. Prov. Misiones: Dpto. L. N. Alem, 2 Km E Cerro Azul, RN 14, 2-XI-2007, AMG 124. Dpto. Candelaria, Mártires, 2-XI-2007, AMG 134. Loreto, 12-II-2008, AMG 141. Candelaria, alrededores de Balneario, 15-XII-2010, AMG 446. Dpto. Capital, RN 12 y desvío a Garupá, 13-XII-2010, AMG 408. Dpto. Iguazú, RP 101 y Arroyo Ñandú, 14-XII-2010, AMG 430.
Adenocalymna paulistarum Bureau & K. Schum. Prov. Misiones: Dpto. Guaraní, RP 2 entre Mesa Redonda y Pque. Pcial. Moconá, 27-XI-2008, AMG 177.
Amphilophium pannosum (DC.) Bureau & K. Schum. Prov. Jujuy: Dpto. Ledesma, Pque. Nac. Calilegua, 23º41´44.5S 64º52´0.2W, 28-XI-10, AMG 339.
Amphilophium vauthieri DC. Prov. Corrientes: Dpto. San Cosme, Paso de la Patria, Punta Iglesia, 30-I-2006, AMG 77. Prov. Misiones: Dpto. Candelaria, Loreto. 19-III-2009, AMG 202. Dpto. Iguazú, camino acceso a Pto. Iguazú, 13-XII-2010, AMG 422. RP 101 y puesto de Gendarmería, 14-XII-2010, AMG 428.
Arrabidaea caudigera (S. Moore) A.H. Gentry Prov. Corrientes: Dpto. Ituzaingó, Isla Apipé Grande, 18-XII-2008, AMG 240. Prov. Misiones: Dpto. Cainguás, RP 7 y Ruiz de Montoya, 27-XI-2008, AMG 181. Dpto. Candelaria, Loreto, 19-III-2009, AMG 205.
Arrabidaea chica (Humb. & Bonpl.) B.Verl.
Prov. Misiones: Dpto. Iguazú, camino acceso a Pto. Iguazú, 10-III-2009, AMG 208, AMG 212, AMG 213, AMG 220, AMG 226. Pque. Nac. Iguazú, estación tren Garganta del Diablo, 14-XII-2010, AMG 427. Pque. Nac. Iguazú, RP 101, 25º40´23S 54º16´10W, 14-XII-2010, AMG 432.
Arrabidaea corallina (Jacq.) Sandwith Prov. Chaco: Dpto. Pcia. de la Plaza, R.N. 16, Guayaibí, 23-IX-2006, AMG 81. RN 16, 30 km. E Pcia. de la Plaza, 30-IX-2006, AMG 90. Dpto. Libertad, Pto. Tirol, 30-IX-2006, AMG 94. Prov. Corrientes: Dpto. San Cosme, Pto. González, 30-I-2006, AMG 72. Pto. Toledo, entrada a cementerio, 30-I-2006, AMG 75, AMG 76. Prov. Jujuy: Dpto. Ledesma, RN 34 entre Ledesma y Fraile Pintado, 23°16'57S 64°13'48W, 28-XI-10, AMG 334.
Arrabidaea forida DC. Prov. Misiones: Dpto. Candelaria, Loreto, 12 -2-2008, AMG 143. Acceso a Mártires, 13-XII-2010, AMG 418.
Arrabidaea mutabilis Bureau & K. Schum. Prov. Formosa: Dpto. Formosa, RP 5 hacia San Hilario, 26°10'38S 58°39'22.2W, 28-XI-10, AMG 322. Prov. Misiones: Dpto. L.N.Alem, 2 Km E Cerro Azul, RN14, 2-XI-2007, AMG 123. Dpto. San Ignacio, San Ignacio, camino a camping, 2-XI-2007, AMG 137. Dpto. Iguazú, camino acceso a Pto. Iguazú, 13-XII-2010, AMG 424. Pque. Nac. Iguazú, RP 101, 25°40'51.8S 54°13'6W, 14-XII-2010, AMG 431.
Arrabidaea samydoides (Cham.) Sandwith Prov. Misiones: Dpto. Iguazú, Pque. Nac. Iguazú, Paseo Superior, Salto Mbiguá, 18-IX-1996, Herrera 201*.
Arrabidaea selloi (Spreng.) Sandwith
Prov. Jujuy: Dpto. Ledesma, entrada a Pque. Nac. Calilegua, Ruta 83, 3-XII-2005, Arbo 8955. Pque. Nac. Calilegua, 23°44'32.4S 64°51'11.3W, 28-XI-10, AMG 342. Pque. Nac. Calilegua, sendero La Herradura, 28-XI-10, AMG 343, AMG 345.
Prov. Misiones: Dpto. Candelaria, Mártires, 2-XI-2007, AMG 131. Candelaria, 27°29'S 55°44'W, 3-XII-2008, AMG 194. RP 103 y Mártires, 19-111-2009, AMG 201. Dpto. Cainguás, RP 220 a Salto Encantado, 27-XI-2008, AMG 169. Ruta 7, 10 Km W de A. del Valle, 27-XI-2008, AMG 179. Dpto. Eldorado, RN 12 y Eldorado, 19-111-2009, AMG 207. Dpto. Guaraní, RP 2 entre Mesa Redonda y Pque. Pcial. Moconá, 27-XI-2008, AMG 176. Dpto. Iguazú, Pque. Nac. Iguazú, 10-III-2009, AMG 215. 10-III-2009, AMG 216. Prov. Salta: Dpto. Metán, Ruta 34, entre Rio Piedras y Lumbrera, 3-XII-2005, Arbo 8944. Dpto. Orán, RN 50 hacia H. Irigoyen, 21º6´5.5S 64º13´2W, 28-XI-10, AMG 328.
Arrabidaea triplinervia (DC.) Baill. ex Bureau Prov. Misiones: Dpto. Iguazú, Camino acceso a Pto. Iguazú, 10-III-2009, AMG 211. Pque. Nac. Iguazú, 10-III-2009, AMG 221.
Campsis radicans L. Bureu
Prov. Chaco: Dpto. Com. Fernández, Sáenz Peña, cultivada, 23-IX-2006, AMG 85.
Catalpa bignonioides Walter
Prov. Jujuy: Dpto. La Caldera, La Caldera, cultivado en calle camino de acceso al Cristo, 1-XII-2010, AMG 384.
Clytostoma binatum (Thunb.) Sandwith
Prov. Corrientes: Dpto. Sto. Tomé, RP 120 y Rio Aguapey, 1 -XI-2007, AMG 117; 12 -II-2008, AMG 140; 26-XI-2008, AMG 162; 13-XII-2010, AMG 400.
Clytostoma sciuripabulum Bureau & K. Schum Prov. Misiones: Dpto. Candelaria, Bonpland, camino a Cerro Corá, 27-IX-2007, AMG 110.
Cuspidaria convoluta (Vell.) A.H. Gentry Prov. Corrientes: Dpto. San Carlos, RN 12 y Arroyo Itaembé, 13-XII-2010, AMG 404. Prov. Misiones: Dpto. Capital, San Isidro, a 15 Km Posadas, 24-X-2006, AMG 101. Dpto. Candelaria, RN 12 y Santa Ana, 27-IX-2007, AMG 104.Loreto, 12 -2-2008, AMG 142. Candelaria, alrededores de Balneario, 15-XII-2010, AMG 444. Dpto. Capital, Ay. Zaimán, 13-XII-2010, AMG 405.
Cybistax antisyphilitica (Mart.) Mart.
Prov. Jujuy: Dpto. Ledesma, Finca Las Peñas, 7 Km W de Ruta Prov. 34, Ingenio San Martin del Tabacal, 23º40´S 64º45´W. 3-XII-2005, Arbo 8949. Calilegua, cultivado en calle en esquina de Avda. principal, 30-XI-2010, AMG 351 y AMG 359.
Dolichandra cynanchoides Cham.
Prov. Chaco: Dpto. Gral. Dónovan, RN 16, a 7 Km E de Makallé, selva marginal del Rio Negro, 23-IX-2006, AMG 79. Prov. Corrientes: Dpto. Itatí, Scorza Cué, RN 12, 30-XI-2010, AMG 312. Dpto. San Cosme, Pto. González, 30-I-2006, AMG 70.
Handroanthus albus (Cham.) Mattos
Prov. Misiones: Dpto. Cainguás, Aristóbulo del Valle, Picada Libertad, km 24, 17-III-1981, Legname et al. 7915* (LIL). Dpto. Guaraní, Predio Guaraní, 26º 54'59S, 54º 12'18W, hacia el Ay. Gracielita, desde el Tramo 1, 29-XI-1994, Tressens 5082*. Dpto. Iguazú, Paraje Aguaray, Lote P (A.P.S.A.), entre rodal 5 y 6, 7-IX-2001, Keller 1229*. Dpto. Oberá, camino a Campo Ramón, 27º27'07 S, 56º03'03 W, 23-IX-2000, Múlgura de Romero 2274*.
Handroanthus chrysotrichus (Mart. ex DC) Mattos Prov. Chaco: Dpto. San Fernando, Resistencia, 23-X-2006, AMG 99. Prov. Salta: Dpto. Capital, Salta, Pasaje Mollinedo 300, 11-XI-2002, Novara 11788*.
Handroanthus heptaphyllus (Vell.) Mattos Prov. Chaco: Dpto. San Fernando, RN 16 y Monte Alto, 12-X-2006, AMG 97. Prov. Corrientes: Dpto. Capital, Fac. Cs. Agrarias UNNE, 6-XII-2010, AMG 399.
Handroanthus impetiginosus (Mart. Ex DC) Mattos Prov. Jujuy: Dpto. Palpalá, Carahunco. RP 59 a 40 S de S.S. Jujuy, 26-VII-2008, AMG 154; 16-IX-2010, Sato 14; 1-XII-2010, AMG 367, AMG 368. Prov. Salta: Dpto. Capital, Salta, cultivada, 24-VII-2008, AMG 150. San Lorenzo, 24-VII-2008, AMG 151. Dpto. La Viña, Ampascachi, 24-VII-2008, AMG 153. Dpto. Gral. J. de San Martín, Embarcación, 28-XI-10, AMG 324. Dpto. Orán, H. Irigoyen, 28-XI-10, AMG 329; AMG 330.
Handroanthus lapacho (K. Schum.) S. O. Grose Prov. Jujuy: Dpto. Ledesma, Pque. Nac. Calilegua, Aguada del Tigre, 23º41'12,3S 64º53'51W, 29-XI-2010, AMG 338. Prov. Salta: Dpto. Capital, Vaqueros, Finca El Daguiri, a la izquierda de Ruta 9, a unos metros de la Policía de Vaqueros hacia La Caldera, varios árboles cultivados de semilla procedente de Los Toldos, 24-VII-2008, AMG 152. Dpto. Orán, 2 km antes del pueblo de San Andrés, en bajada del camino hacia el río, en ladera a mano izquierda, 23º04'34''S, 64º 50'15''W, 19-VIII-2005, Zapater & Califano 2563* (MCNS).
Handroanthus ochraceus (Cham.) Mattos Prov. Chaco: Dpto. San Fernando, Resistencia, 15-IX-2008, AMG 158. Prov. Jujuy: Dpto. Pálpalá, Carahunco, RP 59 a 40 S de S.S. Jujuy: 16-IX-2010, Sato 15. Dpto. Ledesma, Ruta 34, llegando a Ay. El Quemado, desvío a la izquierda más o menos 10 km camino maderero, 22-IX-1981, Legname 7818* (LIL). Pque. Nac. Calilegua, a 3 km de la entrada a mano izquierda, 23°44'14,6S 64°51'04,9W, 20-IX-2004, Zapater 2438* (MCNS). Calilegua, cultivado Avda. principal, 30-XI-2010, AMG 348. Prov. Salta: Dpto. Orán, camino a El Oculto, Km 18, 10-X-2004, Zapater 2454* (MCNS). H. Irigoyen, 28-XI-10, AMG 331.
Handroanthus pulcherrimus (Sandwith) S. O. Grose Prov. Chaco: Dpto. San Fernando, RN 16 y Monte Alto, cultivada, 23-IX-2006, AMG 96. Prov. Misiones: Dpto. Candelaria, Mártires, 2-XI-2007, AMG 132. Dpto. San Ignacio, Complejo Club del Rio, Base de Peñón de la Cruz, 7-XI-2009, Keller 7735*. Dpto. Oberá, PR 103 a 500 m W de RN 14, 13-XI1-2010, AMG 416.
Jacaranda cuspidifolia Mart. ex DC
Prov. Salta: Dpto. Orán, 2 Km al W de San Ramón de la Nueva Orán, 23°10'S 64°20'W, 12-111-2001, Arbo 8987. 3 km S de Orán, RN 50, 23°10'S 64° 20'W, 11-11-2005, Fortunato 7108.
Jacaranda micrantha Cham.
Prov. Misiones: Dpto. Cainguás. RP 220 a Salto Encantado, 27-XI-2008, AMG 167. Dep. Iguazú, Pque. Nac. Iguazú, sendero Macuco, 1-XII-1993, Vanni 3079.
Jacaranda mimosifolia D. Don
Prov. Corrientes: Dpto. Capital, Corrientes, cultivada, 1-X-2010, AMG 308. Prov. Salta: Dpto. Orán, H. Irigoyen, alrededores cementerio, 29-XI-2010, AMG 332.
Jacaranda puberula Cham.
Prov. Misiones: Dpto. Eldorado, Eldorado, Fac. Cs. Forestales, UNAM, 5-XII-2008, AMG 204.
Macfadyena dentata K. Schum.
Prov. Misiones: Dpto. Capital, Ay. Zaimán, 3-XII-2008, AMG 183. Dpto. Candelaria, Candelaria, balneario, 27-IX-2007, AMG 105. Candelaria, 27°29'S 55°44'W, 3-XII-2008, AMG 195. Candelaria, alrededores de Balneario, 15-XI1-2010, AMG 445.
Macfadyena hassleri Sprague
Prov. Corrientes: Dpto. Sto. Tomé, RP120 y Rio Aguapey, 26-XI-2008, AMG 160. Prov. Misiones: Dpto. Capital, Ay. Zaimán, 13-XII-2010, AMG 406.
Macfadyena uncata (Andrews) Sprague & Sandwith Prov. Misiones: Dpto. Candelaria, Mártires, 2-XI-2007, AMG 136.
Macfadyena unguis-cati (L.) A.H. Gentry Prov. Chaco: Dpto. Gral. Dónovan, RN16, La escondida, 23-IX-2006, AMG 80. Prov. Formosa, Dpto. Formosa, RP 5 hacia San Hilario, 26º10´38S 58º39´22.2W, 28-XI-10, AMG 323. Prov. Misiones: Dpto. Candelaria, San Isidro, a 5 Km Posadas, 24-X-2006, AMG 102. Bonpland, 27-IX-2007, AMG 111. Mártires, 12 -2-2008, AMG 144. Dpto. Eldorado, Eldorado, camino al Puerto, 10-III-2009, AMG 206. Dpto. L.N. Alem, Cerro Azul y RN 14, 13-XII-2010, AMG 411.
Mansoa diffcilis (Cham.) Bureau & K. Schum. Prov. Misiones: Dpto. Candelaria, Mártires, 2-XI-2007, AMG 130. Profundidad, Pque. Prov. Cañadón, 2-XI-2007, AMG 139. Dpto. Eldorado, Eldorado, RN12, 10-III-2009, AMG 203. Dpto. L.N.Alem, 2 Km E Cerro Azul, RN14, 2-XI-2007, AMG 126. Camino a Cerro Azul, RN14, 2-XI-2007, AMG 128.
Melloa quadrivalvis (Jacq.) A.H. Gentry Prov. Jujuy: Dpto. Ledesma, Pque. Nac. Calilegua, 23º44´32.4S 64º51´11.3W, 28-XI-10, AMG 341.
Pandorea jasminoides (Lindl.) K. Schum.
Prov. Corrientes: Dpto. Capital, Corrientes, 23-IX-2006, AMG 83.
Parabignonia chodatti (Hassler) A. H. Gentry Prov. Jujuy: Dpto. Ledesma, Pque. Nac. Calilegua, 28-XI-10, AMG 346.
Pithecoctenium carolinae (Lindl.) G. Nicholson Prov. Chaco: Dpto. San Fernando, RN16, entrada a Col. Popular, 23-IX-2006, AMG 82. Fontana, 30-IX-2006, AMG 88. RN 16 y acceso Resistencia, 12-X-2006, AMG 98. Dpto. 25 de Mayo, RN 16, Machagai, 27-X-2007, AMG 116.
Pithecoctenium crucigerum (L.) A.H. Gentry Prov. Corrientes: Dpto. Sto. Tomé, Col. Liebig. y Ay. Chimiray, 2-XI-2007, AMG 120. Prov. Misiones: Dpto. Cainguás, RP 8, 4 Km O de RN 14, 26-XI-2008, AMG 165. RP 220 a Salto Encantado, 27-XI-2008, AMG 168. Ruta 7 y acceso a Ruiz de Montoya, 27-XI-2008, AMG 180. Dpto. Guaraní, RP 2 entre Mesa Redonda y Pque. Pcial. Moconá, 27-XI-2008, AMG 78. Dpto. LN.Alem, 2 Km E Cerro Azul, RN14, 2-XI-2007, AMG 125. RN 14 y Arroyo Mártires, 13-XII-2010, AMG 414. Dpto. Iguazú, RP 101 y puesto de Gendarmería, 14-XII-2010, AMG 429.
Podranea ricasoliana (Tanfani) Sprange Prov. Corrientes: Dpto. Capital, Corrientes, cultivada Fac. Ciencias Agrarias, 23-IX-2006, AMG 84.
Pyrostegia venusta (Ker Gawl.) Miers
Prov. Corrientes: Dpto. Sto. Tomé, 10 Km SE de Azara, 2-XI-2007, AMG 122. Prov. Misiones: Dpto. Candelaria, Bonpland, camino a C. Corá, 27-IX-2007, AMG 109. Dpto. LN.Alem, camino a Cerro Azul, RN14, 2-XI-2007, AMG 127. Dpto. Oberá, camino a Sta. Ana, 2-XI-2007, AMG 129.
Tabebuia áurea (Silva Manso) Benth. & Hook. f. ex S. Moore Prov. Formosa: Dpto. Pirané, Mayor Villafañe, 26°12'16,6 S 59° 0,4'13,9 W, 28-XI-10, AMG 320. Prov. Salta: Dpto. Orán, 2 Km al W de San Ramón de la Nueva Orán, 23°10'S 64°20'W, Arbo 8992.
Tabebuia nodosa (Griseb.) Griseb.
Prov. Chaco: Dpto. Pcia. de la Plaza, RN16, 10 km. E Pcia. de la Plaza, 30-IX-2006, AMG 89. Prov. Corrientes: Dpto. San Cosme, Paso de la Patria, 2-IX-2006, AMG 86.
Tabebuia roseo-alba (Ridl.) Sandwith
Prov. Jujuy: Dpto. Ledesma, Sala del Ingenio
Ledesma en Calilegua, cultivado en Pque., 30-XI-2010, AMG 347. Calilegua, cultivado en calle en esquina de Avda. principal, 30-XI-2010, AMG 350.
Tecoma capensis (Thunb.) Lindl.
Prov. Corrientes: Dpto. Capital, Corrientes, cultivada, 3-IV-2002, AMG 182b.
Tecoma garrocha Hieron.
Prov. Jujuy: Dpto. J. M. Belgrano, RN 9, 7 Km de Lozano camino a Volcán, Rio León, 10-XII-98, Giussani 3181*. Dpto. Rosario de Lerma, Quebrada del Toro, 5 km N de Campo Quijano. 42° 53' S 65° 41' W, 6-111-2001, Fortunato 6951*. Dpto. San Pedro, San Pedro, RN 34, 24° 15'12,7 S 64° 53'55,7 W, 686 m.s.n.m, 30-XI-10, AMG 357.
Tecoma stans (L.) Juss. ex Kunth var. stans Prov. Chaco: Dpto. Cte. Fernández, Pcia. Roque Sáenz Peña, 25-X-2010, AMG 315. Prov. Corrientes: Dpto. Capital, Corrientes, 1-X-2010, AMG 309. Prov. Salta: Dpto. La Caldera, margen Rio Calderas, 24-VII-2008, AMG 149. Dpto. Orán, RN 50 hacia H. Irigoyen, 21°6'5.5S 64°13'2W, 28-XI-10, AMG 325.
Tecoma tenuifora (DC.) Fabris
Prov. Jujuy: Dpto. Sta. Bárbara, R 23 rumbo a Sta. Clara, 3 Km S de El Fuerte, 24°16'S, 64°26'W, Solís Neffa 783*. Prov. Salta: Dpto. Sta. Victoria, R 40 de Condado a Toldos, 22°13' S 64°41 'W, 4-XII-2005, Arbo 9056.
Tynanthus micranthus Correa de Mello ex K. Schum Prov. Misiones: Dpto. Iguazú, RP 101 a 35 Km puesto de Gendarmería, 25°31'3.6S 54°12'15.8W, 14-XI1-2010, AMG 426.














