Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.50 no.2 Córdoba jun. 2015
FISIOLOGÍA
Dormición física y conservación ex situ de semillas de Amburana cearensis y Myroxylon peruiferum (Fabaceae)
Guadalupe Galíndez1,4, Gisela Malagrina2, Diana Ceccato2, Tilda Ledesma3, Lucía Lindow-López4 y Pablo Ortega-Baes4 *
1 Banco Activo de Germoplasma, EEA-INTA-Cerrillos, Ruta Nacional 68, Km 172, Cerrillos (4403), Salta, Argentina;
2 Banco Base de Germoplasma, Instituto de Recursos Biológicos, CIRN-INTA, De los Reseros y N. Repetto s/n, Hurlingham (1686), Buenos Aires, Argentina.
3 EEA-INTA-Yuto, Ruta Nacional 34, Km 1286, Yuto (4518), Jujuy, Argentina.
4 Laboratorio de Investigaciones Botánicas (LABIBO)-CONICET, Facultad de Ciencias Naturales, Universidad Nacional de Salta, Buenos Aires 177, Salta (4400), Argentina.
* Autor de correspondencia: ortega_baes@yahoo.com.ar
Resumen
Amburana cearensis y Myroxylon peruiferum son dos especies nativas del noroeste argentino que se encuentran amenazadas por la explotación de su madera, siendo prioritario establecer programas de manejo, restauración ecológica y conservación. La presencia de dormición física en semillas dificulta su utilización en dichos programas. Los objetivos de este trabajo fueron determinar la presencia de dormición física, los métodos de salida de dormición y el comportamiento durante el almacenamiento en semillas de ambas especies. Las semillas de A. cearensis presentaron dormición física y la escarificación mecánica y química fueron los mejores métodos para la salida de dormición de las semillas. Las semillas de M. peruiferum no presentaron dormición física. Las semillas de A. cearensis produjeron semillas con comportamiento ortodoxo, por lo que pueden ser conservadas en bancos de germoplasma, mientras que las semillas de M. peruiferum fueron sensibles a la desecación y al almacenamiento a -18ºC. Estos resultados serán de utilidad para el uso de estas especies en programas de producción de plantas en invernáculo, reforestación, restauración y conservación ex situ en bancos de germoplasma.
Palabras clave: Amburana cearensis; Conservación ex situ; Dormición física; Myroxylon peruiferum; Quina colorada; Roble del país.
Summary
Physical dormancy and ex situ seed conservation of Amburana cearensis and Myroxylon peruiferum (Fabaceae)
Amburana cearensis and Myroxylon peruiferum are two native species from northwestern Argentina that are threatened by exploitation for their wood, making it a priority to establish programs of plant production, restoration ecology and conservation. However, one obstacle for such programs is the occurrence of seed dormancy. The objectives of this study were to determine the presence of physical seed dormancy, possible methods for breaking dormancy, the seed storage behaviour and to assess the dormancy status after seed storage in both species. The seeds of A. cearensis showed physical dormancy and mechanical and chemical scarification were effective methods for breaking seed dormancy. M. peruiferum seeds showed no physical dormancy. A. cearensis produced orthodox seeds, thus they can be preserved in genebanks, while seeds of M. peruiferum were sensitive to desiccation and storage at -18°C. After a year of dry storage, a high proportion of A. cearensis seeds were able to germinate (i.e. physical dormancy levels had reduced). These results will be useful for plant production in the greenhouse, reforestation ecology and in situ and ex situ conservation programs of these two species.
Key words: Amburana cearensis; Seeds conservation; Physical dormancy; Myroxylon peruiferum; Quina colorada; Roble del país.
Introducción
La germinación es un proceso que tiene un papel fundamental en el mantenimiento de las poblaciones de plantas y es por ello que muchas especies desarrollan mecanismos, como la dormición, que les permite a las semillas permanecer por largos períodos de tiempo en el suelo hasta que las condiciones ambientales sean las favorables para el establecimiento de plántulas (Fenner & Thompson, 2005). Se han descripto cinco tipos de dormición, entre las que se encuentra la dormición física, la cual es causada por la cubierta de la semilla (o fruto) que evita la absorción de agua por parte del embrión (Baskin & Baskin, 2014).
La presencia de dormición física ha sido descripta en 17 familias de Angiospermas, incluyendo a la familia Fabaceae (Baskin & Baskin, 2014). La impermeabilidad de la cubierta se debe a la presencia de una o más capas de células en empalizadas (células de Malpighi) impregnadas con sustancias hidrofóbicas (Rolston, 1978; Baskin & Baskin, 2004; Venier et al., 2012). Se ha documentado que el ingreso del agua ocurre en una región anatómica especializada (como el lente en Fabaceae), que en condiciones favorables, actuaría como una válvula higroscópica permitiendo la imbibición de las semillas (De Paula et al., 2012; Baskin & Baskin, 2014). En condiciones naturales, se ha sugerido que la exposición de las semillas a altas temperaturas o a temperaturas fluctuantes serían los responsables de la salida de dormición (Vazquez-Yañes & Orozco- Segovia, 1982), mientras que en condiciones de laboratorio la escarificación mecánica, térmica y química, así como el almacenamiento en seco, las bajas temperaturas y las altas presiones atmosféricas, facilitarían la salida de dormición de las semillas (ver Baskin & Baskin, 2014). Por lo tanto, identificar la presencia de dormición física y los métodos de salida de este estado resultan fundamentales para el manejo, uso y conservación de semillas de especies que presentan este tipo de dormición.
Amburana cearensis (roble del país) y Myroxylon peruiferum (quina colorada) son dos especies nativas de Fabaceae, cuyas poblaciones naturales se encuentran amenazadas debido a la sobreexplotación de su madera, al avance de la frontera agropecuaria y al cambio climático (Brown, 2009). La madera de A. cearensis es utilizada en la elaboración de muebles de gran valor económico y estético, para revestimientos de coches de ferrocarril, cajas, cofres, marcos de cuadros, instrumentos musicales y revestimiento de interiores (Burkart, 1943); a escala global es considerada una especie en peligro de extinción (IUCN, 2014). En el caso de M. peruiferum, su madera es muy apreciada en la fabricación de muebles y enchapados decorativos, para construcciones hidráulicas (puentes o muelles) y en menor escala se utiliza para tacos de billar, marcos de puertas y ventanas (Tinto, 1977; Legname, 1982; Burkart, 1943). Ante esta situación, es imprescindible generar la información de base que permita establecer programas de reforestación, restauración ecológica y conservación ex situ para ambas especies. En el presente trabajo se estudió la presencia de dormición física en las semillas de A. cearensis y M. peruiferum, procedentes de distintas poblaciones, se identificó los métodos más adecuados para la salida de dormición y se evaluó el estado de dormición luego de 12 meses de almacenamiento. Específicamente se pusieron a prueba las siguientes hipótesis: 1) ambas especies presentan dormición física independientemente del tipo de unidad de dispersión (semilla en A. cearensis y fruto en M. peruiferum) y de la población de procedencia y 2) los niveles de dormición de las semillas disminuyen con el tiempo de almacenamiento (Galíndez et al., 2010).
Materiales y métodos
Especies estudiadas
Amburana cearensis (Allemão) A.C. Sm. y Myroxylon peruiferum L. f. son árboles que miden entre 10 y 35 m de altura, nativos de Argentina, Bolivia, Brasil, Paraguay y Perú (Lewis et al., 2005). En Argentina se distribuyen en las provincias de Salta y Jujuy. Amburana cearensis se encuentra en la Selva Pedemontana y M. myroxylon en la Selva Pedemontana y Montana. La primera de las especies florece en los meses de enero y febrero y fructifica de abril a junio. El fruto es una vaina oblonga y presenta semillas aladas. Myroxylon peruiferum florece de agosto a octubre y fructifica de octubre a diciembre. El fruto es una sámara con una semilla apical. Ambas especies son dispersadas por el viento (Digilio & Legname, 1966).
Colecta de semillas
La colecta de semillas se realizó, para ambas especies, en distintas localidades de las provincias de Salta y Jujuy (Tabla 1). Durante el período de dispersión natural de cada una de las especies, se cosecharon frutos de al menos cinco individuos por especie y población. En el laboratorio, se acondicionaron y almacenaron en bolsas de papel a temperatura ambiente hasta su utilización en los ensayos (no mayor a los 10 días).
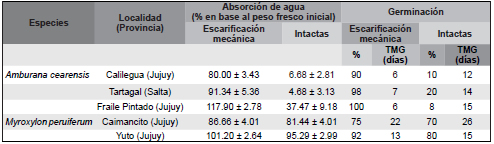
Tabla 1. Media (± 1ES) del porcentaje de absorción de agua y del porcentaje y tiempo medio de germinación (TMG) de las semillas escarificadas mecánicamente e intactas, para cada población (localidad) y especie estudiada.
Presencia de dormición física
Para ambas especies y poblaciones estudiadas, se evaluó la presencia de dormición física en las semillas mediante curvas de imbibición. Para ello, 25 semillas intactas y 25 con escarificación mecánica (obtenida mediante un corte con escalpelo en la región opuesta al micrópilo) se pesaron individualmente con una balanza de precisión (Denver Instrument APX-200) y se sembraron en cajas de Petri sobre agar al 1% en agua a 25 ± 2ºC con luz blanca (fotoperíodo 12/12 hs luz-oscuridad). A intervalos de 2 hs (para las primeras 12 hs) y luego cada 24 hs, las semillas se removieron de las cajas de Petri, se colocaron sobre un papel de filtro (para eliminar la humedad superficial) y se pesaron individualmente. El experimento continuó hasta que la mayoría de las semillas escarificadas mecánicamente germinaron (360 hs de iniciado el ensayo) y se estimó la absorción de agua (% con base en el peso fresco inicial) para las semillas intactas y escarificadas. Debido a que los frutos de M. peruiferum colectados en la localidad de Caimancito presentaron un alto grado de ataque por hongos (> 95%) a las 120 hs de iniciado el ensayo, la viabilidad de las mismas se evaluó mediante una prueba de Tetrazolio siguiendo la metodología propuesta por ISTA (2008).
Salida de dormición física
Para investigar los efectos de la escarificación térmica, química y mecánica sobre la salida de dormición y germinación de las semillas, se realizaron los siguientes tratamientos: 1) escarificación térmica (calor húmedo): las semillas se sumergieron en agua destilada a 40, 60, 80 y 100°C durante dos minutos; 2) escarificación química: las semillas se sumergieron en ácido sulfúrico (98%) durante 10, 20 y 30 minutos; 3) escarificación mecánica: mediante un corte con escalpelo en la región opuesta al micrópilo y 4) semillas intactas (utilizadas como control). Para cada tratamiento, cuatro repeticiones de 25 semillas, fueron colocadas en cajas de Petri con agar al 1% en agua e incubadas en cámaras de germinación a 25 ± 2ºC con luz blanca (fotoperíodo 12/12 hs luz-oscuridad). Los recuentos de germinación se realizaron diariamente por un período de 30 días, tomando como criterio de germinación la emergencia de la radícula. A partir de los datos obtenidos, se estimó la proporción de semillas germinadas y el tiempo medio de germinación (TMG). El TMG en días fue calculado como la S (D n) / S n, donde n es el número de semillas que germinó en el día D y D es el número de días desde el comienzo del ensayo de germinación (Pritchard & Miller, 1995).
Comportamiento de las semillas durante el almacenamiento
Debido a la poca disponibilidad de semillas, el comportamiento durante el almacenamiento sólo se determinó para las semillas de A. cearensis de Fraile Pintado y de M. peruiferum de la localidad de Yuto, siguiendo la metodología propuesta por Pritchard et al. (2004). Para ello, inicialmente se determinó el contenido de humedad (CH) inicial de las semillas (ISTA, 2008) y se evaluó su capacidad germinativa. Luego, lotes de semillas fueron colocados en una cámara de secado (15% humedad relativa y 15°C). Una vez que las semillas equilibraron su CH, aproximadamente a los 30 días, se determinó nuevamente el CH y la capacidad germinativa. Las semillas fueron colocadas en bolsas de aluminio trilaminadas, selladas herméticamente y almacenadas a -18 ± 2°C durante 3 y 12 meses. Al finalizar cada uno de estos períodos se determinó nuevamente el CH y la capacidad germinativa. En todos los casos, para evaluar la capacidad germinativa se utilizaron al menos dos repeticiones de 13 semillas cada una (dependiendo de la disponibilidad de semillas) que fueron colocadas en cajas de Petri con agar al 1% en agua e incubadas en una cámara de germinación a 25 ± 2ºC con luz blanca (fotoperíodo: 12/12 luz-oscuridad). Debido a que las semillas de A. cearensis presentaron dormición física (ver resultados), para evaluar su capacidad germinativa, fue necesario escarificarlas mecánicamente. El estado de dormición de las mismas luego de 12 meses de almacenamiento a -18°C, se evaluó colocando cuatro repeticiones de 25 semillas cada una de semillas escarificadas y sin escarificar en cajas de Petri con agar al 1% en agua e incubadas en cámaras de germinación a 25 ± 2ºC con luz blanca (fotoperíodo 12/12 hs luz-oscuridad).
Análisis estadístico
Los porcentajes finales de incremento relativo de peso de las semillas con y sin escarificación mecánica se compararon utilizando una prueba t de Student. La proporción de semillas germinadas y el TMG entre los distintos métodos de salida de dormición se compararon mediante un ANOVA. En todos los casos, se utilizó la prueba DGC (Di Rienzo et al., 2002) para comparar las medias en los casos en que las diferencias resultaron significativas. A fin de evaluar si hubo diferencias en la proporción de semillas germinadas antes y después de secarlas y después de 3 y 12 meses de almacenamiento se utilizó la prueba exacta de Irwin Fisher que permite realizar esta comparación aun cuando el tamaño de la muestra sea pequeño (Balzarini et al., 2011). Para el análisis se utilizó la transformación arco seno de la raíz cuadrada de la proporción de semillas germinadas.
Resultados
Presencia de dormición física
Para las tres poblaciones de A. cearensis se encontraron diferencias significativas en el porcentaje de incremento relativo de peso entre las semillas escarificadas y las intactas (Calilegua: t = 16.53, p < 0.0001; Tartagal: t = 13.97, p < 0.0001; Fraile Pintado: t = 5.27, p < 0.0001). En todos los casos se registró un incremento promedio ≥ 80% del peso fresco inicial en las semillas escarificadas, mientras que en las intactas fue < 38%. Para todas las poblaciones, se registró mayor porcentaje de germinación y menor tiempo de germinación en las semillas que fueron escarificadas comparados con las semillas intactas (Tabla 1).
Para M. peruiferum, tanto las semillas colectadas en Caimancito como las de Yuto no presentaron diferencias significativas en el porcentaje de incremento en peso entre las semillas escarificadas y las intactas (p > 0.05) y el porcentaje de germinación / viabilidad fueron similares para ambos tratamientos y poblaciones estudiadas (Tabla 1).
Salida de dormición física
Para A. cearensis se registraron diferencias significativas entre los distintos tratamientos de salida de dormición para todas las poblaciones estudiadas (Fig.1). Para la población de Calilegua, las semillas escarificadas mecánica y químicamente con ácido sulfúrico durante 10 minutos, presentaron mayores proporciones de semillas germinadas que los otros tratamientos (F1,5 = 61.76, p < 0.0001). En los tratamientos de calor húmedo a 40 y 60°C no se registró germinación de semillas (Fig. 1A). Los TMG fueron significativamente menores en los tres tratamientos con escarificación química que en los otros tratamientos (F1,5 = 35.93, p < 0.0001; Fig. 1B). Para la población de Tartagal, las semillas escarificadas mecánica y químicamente registraron mayores valores de germinación (F1,6 = 26.60, p < 0.0001). En el tratamiento de calor húmedo a 100ºC no se registró germinación (Fig. 1C). Los menores tiempos de germinación se registraron en los tratamientos de escarificación mecánica, química y con calor húmedo a 40° y 60°C (F1,7 = 340.9, p < 0.0001; Fig. 1D). Para la población de Fraile Pintado, los mayores valores de germinación se registraron en los tratamientos de escarificación mecánica, química y con calor húmedo a 80°C (F1,8 = 24.83, p < 0.0001; Fig. 1E) y los menores TMG en las semillas con escarificación química con ácido sulfúrico durante 20 y 30 minutos (F1,8 = 169.6, p < 0.0001; Fig. 1F).

Fig. 1. Media (± 1ES) de la proporción de semillas germinadas y del tiempo medio de germinación (TMG) de semillas intactas (I) y sometidas a escarificación mecánica (M), con ácido sulfúrico (10',20' y 30') y con agua caliente (40°, 60°, 80° y 100°C) de Amburana cearensis colectadas en Calilegua (A, B), Tartagal (C, D) y Fraile Pintado (E, F). Tratamientos con letras iguales no difieren estadísticamente (p > 0.05).
Comportamiento de las semillas durante el almacenamiento
Previo al secado de las semillas, el contenido de humedad (CH) de las semillas de A. cearensis fue de 8.78 ± 0.1% y una capacidad germinativa del 100%. A los 30 días de ser colocadas en la cámara de secado (15% HR y 15ºC), las semillas equilibraron su CH en 5.99 ± 0.02% y su capacidad germinativa se mantuvo en el 100%. Luego de tres meses de conservación a -18ºC, se registró que el 96.2 ± 3.8% de las semillas germinaron, porcentaje que se mantuvo luego de 12 meses de almacenamiento. Con relación al estado de dormición de las semillas, se registró un mayor porcentaje de germinación cuando las semillas fueron escarificadas comparadas con las intactas (92 ± 3.9 vs 54 ± 2.5), aunque el porcentaje de semillas intactas germinadas duplicó al obtenido inicialmente (Fig. 1E).
Para M. peruiferum, el CH de las semillas inicial fue de 8.9 ± 0.1%, con una capacidad germinativa del 90 ± 6%. Luego de 30 días de permanecer en la cámara de secado, el CH se equilibró en 6.1 ± 0.2%, con una capacidad germinativa del 61.5 ± 7.7%. Luego de tres meses de conservación a -18ºC, el porcentaje de semillas germinadas fue de 46 ± 1.1%, porcentaje que se mantuvo luego de 12 meses de almacenamiento.
Discusión
El cambio en el uso del suelo y el cambio climático están afectando negativamente los ecosistema naturales, por lo que existe la necesidad de llevar a cabo programas de manejo y conservación in situ y ex situ de las especies y comunidades de las que forman parte (Davide et al., 2003; Carvalho et al., 2006). Para ello, es fundamental conocer los requerimientos de germinación, la presencia y tipo de dormición y el comportamiento durante el almacenamiento de las semillas, de tal manera de poder comprender y predecir los procesos que ocurren en las comunidades naturales tales como el establecimiento, la sucesión y la regeneración natural (Vázquez-Yanes & Orozco-Segovia, 1993; Souza & Valio, 2001; Hoyle et al., 2014) y elaborar protocolos de conservación de las especies (Hay & Probert, 2013).
En este trabajo, se estudió la presencia de dormición física, los métodos de salida de dormición y el comportamiento durante el almacenamiento de las semillas de Amburana cearensis y Myroxylon peruiferum, dos especies de importancia forestal, estando la primera categorizada como amenazada de extinción (IUCN, 2014) debido a la sobreexplotación por el valor de su madera. Para A. cearensis las tres poblaciones estudiadas produjeron, al momento de la dispersión, semillas con cubiertas impermeables al agua, es decir que presentaron dormición física. Tal como los resultados indican, la absorción de agua fue significativamente mayor en semillas escarificadas. Esto ha sido ampliamente documentado para numerosas especies de la familia Fabaceae (Baskin & Baskin, 2014; Ortega-Baes et al., 2002; Funes & Venier, 2006; Galíndez et al., 2010; de Souza et al., 2012; Rodrigues-Junior et al., 2014). La presencia de dormición física está fuertemente asociada a la estructura anatómica de la cubierta seminal (o del fruto). Si bien se considera que la dormición física es una característica común de esta familia, algunas especies no presentan este tipo de dormición (Baskin & Baskin, 2014). Este es el caso de M. peruiferum, ya que ambas poblaciones produjeron semillas sin dormición al momento de la dispersión. En esta especie la unidad de dispersión es el fruto, el que no presentaría (ni en la cubierta seminal, ni el pericarpo) una estructura anatómica típica de especies con dormición física (Baskin et al., 2000).
Diversos métodos artificiales han sido descriptos para romper la dormición física de las semillas, como por ejemplo la escarificación mecánica, química con ácido sulfúrico y térmica con calor húmedo (Baskin & Baskin, 2014; Ortega-Baes et al., 2002; Galíndez et al., 2010). Se ha sugerido que la aplicación de ácido sulfúrico incrementaría la permeabilidad de la cubierta de las semillas, ya que se desagregarían porciones de la misma, mientras que los tratamientos con calor húmedo intervendrían a nivel del área anatómica especializada, rompiendo la válvula de agua (Li et al., 1999). La aplicación de cualquiera de estos métodos requiere el ajuste del tiempo en el que las semillas serán sometidas a dichos tratamientos, para evitar el daño o muerte del embrión (Baskin & Baskin, 2014). Para A. cearensis, las semillas procedentes de Calilegua germinaron en mayor porcentaje y en menor tiempo cuando fueron sometidas a escarificación con ácido sulfúrico durante 10 minutos, mientras que las semillas de Tartagal lo hicieron cuando fueron escarificadas mecánicamente y con ácido durante 10, 20 y 30 minutos. En ambos casos, la inmersión en agua caliente a temperaturas de 40, 60 y 100ºC no facilitó la salida de dormición o fue perjudicial para las semillas. Para las semillas de Fraile Pintado, aun cuando los porcentajes de germinación fueron mayores cuando se sometieron a escarificación mecánica, química o inmersas en agua a 80ºC, los menores tiempos de germinación sólo se registraron a 20 y 30 minutos con ácido sulfúrico. Resultados similares han sido citados para otras especies de esta familia y de otras familias que presentan este tipo de dormición (Baskin & Baskin, 2014; Ortega-Baes et al., 2002; Daws et al., 2006; Galindez et al., 2010; Abudureheman et al., 2014). Las diferencias entre poblaciones podrían estar asociadas con el grado de dormición que presentan las semillas debido a las condiciones ambientales a las que estuvieron sometidas durante el desarrollo y maduración (Baskin et al., 2005).
Con base en el comportamiento de las semillas durante el almacenamiento, estas pueden ser clasificadas como ortodoxas, intermedias y recalcitrantes. Las semillas ortodoxas toleran la desecación a bajos contenidos de humedad (3-7 %) y pueden ser almacenadas a temperaturas menores a 0°C (Roberts, 1973). Las semillas con comportamiento intermedio, toleran parcialmente la desecación (hasta un 8%, aproximadamente) y pueden ser almacenadas en un rango de temperaturas entre 0° y 12°C (Hong & Ellis, 1996). Por último, las semillas recalcitrantes no toleran la desecación y no pueden ser almacenadas a temperaturas menores a 0°C (Roberts, 1973). En este trabajo y similar a lo registrado por Figliolia (1988), encontramos que las semillas de A. cearensis se comportaron como ortodoxas ya que toleraron la desecación a contenidos de humedad del 6% y su viabilidad (96%) se mantuvo luego de ser almacenadas a -18°C durante 3 y 12 meses. Este resultado coincide con los publicados por Jayasuriya et al. (2012, 2013) quienes mencionaron que más del 98% de las especies de Fabaceae tienen semillas ortodoxas, por lo que pueden ser conservadas a largo plazo en bancos de germoplasma. Asimismo, se ha mencionado que las semillas de algunas especies con dormición física, salen de este estado parcial o totalmente cuando son almacenadas en seco (Baskin et al., 2005; Galindez et al., 2010). Este es el caso de las semillas de A. cearensis, ya que luego de 12 meses de almacenamiento presentaron mayores porcentajes de germinación comparado con las semillas recién colectadas (54 vs 20 %, respectivamente).
Las semillas de M. peruiferum, fueron sensibles al secado y al almacenamiento a -18ºC ya que la viabilidad inicial (90%) disminuyó aproximadamente un 30% luego de ser secadas (6% de CH) y un 25% luego de 3 meses de almacenamiento (46%), el que se mantuvo a los 12 meses. Así, la población de semillas estudiada de esta especie presentó comportamiento intermedio (Hong & Ellis, 1996). Estos resultados difieren de los registrados por Carvalho et al., (2006), quienes mencionaron que esta especie tendría un comportamiento ortodoxo. Sin embargo, estos autores almacenaron las semillas con CH del 10% a 5º y -18ºC durante 3 meses, condiciones que se asemejarían más a un comportamiento intermedio que ortodoxo. No obstante, se deben realizar nuevos estudios con semillas de otras poblaciones de esta especie, para evaluar si los resultados registrados en el presente trabajo son consistentes a lo largo del rango de distribución y así poder dilucidar si las respuestas obtenidas son específicas de la especie.
En síntesis, las semillas de A. cearensis presentan dormición física, siendo la escarificación mecánica y química los métodos más eficiente para la salida de dormición. Además, presentan semillas ortodoxas por lo que pueden ser conservadas a largo plazo en bancos de germoplasma. El almacenaje de las semillas durante 12 meses afectó los niveles de dormición física de las semillas. Las semillas de M. peruiferum no presentan dormición física al momento de la dispersión y son sensibles al secado y al almacenamiento a bajas temperaturas. Al menos, para esta última especie es necesario evaluar estos últimos resultados en diferentes poblaciones. El conocimiento generado en el presente trabajo será de utilidad para programas de conservación in situ y ex situ de estas dos especies arbóreas de importancia forestal.
Agradecimientos
A Silvia Sühring por el asesoramiento con el análisis estadístico de los datos y a Gustavo Viera y Lucio Ortiz quienes colectaron las semillas. El trabajo fue financiado por los proyectos INTA-SALJU-1232206, INTA-PNBIO 1131044 e INTA-PNBIO 1131022.
Bibliografía
1. ABUDUREHEMAN, B., LIU, H., ZHANG, D. & GUAN, K. 2014. Identification of physical dormancy and dormancy release patterns in several species (Fabaceae) of the cold desert, north-west China. Seed Sci. Res. 24: 133-145. [ Links ]
2. BALZARINI, M. G., GONZALEZ, L., TABLADA, M., CASANOVES, F., DI RIENZO, J. A. & ROBLEDO C. W. 2011. Manual del Usuario. Ed. Brujas, Córdoba. [ Links ]
3. BASKIN, C. C. & BASKIN, J. M. 2014. Seeds: Ecology, Biogeography, and Evolution of Dormancy and Germination. Academic Press, San Diego. [ Links ]
4. BASKIN, J. M., BASKIN, C. C. & XIAOJIE L. 2000. Taxonomy, anatomy and evolution of physical dormancy in seeds. Plant Spec. Biol. 15: 139-152. [ Links ]
5. BASKIN, J. M. & BASKIN, C. C. 2004. A classification system for seed dormancy. Seed Sci. Res. 14: 1-16. [ Links ]
6. BASKIN, C. C., BASKIN, J. M., YOSHINAGA, A. & THOMPSON, K. 2005. Germination of drupelets in multi-seeded drupes of the shrub Leptecophylla tameiameiae (Ericaceae) from Hawaii, a case for deep physiological dormancy broken by high temperatures. Seed Sci. Res. 15: 349-356. [ Links ]
7. BROWN, A. 2009. Las selvas pedemontanas de las Yungas: Manejo sustentable y conservación de la biodiversidad de un ecosistema prioritario del noroeste argentino. En: Brown, A. D., Blendinger, P. G, Lomáscolo, T., García Bes, P. (eds.), Selva Pedemontana de las Yungas. Historia natural, ecología y manejo de un ecosistema en peligro: 13- 36. Ediciones del Subtrópico, Tucumán. [ Links ]
8. BURKART, A. 1943. Las Leguminosas Argentinas Silvestres y Cultivadas. Acme, Buenos Aires. [ Links ]
9. CARVALHO, L. R., DA SILVA, E. A. A. & DAVIDE, A. C. 2006. Classificação de sementes florestais quanto ao comportamento no armazenamento. Revista Brasil. Sementes 28: 15-25. [ Links ]
10. DAVIDE, A. C., CARVALHO, L. R, CARVALHO, M. L. M. & GUIMARÃES, R. M. 2003. Classificação fisiológica de sementes de espécies florestais pertencentes à família Lauraceae quanto à capacidade de armazenamento. Cerne, Lavras, 9: 29-35. [ Links ]
11. DAWS, M. I., GARWOOD, N. C. & PRITCHARD, H. W. 2006. Prediction of desiccation sensitivity in seeds of woody species: a probabilistic model based on two seed traits and 104 species. Ann. Bot. 97: 667-674. [ Links ]
12. DE PAULA, A. S., DELGADO, C. M. L., PAULILO, M. T. S. & SANTOS, M. 2012. Breaking physical dormancy of Cassia leptophylla and Senna macranthera (Fabaceae: Caesalpinioideae) seeds: water absorption and alternating temperatures. Seed Sci. Res. 22: 259-267. [ Links ]
13. DE SOUZA, T. V., VOLTOLINI, C. H., SANTOS, M. & PAULILO, M. T. S. 2012. Water absorption and dormancy-breaking requirements of physically dormant seeds of Schizolobium parahyba (Fabaceae - Caesalpinioideae). Seed Sci. Res. 22: 169-176. [ Links ]
14. DIGILIO, A. P. & LEGNAME, P. R. 1966. Los árboles indígenas de la provincia de Tucumán. Opera Lilloana 15. [ Links ]
15. DI RIENZO, J. A., GUZMÁN, A. W. & CASANOVES, F. 2002. A multiple-comparisons method based on the distribution of the root node distance of a binary tree. J. Agric. Biol. Environ. Stat. 7: 129-142. [ Links ]
16. FENNER, M. & THOMPSON, K. 2005. The Ecology of Seeds. Cambridge University Press, Cambridge. [ Links ]
17. FIGLIOLIA, M. B. 1988. Conservatorio de sementes de essencias florestais. Boletim Tecn. Inst. Florestal 42:1-18. [ Links ]
18. FUNES, G. & VENIER, P. 2006. Dormancy and germination in three Acacia (Fabaceae) species from central Argentina. Seed Sci. Res. 16: 77-82. [ Links ]
19. GALÍNDEZ, G., P. ORTEGA-BAES, C.E. SEAL, M. I. DAWS, A. L. SCOPEL & H.W. PRITCHARD. 2010. Physical seed dormancy in Collaea argentina (Fabaceae) and Abutilon pauciflorum (Malvaceae). Seed Sci. and Tech. 38: 777-782. [ Links ]
20. HAY, F. R. & PROBERT, R. J. 2013. Advances in seed conservation of wild plant species: a review of recent research. Conserv. Physiol. 1: 1-11. [ Links ]
21. HONG, T. D. & ELLIS, R. H. 1996. A protocol to determine seed storage behavior. Technical Bulletin 1, Bioversity Internacional, Roma. [ Links ]
22. HOYLE, G. L., CORDINER, H., GOOD, R. B. & NICOTRA, A. B. 2014. Effects of reduced winter duration on seed dormancy and germination in six populations of the alpine herb Aciphyllya glacialis (Apiaceae). Conserv. Biol. 2: 1-11. [ Links ]
23. ISTA, 2008. International Rules for Seed Testing. International Seed Testing Association, Bassersdorf. [ Links ]
24. IUCN. 2014. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org> [ Links ].
25. JAYASURIYA, K. M. G. G., BASKIN, J. M., BASKIN, C. C. & FERNANDO, M. T. R. 2012. Variation in seed dormancy and storage behavior of three liana species of Derris (Fabaceae, Faboideae) in Sri Lanka and ecological implications. Res. J. Seed Sc. 5: 1-18. [ Links ]
26. JAYASURIYA, K. M. G. G., WIJETUNGA, A. S. T. B., BASKIN, J. M. & BASKIN, C. C. 2013. Seed dormancy and storage behaviour in tropical Fabaceae: a study of 100 species from Sri Lanka. Seed Sci. Res. 23: 257-269. [ Links ]
27. LEGNAME, P. R. 1982. Árboles Indígenas del Noroeste Argentino. Opera Lilloana 34. [ Links ]
28. LEWIS, G. P., SCHRIRE, B., MACKINDER, B. & LOCK, M. 2005. Legumes of the World. The Royal Botanic Gardens, Kew. [ Links ]
29. LI, X., BASKIN, J. M. & BASKIN, C. C. 1999. Seed morphology and physical dormancy of several North American Rhus species (Anacardiaceae). Seed Sci. Res. 9: 247-258. [ Links ]
30. ORTEGA BAES P., DE VIANA M. & SÜHRING, S. 2002. Germination in Prosopis ferox seeds: effects of mechanical, chemical and biological scarificatiors. J. Arid Environ. 50: 185-189. [ Links ]
31. PRITCHARD, H. W. & MILLER, A. P. 1995. The effect of constant temperatures, light and seed quality on the germination characteristics of Agave americana. Bol. Soc. Bot. México 57: 11-14. [ Links ]
32. PRITCHARD, H. W., WOOD, C. B., HODGES, S. & VAUTIER, H. J. 2004. 100-seed test for desiccation tolerance and germination: a case study on eight tropical palm species. Seed Sci. Technol. 32: 393- 403. [ Links ]
33. ROBERTS, E. H. 1973. Predicting the storage life of seeds. Seed Sci. Technol. 1: 499-514. [ Links ]
34. RODRIGUES-JUNIOR, A. G., FARIA, J. M. R., VAZ, T. A. A., NAKAMURA, A. T. & ANDERSON, C. J. 2014. Physical dormancy in Senna multijuga (Fabaceae: Caesalpinioideae) seeds: the role of seed structures in water uptake. Seed Sci. Res. 24: 147-157. [ Links ]
35. ROLSTON, M.P. 1978. Water impermeable seed dormancy. Bot. Rev. 44: 365-396. [ Links ]
36. SOUZA, R. P. & VALIO, I. F. M. 2001. Seed size, seed germination, and seedling survival of Brazilian tropical tree species differing in successional status. Biotropica 33: 447-457. [ Links ]
37. TINTO, J., 1977. Utilización de los Recursos Forestales Argentinos. Instituto Forestal Nacional, Subsecretaría de Recursos Naturales Renovables y Ecología, Ministerio de Economía, Buenos Aires. [ Links ]
38. VÁZQUEZ-YAÑES, C. & OROZCO-SEGOVIA, A. 1982. Seed germination of a tropical rain forest pioneer tree Heliocarpus donnell-smithii in response to diurnal fluctuation of temperature. Physiol. Plant 56:295-298. [ Links ]
39. VÁZQUEZ-YAÑES, C. & OROZCO-SEGOVIA, A. 1993. Patterns of seed longevity and germination in the tropical rain forest. Ann. Rev. Ecol. Syst. 24: 69-87. [ Links ]
40. VENIER, P., FUNES, G. & CARRIZO GARCÍA, C. 2012. Physical dormancy and histological features of seeds of five Acacia species (Fabaceae) from xerophytic forests in central Argentina. Flora 207: 39-46. [ Links ]
Recibido el 23 de octubre de 2014,
aceptado el 6 de marzo de 2015.













