Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.51 no.2 Córdoba jun. 2016
PALEOBOTÁNICA Y PALINOLOGÍA
Esporas de helechos (monilofitas) y licofitas presentes en el Parque Nacional El Palmar (Entre Rios, Argentina)
Mercedes Di Pasquo1, Estela Rodríguez2, Noelia Nuñez Otaño1, Nadia Muñoz1 y Leonardo Silvestri1
1 Laboratorio de Palinoestratigrafía y Paleobotánica y
2 Laboratorio de Ecología Vegetal, CICYTTP-CONICET, Dr. Matteri y España S/N, Diamante (E3105BWA), Entre Ríos, Argentina. Repositorio del material. E-mail: medipa@cicyttp.org.ar
Resumen
Se analiza la morfología de esporas de doce especies de helechos (monilofitas) y licofitas colectadas entre 2011 y 2014 (Adiantopsis chlorophylla (Swartz) Fée, Adiantum raddianum C. Presl., Anemia tomentosa (Savigny) Sw. var. tomentosa, Asplenium ulbrichtii Rosenst., Doryopteris concolor (Langsd. & Fisch.) Kuhn, Equisetum giganteum L., Microgramma x mortoniana De la Sota, Nephrolepis cordifolia (L.) C. Presl, Pleopeltis pleopeltifolia (Raddi) Alston, Pleopeltis minima (Bory) Prado & Hirai, Rumohra adiantiformis (G. Forst.) Ching, Selaginella sellowii Hieronymus) en el Parque Nacional El Palmar. Se describen e ilustran esporas monoletes y triletes con MO (algunas complementadas con MEB y fluorescencia), y se muestran variaciones morfológicas intraespecíficas presentes en varios taxones. Se brinda información de la distribución de especies dentro del parque, siendo A. clorophylla la forma terrestre dominante en áreas abiertas de pastizales-palmares en tanto, M. mortoniana y P. pleopeltifolia son epífitas en la palmera Butia yatay (Mart.) Becc. (zonas de palmares) y en algunas especies arbóreas de bosques en galería. Se adicionan Nephrolepis cordifolia, Pleopeltis pleopeltifolia y Rumohra adiantiformis como nuevos registros para la Provincia de Entre Ríos, las cuales no se encuentran documentadas en la Base de datos de la Flora del Cono Sur. Se incorporan seis nuevos registros para el PNEP y siete especies para la cuenca del Arroyo El Palmar. El análisis de riesgo de las especies basado en las caterorías de PlanEar nos indica que los helechos registrados son abundantes en los lugares de origen y tienen una amplia distribución geográfica en más de una de las unidades fitogeográficas del país, por lo tanto, no se encuentran en riesgo.
Palabras clave: Esporas; Helechos; Licofitas; Morfología; Diversidad; Ecología; Distribución.
Summary
Fern (Monilophyta) and lycophyte spores present in the National Park El Palmar (Entre Rios, Argentina).
Spore morphology of twelve species of ferns (monilophytes) and lycophytes collected between 2011 and 2014 (Adiantopsis chlorophylla (Swartz) Fée, Adiantum raddianum C. Presl., Anemia tomentosa (Savigny) Sw. var. tomentosa, Asplenium ulbrichtii Rosenst., Doryopteris concolor (Langsd. & Fisch.) Kuhn, Equisetum giganteum L., Microgramma x mortoniana De la Sota, Nephrolepis cordifolia (L.) C. Presl, Pleopeltis pleopeltifolia (Raddi) Alston, Pleopeltis minima (Bory) Prado & Hirai, Rumohra adiantiformis (G. Forst.) Ching, Selaginella sellowii Hieronymus) in the El Palmar National Park are analysed. Trilete and monolete and one monoporate spores are described and illustrated with LM (some complemented with SEM and fluorescence´s pictures). Morphological variations observed into each species of several taxa are documented. Information on the distribution of species within the park is provided, where A. clorophylla is the dominant terrestrial species in grassland and palm areas whilst, M. x mortoniana and P. pleopeltifolia are epiphytes in the palm Butia yatay (Mart.) Becc. (palm areas) and in some tree species in gallery forests. Nephrolepis cordifolia, Pleopeltis pleopeltifolia and Rumohra adiantiformis are added as new records for the Entre Ríos Province, which are not documented in the database of the Flora of the Southern Hemisphere. Seven new records are incorporated to the Arroyo El Palmar basin (18 species in total) and six species to the PNEP (15 species). The risk analysis based on the categories proposed by PlanEar indicates that the documented ferns are abundant in their places of origin and have broad geographical distributions in more than one of the phytogeographic units in the country, therefore they are not in risk.
Key words: Spores; Helechos; Licofitas; Morphology; Diversity; Ecology; Distribution.
Introducción
Los helechos (monilofitas) y licofitas (Pryer et al., 2004) son plantas vasculares sin semillas cuyo ciclo de vida presenta una alternancia de generaciones, donde la fase gametofítica es efímera y la esporofítica posee porte herbáceo (incluye helechos arborescentes en áreas trópico-ecuatoriales) y una vida que puede ser prolongada por años hasta unas pocas décadas en situaciones ambientales favorables (Page, 2002; Zuquim et al., 2008, p. 32). Este grupo de plantas presenta caracteres primitivos, de interés, desde los puntos de vista filogenético, evolutivo, palinológicos y ecológicos (Rothwell, 1996; De la Sota et al., 2009). En la actualidad, los helechos y licófitas, representan el 8% (12.240 especies) de las plantas vasculares, distribuidas en diversos ecosistemas de todo el mundo (Moran, 2008; Martínez et al., 2012). Numerosos estudios de vegetación, realizados por diversos investigadores en América del Sur, permitieron a Zuloaga et al. (2008) generar una base de datos sobre la Flora del Cono Sur. En ella, los helechos y licofitas representan el 3,6 % de un de total 9.690 especies citadas para la flora vascular de la Republica Argentina, con algo más de 90 géneros y 402 taxones específicos e infraespecíficos. La mayoría de los trabajos florísticos relacionados con las esporas de estos grupos, han sido tratados por regiones o provincias (e.g., Morbelli, 1980; De la Sota & Morbelli, 1985; Naab, 1987 a, 1987b; Morbelli & Michelena, 1989; Michelena, 1989; Morbelli, 1995; Giudice & Morbelli, 1998; Morbelli et al., 2001; Arana et al., 2004; Ramos Giacosa et al., 2004 a, 2004b; Gardenal et al., 2007; Piñeiro & Morbelli, 2012). Si bien se tiene registros de helechos y licofitas presentes en toda la provincia de Entre Ríos (e.g., 32 géneros en Ramos Giacosa et al., 2004 a), Aceñolaza & Rodríguez (2009, 2011) y Rodríguez (2013) mencionaron para área de la cuenca del Palmar la presencia de diez especies: Adiantum raddianum C. Presl., Adiantopsis tweediana (Hook.) Link-Pérez & Hickey, A. chlorophylla (Swartz) Fée, Azolla filiculoides Lam., Equisetum giganteum L., Marsilea ancylopoda A. Braun, Microgramma x mortoniana De la Sota, Pleopeltis minima (Bory) Prado & Hirai, Salvinia biloba Raddi y Selaginella muscosa Spring. En tanto, Batista et al. (2014) citan 8 especies en el Parque Nacional El Palmar: Adiantopsis chlorophylla, Anemia tomentosa (Savigny) Sw., Anogramma chaerophylla (Desv.) Link, Doryopteris concolor (Langsd. & Fisch.) Kuhn, Marsilea ancylopoda, Microgramma sp., Rumohra adiantiformis (G. Forst.) Ching y Selaginella sp.
Es bien conocido, que el estudio de las esporas de helechos y licofitas es una herramienta importante para la determinación de las plantas, ya que proveen de caracteres útiles para distinguir géneros y especies, tales como el tamaño, forma y estructura de la pared de la espora. Sin embargo, el carácter diagnóstico más distintivo en las esporas reside en la ornamentación del exosporio y perisporio (Morbelli, 1980; Tyron & Lugardon, 1991).
No obstante, son escasos los estudios palinológicos publicados de especies de helechos y licofitas procedentes de la Provincia de Entre Ríos (De la Sota & Morbelli, 1981, 1985; Ponce & Morbelli, 1989; Ramos Giacosa et al., 2001; Morbelli et al., 2001). Los análisis palinológicos realizados hasta el momento en helechos y licofitas de esta provincia incluyen el estudio de la distribución de los esporangios en estróbilos de Selaginella sellowii y micro- y megasporas de S. muscosa mediante Microscopía electrónica de barrido (MEB) y de transmisión (TEM), utilizando ejemplares del Arroyo El Palmar y de otros sitios de Argentina (De la Sota & Morbelli, 1981; Morbelli et al., 2001). De la Sota & Morbelli (1985) determinaron la presencia de Pteris vittata L. en Argentina analizando sus esporas de material de herbario entre los que citaron ejemplares de la Provincia de Entre Ríos y Ponce & Morbelli (1989) analizaron la morfología de las esporas del grupo Cheilantes dichotoma de América del Sur, y entre ellos describen la especie Adiantopsis tweediana como único representante del grupo en Entre Ríos.
A partir de la escasa información palinológica mencionada para la provincia de Entre Ríos, el principal objetivo de este trabajo es describir e ilustrar la morfología de esporas obtenidas de ejemplares maduros e inmaduros de especies de pteridofitas colectadas en el parque, y registrar posibles variaciones morfológicas intraespecíficas. Este estudio es el primero de una serie de publicaciones sobre la palinoflora actual del PNEP que permitirá asegurar la clasificación taxonómica de especies de palinomorfos dispersos obtenidos de muestras aeropalinológicas (Muñoz & di Pasquo, 2015), y de sedimentos de superficie y subsuperficie del Holoceno (Nuñez Otaño et al., 2015 a, 2015b). Se analiza, además, el estado de conservación de las especies registradas dentro del parque siguiendo la clasificación propuesta por PlanEar (Villamil et al., 2009-2010).
Materiales y Métodos
Características del sitio de estudio: El Parque Nacional el Palmar (PNEP, 31º55' S; 58º17' O) está ubicado en el centro-este de la provincia de Entre Ríos (Dpto. Colón) sobre la margen derecha del Río Uruguay (Fig. 1 A). Fue creado en el año 1965 mediante Ley Nacional Nº 16.802/65, con el propósito de conservar la porción de la sabana húmeda mesopotámica de pastizales templados dominados por la palmera Butia yatay (Mart.) Becc. Forma parte del Sitio Ramsar Palmar Yatay designado "de importancia internacional" por la Convención Ramsar en 2011 e integra la lista mundial de sitios Ramsar (www.ramsar.org/ris/key_ris_index.htm). Constituye un relicto de 8.500 hectáreas, dividido en dos áreas principales de acuerdo con la ubicación del arroyo El Palmar (Fig. 1 B): la zona norte donde tienen lugar las actividades turísticas (paseos y áreas de recreación) y se encuentran las áreas de Intendencia, Camping, y los sitios asignados a los guardaparques (viviendas y áreas de control), y la zona sur llamada intangible, cerrada al turismo a fin de preservar sus ambientes naturales.

Fig. 1. A: Ubicación geográfica del Parque Nacional El Palmar en la Provincia de Entre Ríos, en la cual se reconocen dos Ecoregiones de la Argentina (Brown & Pacheco, 2006). B: Mapa de vegetación del PNEP modificado de la Administración de Parques Nacionales (Movia & Menvielle, 1994; Batista et al., 2014). El Arroyo El Palmar atraviesa el parque y lo divide en dos zonas, Norte y Sur. Los sitios de colecta corresponden a: sitio 3- área de Intendencia y bosque en galería, sitio 4- Paseos La Glorieta y Vuelta de Yatay (bosque en galería), sitios 5 y 6- área sur del parque (intangible). El arroyo Los Loros se ubica al norte del sitio 3.
Esta región se caracteriza por presentar un clima templado-cálido, lluvioso, con temperatura media anual de 19 ºC y precipitación media anual de 1346 mm. Si bien la precipitación máxima se registra en verano, la elevada temperatura produce un déficit hídrico que favorece la probabilidad de incendios naturales (Goveto, 2005). Fitogeográficamente, Soriano (1991) incluye el área de estudio en la región de pastizales subhúmedos templados del Río de la Plata, los cuales se extienden entre los 28º y 38º S, en las planicies del centro-este de Argentina (Fig. 1 A), Uruguay y sur de Brasil (campos). Los tipos de vegetación dominante en el paisaje del PNEP son los pastizales (con y sin arbustos) y los palmares, con una marcada heterogeneidad geomorfológica, producto de la acción fluvial del Río Uruguay y de sus afluentes: los arroyos Capilla, El Palmar, Los Loros y Ubajay, donde alternan con pastizales psammófitos, halófilos, humedales, sectores de la selva ribereña y arbustos con distinto grado de invasión de especies arbóreas exóticas (León, 1991; Ciccero & Balabusic, 1994; Ruiz Selmo et al., 2007; Batista et al., 2014; Fig. 1 B). El estrato arbustivo en los palmares es discontinuo y está dominado por especies de Baccharis y Eupatorium. El estrato herbáceo tiene alta cobertura y una gran diversidad de especies de gramíneas y otras hierbas además del helecho Adiantopsis chlorophylla. Estos pastizales se distinguen de los pastizales pampeanos por la abundancia de poáceas subtropicales, principalmente de los géneros Axonopus, Paspalum, Digitaria, Schizachyrium y Bothriochloa (León, 1991; Batista et al., 2014). En la selva ribereña (bosque en galería) se registran numerosas especies arbóreas y entre las más frecuentes se hallan Myrtaceas (Myrcia, Blepharocalyx, Myrceugenia, Eugenia, etc.), y otras como Guettarda uruguensis Cham. & Schltdl., Pouteria salicifolia (Spreng.) Radlk., Alophyllus edulis (A. St.-Hil., A. Juss. & Cambess.) Radlk.), Luehea divaricata Mart. Tanto en las palmeras como en algunos árboles de la selva ribereña se registran especies epífitas principalmente helechos y bromeliáceas.
Colecta: El estudio se desarrolló sobre muestras de esporas que se tomaron de especímenes con frondes fértiles (maduros e inmaduros). El material pteridológico fue colectado de distintos ambientes del PNEP, durante los meses de marzo y diciembre de 2011, abril de 2012, 2013 y 2014, para su posterior herborización e identificación a nivel específico (Apéndice on line: Figs. A1 y A2). A estas especies colectadas, se suman los ejemplares que no se encontraban en estado fértil al momento de la colecta en el parque, los mismos corresponden a las especies acuáticas Azolla filiculoides y Marsilea ancylopoda presentes en áreas inundables y Pteris vittata identificada en las paredes y sustrato rocoso del área de la Intendencia (Fig. 1 B).
Procesamiento: Las muestras fértiles correspondientes a cada una de las especies colectadas fueron incorporadas en tubos Falcon (50 ml) y tratadas con el método de acetólisis para eliminar el contenido celular de las esporas (Gray, 1995). La metodología fue aplicada de manera uniforme en todas las especies (se aplicó la mezcla acetolítica 2 minutos) con el objeto de comparar el resultado aquí obtenido con MO y luz fluorescente. A su vez, esta información podrá ser contrastada con las esporas bajo estudio obtenidas de muestras de sedimentos (superficie y subsuperficie) y aeropalinológicas (Muñoz et al., 2013; Muñoz & di Pasquo, 2015), debido a que fue acetolizado de la misma forma. Los preparados palinológicos de cada residuo orgánico fueron montados con glicerina - parafina (preparados temporarios en los cuales se facilita el movimiento de las esporas para mejorar su observación) y con gelatina - glicerina (permanentes), los cuales fueron objeto de estudio e ilustración bajo microscopía óptica (MO) y luz fluorescente. Para ello se utilizaron dos equipos de microscopía en el Laboratorio de Palinoestratigrafía y Paleobotánica (CICYTTP, Diamante): Nikon Eclipse E200, con videocámara Labomed (5.0 Mp) y Leica DM500 dotado con videocámara Leica EC3 (3.0 Mp) y fluorescencia (MF, lámpara LED y filtro azul de fluoresceina ca. 450 nm). Algunas de las especies colectadas en marzo de 2011 fueron preparadas e ilustradas con Microscopio Electrónico de Barrido (MEB). Se siguió la metodología de deshidratación de la materia orgánica publicada por Morbelli (1980), que consiste brevemente en tratar las esporas con CO3Na2 al 3% en caliente durante 2 minutos, lavar el residuo con agua destilada y filtrar con mallas de 25 y 10 µm (para eliminar el material muy fino) y centrifugar para eliminar toda el agua. La deshidratación se realizó aplicando soluciones cada vez más concentradas de etanol. Las esporas fueron montadas sobre recortes de cubreobjetos según el tamaño de los tacos utilizados por el servicio de MEB del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" (MACN, Buenos Aires, marca Phillips serie XL model 30) y del CERIDE (Santa Fé, marca JEOL, modelo JSM-35C equipado con un sistema dispersivo en energía, marca EDS para análisis químico elemental por rayos X - EPMA). Los trozos de cubreobjetos se ajustaron a una base de alumnio, la cual es adherida con cinta doble faz al taco o portamuestra metálico. Los mismos se recubrieron con Oro-Paladio (200-300 Å de espesor) en el MACN y con Oro en el CERIDE. En este último, además, se realizó un análisis químico elemental por rayos X (detecta sólo aquellos elementos cuyo número atómico esté comprendido entre 11 (Sodio) y 92 (Uranio) inclusive), sobre los elaterios de las esporas de Equisetum giganteum. El análisis químico elemental cualitativo (Tabla 1) se llevó a cabo tratando el espectro de rayos X con el software del sistema EDS y los resultados semicuantitativos se obtuvieron usando el método cuantitativo teórico, comúnmente denominado SEMIQ, que no requiere del empleo de estándares. El espectro de rayos X se adquirió con una tensión de aceleración de 20 kV. La metodología analítica empleada considera como el cien por cien al total de elementos presentes detectados. La distribución porcentual se expresa sobre la base de esta consideración (el oro con el cual se recubrieron los especímenes no fue cuantificado). La observación se realizó bajo el modo de imágenes de electrones secundarios utilizando una tensión de aceleración de 20 kV.
Tabla 1. Elementos químicos identificados en los elaterios de dos ejemplares ilustrados con MEB (Fig. 10 E, I), y su distribución porcentual (promedio) en peso-peso (% p/p).

Repositorio y análisis del material: Los preparados palinológicos fueron incorporados en la Palinoteca de Referencia del laboratorio, numeradas bajo el acrónimo CICYTTP-R (di Pasquo & Silvestri, 2014). Por otra parte, los ejemplares de las especies estudiadas fueron herborizados mediante técnicas convencionales y alojados en el Herbarium Lorentz (DTE) perteneciente al mismo instituto. Las especies fueron identificadas mediante el empleo de claves específicas y bibliografía de referencia (e.g., De la Sota, 1977; Cabrera & Zardini, 1993; Arana & Bianco, 2011; Lorscheitter & Dillenburg, 1998; Lorscheitter et al., 2001, 2002, 2005, 2009). La nomenclatura de los taxones sigue a Zuloaga et al. (2008), donde pueden ser consultadas las listas de sinonimias de las especies vegetales aquí tratadas. Ambas numeraciones se incluyen en la descripción taxonómica de las especies, para lo cual se siguen los criterios morfológicos presentados por Tyron & Lugardon (1991), Morbelli et al. (2001) y Punt et al. (2007). Las mediciones de distintos caracteres fueron tomadas en todos los casos sobre 25 a 30 esporas, y se indican tanto para los diámetros ecuatorial (único o mayor y menor) como polar, sus tamaños mínimo, moda (valor de mayor frecuencia absoluta) y máximo, respectivamente. El grado de amenaza de las especies de helechos aquí analizadas se realiza utilizando la escala de riesgo compuesta por cinco categorías (sin riesgo- 1, amenazada- 5) propuesta por el grupo PlanEar (Villamil et al., 2009-2010) con base principalmente en la distribución regional registrada en la Flora del Cono Sur (Zuloaga et al., 2008).
Resultados
Se describen doce especies de esporas (trilete y monolete) de monilofitas y licofitas terrestres y epífitas registradas en el PNEP, las mismas se presentan bajo el ordenamiento alfabético de sus géneros. La clasificación supragenérica de estos grupos aquí aceptada es la propuesta por Pryer et al. (2004; Smith et al., 2006; Zuloaga et al., 2008), quienes reconocen dos linajes monofiléticos distintos: licofitas y monilofitas. Dentro de las licofitas se incluyen las Lycopodiaceae, Selaginellaceae e Isoetaceae (Moran & Riba, 1995). Entre las monilofitas se incluyen las clases Psilotopsida (Ophioglossaceae y Psilotaceae), Equisetopsida (Equisetaceae), Marattiopsida (Marattiaceae) y Polypodiopsida, siendo este último grupo el de las pteridofitas leptosporangiadas actuales (Smith et al., 2006).
Esporas con marca trilete
Orden Polypodiales
Familia Pteridaceae
1. Adiantopsis chlorophylla (Swartz) Fée (Fig. 2 A-H)
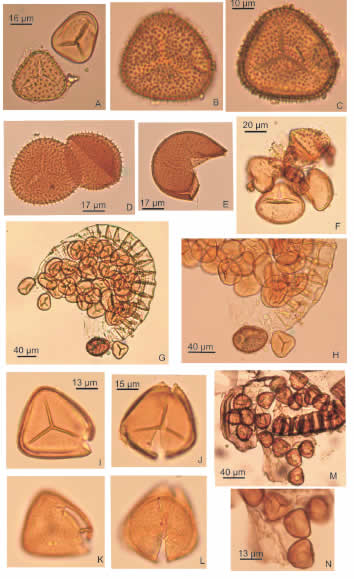
Fig. 2. Esporas de Adiantopsis chorophylla y Adiantum raddianum con MO. A-H: Adiantopsis chlorophylla. A: Dos esporas, una con exosporio liso y otra con perisporio densamente ornamentado de espinas con un patrón rúgulo-reticulado poco distinguible. B-C: Espora con perisporio espinoso (B, cara distal; C, cara proximal). D: Esporas con perisporio ornamentado. E: Espora con perisporio erosionado o degradado. F: Tetrade con esporas lisas (con glóbulos) y una espora con perisporio ornamentado con baja densidad de espinas. G-H: Esporangio con esporas lisas. I-N: Adiantum raddianum. I-L: Esporas con exosporio liso y perisporio ornamentado, cara proximal lisa a sagrinada, y cara distal sagrinada a microgranular (anisopolar). M-N: Esporas en esporangio obtenido de un soro de un ejemplar maduro.
Número de colección de Herbario: 5029DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R40. Colector M. di Pasquo. Período y sitio de colecta: marzo 2011, diciembre 2011 y abril 2013, zona intangible (Fig. 1, sitios 5 y 6).
Descripción: esporas trilete de contorno triangular a subtriangular de lados rectos, tanto para las formas lisas (exosporio adpreso sin perisporio, espesor 1-2 µm) como aquéllas con perisporio ornamentado en ambas caras, cuyo espesor es de 1,5-3 µm (sin ornamentación). La ornamentación se compone de espinas de tamaño y densidad variable, cuyas bases muestran un patrón rúgulo-reticulado (por fusión de sus bases) pobremente definido al microscopio óptico. Laesura 2/3 a ¾ del radio de la espora acompañada en general por márgenes delgados o pliegues.
Dimensiones: Diámetro polar en formas lisas 25(35)40 µm, y formas ornamentadas 40(50)60 µm; altura de espinas 2-4 µm, ancho en sus bases 1-2 µm.
Obs. 1: De una fronde madura verde colectada en diciembre 2011 fueron acetolizados varios soros tomados de una sola pínnula, los cuales brindaron ca. 80% de esporas lisas (en general dentro de los esporangios algunos cerrados) con respecto a las formas ornamentadas (Fig. 2 F-H). En marzo de 2013, se acetolizaron varios soros tomados de un ejemplar muy maduro color verde oscuro a muy oscuro. En este caso se observó un incremento en el número de esporas ornamentadas llegando al 50 % con respecto a las esporas lisas. En general, las esporas lisas presentaron una mayor proporción de glóbulos relacionados con el tapete (Tyron & Lugardon, 1991). Se observaron esporangios con dominio de esporas lisas (Fig. 2 G-H), y tetrades tanto con esporas lisas como ornamentadas (con variable grado de densidad en la ornamentación de cada ejemplar, Fig. 2 F). Las esporas de mayor tamaño y con mejor desarrollo de ornamentación del perisporio (mayor densidad y más complejidad especialmente en la relación entre las bases de las espinas formando un patrón rugulo-reticulado), resultaron ser especímenes maduros liberados de sus tetradas. El patrón rugulo-reticulado formado por la fusión de bases de espinas es poco distinguible en el MO (Fig. 2 B-D). Se observó fluorescencia naranja del perisporio y amarilla del exosporio.
Obs. 2: Michelena (1989) y Tyron & Lugardon (1991) caracterizaron esta especie con perisporio ornamentado por espinas (equinado) y exosporio liso. Las formas ilustradas con MEB por dichos autores muestran un patrón rúgulo-reticulado en las bases de las espinas, el cual es poco distinguible al MO. Michelena (1989) señaló que las Adiantaceae con perisporio ornamentado aparecen en sedimentos del Cuaternario de la Provincia de Buenos Aires como formas globosas de exina lisa, con marca trilete de rayos más o menos elevados. Se observó que el perisporio puede ser degradado o separado del exosporio por procesos mecánicos relacionados con el procesamiento, y con certeza por procesos tafonómicos, por lo que con frecuencia esta especie puede aparecer con exina lisa o con una ornamentación poco distinguible (Fig. 2 E). A esto se suma la producción de un número variable de especímenes lisos inmaduros, en los cuales el perisporio no llega a desarrollarse antes de ser introducidos en los sedimentos por diversas razones. Piñeiro et al. (2006) realizaron un estudio de la ultraestructura (TEM) de las formas ornamentadas concluyendo que los rasgos morfológicos del perisporio ornamentado son útiles para diferenciar esta especie de otras del género (e.g. A. radiata (L.) Fée). Lorscheitter et al. (2001) describieron e ilustraron tanto la especie botánica como sus esporas lisas y ornamentadas con MO y MEB, para el Estado de Rio Grande do Sul. La comparación de todos estos ejemplares con los aquí estudiados, principalmente aquéllos ornamentados, confirma que se trata del mismo taxón.
Ecología y distribución: Terrestre. Perenne. Abunda en áreas abiertas y xéricas de pastizales y en zonas de palmares hasta la zona marginal de las áreas de bosque en galería. Dentro de áreas de bosque en galería no fue registrada. Categoría PlanEar 1: debido a su amplia distribución geográfica en Argentina, Brasil, Uruguay, Paraguay (Zuloaga et al., 2008), con alta capacidad de 8 colonización especialmente en zonas abiertas de pastizales (Bocanelli & Pire, 2011).
2. Adiantum raddianum C. Presl. (Fig. 2 I-N)
Número de colección de Herbario: 5343DTE 17/03/14. Número de colección en Palinoteca de Referencia: CICYTTP-R36. Colectores M. di Pasquo y E. Rodriguez. Fecha y sitio de colecta: diciembre 2011, abril 2013 y marzo 2014, bosque en galería (Fig. 1 B, sitio 4).
Descripción: esporas trilete de contorno triangular de bordes rectos a levemente convexos, lesura recta, sin engrosamientos ni bifurcada en sus extremos extendida aproximadamente hasta su margen externo. Exina lisa. Perisporio sagrinado a microgranular (anisopolar), con cara proximal lisa a sagrinada, y cara distal sagrinada a microgranular.
Dimensiones: Diámetro polar 26(40)52 µm.
Obs. 1: De un soro de un ejemplar maduro se obtuvieron esporas (Fig. 2 M-N) lisas dentro del rango menor del diámetro ecuatorial, y otras de mayor tamaño con perisporio ornamentado. Se observó fluorescencia naranja del perisporio y amarilla del exosporio y en especial se destaca la marca de dehiscencia.
Obs. 2: Esta especie fue descripta e ilustrada sólo con MEB por Michelena (1989), y con microscopía óptica y de barrido por Lorscheitter et al. (2001). La primera autora indicó la presencia de perisporio delgado, granuloso constituido por una sola capa. La segunda autora describió tanto el ejemplar botánico como sus esporas compuestas por un perisporio papillado-rugulado y exosporio liso. Giudice y Morbelli (1998) estudiaron cinco especies de Adiantum y señalaron que resulta dificultoso diferenciarlas a nivel inter e intra específico. La presente especie es muy similar a A. orbignyanum Mett. ex Khun y A. lorentzii Hieron. ilustradas por dichos autores solamente con MEB. Asimismo, es muy similar en forma y tamaño a las formas lisas de A. chlorophylla.
Ecología y distribución: Terrestre. Perenne. Especie umbrófila de áreas ribereñas, asociadas a los bosques en galerías de los arroyos presentes en el parque. Fue registrado solamente en zonas húmedas y umbrías del sitio 4. Categoría PlanEar 1: siendo originaria de América del Sur, se la encuentra en Brasil, Paraguay y Uruguay y Argentina (Zuloaga et al., 2008).
3. Doryopteris concolor (Langsd. & Fisch.) Kuhn (Fig. 3 A-H)

Fig. 3. A-H: Doryopteris concolor. A-D: Esporas de soros tomados de una pinna inmadura. A, C, D: Esporas con exosporio liso y perisporio en su mayor parte liso. B. Espora con perisporio algo ornamentado con crestas y rúgulas. E-H: Esporas y esporangios de soros maduros. E, F, H: Esporangios con esporas con perisporio ornamentado. G: Esporangio con esporas con exosporio color amarillo y perisporio color naranja bajo fluorescencia. I-K: Anemia tomentosa var. tomentosa. I-J: Espora con exosporio ornamentado en cara distal y proximal respectivamente. El perisporio liso (al MO) es poco distinguible en algunos puntos del contorno ecuatorial. K: Espora con exosporio parcialmente fragmentado (no se observa perisporio).
Número de colección de Herbario: 5661DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R44. Colector M. di Pasquo. Fecha y sitio de colecta: abril 2013, sotobosque próximo a zona de Intendencia y bosque en galería (Fig. 1 B, sitio 3).
Descripción: esporas trilete de contorno triangular a subesferoidal, con perisporio ornamentado y exosporio liso, lesura simple y recta, 2/3 a ¾ del radio de la espora, puede estar acompañada por labios delgados, y desarrollar áreas de contacto delimitadas por arcos alrededor de la lesura. Ambas caras del perisporio ornamentado por crestas o rúgulas bajas poco distinguibles al MO.
Dimensiones: Diámetro polar 23(25-31)52 µm, espesor del exosporio 1 µm, espesor del perisporio 2-3 µm.
Obs. 1: Se colectaron en abril de 2013 pinnas fértiles, maduras e inmaduras, y sus soros fueron acetolizados separadamente. En el caso de los soros tomados de una pinna inmadura, tanto las esporas libres como las contenidas en esporangios presentaron en su mayoría perisporio sin ornamentación (Fig. 3 A, C-D) o poco definida (Fig. 3 B). De soros maduros se obtuvieron numerosos esporangios (Fig. 3 G-H), en los cuales se observó que algunos contenían esporas con perisporio ornamentado (Fig. 3 E-F, H), y otros preferentemente esporas con perisporio liso (Fig. 3 G), mientras que entre las esporas libres se observaron cantidades semejantes de ambos tipos de formas. Se observó fluorescencia naranja del perisporio y exosporio.
Obs. 2: Michelena (1989) caracterizó esta especie con perisporio crestado-ruguloso, de crestas aisladas y dispuestas concéntricamente, la cual fue ilustrada solamente con MEB. Giudice et al. (2000) realizaron el estudio de MEB y TEM de Doryopteris concolor y otras cinco especies del género procedentes del Noroeste de Argentina. Las autoras no indicaron diferencias entre esporas inmaduras versus maduras, a la vez que no presentaron ilustraciones con MO, por lo que resulta difícil visualizar los rasgos ilustrados con MEB en comparación con las fotografías de MO aquí provistas (Fig. 3 A-H). Sin embargo, la comparación de la descripción realizada por dichos autores permite referirlas a las formas aquí halladas en los soros maduros (Fig. 3 E-F), con excepción del tamaño cuyo rango resulta ser algo menor y más restringido para los ejemplares en Giudice et al. (2000; 31-35 µm) con respecto al observado en este estudio a partir de soros maduros e inmaduros (23- 52 µm). Otro rasgo descripto por los mencionados autores no reconocido tan claramente en nuestros ejemplares se refiere a las tres capas del perisporio. Aquí se identifica aparentemente una capa de perisporio y una capa de exosporio (en la cual se deben encontrar adpresas sus capas interna y externa) y entre ambas una zona de separación o cavidad de ancho variable según el ejemplar (Fig. 3 A-F).
Ecología y distribución: Terrestre. Hierba Perenne. Distribución restringida a una zona de sotobosque del área de bosque en galería en la zona de Intendencia. No observada en áreas naturales dentro del parque. Categoría PlanEar 1: es originaria de América del Sur presente en Brasil, Paraguay y Uruguay y Argentina (Zuloaga et al., 2008).
Anemiaceae
4. Anemia tomentosa (Savigny) Sw. var. tomentosa (Fig. 3 I-K)
Número de colección de Herbario: 2021DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R46. Colector M. di Pasquo. Fecha y sitio de colecta: abril 2013, zona de Intendencia (Fig. 1 B, sitio 3).
Descripción: espora trilete de contorno ecuatorial triangular, márgenes rectos a levemente convexos, extremos radiales ampliamente redondeados. Lesura de radios rectos entre ½ y hasta el margen de la espora. Ornamentación del exosporio en cara proximal formado por muros paralelos entre sí en las tres facetas proximales. En la cara distal los muros se disponen también siguiendo el patrón de la cara proximal. Perisporio delgado adpreso al exosporio.
Dimensiones: Diámetro polar 100-160 µm. Muros: 5-6 µm de ancho. Estrías: 1-2 µm de ancho entre los muros.
Obs. 1: De soros maduros se obtuvieron esporas maduras separadas (Fig. 3 I-K), y no se observaron tetrades ni esporangios en los preparados montados para su estudio. Se observó fluorescencia naranja del exosporio entre costillas.
Obs. 2: Los ejemplares aquí descriptos concuerdan con la morfología general de esta especie descripta e ilustrada por Lorscheitter et al. (1998, MO y MEB) para la flora de Rio Grande do Sul, y por Ramos Giacosa et al. (2012, MEB y TEM) para Argentina (si bien no se menciona su presencia en Entre Ríos). Se destaca la dificultad de observar en MO la diminuta ornamentación apiculada de los muros ilustrada con MEB por los mencionados autores.
Ecología y distribución: Terrestre. Cultivada en el área parquizada de la Intendencia. Se indica que estuvo presente en áreas naturales dentro del parque preferentemente en zonas de pastizales, pero no se la ha observado en los relevamientos realizados durante las campañas del presente estudio. Categoría PlanEar 1: se halla en Argentina, Brasil, Paraguay, Uruguay. Según De la Sota (1973) es muy frecuente en Brasil meridional y se ha desplazado a lo largo de las sierras hasta el Noroeste de Argentina y por la cuenca del Paraná y Uruguay (Zuloaga et al., 2008).
Esporas con marca monolete
Aspleniaceae
5. Asplenium ulbrichtii Rosenst. (Fig. 4 A-K)

Fig. 4. A-K: Asplenium ulbrichtii. A: Esporas lisas en esporangio de soro inmaduro. B: El mismo esporangio bajo fluorescencia, se observa el color naranja-amarillento de la exina. C y F, I, J, L-N: Esporas con perisporio ornamentado de crestas con espinas marginales y microespinas o microperforaciones. Se observan pliegues semejando marca trilete a monolete y el cuerpo interno correspondiente a la exosporio liso. D-E: Espora con perisporio ornamentado, la cual muestra un bajo color de fluorescencia anaranjado. G: Espora con perisporio degradado y roto exhibiendo exosporio interno liso bajo fluorescencia. K: Espora monolete con exosporio liso.
Número de colección de Herbario: 5111DTE 02/IV/14. Número de colección en Palinoteca de Referencia: CICYTTP-R 48. Colector M. di Pasquo y E. Rodríguez. Período y sitio de colecta: abril de 2014, bosque en galería del paseo La Glorieta (Fig. 1 B, sitio 4).
Descripción: espora monolete de contorno elipsoidal a subcircular, cara proximal plana levemente cóncava, cara distal convexa. Exosporio acamerada a levemente camerada, exosporio liso, lesura simple, ½ a 2/3 del radio. Perisporio laxo, alado, fenestrado-equinado con crestas espinosas en el margen y en la superficie se delinean facetas amplias (3-6 µm de ancho máximo). Un pliegue trilete a dilete se evidencia con frecuencia.
Dimensiones: Espora con perisporio de diámetro polar mayor 40-24 µm, diámetro menor 24-33 µm, alto en vista ecuatorial 25-35 µm. Espora sin perisporio, exosporio liso, diámetro polar mayor 24-28 µm, diámetro menor 16-17 µm.
Obs. 1: Se procesaron soros inmaduros y maduros. Del inmaduro se obtuvieron principalmente esporangios cerrados con esporas lisas (Fig. 4 A-B) y esporas dispersas lisas y en menor proporción con perisporio. De los esporangios maduros se obtuvieron principalmente esporas dispersas con perisporio y menos frecuentes lisas. A partir del análisis de la ultraestructura de cinco especies del género, Morbelli & Giudice (2005) definen al perisporio camerado por presentar procesos radiales entre ambas paredes. Se observó muy pobre fluorescencia naranja del perisporio y moderada fluorescencia amarilla especialmente de las formas de exosporio liso (sin perisporio) (Fig. 4 B, E, H).
Obs. 2: Lorscheitter et al. (2002) describen e ilustran (MO y MEB) 25 especies de Asplenium e indican que las esporas del taxón aquí descripto se asemejan a las de A. kunzeanum Ronsens., A. monanthes Linn., A. raddianum Gaud., A. sellowianum Hieron. en la presencia de un perisporio alado y ornamentado con crestas espinosas. Giudice et al. (2002) describen e ilustran esporas de Asplenium del Noroeste de Argentina, entre las cuales A. lorentzii Hieron. y A. argentinum Hieron. son similares en tamaño, forma y ornamentación. Entre las especies ilustradas con MEB por Morbelli & Giudice (2005), A. auritum Sw. se asemeja a la especie que crece en el parque por su perisporio alado y fenestrado.
Ecología y distribución: Terrestre o epífita. Especie registrada en los bosques ribereños del parque. Categoría PlanEar 1: dada su amplia distribución en Argentina, Brasil, Uruguay y Paraguay (Lorscheitter et al., 2002; Giudice et al., 2002; Zuloaga et al., 2008).
Davalliaceae
6. Nephrolepis cordifolia (L.) C. Presl (Fig. 5 A-K)

Fig. 5. Nephrolepis cordifolia. A-C y H: Esporas de esporangios de un ejemplar fértil presente en la zona intangible del parque (ambiente natural), en las cuales se reconoce perisporio ornamentado con verrugas y rúgulas. H: Espora ilustrada en el ME. D-G, I-K: Esporas en esporangios de ejemplares colectados en el área de la Intendencia. D-G y J: Esporas con procesos ornamentales tanto en el exosporio como en el perisporio, heteromórficos y heterométricos, representados fundamentalmente por verrugas, en el exosporio y, verrugas y tubérculos de formas irregulares en el perisporio (rugado). I-K: Esporas en esporangios muestran formas con perisporio verrucoso en diferente grado de desarrollo hasta formas lisas.
Número de colección de Herbario: 5011DTE 20/III/11. Número de colección en Palinoteca de Referencia: CICYTTP-R37 (Fig. 1, sitio 3 Intendencia) y CICYTTP-R39 (zona intangible, Fig. 1 B, sitio 6). Colector M. di Pasquo. Período y sitio de colecta: marzo de 2011, alrededores de la base de palmeras en la zona sur del parque (Fig. 1 B, sitio 6), y en zona de Intendencia (Fig. 1 B, sitio 3). En abril de 2013 sólo fue hallada en la zona de Intendencia.
Descripción: espora monolete de contorno elipsoidal a subcircular, cara proximal plana levemente cónica, cara distal globosa, lesura simple, ½ a 2/3 del radio con áreas de contacto lisas a ornamentadas. Perisporio ornamentado por verrugas y rúgulas, 2-6 µm de ancho, 1-2 µm de alto. Exosporio liso, microgranular o verrucoso.
Dimensiones: Diámetro polar mayor 24-45 µm, diámetro menor 13-26 µm.
Obs. 1: Dentro de esporangios se reconocieron formas con perisporio verrucoso en diferente grado de desarrollo hasta formas lisas (Fig. 5 I-K). Entre las esporas libres se vieron formas subcirculares en bajo porcentaje, y con exosporio lisa (formas inmaduras sin perisporio) a levemente ornamentada cuando el desprendimiento del perisporio es total o parcial. En cambio, las esporas obtenidas del ejemplar presente en la zona intangible del parque (ambiente natural), presentaron en su mayoría perisporio ornamentado con verrugas y rúgulas de manera más uniforme (Fig. 5 A-C y H). Se observó fluorescencia naranja del perisporio y fluorescencia amarilla especialmente de las formas de exosporio liso (sin perisporio).
Obs. 2: Las esporas estudiadas (Fig. 5 H) presentan características comunes con las formas ilustradas con MEB y TEM por Tyron & Lugardon (1991) y Piñeiro & Morbelli (2012). Los análisis de TEM presentados por los últimos autores confirman la presencia de procesos ornamentales tanto en el exosporio como en el perisporio, heteromórficos y heterométricos, representados fundamentalmente por verrugas, en el exosporio y, verrugas y tubérculos de formas irregulares en el perisporio (rugado). Algunos procesos del perisporio se unen formando lomos irregulares (Fig. 5 G). Si bien los elementos ornamentales están presentes sobre ambas caras, éstos predominan sobre la distal (Fig. 5 A y E). Además, indicaron que no observaron formas con exosporio liso ni esferoidales, contrariamente a lo hallado en este estudio en esporangios de ejemplares colectados en el área de la Intendencia (Fig. 5 D-G, I-K). Tyron & Lugardon (1991) indicaron que las formas más esferoidales o irregulares representarían fases de hibridización. Piñeiro & Morbelli (2012) compararon las esporas de las Davalliaceae con las del resto de las familias estudiadas para la Flora del Noroeste de Argentina, y citan cierta similitud entre las esporas de Nephrolepis cordifolia y las de los géneros Microgramma, Pecluma y Polypodium, de la familia Polypodiaceae, en relación al tipo de esporas monoletes y la superficie verrucoso-tuberculada. Se diferencian de las Polypodiaceae (Giudice et al., 2004; Morbelli & Giudice, 2010) en el tamaño, pues las esporas de Nephrolepis presentan diámetros menores que oscilan entre 20-35 µm de diámetro ecuatorial mayor, en tanto las Polypodiaceae pueden medir entre 40-90 µm. También presentan diferencias a nivel de la estructura de la esporodermis, pues en este grupo la ornamentación se encuentra en el exosporio.
Ecología y distribución: Terrestre o epífita. Se la observó en palmares densos y semidensos alrededor de las palmeras y como epífita en algunas palmeras y el aljibe del parque de la Intendencia. Categoría PlanEar: Podría ser asignada a la categoría 1 dado que ha sido documentada en el Noroeste argentino (única especie N. cordifolia; Piñeiro & Morbelli, 2012) y en otras regiones de Argentina (Buenos Aires, Catamarca, Córdoba, Corrientes, Jujuy, Salta, Santa Fe, Tucumán), Brasil (Estados de Paraná y Rio Grande do Sul), y Paraguay (Arana et al., 2004; Zuloaga et al., 2008). Se consigna aquí su primer registro para Entre Ríos, pues no fue citada por Zuloaga et al. (2008) ni en trabajos posteriores (e.g. Piñeiro & Morbelli, 2012).
Dryopteridaceae
7. Rumohra adiantiformis (G. Forst.) Ching (Fig. 6 A-G)

Fig. 6. A-G: Ruhmora adiantiformis. A-B: Esporas de soro en pinna madura, con perisporio ornamentado tanto dentro como fuera de los esporangios, con pliegues bien desarrollados. C: Espora con exina lisa de soro en pinna inmadura. D-G: Esporas con perisporio ornamentado con pliegues en variado grado de desarrollo y exosporio interno. E-F: Espora con perisporio bajo MO mostrando bajo fluorescencia color naranja. H-I: Microgramma x mortoniana. Esporas ilustradas con MEB con exosporio verrucoso y perisporio delgado adpreso.
Número de colección de Herbario: 2185DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R38. Colector M. di Pasquo. Período y sitio de colecta: diciembre 2011 y abril 2013, zona de Intendencia (Fig. 1 B, sitio 3).
Descripción: espora monolete de contorno oval a subcircular en vista polar, cara proximal recta a levemente convexa y distal subcuadrangular en vista ecuatorial. Perisporio ornamentado con pliegues largos y en menor proporción otros cortos (tipo verrugas) de 2-3 µm de alto con densidad, longitud y distribución variables. Exosporio liso a débilmente ornamentado. Lesura simple, ½ - 2/3 del radio de la espora.
Dimensiones: Diámetro polar mayor 35-45 µm, altura en vista ecuatorial 25-30 µm.
Obs. 1: Las esporas recuperadas de soros tomados de frondes maduras e inmaduras presentaron las siguientes diferencias: 1- De soro en pinna madura, presentan mayor tamaño en general, con perisporio ornamentado tanto dentro como fuera de los esporangios, con pliegues tipo verrucosos, bien desarrollados (Fig. 6 A-B, D-F). 2- De soro en pinna inmadura, se observaron esporas de menor tamaño en su mayoría, con exosporio liso (Fig. 6 C) y perisporio ornamentado con pliegues en variado grado de desarrollo y con un menor grado de desprendimiento del exosporio (Fig. 6 G). Estos rasgos se observaron tanto en tetrades como esporas libres y también dentro de esporangios. Se observó moderada fluorescencia naranja del perisporio (Fig. 6 F) y fluorescencia amarilla especialmente de las formas de exosporio liso (sin perisporio).
Obs. 2: Morbelli (1980) describió e ilustró con MO esporas de esta especie procedentes de Río Negro e Islas Malvinas, los cuales concuerdan en líneas generales con las esporas aquí estudiadas.
Ecología y distribución: Se presenta como epífita en algunos árboles de la zona de Intendencia. Categoría PlanEar 1: de acuerdo con su amplia distribución en Argentina, Brasil, Chile y Uruguay según Zuloaga et al. (2008). Registrada por Meza Torres et al. (2013) en el parque Mburucuya en Corrientes. Primer registro para Entre Ríos.
Polypodiaceae
8. Microgramma x mortoniana De la Sota (Fig. 6 H-I, 7 A-G)

Fig. 7. A-G: Microgramma x mortoniana. A-B, D-E, G: Ejemplares de soro de pínnula madura. C: Esporangio con esporas ornamentadas de soro de pínnula madura. F. Espora de soro de pínnula inmadura. H-M: Pleopeltis minima. H-K: Esporas de soro maduro mostrando perisporio con ornamentación y exosporio liso. L: Esporas del ejemplar inmaduro con exosporio delgado y liso. M: Espora de soro maduro muestra perisporio ornamentado en cara distal.
Número de colección de Herbario: 5315DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R35. Colector M. di Pasquo. Período y sitio de colecta: diciembre 2011 y abril 2013, áreas de palmares y bosque en galería (Fig. 1 B, sitios 3, 4, 5 y 6).
Descripción: espora monolete de contorno oval (vista polar), cara proximal levemente cóncava y cara distal convexa, lesura ½ a 2/3 del radio. Exosporio densamente ornamentado con verrugas bajas de tope redondeado y forma elongada (1-4 µm de ancho, 1 µm de alto), las cuales se van agrandando hacia la cara distal (4-10 µm ancho y 2-3 µm alto), en disposición radiada. Perisporio papillado al MEB (Fig. 6 H-I), no distinguible bajo MO.
Dimensiones: Diámetro polar mayor 60-110 µm, diámetro polar menor 39-65 µm, alto en vista ecuatorial 25-35 µm.
Obs. 1: no se encontraron diferencias morfológicas entre las esporas liberadas por soros de ejemplares maduros e inmaduros colectados en diciembre de 2011 (Fig. 7 F) y abril de 2013, respectivamente (Fig. 7 A-E y G). Se observó fluorescencia del exosporio color naranja.
Obs. 2: Microgramma vacciniifolia (Langsd. & Fisch.) Copel. y Microgramma (Marginaria) squamulosa (Kaulf.) De la Sota, son formas naturales, las cuales se hibridizan en la forma M. mortoniana De la Sota (véase Zuloaga et al., 2008). En el parque se ha determinado en general la presencia de la especie híbrida M. mortoniana debido a que se observan frondes anómalas en las cuales hay un predominio de pínnulas estériles con forma algo más elongada y ápice más redondeado con respecto a M. vacciniifolia, teniendo en cuenta las frondes ilustradas por Lorscheitter et al. (2005, p. 41) y Zuloaga et al. (2008). Si bien Meza Torres et al. (2013) reconocen solamente la especie M. vacciniifolia en el parque Mburucuya en Corrientes, aceptan la presencia de un marcado dimorfismo donde se combinan caracteres de las frondes estériles y fértiles como un estadío intermedio habitual. Se confirma la atribución de esta especie a la forma híbrida teniendo en cuenta el mayor tamaño de las esporas respecto del que presentan sus especies naturales: M. vacciniifolia (diámetro polar mayor 40-60 µm; Lorscheitter et al., 2005), y M. squamulosa (diámetro polar mayor de 42-80 µm; Giudice et al., 2004; Lorscheitter et al., 2005). Tyron & Lugardon (1991) explican que el mayor tamaño puede ser reflejo de un número mayor de ploidía (por hibridización?). Sin embargo, la forma general y el patrón de ornamentación del exosporio son muy similares en las tres especies, compuesto por verrugas discretas elongadas cuyo tamaño disminuye hacia la cara proximal. El perisporio es delgado y bien adherido al exosporio, liso, microverrucoso o papillado visible al MEB (no distinguible al MO). M. x mortoniana no fue tratado por Giudice et al. (2004) debido a que el espécimen de herbario era estéril.
Ecología y distribución: perenne epífita hallada con frecuencia en las copas y troncos de la palmera Butia yatay, especialmente en palmares densos y semidensos y en árboles de los bosques en galería. Se encuentra también en los árboles de la Intendencia. Categoría PlanEar 1: de acuerdo con su amplia distribución en Argentina, Brasil, Paraguay y Uruguay según Zuloaga et al. (2008). Sin embargo, en esta base de datos no figura su presencia en la provincia de Entre Ríos (si bien se incluye un ejemplar ilustrado de dicha provincia).
9. Pleopeltis minima (Bory) Prado & Hirai (Fig. 7 H-M)
Número de colección de Herbario: 5282DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R41 (2011) y CICYTTP-R47 (2013). Colector M. di Pasquo. Período y sitio de colecta: diciembre 2011 y abril 2013, bosque en galería (Fig. 1 B, sitio 4).
Descripción: esporas monolete de contorno oval (vista polar), cara proximal recta a levemente convexa y distal globosa en vista ecuatorial. Lesura sin engrosamientos ni bifurcaciones distales, longitud ½ - 2/3 del radio de la espora. Perisporio sagrinado a levemente ornamentado, delgado y adherido al exosporio, con papillas laxamente distribuidas, de tamaño 1-2 µm de diámetro y glóbulos frecuentes. Exosporio liso a verrucoso poco definido al MO, 1-2 µm de espesor.
Dimensiones: Diámetro polar mayor 45-65 µm, alto en vista ecuatorial 30-40 µm.
Obs. 1: Las formas maduras recuperadas de un ejemplar colectado en el parque en diciembre 2011 mostraron un perisporio algo ornamentado (Fig. 7 M), y exosporio liso (Fig. 7 H-K). En tanto las esporas obtenidas del ejemplar algo inmaduro de abril 2013 presentaron en su mayoría formas con exosporio liso (Fig. 7 L) y en menor proporción levemente ornamentadas con pequeñas verrugas y glóbulos en el perisporio. Se observó fluorescencia del perisporio color naranja y del exosporio amarilla.
Obs. 2: Polypodium squalidum actualmente en sinonimia con P. minima según Zuloaga et al. (2008), fue descripto (ilustrado con MEB) por Giudice et al. (2004) con exosporio verrucoso y tamaño similar a los especímenes maduros del parque. Lorscheitter et al. (2005) describieron e ilustraron la fronde de Polypodium polypodioides, actualmente en sinonimia con P. minima según Zuloaga et al. (2008), y sus esporas ilustradas con MO y MEB muestran una morfología y tamaño semejante a las formas maduras del parque.
Ecología y distribución: Epífita en árboles del bosque en galería (y terrestre cuando cae al suelo). Poco frecuente como epífita en palmeras. Categoría PlanEar 1: de acuerdo con su amplia distribución en Argentina (incluyendo Entre Ríos), Bolivia, Brasil, Paraguay y Uruguay según Zuloaga et al. (2008). Arana et al. (2004) citan esta especie como Pleopeltis squalida raramente presente como forma terrestre en la provincia de Córdoba, en tanto Meza Torres et al. (2013) la encuentran en áreas de bosque en el parque Mburucuya.18
10. Pleopeltis pleopeltifolia (Raddi) Alston (Fig. 8 A-E)

Fig. 8. A-E: Pleopeltis pleopeltifolia. Esporas tomadas de soros de frondes maduras e inmaduras respectivamente. A-C: Esporas de mayor tamaño, más fragmentadas o plegadas, y con ornamentación bien desarrollada de verrugas y menor de cuerpos de glóbulos en el perisporio. D-E: Esporas con variaciones en, tamaño, desarrollo de la ornamentación y con glóbulos en el perisporio. F-G: Megasporas de Selaginella sellowii.
Número de colección de Herbario: 5032DTE 02/IV/13. Número de colección en Palinoteca de Referencia: CICYTTP-R47. Colector M. di Pasquo. Período y sitio de colecta: abril de 2013, palmar abierto (Fig. 1 B, sitio 5) y sobre árboles en bosque en galería (Fig. 1 B, sitio 4).
Descripción: espora monolete, contorno oval a subcircular en vista polar, cara proximal recta a levemente convexa y distal globosa en vista ecuatorial. Lesura sin engrosamientos ni bifurcaciones, longitud ½ - 2/3 del radio de la espora. Exosporio 1-2 µm de espesor, ornamentado con verrugas (1-2 µm), densamente distribuidas en ambas caras. Perisporio adpreso y liso con glóbulos frecuentes.
Dimensiones: Diámetro polar mayor 39-78 µm, alto en vista ecuatorial 25-55 µm.
Obs. 1: se recuperaron esporas de Pleopeltis pleopeltifolia de soros tomados de frondes maduras e inmaduras colectadas en abril de 2013. Si bien no se observan diferencias importantes entre ambos, en el primer caso las esporas presentaron mayor tamaño, más fragmentadas o plegadas, y con ornamentación bien desarrollada de verrugas y menor proporción de glóbulos en el perisporio (Fig. 8 A-C). En el segundo caso se observaron esporas con variaciones en tamaño, desarrollo de la ornamentación, y con glóbulos frecuentes en el perisporio (Fig. 8 D-E). Se observó fluorescencia del perisporio color naranja y del exosporio amarilla.
Obs. 2: Es interesante destacar que la especie natural presenta rasgos morfológicos similares a los exhibidos por morfoespecies fósiles tales como Polypodiisporites inangahuensis (Couper) Potonié, ilustrada para el Neógeno de Neuquén por Cornou et al. (2012), y el Neógeno de Nueva Zelanda y otras regiones del Hemisferio Sur (Raine et al., 2011).
Ecología y distribución: Epífita en palmeras jóvenes y selvas ribereñas.
Categoría PlanEar 1: de acuerdo con su amplia distribución en Argentina (incluyendo Entre Ríos), Brasil, Paraguay y Uruguay según Zuloaga et al. (2008). Meza Torres et al. (2013) la encuentran como epífita en áreas de bosques higrófilos en el parque Mburucuya. Primer registro para Entre Ríos.
Lycophyta
Selaginellales
Selaginellaceae
11. Selaginella sellowii Hieronymus (Fig. 8 F-G, Fig. 9 A-F)

Fig. 9. A-F: Microsporas de Selaginella sellowii. A: Esporas de contorno circular a subtriangular, exosporio de capas separadas (exosporio interno y externo). B-C: Las esporas en vistas proximal y distal muestran exosporio delgado y microplegado adherido en cara proximal. D: Tetrade tetrahédrica donde se observan todas las características descriptas. E-F: Espora bajo fluorescencia, donde se destacan exosporio interno, exosporio con engrosamiento ecuatorial y ornamentación lisa en ambas caras, pliegues radiales en la cara proximal y perisporio no distinguible con MO. G: Equisetum giganteum. Esporas con y sin perisporio y elaterios adheridos al exosporio.
Número de colección de Herbario: 5174DTE 13/XII/2011. Número de colección en Palinoteca de Referencia: CICYTTP-R42. Colector M. di Pasquo. Período y sitio de colecta: diciembre de 2011, ejemplar tomado de un sustrato arenoso/ rocoso expuesto al sol en un área mixta con palmar, pajonal, pastizal y áreas inundables (Fig. 1 B, sitio 5).
Megasporas (Fig. 8 F-G): presentan contorno circular, lesura trilete ½ del radio, poco distintiva portando labios fuertes. Exosporio compuesto por dos capas separadas, la interna, delgada y desprendida de la externa. Esta última muestra una zona ecuatorial engrosada de espesor variable (8-13 µm), con estructura interna laberíntica y ornamentación de rúgulas o cordones mayores de disposición laxa en ambas caras que pueden delimitar áreas deprimidas donde aparecen rúgulas más cortas y delgadas.
Dimensiones: Diámetro ecuatorial 117-145 µm (3 esporas).
Microsporas (Fig. 9 A-F): Tetrades tetrahédricas. Esporas de contorno circular a subtriangular, exosporio compuesto de dos capas separadas (exosporio externo y exosporio interno), con perisporio a veces presente. Cara proximal piramidal, distal globosa, lesura trilete recta a sinuosa, entre 1/2 del radio o hasta el margen del cuerpo central. La lesura se prolonga con frecuencia en pliegues que pueden alcanzar o superar escasamente el margen del exosporio interno. Perisporio delgado y plegado cuando presente adherido en cara proximal. Exosporio interno delgado de menor diámetro. Exosporio con estructura interna laberíntica, engrosamiento ecuatorial de 2-5 µm de espesor, y ornamentación lisa en ambas caras con pliegues radiales frecuentemente en la cara proximal.
Dimensiones: Diámetro ecuatorial mayor (medido en 50 esporas) 65-96 µm, diámetro polar (medido en 10 tetrades) 45-65 µm.
Obs. 1: las micro y megasporas aquí estudiadas fueron obtenidas de estróbilos de un ejemplar que fue primero rehidratado en agua para ser clasificado, y luego de varios días se procedió a acetolizar los estróbilos y montar los preparados de estudio.
De allí el mayor tamaño en general exhibido por las microsporas principalmente con respecto al informado por Morbelli (1977, p. 132, diámetro ecuatorial mayor 28-52 µm) y por Lorscheitter et al. (1998, p. 102-104, diámetro ecuatorial mayor 50-60 µm). La baja representatividad de megasporas respecto de microsporas aquí encontrada se explica porque se tomó un solo estróbilo, el cual posiblemente sería portador de un mayor número de microsporangios respecto de megasporangios (De la Sota & Morbelli, 1981). Por otro lado, las megasporas recuperadas presentan un color castaño y el tamaño está dentro del rango menor informado por Morbelli (1977, p. 131) alrededor de 110-130 µm. Estos rasgos podrían sugerir que se trata de megasporas abortadas (véase Morbelli, 1977). Bajo fluorescencia (naranja) se pueden distinguir las capas del exosporio con su engrosamiento ecuatorial y ornamentación lisa en ambas caras, pliegues radiales en la cara proximal y perisporio poco distintivo (Fig. 9 E-F).
Obs. 2: según Morbelli (1977) la morfología de las microsporas es distintiva y permite diferenciar especies de Selaginella. La morfología de las megasporas y microsporas aquí estudiadas bajo microscopía óptica resultó concordante con las descripciones e ilustraciones (MO y MEB) de especímenes de Sellaginella sellowii principalmente de Argentina y Paraguay presentadas por Morbelli (1977) y Morbelli et al. (2001 y trabajos allí citados), y por Lorscheitter et al. (1998, microsporas; 2009, megasporas, MO y MEB) para el sur de Brasil.
Ecología y distribución: Selaginella es una planta poiquilohídrica, es decir no regula su cantidad de agua interna y tras un período de desecación (desde unos días a varios años) si se rehidrata puede continuar su ciclo vital. Esta propiedad fue usada para obtener el estróbilo aquí estudiado del ejemplar colectado en estado de latencia debido al período de sequía en diciembre 2011. Fue observada en dos sectores de suelo arenoso próximos al arroyo El Palmar en áreas de la zona intangible (Fig. 1, sitios 5 y 6, Material suplementario, Lámina 1 D-E). En abril de 2012 no fue observada su presencia debido a la cobertura de agua y vegetación de ambos sitios. Categoría PlanEar 1: se trata de una especie con amplia tolerancia a diferentes tipos de suelos y climas en diferentes alturas, ampliamente distribuida en nuestro país y en el resto de América del Sur hasta México y Cuba (De la Sota & Morbelli 1981; Arana et al., 2004, 2011; Zuloaga et al., 2008; Meza Torres et al., 2013).
Equisetopsida
Equisetaceae
12. Equisetum giganteum L. (Fig. 9 G, Fig. 10 A-L)

Fig. 10. A-L: Esporas de Equisetum giganteum, ilustradas con MO (A-D, F-H), MEB (E, I, J, L), y con luz fluorescente (K). Se observan formas esferoidales y de color castaño verdoso (clorofílicas) portando dos elaterios transparentes, los cuales se observan enroscados y adheridos por un anillo a la zona apertutal ubicada en el exosporio. Poro poco distintivo con MO, circular, acompañado por un ánulo o engrosamiento. De esta zona se sostiene el perisporio delgado y microplegado (fluorescencia naranja) que cubre toda la espora. Exosporio liso (fluorescencia amarilla) con frecuente presencia de glóbulos de origen tapetal sobre perisporio y elaterios. Figs. H y L. Se ilustra el mismo material del cubreobjeto metalizado y fotografiado bajo MEB, montado con gelatina - glicerina para su estudio en MO.
Número de colección de Herbario: 5080DTE 02/IV/2013. Número de colección en Palinoteca de Referencia: CICYTTP-R34. Colector M. di Pasquo. Período y sitio de colecta: abril 2011, diciembre 2011, abril 2012 y abril 2013, zonas palustres en área intangible (Fig. 1 B, sitios 5 y 6).
Descripción: esporas esferoidales de color castaño verdoso (clorofílicas) portando dos elaterios transparentes (bandas hialinas de 5-8 µm de ancho, Fig. 9 G, Fig. 10 D-F), los cuales se observan enroscados y adheridos por un anillo a la zona abertural ubicada en el exosporio. Este poro es poco distintivo, circular (Fig. 10 A, B, G, H, K), y está acompañado por un ánulo o engrosamiento (5- 10 µm de ancho total, 1-3 µm de alto, Fig. 10 H, I, K-L). En esta zona se adhiere el perisporio delgado y microplegado que cubre toda la espora (Fig. 10 B, G, I, J). Exosporio liso, 1-3 µm de espesor (Fig. 9 G, Fig. 10 A, C, K). Frecuente presencia glóbulos de origen tapetal sobre perisporio y elaterios (Fig. 10 E, I).
Dimensiones: Diámetro ecuatorial (50 esporas) 30-60 µm.
Obs. 1: Los rasgos morfológicos identificados en este estudio con MO (Fig. 9 G, Fig. 10 A-D, F-H) y MEB (Fig. 10 E, I, J, L) concuerdan con la descripción de material de herbario procedente de la provincia de La Pampa (Naab, 1987b, MO, MEB) y del Noroeste de Argentina (Piñeiro & Morbelli, 2014, MEB, TEM), de Rio Grande do Sul en Brasil (Lorscheitter & Dillenburg, 1998, MO, MEB) y Colombia (Rincón Barón et al., 2011, MO), así como con la ilustración de MEB de un ejemplar de Argentina publicada por Tyron & Lugardon (1991, fig. 226-5, p. 585). Un estudio exhaustivo de la ontogenia y esporogénesis de las esporas de E. giganteum realizado por Rincón Barón et al. (2011), mostró que el exosporio se forma a partir del protoplasto y que las esporas luego de ser liberadas de la fase de tétrades, se desarrollan en cámaras plasmodiales individuales dentro del esporangio rodeadas por el tapete. En su etapa final (madura) comienzan a desarrollarse el perisporio y los elaterios relacionados con este último. En nuestro estudio no fueron observadas tetrades en los preparados realizados por lo que se concluye que los rasgos morfológicos de las esporas revelan un alto grado de madurez alcanzado en el estróbilo.
Con respecto a la marca de dehiscencia, a diferencia del resto de las pteridofitas, la zona apertural sería el área de contacto de las esporas en la fase tétrade. Sin embargo, en las especies del género actual se exhibe como una zona adelgazada del exosporio en forma de poro (Tyron & Lugardon, 1991). Grauvogel-Stamm & Lugardon (2009) realizaron un estudio sobre la morfología de esporas fósiles in situ de Equisetaceae del Triásico y Jurásico de Europa. Los autores propusieron una evolución de la zona apertural desde una corta marca trilete (típica del morfogénero Calamospora conocido desde el Carbonífero), a una apertura reducida a un poro en la especie viviente Equisetum, en la cual el exosporio (formado por dos capas) está reducido y se refuerza o engrosa internamente por el depósito de una masa de esporopolenina homogénea a modo de obturador. Los especímenes aquí estudiados muestran una zona abertutal, si bien poco distintiva, con forma de poro circular (Fig. 10 A, B, G, H, K), acompañado por un ánulo (Fig. 10 H, I, K-L).
Es interesante tener en cuenta que Grauvogel- Stamm & Lugardon (2009) encontraron que al aplicar KOH durante el tratamiento químico de sus estróbilos fósiles, se produjo la destrucción de las esporas de Echinostachys oblonga y no de las de Equisetostachys verticillata. Según Traverse (2007), este tipo de efectos se relaciona principalmente con el poder oxidativo aunque leve del KOH (y de la acetólisis), en especial cuando se aplica en especies con bajo contenido de esporopolenina en su exina como es el caso de Equisetum (5% calculado luego de acetólisis). Posiblemente esto también es un rasgo de las especies fósiles de Equisetaceae en general (Traverse, 2007). En nuestro caso, la acetólisis realizada al estróbilo seleccionado, brindó numerosas esporas de E. giganteum aquí estudiadas, tanto especímenes completos como en distinto grado de desintegración aproximadamente en las mismas proporciones (Fig. 9 G, Fig. 10 K). En cambio, Naab (1987b) indicó la destrucción por acetólisis de los elaterios de E. giganteum, de igual forma que los de E. bogotense Kunth estudiados por Morbelli (1980). Esta última especie se diferencia por su tamaño algo menor (30-41 µm), exosporio más delgado sin pliegues y perisporio con gránulos de menor tamaño (Morbelli, 1980; Piñeiro & Morbelli, 2014).
El análisis de la composición química de los elaterios (véase materiales y métodos) de las esporas de Equisetum giganteum ilustradas con MEB, permitió comprobar un predominio del anión Si (Tabla 1), tal como fue documentado por Currie & Perry (2009, y trabajos allí citados). Estos autores hallaron Si o compuestos silíceos asociados estrechamente con carbohidratos y otros compuestos orgánicos presentes en el exosporio y en glóbulos presentes en éste, y recubriendo los elaterios de Equisetum arvense. Se destaca la presencia subordinada de los cationes Na y Ca, y otros elementos en muy baja proporción (K, Al, Cl y Mg). Estos elementos podrían reflejar la composición del sustrato incorporándose al compuesto silíceo mencionado, lo que ayudaría a mejorar las propiedades de protección de la espora ante el accionar de agentes físicos y/o biológicos del ambiente (Currie & Perry, 2007). Según Tyron & Lugardón (1991), la formación y maduración de las esporas sería sincrónica y su liberación sería concordante con el período de mayor humedad para germinar. Además, estos autores presentaron datos sobre la autoflorescencia de los elaterios y la pared de la espora, los cuales están en el rango de longitud de onda amarillo-naranja. Esto se confirma e ilustra a partir del análisis de los preparados con luz fluorescente y filtro azul para fluoresceina (ca. 450 nm; Fig. 10 K).
Ecología y distribución: Terrestre en márgenes de humedales, observada en suelo arenoso en dos áreas próximas al arroyo El Palmar en la zona intangible (Fig. 1 B, sitios 5 y 6). Categoría PlanEar 1: se trata de una especie terrestre a acuática de ambientes palustres, tanto lóticos como lénticos y humedales y en zonas despejadas como áreas más protegidas a orillas de quebradas y bordes de barrancos sombríos y húmedos. También son colonizadores de áreas deforestadas. Ampliamente distribuida en nuestro país y en el resto de América del Sur hasta México (Zuloaga et al., 2008).
Discusión y Conclusiones
Análisis morfológico y variaciones intraespecíficas
Numerosos estudios morfológicos de ambas partes vegetativa y reproductiva, químicos y más recientemente moleculares (e.g., Kremp & Kawasaki, 1972; Tyron & Lugardon, 1991; Pryer et al., 2004; Guillón, 2004; Smith et al., 2006; Currie & Perry, 2009), han permitido entender aspectos relativos a la ontogenia y la filogenia de estas plantas. Estudios palinológicos de detalle realizados con MEB y TEM permitieron revelar aspectos de la estructura de las paredes de esporas de numerosas especies de pteridofitas del mundo, rasgos no observables o de difícil interpretación bajo microscopía óptica (e.g., Kremp & Kawasaki, 1972; Tyron & Lugardon, 1991). En Argentina, este tipo de estudios pioneros fueron iniciados por Morbelli (1977, 1978, 1980) principalmente sobre la flora de la región Fuego-Patagónica. Numerosos trabajos posteriores analizaron en detalle esporas de diferentes grupos de pteridofitas del noroeste de Argentina y en menor medida de otras regiones en gran parte obtenidos de herbarios (e.g., De la Sota & Morbelli, 1985; Naab, 1987 a, 1987b; Morbelli & Michelena, 1989; Michelena, 1989; Morbelli, 1995; Giudice & Morbelli, 1998; Morbelli et al., 2001; Arana et al., 2004; Ramos Giacosa et al., 2004 a, 2004b, 2013; Gardenal et al., 2007; Piñeiro & Morbelli, 2012). Cabe señalar que las esporas de Anogramma chaerophylla, fueron estudiadas e ilustradas con MO y MEB por Lorscheitter et al. (2001) para Brasil, por Mautino & Anzótegui (1998, con MO) en ejemplares de Corrientes, y por Ramos Giacosa et al. (2004b, MEB y TEM) basado en ejemplares de herbario del noroeste y centro de Argentina. Pteris vittata fue analizada por De la Sota & Morbelli (1985), incluyendo ejemplares de la provincia de Entre Ríos y Azolla filiculoides y Marsilea ancylopoda por Gardenal et al. (2007, 2008, MEB y TEM).
Sin embargo, en la mayoría de las publicaciones mencionadas las esporas se ilustran sólo con MEB y/o TEM, lo cual dificulta su comparación con las observaciones bajo MO. Por ello, en este trabajo se ilustraron con MO todas las especies, se complementaron en aquéllas especies que cuentan con pocas ilustraciones de MEB en la literatura (e.g. Microgramma x mortoniana) y se incluyeron microfotografías bajo fluorescencia (F). En el caso de Equisetum giganteum y Selaginella sellowii las fotos de F resaltan la relación exosporio-perisporio, como en el primer caso la unión de ambas capas, y en el segundo, su separación mostrando un espacio (cameración) entre ambas. Las esporas trilete Adiantopsis chlorophylla y Adiantum raddianum y monolete Asplenium ulbritchi, Nephrolepis cordifolia y Rumohra adiantiformis mostraron variaciones morfológicas intraespecíficas, es decir de cada especie se han obtenido formas de exina lisa sin perisporio, y otras con perisporio ornamentado. En su mayoría las primeras fueron obtenidas de pinnas con soros inmaduros y las ornamentadas de ejemplares maduros, lo cual no fue ilustrado en trabajos previos citados más arriba.
Por otro lado, teniendo en cuenta las variaciones morfológicas aquí mostradas en relación con ejemplares de helechos y licofitas maduros e inmaduros, nos permite hacer una comparación con morfoespecies fósiles conocidas (principalmente en Argentina), y reafirmar la necesidad de contar con estudios del material actual para asegurar la determinación taxonómica de esporas halladas dispersas en sedimentos holocénicos y muestras aeropalinológicas del parque actualmente en estudio (Muñoz et al., 2013; Muñoz & di Pasquo, 2015; Nuñez Otaño et al., 2015 a, 2015b).
Entre las comparaciones, se encuentra relación entre las formas monolete lisas obtenidas de las especies de Nephrolepis, Asplenium y Pleopeltis, con la morfoespecie Laevigatosporites ovatus Wilson & Webster, conocido desde el Devónico (cf. Traverse, 2007). Esta morfoespecie fue vinculada con varias familias actuales de helechos como por ejemplo, Aspleniaceae, Blechnaceae, Polypodiaceae, Schizaeaceae (véase Raine et al., 2011). Entre las formas monolete ornamentadas, Microgramma x mortoniana presenta similitudes estrechas con formas actuales como Serpocaulon latipes (Langsd. & Fisch.) y A.R.Sm., S. levigatum (Cav.) A.R.Sm. (Polypodiaceae) descriptas e ilustradas (MO) por Coelho & Esteves (2011) en Brasil, y fósiles como las esporas de la planta fósil Davallia walkeri Conran et al. (Davalliaceae), presente en Nueva Zelanda (Conran et al., 2010), y la especie de espora Polypodiisporites radiatus Pocknall & Mildenhall conocida desde el Cretácico al Mioceno en Argentina y otras regiones del Hemisferio Sur (Raine et al., 2011). Anzótegui & Garalla (1986, p. 110, lam. II, fig. 19) ilustraron una forma similar
asignada como Microgramma vaccinifolia del subsuelo de la Formación Paraná (Mioceno tardío) en Santa Fé, la cual se diferencia de la especie aquí descripta por poseer una ornamentación de verrugas levemente de menor tamaño. Cornou et al. (2012) ilustraron la especie Polypodiisporites radiatus, para el Neógeno de Neuquén, la cual es muy similar a la presente especie en forma y distribución de las verrugas, sólo diferente en su diámetro ecuatorial algo menor (alrededor del diámetro mínimo de M. x mortoniana). La semejanza entre éstas y otras especies de Campyloneurum, Pleopeltis y Polypodium sostiene la relación filogenética de los taxones de las Familias Polypodiaceae y Davalliaceae y confirma la necesidad de realizar estudios de la flora local para poder asegurar la clasificación de esporas dispersas en el aire y en sucesiones sedimentarias.
Otro caso similar se da en Anemiaceae (Anemia y Mohria), bien representada y con amplia distribución en trópicos y subtrópicos en América del Sur, la cual presenta diversas morfologías de esporas trilete presentes desde el Jurásico (Dettmann & Clifford, 1991, 1992; Ramos Giacosa et al., 2012). En el caso de la especie aquí estudiada Anemia tomentosa var. tomentosa, fue registrada por Anzótegui & Garalla (1986) en el subsuelo de la Formación Paraná en Santa Fé. La morfoespecie más semejante aunque de menor tamaño (39- 60 µm), es Ruffordiaspora (Cicatricosisporites) australiensis (Cookson) Dettmann & Clifford, la cual es ampliamente registrada en sucesiones fósiles desde el Jurásico Tardío al Cretácico Tardío (véase Raine et al., 2011). Esto permite confirmar la perdurabilidad o estatismo de los caracteres de la exina tal como fue planteado por Tyron (1986), posiblemente relacionado a un exitoso poder de adaptación de las especies a cambios ambientales. Ramos Giacosa et al. (2012) concordaron con Mickel (1962) y De la Sota & Mickel (1968), que las variaciones en el tamaño y la forma en las esporas de A. tomentosa var. tomentosa pueden vincularse con esporas abortadas posiblemente debido a su tipo de reproducción (apogámica hexaploide).
Distribución areal y estado de conservación de las pteridofitas en el parque
Quince especies de pteridofitas fueron identificadas en distintos ambientes dentro del parque entre 2011 y 2014, de las cuales doce especies en estado fértil fueron colectadas en ambientes naturales (Fig. 1 B), a saber: 1- Adiantopsis chlorophylla, forma terrestre dominante entre pastizales en áreas de palmares y pastizales, 2- Adiantum raddianum, Asplenium ulbritchi, Doryopteris concolor (formas terrestres), Microgramma mortoniana, Pleopeltis minima, P. pleopeltifolia (formas epífitas), en bosque en galería, 3- Microgramma x mortoniana y Pleopeltis pleopeltifolia, epífitas en palmeras, 4- Equisetum giganteum y Selaginella sellowii, en áreas bajas inundables entre pastizales y palmares próximos a arroyos, 5- restringidas al área de la Intendencia (Fig. 1 B, sitio 3), Anemia tomentosa (terrestre), Nephrolepis cordifolia (epífita y terrestre), Pteris vittata (en paredes y rocas) y Rhumora adiantiformis (epífita), 6- helechos acuáticos Azolla filiculoides en lagos y Marsilea ancylopoda, en áreas inundables.
Para evaluar su grado de amenaza de las mencionadas especies de helechos según la clasificación de PlanEar (Villamil et al., 2009-2010), se consideró la distribución geográfica regional sumarizada por Zuloaga et al. (2008) para la Flora del Cono Sur. Dentro del parque se observaron diferencias en distribución y representatividad como fue mencionado para cada especie resultando que Adiantopsis chlorophylla, Microgramma x mortoniana y Pleopeltis pleopeltifolia presentan alta abundancia y amplia distribución mientras Pleopeltis minima, Adiantum raddianum, Selaginella sellowii y Equisetum giganteum están bien representadas pero arealmente restringidas. Las restantes especies muestran baja representatividad y distribución restringida dentro del parque (Anemia tomentosa, Anogramma chaerophylla, Asplenium ulbritchi, Azolla filiculoides, Doryopteris concolor, Marsilea ancylopoda, Nephrolepis cordifolia, Pteris vittata y Rhumora adiantiformis). En concordancia con Giudice et al. (2011), la protección de los ambientes naturales es la principal estrategia de conservación in situ de la flora. Por ello, el parque puede considerarse un reservorio para la preservación de las presentes especies de helechos, algunas de las cuales pueden contar con poblaciones escasas fuera del parque dado que son sensibles a los cambios medioambientales por uno o más factores de amenaza (destrucción de hábitat, sobreexplotación, invasiones biológicas, etc.), principalmente debido al alto grado de antropización de la cuenca del Arroyo El Palmar (Aceñolaza & Rodríguez, 2009). Por otro lado, las diferencias mostradas en la distribución de las distintas especies dentro del parque son de suma importancia en la construcción del modelo palinológico análogo que se contruye además, con base en el polen en relación a los datos de la vegetación actual (Muñoz et al., 2013), y en estudios de secuencias fósiles en el parque (Nuñez Otaño et al., 2015b), los cuales contribuirán a entender como fueron estas fluctuaciones naturales en relación a los cambios climáticos del Holoceno y quizás ayuden a predecir su comportamiento futuro (McLachlan, 2007).
Comparación con otras regiones
Este estudio permite sumar siete especies (Anemia tomentosa, Asplenium ulbrichtii, Doryopteris concolor, P. pleopeltifolia, Nephrolepis cordifolia, Rumohra adiantiformis y Selaginella sellowii) a las 10 especies identificadas por Aceñolaza & Rodríguez (2009) en la cuenca del Arroyo El Palmar y Pteris vittata identificada en el PNEP por De la Sota & Morbelli (1985). Además, se eleva a 14 el número de especies identificadas en el parque por Batista et al. (2014, 8 especies), adicionando aquí Adiantum raddianum, Asplenium ulbrichtii, Equisetum giganteum, Nephrolepis cordifolia, Pleopeltis minima, P. pleopeltifolia. Las especies citadas por los mencionados autores como Microgramma sp. y Selaginella sp. son clasificadas en este trabajo como Microgramma x mortoniana y Selaginella sellowii con base en la morfología de sus esporas, y de los rasgos de ambas plantas. Asimismo, se informa la incorporación de Nephrolepis cordifolia, Pleopeltis pleopeltifolia y Rumohra adiantiformis como nuevos registros para la Provincia de Entre Ríos, pues no están documentadas en la Base de datos de la Flora del Cono Sur (Zuloaga et al., 2008). En el caso de Microgramma x mortoniana se observó que en la base de datos se ilustró un espécimen de la provincia de Entre Ríos pero no figura como región en la lista de distribución geográfica.
Desde el punto de vista fitogeográfico, Ponce et al. (2002) indican que en términos generales las floras pteridofíticas de Argentina y Chile son relativamente pobres en comparación con las de Perú, Bolivia y Brasil, pues tienen entre tres y cuatro veces más especies. De la Sota (1973) en su publicación sobre la distribución de las Pteridófitas del Cono Sur cita por ejemplo, la presencia de Anemia tomentosa y Microgramma vaccinifolia como especies comunes en Brasil que se desplazaron hacia Argentina a través de la vía acuática del sistema del Plata (ríos Paraná y Uruguay). En Brasil, una serie de contribuciones sobre las pteridofitas de Rio Grande do Sul publicadas por Lorscheitter y colaboradores entre los años 1998 y 2009, donde se describen e ilustran 212 especies de pteridofitas y sus esporas estudiadas con microscopía óptica y de barrido, revelan una muy baja cantidad de especies comunes con el PNEP: Adiantopsis clorophylla, Adiantum raddianum, Anemia tomentosa, Anogramma chaerophylla, Asplenium ulbritchi, Doryopteris concolor, Equisetum giganteum, Pteris vittata, y Selaginella sellowii.
En Argentina Zuloaga et al. (1999, 2008) reconocen 91 géneros de helechos y licofitas con 402 taxones específicos e infraespecíficos (3,6 % de las 9.690 especies de la flora vascular. Por lo tanto, las 18 especies aquí actualizadas para la cuenca del arroyo El Palmar (incluyendo las 15 especies encontradas en el parque), revelan una muy baja riqueza de especies del grupo, que se mantiene al considerar el número de taxones infragenéricos informados por Ramos Giacosa et al. (2004 a) para las provincias de Entre Ríos (61 especies), Córdoba (83 especies), Buenos Aires (87 especies) Misiones (182 especies), y Corrientes (103 especies en Meza Torres et al., 2013). En tanto para Santa Fé los citados autores mencionan un número equivalente al hallado en este trabajo (20 especies). La comparación con el Parque Nacional Mburucuya en Corrientes, el cual representa un ambiente similar al nuestro, de savana con Butia yatay, muestra un número mayor de 48 taxones infragenéricos documentados por Meza Torres et al. (2013). Entre ellos 10 especies son comunes: Adiantopsis chlorophylla, Anogramma chaerophylla, Azolla filiculoides, Doryopteris concolor, Marsilea ancylopoda, Pleopeltis minima, P. pleopeltifolia, Pteris vittata, Rhumora adiantiformis, Selaginella sellowii. La baja riqueza de especies registrada en el área de estudio se puede explicar porque presenta menores condiciones de humedad bajo un clima templado dentro de la provincia de Entre Ríos, sumado a una relativa uniformidad ambiental según Ramos Giacosa et al. (2004 a). Sin embargo, los ríos Paraná y Uruguay son importantes rutas migratorias a lo largo de las selvas en galería que permitieron un incremento en la biodiversidad de los helechos (De la Sota, 1967).
Apendice

Fig. A1. Especies de helechos presentes en savana con palmeras Butia yatay en el PNEP. A: Adiantopsis clorophylla (verde) entre gramíneas. B: Detalle de Adiantopsis clorophylla. C e I. Microgramma mortoniana, epífita en palmeras. D-E: Selaginella sellowii, parches secos y verdes en temporada seca y húmeda respectivamente. F-G: Pleopeltis pleopeltifolia, en palmares y bosque en galería respectivamente. H: Marsilea ancylopoda en sustrato fangoso de bosque en galería. J-K: Equisetum giganteum, en áreas de palmares abiertos asociados a zonas bajas inundadas (área Totoral, Fig. 1 B, sitios 5 y 6).

Fig. A2. Especies de helechos presentes en bosques en galería en el PNEP. A: Límite de los ecotonos bosque en galería y pastizal/palmar (Fig. 1 B, sitio 4). B-C: Microgramma x mortoniana, epífita en árboles. D: Adiantum raddianum, en áreas sombrías y húmedas (Fig. 1 B, sitio 4). E: Anemia tomentosa, forma cultivada en el área de Intendencia (Fig. 1 B, sitio 3). F: Asplenium ulbrichtii, en áreas sombrías y húmedas (Fig. 1 B, sitio 3). G, J: Nephrolepis cordifolia y Rumohra adiantiformis, epífitas en palmeras (G) y árboles (J, con Microgramma x mortoniana) en el área de Intendencia (Fig. 1 B, sitio 3). H: Pleopeltis minima, epífita en árboles (Fig. 1 B, sitio 4). I: Doryopteris concolor, en áreas sombrías y húmedas (Fig. 1 B, sitio 3).
Agradecimientos
La primera autora desea expresar su agradecimiento al Dr. Fernando Biganzolli por su colaboración en los censos realizados en el parque y la determinación de algunas de las especies de helechos colectados en 2011. De igual forma, agradece al Dr. Diego Brandoni por su colaboración desinteresada en tareas de campo, y a Fabio Fontanarrosa (CERIDE) y Fabián Tricárico (MACN) por su asistencia en los análisis de MEB del material estudiado. A la Administración de Parques Nacionales y a todo el personal del Parque Nacional El Palmar por el apoyo brindado en todos los aspectos vinculados con el estudio palinológico integral (Aristóbulo Maranta, Marina Panziera, entre otros) incluyendo principalmente la asistencia en campañas, en recambio de muestreadores aeropalinológicos (Guardaparque Juan Balay) y proveyendo información climática (ICE). Este trabajo fue realizado con el aporte del subsidio PIP 0305 CONICET (2011-2013), y con aportes personales de la primera autora y becarios. Se agradece el apoyo brindado por el CICYTTP permitiendo el uso del vehículo en las tareas de campo realizadas y del laboratorio de procesamiento (a cargo de la primera autora).
Bibliografia
1. ACEÑOLAZA, P. & E. RODRÍGUEZ. 2009. Sitio Ramsar Arroyo "El Palmar". Informe florístico preliminar para la Secretaria de ambiente de la provincia de Entre Ríos. [ Links ]
2. ACEÑOLAZA, P. G. & E. E. RODRÍGUEZ. 2011. Flora del "Arroyo El Palmar", Provincia de Entre Ríos. Bol. Soc. Argent. Bot. 46 (s): 179. [ Links ]
3. ANZÓTEGUI, L. M. & S. S. GARRALLA. 1986. Estudio palinológico de la Formación Paraná (Mioceno superior) (Pozo "Josefina", provincia de Santa Fe, Argentina. I Parte - Descripción sistemática. Facena 6: 101-177. [ Links ]
4. ARANA, M.D. & C.A. BIANCO. 2011. Helechos y Licofitas del centro de la Argentina. Universidad Nacional de Río Cuarto, Río Cuarto. [ Links ]
5. ARANA, M., M. PONCE & N. VISCHI. 2004. Sinopsis de los helechos y grupos relacionados (Pteridophyta) de la provincia de Córdoba, Argentina. Bol. Soc. Argent Bot. 39: 89-114. [ Links ]
6. ARANA, M. D., J. J. MORRONE, M. PONCE & A. J. OGGERO. 2011. Licofitas (Equisetopsida: Lycopodiidae) de las sierras centrales de Argentina: Un enfoque panbiogeográfico. Gayana Bot. 68: 14- 21. [ Links ]
7. BATISTA, W. B., A. G. ROLHAUSER, F. BIGANZOLI, S. E. BURKART, L. GOVETO, A. MARANTA, A. G. PIGNATARO, N. S. MORANDEIRA, & M. RABADÁN. 2014. Savanna plant community types at El Palmar National Park (Argentina). Darwiniana, n.s. 2: 5-38. [ Links ]
8. BOCCANELLI, S. I. & E. F. PIRE. 2011. Adiantopsis chlorophylla ¿Una nueva especie en la llanura pampeana?. Ciencias Agronómicas 17: 35-37. [ Links ]
9. BROWN, A.D. & S. PACHECO. 2006. Propuesta de actualización del mapa ecorregional de la Argentina. En: BROWN, A. D., U. MARTÍNEZ ORTÍZ, M. ACERBI & J. CORCUERA (eds.), La situación ambiental argentina 2005: pp 28-31. Fundación Vida Silvestre Argentina, Buenos Aires. [ Links ]
10. CABRERA, A.L. & E.M. ZARDINI. 1993. Manual de la flora de los alrededores de Buenos Aires. 2da ed. ACME, Buenos Aires. [ Links ]
11. CICCERO, P. & A. BALABUSIC (eds.). 1994. Plan de Manejo Parque Nacional el Palmar. Administración de Parques Nacionales, Buenos Aires. [ Links ]
12. COELHO, C. B. & L. M. ESTEVES. 2011. Spore morphology of Serpocaulon A. R. Sm. and related taxa from Brazil (Polypodiaceae). Grana 50: 165- 181. [ Links ]
13. CONRAN, J. G., U. KAULFUSS, J. M. BANNISTER, D. C. MILDENHALL & D. E. LEE. 2010. Davallia (Polypodiales: Davalliaceae) macrofossils from Early Miocene Otago (New Zealand) with in situ spores. Rev. Palaeobot. Palynol. 162: 84-94. [ Links ]
14. CORNOU, M. E., M. A. MARTÍNEZ, M. E. QUATTROCCHIO & M. A. ASENSIO. 2012. Estudio palinológico de esporas de la Formación Salto del Macho, paleógeno de la Cuenca de Ñirihuau, Argentina. Ameghiniana 49: 26-37. [ Links ]
15. CURRIE, H. A. & C. C. PERRY. 2007. Silica in Plants: Biological, Biochemical and Chemical Studies. Ann. Bot. 100: 1383-1389. [ Links ]
16. CURRIE, H. A. & C. C. PERRY. 2009. Chemical evidence for intrinsic ‘Si' within Equisetum cell walls. Phytochemistry 70: 2089-2095.
17. DE LA SOTA, E. R. 1967. Composición, origen y vinculaciones de la flora pteridológica de las Sierras de Buenos Aires (Argentina). Bol. Soc. Argent. Bot. 11: 105-128. [ Links ]
18. DE LA SOTA, E. R. 1973. La distribución geográfica de las Pteridofitas en el Cono Sur de América meridional. Bol. Soc. Argent. Bot. 15: 23-34. [ Links ]
19. DE LA SOTA , E. R. 1977. Pteridophyta. En: A. CABRERA (dir.), Flora de Jujuy. Colecc. Ci. Inst. Nac. Tecnol. Agropecu., 13: 1-275. Buenos Aires. [ Links ]
20. DE LA SOTA, E. R. & J. T. MICKEL. 1968. Sinopsis de las especies argentinas del género Anemia Swartz (Schizaeaceae). Revista Museo de La Plata (n.s.), Bot. 11: 133-152. [ Links ]
21. DE LA SOTA, E. R. & M. A. MORBELLI. 1981. Distribución de esporangios en estróbilos de las especies sudamericanas de Selaginella Pal. Beauv. I. S. peruviana (Milde) Hieron. y S. sellowii Hieron. Physis, Secc. C, 40(98): 39-53. [ Links ]
22. DE LA SOTA, E. R. & M. A. MORBELLI. 1985. Pteris longifolia L. o P. vittata L. (Adiantaceae, Pteridophyta). Lo que ocurre en Argentina. Physis, Secc. A, B & C 43: 73-83. [ Links ]
23. DE LA SOTA, E. R., M. L. LUNA, G. E. GIUDICE & J. P. RAMOS GIACOSA. 2009. Sinópsis de las Pteridofitas de la Provincia de San Luis (Argentina). Bol. Soc. Argent. Bot. 44: 367-385. [ Links ]
24. DETTMANN, M. E. & H. T. CLIFFORD. 1991. Spore morphology of Anemia, Mohria and Ceratopteris (Filicales). Amer. J. Bot. 78: 303-325. [ Links ]
25. DETTMANN, M. E. & H. T. CLIFFORD. 1992. Phylogeny and biogeography of Ruffordia, Mohria and Anemia (Schizaeaceae) and Ceratopteris (Pteridaceae): evidence from in situ and dispersed spores. Alcheringa 16: 269-314. [ Links ]
26. DI PASQUO, M. & L. J. SILVESTRI. 2014. Las colecciones de Palinología y Paleobotánica del Laboratorio de Palinoestratigrafía y Paleobotánica del Centro de Investigaciones Científicas y Transferencia de Tecnología a la Producción (CICyTTP), Entre Ríos, Argentina. Bol. Asoc. Latinoam. Paleobot. Palinol. 14: 39-47. [ Links ]
27. GARDENAL, P., M. A. MORBELLI & G. E. GIUDICE. 2007. Morphology and ultrastructure of heterosporous Filicophyta spores from north-west Argentina. Grana 46: 65-77. [ Links ]
28. GARDENAL, P., M. A. MORBELLI & G. E. GIUDICE. 2008. Spore morphology and ultrastructure in Salvinia Ség. species that grow in Southern South America. Palynology 32: 143-156. [ Links ]
29. GIUDICE, G. E. & M. A. MORBELLI. 1998. Pityrogramma tartarea (Pteridaceae, Pteridophyta) su presencia en Argentina. Hickenia 2: 277-280. [ Links ]
30. GIUDICE, G. E., M. A. MORBELLI & M. R. PIÑEIRO. 2000. Palynological analysis in Doryopteris J. Smith species from Northwestern Argentina (Pteridaceae, Pteridophyta). Grana 39: 279-287. [ Links ]
31. GIUDICE, G. E., M. A. MORBELLI & M. R. PIÑEIRO. 2002. Palynological study in Aspleniaceae from Northwest Argentina. Bol. Soc. Argent. Bot. 37: 217-229. [ Links ]
32. GIUDICE, G. E., M. A. MORBELLI, M. R. PIÑEIRO, M. COPELLO & G. ERRA. 2004. Spore morphology of the Polypodiaceae from the Northwest Argentina. Amer. Fern J. 94: 9-27. [ Links ]
33. GIUDICE, G. E., J. P. RAMOS GIACOSA, M. L. LUNA, C. MACLUF, M. PONCE, G. MARQUEZ & E. R. DE LA SOTA. 2011. Evaluación preliminar del grado de amenaza de los helechos y licofitas de Argentina. Bol. Soc. Argent. Bot. 46: 151-161. [ Links ]
34. GOVETO, L. 2005. Ocurrencia histórica de fuegos en la sabana del Parque Nacional El Palmar: evidencias climáticas y florísticas. Tesis de maestría. Facultad de Agronomía, Universidad de Buenos Aires. [ Links ]
35. GRAUVOGEL STAMM, L. & B. LUGARDON. 2009. Phylogeny and evolution of the horsetails: Evidence from spore wall ultrastructure. Rev. Palaeobot. Palynol. 156: 116-129. [ Links ]
36. GRAY, J. P. 1995. Techniques in Palynology. En: B. KUMMEL & B. RAUP (eds.), Handbook of Paleontological Techniques, pp. 471-481. Freeman and Co., San Francisco/London. [ Links ]
37. GUILLON, J. M. 2004. Phylogeny of horsetails (Equisetum) based on the chloroplast rps4 gene and adjacent noncoding sequences. Syst. Bot. 29: 251-259. [ Links ]
38. KREMP, G. O. W. & T. KAWASAKI. 1972. The spores of the pteridophytes. Hirokawa Publ. Co., Tokio. [ Links ]
39. LEÓN, R. J. C. 1991. Vegetación. En: R.T. COUPLAND (ed.), Ecosystems of the World 8A. Natural Grasslands. Introduction and Western Hemisphere, pp. 380-387. Elsevierm Amsterdam, New York. [ Links ]
40. LORSCHEITTER, M. L., A. R. ASHRAF, R. MACHADO BUENO & V. MOSBRUGGER. 1998. Pteridophyte spores of Rio Grande do Sul flora, Brazil. Part I. Palaeontographica Abt. B, 246: 1-113. Stuttgart. [ Links ]
41. LORSCHEITTER, M. L., A. R. ASHRAF, P. WINDISCH & V. MOSBRUGGER. 2001. Pteridophyte spores of Rio Grande do Sul flora, Brazil. Part III. Palaeontographica Abt. B, 260: 1-165. Stuttgart. [ Links ]
42. LORSCHEITTER, M. L., A. R. ASHRAF, P. WINDISCH & V. MOSBRUGGER. 2002. Pteridophyte spores of Rio Grande do Sul flora, Brazil. Part IV. Palaeontographica Abt. B, 263: 1-159. Stuttgart. [ Links ]
43. LORSCHEITTER, M. L., A. R. ASHRAF, P. WINDISCH & V. MOSBRUGGER. 2005. Pteridophyte spores of Rio Grande do Sul flora, Brazil. Part V. Palaeontographica Abt. B, 270: 1-180. Stuttgart. [ Links ]
44. LORSCHEITTER, M. L., A. R. ASHRAF, P. WINDISCH & V. MOSBRUGGER. 2009. Pteridophyte spores of Rio Grande do Sul flora, Brazil. Part VI. Palaeontographica Abt. B, 281: 1-96. Stuttgart. [ Links ]
45. MARTINEZ, O., TANCO, M., CHAMBI, J., BONOMO, M., RAMÍREZ, M., AVILEZ, Z. 2012. Temas BGNoa 2 (2): 48-53. [ Links ]
46. MAUTINO, L. R. & L. M. ANZÓTEGUI. 1998. Palinología de la Formación Chiquimil (Mioceno Superior) en Vallecito, Provincia de Catamarca, Argentina. Parte 1. Esporas: especies nuevas. Revista Asoc. Paleontol. Argent. 35: 227-233. [ Links ]
47. MCLACHLAN, J. S. 2007. Paleophytogeography. In: S. A. ELIAS (ed.), Encyclopedia of Quaternary Science, pp. 1594-1595. Elsevier Press, Amsterdam. [ Links ]
48. MEZA TORRES, E. L., E. R. DE LA SOTA & M. S. FERRUCCI. 2013. Sinopsis de los helechos y licofitos del Parque Nacional Mburucuyá (Corrientes, Argentina): Claves de especies. Bol. Soc. Argent. Bot. 48: 121-136. [ Links ]
49. MICHELENA, I. G. 1989. Esporas de Adiantaceae (Pteridophyta) de la Provincia de Buenos Aires, Argentina. Bol. Asoc. Latinoam. Paleobot. Palinol. 12: 25-31. [ Links ]
50. MICKEL, J. T. 1962. A monographic study of the fern genus Anemia, subgenus Coptophyllum. Iowa St. J. Sci. 36: 349-482. [ Links ]
51. MORAN, R.C. 2008. Diversity, Biogeography, and Floristic. En: T.A. RANKER & C.H. HAUFLER (eds.), Biology and Evolution of Fern and Lycophytes, pp. 367-394. Cambridge University Press, Cambridge. [ Links ]
52. MORAN, R. C. & R. RIBA. 1995. Psilotaceae a Salviniaceae. En: G. DADVISE, M. S. SOUSA & S. KNAPP (eds.), Flora Mesoamericana Vol. 1, pp. 1-470. Universidad Nacional Autónoma de México. [ Links ]
53. MORBELLI, M. A. 1977. Presencia de Corpúsculos de Ubisch en las esporas de las Pteridofitas. Obra Centenario Museo La Plata 3 (Bot.): 237-247. [ Links ]
54. MORBELLI, M. A. 1978. Spore morphologic key and photomicrographs of the genera of the Fuego- Patagonian Pteridophyta. En: V. MARKGRAF & H.L. D'ANTONI (eds.), Pollen Flora of Argentina, pp. 208. The University of Arizona Press, Tucson. [ Links ]
55. MORBELLI, M. A. 1980. Morfología de las esporas de Pteridophyta presentes en la región Fuegopatagónica, República Argentina. Opera Lilloana 28: 1-138. [ Links ]
56. MORBELLI, M. A. 1995. Megaspore wall in Lycophyta-ultrastructure and function. Rev. Palaeobot. Palynol. 85: 1-12. [ Links ]
57. MORBELLI, M. A & G. E. GIUDICE. 2005. Spore wall ultrastructure in Aspleniaceae (Pteridophyta) from North-West Argentina. Rev. Palaeobot. Palynol. 135: 131-143. [ Links ]
58. MORBELLI, M. A. & G. E. GIUDICE. 2010. Spore wall ultrastructure of Polypodiaceae from north-western Argentina. Grana 49: 204-214. [ Links ]
59. MORBELLI, M. A. & I. G. MICHELENA. 1989. Palynological analysis of Cheilanthes species of Northwestern Argentina. Grana 28: 295-304. [ Links ]
60. MORBELLI, M. A., M. M. PONCE, C. C. MACLUF & M. R. PIÑEIRO. 2001. Palynology of South American Argyrochosma and Notholaena (Pteridaceae) species. Grana 40: 280-291. [ Links ]
61. MOVIA, C. P. & M. F. MENVIELLE. 1994. Vegetación. En: CICCERO P., A. BALABUSIC (eds.), Plan de Manejo del Parque Nacional El Palmar, Administración de Parques Nacionales. [ Links ]
62. MUÑOZ, N., DI PASQUO, M., 2015. Análisis aeropalinológico en tres áreas de vegetación dentro del Parque Nacional El Palmar (Colón, Entre Ríos) y su relación con la vegetación local y regional. Resúmenes 16° Simposio Argentino de Paleobotánica y Palinología (La Plata 2015). Ameghiniana 52 (4) Suplemento 2015: 7. [ Links ]
63. MUÑOZ, N.S., A. R. PRIETO, M. M. DI PASQUO. 2013. Relación polen-vegetación actual en la región pastizal-palmar del Parque Nacional El Palmar, Argentina. Resúmenes 14° Simpósio Brasileiro de Paleobotânica e Palinologia, Río de Janeiro: 120. [ Links ]
64. NAAB, O. A. 1987 a. Estudio morfológico de las esporas de Pteridophyta de la Provincia de La Pampa. Resúmenes 7° Simposio Argentino de Paleobotánica y Palinología (Mendoza): 153-156. [ Links ]
65. NAAB, O. A. 1987b. Estudio morfológico de las esporas de Pteridophyta de la Provincia de La Pampa. Bol. Soc. Argent. Bot. 25: 163-185. [ Links ]
66. NUÑEZ OTAÑO, N., M. DI PASQUO & N. MUÑOZ. 2015 a. Airborne fungal spore's identifications from three sites at the El Palmar National Park (Colón, Entre Ríos, Argentina): Their spatial and temporal variation. Aerobiologia (Publ. Online DOI 10.1007/s10453-015-9382-6). [ Links ]
67. NUÑEZ OTAÑO, N., M. DI PASQUO, M. V. BIANCHINOTTI & G. BURR. 2015b. Primer registro de Potamomyces hyde en el Holoceno tardío del Parque Nacional "El Palmar", Entre Ríos, Argentina. Resúmenes 16° Simposio Argentino de Paleobotánica y Palinología (La Plata 2015). Ameghiniana 52 (4) Suplemento 2015: 17. [ Links ]
68. PAGE, C. N. 2002. Ecological strategies in fern evolution: a neopteridological overview. Rev. Palaeobot. Palynol. 119: 1-33. [ Links ]
69. PIÑEIRO, M. R. & M. A. MORBELLI. 2012. Morfología y ultraestructura de las esporas de Nephrolepis cordifolia (Davalliaceae) del Noroeste de Argentina. Bol. Soc. Argent. Bot. 47: 71-75. [ Links ]
70. PIÑEIRO, M. R. & M. A. MORBELLI. 2014. Morfología y ultraestructura de las esporas de las Equisetaceae (Equisetopsida) del Noroeste de Argentina. Bol. Soc. Argent. Bot. 49: 35-40. [ Links ]
71. PIÑEIRO, M. R., G. E. GIUDICE & M. A. MORBELLI. 2006. Spore morphology and sporoderm ultrastructure in Adiantopsis Fée (Pteridaceae- Pteridophyta) from Argentina. Grana 45: 101-108. [ Links ]
72. PONCE, M. M. & M. A. MORBELLI. 1989. The Cheilanthes dichotoma Group of South America. Amer. Fern J. 79: 127-135. [ Links ]
73. PONCE, M., K. MEHLTRETER & E. R. DE LA SOTA. 2002. Análisis biogeográfico de la diversidad pteridofitica en Argentina y Chile continental. Revista Chil. Hist. Nat. 75: 703-717. [ Links ]
74. PRYER, K. M., E. SCHUETTPELZ, P. G. WOLF, H. SCHNEIDER, A. R. SMITH & R. CRANFILL. 2004. Phylogeny and evolution of ferns (monilophytes) with a focus on the early leptosporangiate divergences. Amer. J. Bot. 91: 1582-1598. [ Links ]
75. PUNT, W., P. P. HOEN, S. BLACKMORE, S. NILSSON & A. LE THOMAS. 2007. Glossary of pollen and spore terminology. Rev. Palaeobot. Palynol. 143: 1-83. [ Links ]
76. RAINE, J. I., D. C. MILDENHALL & E. M. KENNEDY. 2011. New Zealand fossil spores and pollen: an illustrated catalogue. 4th edition. GNS Science miscellaneous series no. 4. http://www.gns.cri.nz/what/earthhist/fossils/spore_pollen/catalog/index.htm [ Links ]
77. RAMOS GIACOSA, J. P., E. R. DE LA SOTA & G. E. GIUDICE. 2004 a. Actualización florística y análisis numérico de la biodiversidad de las pteridofitas de la Provincia de Buenos Aires. Bol. Soc. Argent. Bot. 39: 125-130. [ Links ]
78. RAMOS GIACOSA, J. P., M. A. MORBELLI & G. E. GIUDICE. 2004 b. Spore wall ultrastructure in Anogramma species (Pteridaceae) from Argentina. Grana 43: 231-237. [ Links ]
79. RAMOS GIACOSA, J. P., M. A. MORBELLI & G. E. GIUDICE. 2012. Spore morphology and wall ultrastructure of Anemia Swartz species (Anemiaceae) from Argentina. Rev. Palaeobot. Palynol. 174: 27-38. [ Links ]
80. RAMOS GIACOSA, J. P., M. A. MORBELLI & G. E. GIUDICE. 2013. Comparative palynological analysis of Lygodium venustum Sw. and L. volubile Sw. (Lygodiaceae). An. Acad. Bras. Cienc. 85: 699- 707. [ Links ]
81. RAMOS GIACOSA, J. P., M. A. MORBELLI & M. M. PONCE. 2001. Las esporas de las Pteridophyta de la Provincia de Entre Ríos. Resúmenes 28° Jornadas Argentinas de Botánica (Santa Rosa). Bol. Soc. Argent. Bot. 36 (supl. [ Links ]).
82. RINCÓN BARÓN, E. J., H. G. FORERO BALLESTEROS, L. V. GÉLVEZ LANDAZÁBAL, G. A. TORRES & C. H. ROLLERI. 2011. Ontogenia de los estróbilos, desarrollo de los esporangios y esporogénesis de Equisetum giganteum (Equisetaceae) en los Andes de Colombia. Revista Biol. Trop. 59: 1845- 1858. [ Links ]
83. RODRÍGUEZ, E. E. 2013. Heterogeneidad de la vegetación en una porción del Espinal Mesopotámico. Tesis de Doctorado en Ciencias Biológicas. Facultad de Ciencias Naturales, Universidad Nacional de Salta. [ Links ]
84. ROTHWELL, G. W., 1996. Pteridophytic evolution: an often underappreciated phytological success story. Rev. Palaeobot. Palynol. 90: 209-222. [ Links ]
85. RUIZ SELMO, F. E., P. G. MINOTTI, A. SCOPEL & M. PARIMBELLI. 2007. Análisis de la heterogeneidad fisonómico-funcional de la vegetación del Parque Nacional El Palmar y su relación con la invasión por leñosas exóticas. En: MARTIN (ed.), Teledetección- Hacia un mejor entendimiento de la dinámica global y regional, pp. 257-263. [ Links ]
86. SMITH, A. R., K. M. PRYER, E. SCHUETTPELZ, P. KORALL, H. SCHNEIDER & P. G. WOLF. 2006. A classification for extant ferns. Taxon 55: 705-731. [ Links ]
87. SORIANO, A. 1991. Rio de la Plata Grasslands. En: R.T. COUPLAND (ed.), Ecosystems of the World 8 A. Natural Grassland. Introduction and Western Hemisphere, pp. 367-369. Elsevier, Amsterdam, New York. [ Links ]
88. TRAVERSE, A. 2007. Paleopalynology, Second Ed. Springer, Dordrecht. [ Links ]
89. TRYON, A. F. 1986. Stasis, diversity and function in spores based on an electron microscope survey of the Pteridophyta. En: BLACKMORE S. & I. K. FERGUSON (eds.), Pollen and Spores: Form and Function. Linnean Society Symposium, Series 12, pp. 233-249. Academic Press, London. [ Links ]
90. TRYON, A. F. & B. LUGARDON. 1991. Spores of the Pteridophyta, surface, wall structure and diversity based on electron microscope studies. Springer-Verlag, New York. [ Links ]
91. VILLAMIL, C. B., A. E. DE VILLALOBOS & R. L. SCOFFIELD. 2009-2010. Plantas endémicas de Argentina. www.lista-planear.org. [ Links ]
92. ZULOAGA, F. O., O. MORRONE & D. RODRÍGUEZ. 1999. Análisis de la biodiversidad en plantas vasculares de la Argentina. Kurtziana27: 17-167. [ Links ]
93. ZULOAGA, F. O., O. MORRONE. & M. J. BELGRANO (eds.). 2008. Catálogo de las plantas vasculares del Cono Sur. (Argentina, sur de Brasil, Chile, Paraguay y Uruguay). Monogr. Syst. Bot. Missouri Bot. Gard. 107: 1-3348. http://www2.darwin.edu.ar/Proyectos/FloraArgentina. [ Links ]
94. ZUQUIM, G., COSTA, F. R. C., PRADO, J. & TUOMISTO, H., 2008. Guía de samambaias e licófitas da REBIO Uatumã, Amazônia Central. Instituto Nacional de Pesquisa de Amazônia, Manaus. [ Links ]
Recibido el 25 de noviembre de 2015,
aceptado el 9 de marzo de 2016.














