Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.52 no.3 Córdoba set. 2017
ANATOMÍA Y MORFOLOGÍA
Modificaciones histológicas foliares causadas por organismos fúngicos en tres especies de Myrtaceae
Franco M. Mangone1,2, Myriam Del V. Catania3 y Patricia L. Albornoz1,3
1 Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Miguel Lillo 205, T4000JFE, San Miguel de Tucumán, Tucumán, Argentina. albornoz@csnat.unt.edu.ar
2 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina. franco_mangone@hotmail.com
3 Fundación Miguel Lillo, Miguel Lillo 251, T4000JFE, San Miguel de Tucumán, Tucumán, Argentina. mcatania@tucbbs.com.ar
Resumen
La familia Myrtaceae es una de las más numerosas en Argentina. En la provincia de Tucumán habitan 11 especies nativas, de las cuales Blepharocalyx salicifolius (Kunth) O. Berg, Eugenia uniflora L. y Myrcianthes pungens (O.Berg) D. Legrand presentan importancia medicinal, alimenticia y forestal. La información sobre las especies fúngicas y las modificaciones histológicas foliares que ellos producen es escasa. Por lo tanto, el objetivo de la presente investigación fue identificar las especies de hongos en hojas de las tres especies arbóreas y describir las modificaciones anatómicas causadas por la presencia de los mismos. Se trabajó con material fresco al que se aplicó técnicas y tinciones convencionales para su estudio. Se identificaron 12 especies fúngicas, 10 de ellas se citan por primera vez para la Argentina, en los tres hospedantes arbóreos estudiados. Puccinia psidii y Alternaria sp. se encontraron con mayor frecuencia. Los tejidos foliares más afectados fueron el parénquima esponjoso y el parénquima en empalizada. La lesión más significativa en la lámina foliar se observó en E. uniflora, producida por Microsphaerospis arundinis. Las especies fúngicas identificadas amplían el conocimiento de la diversidad de hongos asociados a hojas en especies arbóreas nativas de la provincia de Tucumán.
Palabras clave: Anatomía foliar; Hongos; Myrtaceae.
Summary
Histological changes in leaves caused by fungi in three species of Myrtaceae
The family Myrtaceae is one of the largest in Argentina. In the province of Tucumán, eleven native species inhabit, three of them, Blepharocalyx salicifolius (Kunth) O. Berg, Eugenia uniflora L. and Myrcianthes pungens (O. Berg) D. Legrand have medicinal, alimentary and forestry importance. Information about fungal species and histological foliar changes produced by them is limited. So the objective of this research is to identify the species of fungi present in leaves of these three tree species; and evaluate the anatomical changes caused by the presence of them. Conventional techniques and stains were used. Twelve fungal species were identified in the three arboreal hosts studied. Ten species were cited for the first time for Argentina. Puccinia psidii and Alternaria sp. were found more frequently. The most affected leaf tissues were the palisade and spongy parenchyma. The most significant lesion was that one observed in the leaf of E. uniflora, it was produced by Microsphaerospis arundinis. Fungal identified species increases the knowledge of the diversity of fungi associated with leaves in native tree species from province of Tucuman.
Key words: Leaf anatomy; Fungi; Myrtaceae.
Introducción
La familia Myrtaceae es una de las más numerosas en Argentina (Zuloaga et al., 2014). En la provincia de Tucumán habitan 11 especies nativas, entre las cuales Blepharocalyx salicifolius (Kunth) O. Berg, Eugenia uniflora L. y Myrcianthes pungens (O. Berg) D. Legrand son especies abundantes (Brown et al., 2006) y presentan importancia medicinal, alimenticia y forestal (Cortadi et al., 1996; Zuloaga et al., 2014).
La micobiota asociada a B. salicifolius, E. uniflora y M. pungens, está relacionada generalmente con las hojas. En B. salicifolius, Bettucci et al. (2004), identificaron diferentes especies fúngicas en hojas de árboles nativos de Uruguay. Pereira-Carvalho et al. (2010), describen a Plurispermiopsis, como un nuevo género; mientras que, Larran et al. (2011), realizaron el primer reporte de Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. sobre este hospedante para Argentina. En E. uniflora, Nag Raj (1993), Crous et al. (1997), Crous (1999) y Braun (2001), aportaron estudios sobre la diversidad de la micobiota foliar, describiendo nuevas especies y combinaciones. Langrell et al. (2008), Crous et al. (2009) y Dixon et al. (2009), realizaron aislamientos de hongos asociados a hojas, para posteriores estudios filogenéticos. En M. pungens, Pérez et al. (2010), contribuyeron con la identificación de especies de Botryosphaerciaceae en ramas, pecíolo y hojas. Pérez et al. (2011), efectuaron estudios filogenéticos de hongos foliares, aislados de este hospedante.
La caracterización de la anatomía foliar de B. salicifolius, fue realizada por Guantay (2004) y Arambarri et al. (2006), en individuos de las regiones del noroeste y del litoral argentino, respectivamente. En E. uniflora, Alves et al. (2008) y Gomes et al. (2009), realizaron estudios en muestras foliares de Brasil; mientras que, González & González (2011), trabajaron con ejemplares de la región chaqueña de Argentina. En M. pungens, los estudios histológicos foliares fueron efectuados por Ponessa (2007), Arambarri et al. (2008, 2009) y González & González (2011), en las regiones del noroeste, litoral y chaco argentino, respectivamente. A su vez, Cortadi et al. (1996), estudiaron la anatómica foliar de las tres especies arbóreas, citadas anteriormente.
En la Argentina, el conocimiento sobre la diversidad fúngica en las diferentes regiones, principalmente en el NOA se encuentra en constante investigación (Sir et al., 2012; Gallo et al., 2014). El estudio de los hongos asociados a hojas, en hospedantes nativos, en la provincia de Tucumán son escasos (Catania et al., 2011, 2012; entre otros), por lo que los objetivos del presente trabajo fueron identificar las especies fúngicas en hojas de Blepharocalyx salicifolius, Myrcianthes pungens y Eugenia uniflora, y describir las modificaciones histológicas foliares en presencia de los hongos.
Materiales y Métodos
Área de estudio
Los muestreos se realizaron en el Parque Sierra de San Javier (Horco Molle, camino al funicular, a los 650 msnm, 26°4707"S, 65º2005"O), perteneciente a la provincia biogeográfica de "Las Yungas" (Cabrera, 1976; Brown et al., 2006), y en el Jardín Botánico de la Fundación Miguel Lillo (San Miguel de Tucumán, a los 420 msnm, 26°4951"S, 65º1318"O), esta es una muestra de la selva tucumano-boliviana, pudiéndose diferenciar especies de árboles y arbustos autoctónos del Noroeste Argentino (Carrizo et al., 1991; Bulacio et al., 2001).
Recolección de las muestras
Se recolectaron hojas al azar, de las tres especies de Myrtaceae, las cuales presentaron manchas y/o colonias fúngicas, visibles a simple vista. Las muestras fueron conservadas en papel absorbente, hasta su procesamiento. En el laboratorio, se colocaron en sobres de papel para su posterior identificación.
Identificación de las especies fúngicas
En el estudio morfológico de las especies de hongos se utilizó microscopio estereoscópico (Leica, MZ6) y microscopio binocular de campo claro (Olympus, CX31). Para observar las estructuras fúngicas se realizaron cortes transversales de la hoja a mano alzada. Las tinciones utilizadas fueron azul de algodón y floxina en solución acuosa al 5% (Kirk et al., 2008) y el medio de montaje agua y agua-glicerina (1:1). Se realizaron mediciones y fotografías de las estructuras macroscópicas y microscópicas. En el reconocimiento taxonómico de las especies fúngicas encontradas se utilizaron claves y bibliografía específica (Ellis, 1971, 1976; Sutton, 1980; Nag Raj, 1993; Seifert et al., 2011). Los ejemplares de referencia se depositaron en el herbario micológico de la Fundación Miguel Lillo (LIL) (Thiers, 2016).
Tratamiento de las muestras para las observaciones de las modificaciones histológicas
Se utilizaron hojas vivas con manchas necróticas y colonias de hongos; se realizaron cortes transversales con la técnica de "mano libre". Las tinciones fueron safranina, violeta de cresilo y una doble tinción de azul astra-safranina (D´Ambrogio de Argüeso, 1986). Los preparados fueron montados en agua-glicerina (1:1). Las observaciones se realizaron con microscopio estereoscópico (Olympus, SZX7) y microscopio óptico (Zeiss, Axiostar Plus); las fotomicrografías fueron tomadas con cámara digital Canon (A620, 7,1 MP). Se observó la presencia/ausencia de tejidos, cambios estructurales y de pigmentación de los mismos. Presencia/ausencia de cristales de oxalato de calcio, glándulas esquizolisígenas y haces vasculares, por encontrarse en tejidos sanos. Se realizaron mediciones del espesor de láminas en hojas sanas y en hojas con manchas necróticas y/o en colonias fúngicas superficiales. Se calcularon los porcentajes de reducción de la lámina foliar a partir del promedio de diez mediciones por cada especie de hongo/hospedante.
Micobiota asociada con los tres hospedantes
Se realizó una búsqueda bibliográfica de las especies fúngicas registradas en B. salicifolius, E. uniflora y M. pungens, distribuidas en el mundo.
Material examinado en hojas de:
Blepharocalyx salicifolius: ARGENTINA. Prov. Tucumán: Dpto. Capital, 420 m, 26-VII-2012, Mangone 3384 (LIL); Idem, 29-VIII-12, Mangone 3385, 3388 (LIL). Dpto. Tafí Viejo, Parque Sierra de San Javier, Horco Molle, camino al funicular, 650 m, 26-III-2013, Mangone 3413, 3420, 4316, 3414, 3425 (LIL).
Eugenia uniflora: ARGENTINA. Prov. Tucumán: Dpto. Capital, 420 m, 26-VII-2012, Mangone 3382 (LIL); Idem, 19-IV-2013, Mangone 3400, 3402 (LIL); Idem, 24-VII-2013, Mangone 3405 (LIL).
Myrcianthes pungens: ARGENTINA. Prov. Tucumán: Dpto. Capital, 420 m, 26-IX-2012, Mangone 3394, 3393, 3395 (LIL); Idem, 05-VI- 2012, Mangone 3378, 3379 (LIL); Idem, 26-IX- 2012, Mangone 3394, 3395, 3396 (LIL); Idem, 05- VI-2012, Mangone 3378 (LIL); Idem, 06-XII-2012, Mangone 3398 (LIL).
Resultados
Del estudio de 43 muestras en total de hojas de Blepharocalyx salicifolius, Eugenia uniflora y Myrcianthes pungens, se identificaron 12 especies de hongos.
Dothideomycetes
Capnodiales
Teratosphariaceae
Tripospermum myrti (Lind) S. Hughes, Mycol. Pap. 46: 18. 1951.
El micelio forma una película delgada en ambas superficies foliares de B. salicifolius (Fig. 1A, C) y M. pungens. La lámina foliar presentó una reducción del espesor en un 8% en B. salicifolius (Fig. 1B) y un 14,5% en M. pungens; sin embargo, la estructura de los tejidos de la lámina no presentó modificación.

Fig. 1. Blepharocalyx salicifolius. A-C: Tripospermum myrti. A: Hoja con colonias castaño grisácea. B: Corte transversal de la lámina a la altura de la colonia. C: Micelio; conidio. Eugenia uniflora. D-G: Cladosporium oxysporum. D-E: Láminas con colonias fúngicas; detalle. F. Corte de la lámina. G. Conidióforo y conidios. Eugenia uniflora. H-I: Microsphaeropsis arundinis. H: Lesión con borde oscuro, con conidiomas picnidiales. I: Corte transversal de la lámina mostrando reducción en el espesor de la misma. Myrcianthes pungens. J, K, M: Alternaria sp. J: Lesiones castañas. K: Detalle de las colonias (flecha). M: Conidióforos, conidios. Eugenia uniflora. Alternaria sp. L: Corte transversal de la lámina. Myrcianthes pungens. N-Ñ: Periconia byssoides. N: Lesión con conidióforos (flecha). Ñ: Detalle de conidióforo y conidios. Abreviaturas: ms= mesofilo, pem= parénquima empalizada, pes= parénquima esponjoso.
Según Grabowski (2007), especies del género forman parte de un grupo de hongos conocidos como fumagina, en inglés, "sooty moulds", dando lugar a películas delgadas y oscuras, sobre hojas, ramas y a veces frutos de diferentes plantas; pudiendo llegar a inhibir la fotosíntesis. Se diferencian formas saprófitas y patógenas de plantas (Hughes, 1976; Grabowski, 2004; Wrona & Grabowski, 2004). Rubial et al. (2009) realizaron un análisis filogenético de hongos de la clase Dothidiomycetes, incluyendo en la familia Teratosphaeriaceae dos grupos según el hábitat, citando a T. myrti como especie que coloniza hojas. Quaedvlieg et al. (2014) realizaron secuencia de ADN de numerosas especies fúngicas con diferentes hábitat de la familia Teratosphaeriaceae, incluyendo a T. myrti en la nueva familia Neodevriesiaceae.
Capnodiales
Cladosporiaceae
Cladosporium oxysporum Berk. & M. A. Curtis, in Berkeley, J. Linn. Soc., Bot. 10
(46): 362. 1868.
Se desarrolla en la superficie abaxial de hojas de E. uniflora (Fig. 1D, E, G) y M. pungens. La lámina foliar no presenta modificación estructural (Fig. 1F). Barrios & Pérez (2005) y Baiswar et al. (2011) mencionan a Cladosporium oxysporum como un organismo saprófito y/o patógeno de plantas. Bensaci et al. (2015) utilizaron suspensiones de conidios de C. oxysporium, endófito aislado de tallos de Euphorbia bupleuroides subsp. luteola (Kralik) Maire, para control biológico del pulgón negro (Aphis fabae Scop.) de granos.
Pleosporales
Didymellaceae
Microsphaeropsis arundinis (S. Ahmad) B. Sutton, The Coelomycetes (Kew): 423. 1980.
Se desarrolla en la superficie adaxial de hojas de E. uniflora (Fig. 1H). El micelio del hongo se extiende por el mesofilo parenquimático de la lámina, dañando casi la totalidad del mismo. El conidioma picnidial, inmerso en la hoja, rompe la epidermis adaxial (Fig. 1I). En el punto de localización de las manchas necróticas se observó reducción del espesor total de la lámina en un 29,7% (Fig. 1I). En el género Microsphaeropsis Höhn se diferencian formas saprófitas, endófitas, parásitas de plantas, animales y del hombre (Wanderley et al., 2012). Luo et al. (2013) aislaron de una planta extracto de un hongo endofítico, M. arundinis, resultando inhibidor contra la bacteria Staphylococcus aureus.
Pleosporales
Pleosporaceae
Alternaria sp.
Los conidióforos se desarrollan hacia el envés de las hojas de E. uniflora, mientras que, en B. salicifolius y M. pungens están presentes en ambas superficies foliares (Fig. 1J, K). En E. uniflora ambas epidermis se mantienen, el parénquima en empalizada se deshidrata, y el parénquima esponjoso se desorganiza; se observaron hifas en el mesofilo (Fig. 1L). En B. salicifolius ambas epidermis y el mesofilo parenquimático se mantienen; el parénquima en empalizada toma una coloración castaña. En M. pungens ambas epidermis y la hipodermis adaxial están presentes, sin embargo, el mesofilo parenquimático de la lámina se desorganiza; observándose restos de pared celular e hifas del hongo (Fig. 1M). Los cristales de oxalato de calcio en forma de drusas y los haces vasculares se presentaron sin modificaciones en los tres hospedantes; mientras que, las glándulas esquizo-lisígenas solo se observaron en E. uniflora y B. salicifolius. En el punto de localización de las manchas necróticas, el espesor total de la lámina se redujo un 17,5% en B. salicifolius, un 48,8% en M. pungens y un 41,4% en E. uniflora. Las especies del género incluyen formas parásitas, saprófitas y endófitas (Peever et al., 2004; Woudenberg et al., 2013).
Pleosporales
Incertae sedis
Periconia byssoides Pers., Syn. meth. fung. (Göttingen) 1: 18. 1801.
Este hongo se desarrolla sobre las lesiones ocasionadas por Alternaria sp., en ambas superficies de las hojas de B. salicifolius y M. pungens (Fig. 1N, Ñ). La lámina no presentó modificación estructural, debido a su condición de saprófito.
Algunas especies del género pueden causar enfermedades en diferentes plantas (Sandoval et al., 2003; Sandoval & Estrada, 2003).
Pleosporales
Didymellaceae
Phoma glomerata (Corda) Wollenw. & Hochapfel, Z. ParasitKde 3 (5): 592. 1936.
Se desarrolla en la superficie adaxial de hojas de M. pungens (Fig. 2A, C, D). Los conidiomas picnidiales ocupan gran parte del espesor de la lámina, próximos a los haces vasculares; desgarran la epidermis e hipodermis adaxial. El mesofilo parenquimático se necrosa y desorganiza, tomando una coloración castaño rojiza (Fig. 2B). Los cristales de oxalato de calcio en forma de drusa estuvieron presentes, no se observaron las glándulas esquizo-lisígenas. En las manchas necróticas el espesor total de la lámina se redujo un 57,6% en M. pungens. Aveskamp et al. (2008) mencionan que, en las especies del género, se diferencian formas saprófitas, endófitas, parásitas de plantas y animales, incluido el hombre.

Fig. 2. Myrcianthes pungens. A-D: Phoma glomerata. A: Lesión con conidiomas picnidiales (flecha). B: Corte transversal de la lámina. C: Células conidiógenas. D: Conidios. Eugenia uniflora. E-G: Colletotrichum gloeosporioides. E: Lesión con conidiomas acervulares. F: Corte transversal de la lámina, conidioma acervular. G: Seta acervular. Blepharocalyx salicifolius. H-J: Discosia artocreas. H: Lesión con bordes oscuros, conidiomas picnidiales (flecha). I: Corte transversal de la lámina, conidiomas picnidiales. J: Conidios. Eugenia uniflora. K-M: Discosia lauricola. K: Lesión irregular. L: Corte transversal de la lámina, con conidioma picnidial. M: Conidios. Myrcianthes pungens. N-O: Discosia lauricola. N: Lesión en la lámina. Ñ: Corte transversal de la lámina. O: Conidios. Abreviaturas: ms= mesofilo, pem= parénquima empalidaza, pes= parénquima esponjoso.
Sordariomycetes
Insertae sedis
Glomerellaceae
Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Complejo de especies.
El conidioma acervular, subcuticular, se desarrolla en la superficie adaxial de hojas de E. uniflora (Fig. 2E, G). Los diferentes tejidos de la lámina se mantienen sin modificación; las glándulas esquizo-lisígenas, los cristales de oxalato de calcio en forma de drusa y los haces vasculares están presentes. El espesor total de la lámina se reduce un 17,4%, a la altura de las manchas necróticas (Fig. 2F). Colletotrichum gloeosporioides es un importante patógeno de plantas que ocasiona graves pérdidas económicas (Carrillo et al., 2005; Pardo et al., 2012).
Amphisphaeriales
Discosiaceae
Discosia artocreas (Tode) Fr., Summa veg. Scand., Section Post. (Stockholm): 423. 1849.
El conidioma picnidial, subcuticular, se desarrolla hacia la superficie adaxial de las hojas de B. salicifolius (Fig. 2H, J). Ambas epidermis se mantienen; el mesofilo parenquimático se desorganiza; los cristales de oxalato de calcio en forma de drusa, haces vasculares y glándulas esquizo-lisígenas se encuentran presentes. En las manchas necróticas se observa una reducción de un 54,7% en el espesor total de la lámina (Fig. 2I). El género incluye formas saprófitas y patógenas de plantas (Vanev, 1991; Tanaka et al., 2011).
Discosia lauricola Nag Raj, Coelomycetous Anamorphs with Appendagebearing Conidia (Ontario): 312. 1993.
El conidioma picnidial se desarrolla hacia la superficie adaxial en hojas de E. uniflora (Fig. 2K, M) y M. pungens (Fig. 2N, O); la epidermis de ambos hospedantes y la hipodermis de M. pungens, se desgarra. En ambas especies arbóreas el conidioma picnidial se encuentra en el parénquima en empalizada. En E. uniflora el parénquima esponjoso reduce sus espacios intercelulares (Fig. 2L), mientras que en M. pungens se desorganiza (Fig. 2Ñ). Los cristales de oxalato de calcio en forma de drusa y los haces vasculares están presentes en las manchas necróticas de ambos hospedantes. Las glándulas esquizo-lisígenas se mantuvieron en E. uniflora. La lámina foliar, a la altura de las manchas necrosadas, se redujo un 37,7% en E. uniflora y un 48,8% en M. pungens.
Amphisphaeriales
Phlogicylindriaceae
Monochaetinula ceratoniae (Sousa da Câmara) Nag Raj, Coelomycetous Anamorphs with Appendage-bearing Conidia (Ontario): 516. 1993.
Esta especie desarrolla conidioma acervular subepidérmico en la superficie adaxial de hojas de B. salicifolius (Fig. 3 A). La epidermis adaxial se eleva junto a la cutícula abriéndose al exterior. Las células del parénquima en empalizada se comprimen a la altura del conidioma y el parénquima esponjoso se desorganiza (Fig. 3B). Los cristales de oxalato de calcio en forma de drusa, las glándulas esquizo-lisígenas y los haces vasculares no presentan modificaciones. El espesor total de la lámina se redujo un 41,4% en el punto de localización de las manchas necróticas.

Fig. 3. Blepharocalyx salicifolius. A-B: Monochaetinula ceratoniae. A: Lesión con borde irregular. B: Corte transversal de la lámina, conidioma picnidial, conidio. Blepharocalyx salicifolius. C-E: Pestalotiopsis neglecta. C: Lesión en la lámina, conidiomas (flecha). D: Corte transversal de la lámina, conidioma acervular. E: Conidios. Myrcianthes pungens. F-I: Pestalotiopsis neglecta. F: Lesión con bordes oscuros y engrosados. G: Corte transversal de lámina. H: Conidioma acervular. I: Conidios. Myrcianthes pungens. J-N: Puccinia psidii. J: Lesiones con bordes irregulares. K: Detalle de la lesión con telios (flecha). L: Corte transversal de la lámina, telio (flecha). M: Teliósporas bicelulares. N: Corte transversal de la lámina, uredinio (flecha). Abreviaturas: ms= mesofilo, pem= parénquima empalizada, pes= parénquima esponjoso.
Amphisphaeriales
Pestalotiopsidaceae
Pestalotiopsis neglecta (Thüm.) Steyaert, Trans. Br. mycol. Soc. 36 (2): 83. 1953.
El conidioma acervular, subepidérmico, erumpente, se desarrolla hacia la superficie adaxial de hojas de B. salicifolius (Fig. 3C, E), y hacia la abaxial en M. pungens (Fig. 3F, H, I). La epidermis junto a la cutícula se eleva abriéndose al exterior. En B. salicifolius el parénquima en empalizada se mantiene, el esponjoso se desorganiza (Fig. 3D). En M. pungens el mesofilo parenquimático colapsa, observándose numerosas hifas del hongo (Fig. 3G). En las manchas necrosadas el espesor total de la lámina se reduce un 19% en B. salicifolius y un 56% en M. pungens. Las especies del género son parásitas, saprófitas, endófitas y simbiontes de plantas (Maharachchikumbura et al., 2011).
P. neglecta fue citada como endófito-parásito de plantas que pueden utilizarse en el control biológico de plagas y enfermedades de las plantas; sus metabolitos secundarios son utilizados como compuestos bioactivos en la industria farmacéutica (Qiu-Yue et al., 2015; Sharma et al., 2016).
Pucciniomycetes
Pucciniales
Pucciniaceae
Puccinia psidii G. Winter, Hedwigia 23: 171. 1884.
Los telios y uredinios se desarrollan con mayor frecuencia hacia la superficie abaxial de las hojas de M. pungens (Fig. 3 J, K). En los primeros estadios de desarrollo de los telios las células epidérmicas foliares se alargan. El parénquima en empalizada comienza a colapsar en algunos sectores y el parénquima esponjoso se desorganiza. En un estadio avanzado, los telios desgarran la epidermis y la cutícula, el mesofilo parenquimático se desorganiza (Fig. 3L, M). Los uredinios ocupan el mesofilo parenquimático y elevan la epidermis abaxial (Fig. 3 N). En todos los estadios del hongo, se observan cristales de oxalato de calcio en forma de drusa, glándulas esquizo-lisígenas y haces vasculares. El espesor total de la lámina se reduce un 46% en las manchas con telios y un 45% en las de uredinios.
Análisis comparativo del espesor de las hojas sanas y hojas con manchas necróticas en Blepharocalyx salicifolius, Eugenia uniflora y Myrcianthes pungens
En B. salicifolius el mayor porcentaje de reducción de la lámina foliar fue producida por Discosia artocreas, y el menor porcentaje se observó en las hojas con Tripospermum myrti (Fig. 4).
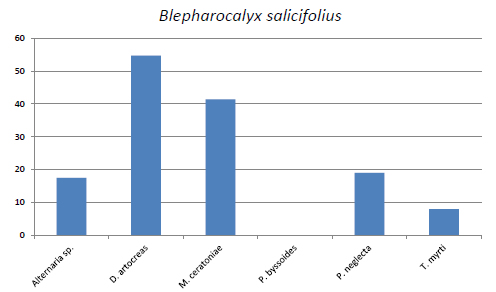
Fig. 4. Blepharocalyx salicifolius. Reducción de lámina foliar (%).
En E. uniflora el mayor porcentaje de reducción del tejido foliar fue producida por Alternaria sp. y Discosia lauricola; mientras que, Colletotrichum gloeosporioides presentó el menor porcentaje de reducción (Fig. 5).
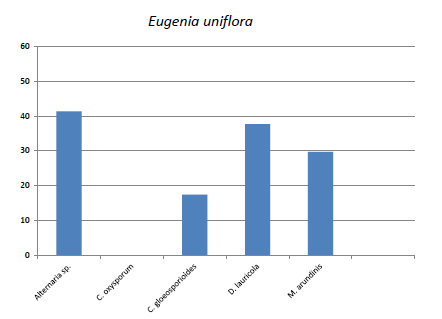
Fig. 5. Eugenia uniflora. Reducción de lámina foliar (%).
En M. pungens la mayoría de los hongos modificaron los tejidos foliares, presentando la mayor reducción de la lámina (Fig. 6).

Fig. 6. Myrcianthes pungens. Reducción de lámina foliar (%).
Micobiota asociada con los tres hospedantes
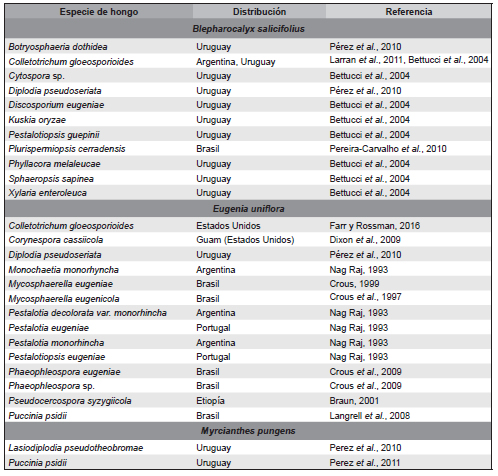
De la revisión bibliográfica de los géneros y/o especies de hongos descriptos y/o citados sobre B. salicifolius, E. uniflora y M. pungens, se observan diferentes especies de ascomicetes y un basidiomicetes, distribuidos principalmente en Sudamérica (Tabla 1). La mayoría de los hongos citados se encuentran asociados a hojas.
Tabla 1. Especies de hongos asociados con Blepharocalyx salicifolius, Eugenia uniflora y Myrcianthes pungens.
Discusión y Conclusiones
De las observaciones histológicas realizada en hojas de Blepharocalyx salicifolius, Eugenia uniflora y Myrcianthes pungens se observó, en los tres hospedantes, que el tejido foliar más afectado fue el mesofilo. En el caso de Microsphaerospis arundinis se vió daño del mesofilo en hojas de E. uniflora; la especie fúngica fue citada por Wanderley et al. (2012) y Luo et al. (2013) como endófita, saprófita y parásita. En algunos casos se observaron cambios estructurales en las hojas de los hospedantes; mientras que en otros no se visualizaron modificación en los tejidos de la lámina; sin embargo, en el caso de Tripospermum myrti se notó una leve reducción en el espesor total de la lámina de B. salicifolius y M. pungens. T. myrti forma parte de un grupo de hongos conocidos como fumagina (sooty moulds), dando lugar a películas delgadas y oscuras, sobre hojas de diferentes plantas, lo que lleva a tener efectos negativos en la fotosíntesis (Grabowski, 2007).
De la revisión bibliográfica sobre la micobiota en hojas de los hospedantes estudiados, se presentan escasos registros. Langrell et al. (2008) y Graça et al. (2011) citan a Puccinia psidii en E. uniflora, mientras que, Hennen et al. (2005) y Pérez et al. (2011), mencionan la misma especie en M. pungens. Alfieri et al. (1984) y Farr & Rossman (2016) registraron a Colletotrichum gloeosporioides sobre hojas de E. uniflora. Este trabajo aporta nuevos registros de ascomicetes para las especies arbóreas estudiadas, incluyendo nueve especies.
Para Argentina se citan por primera vez los siguientes géneros y/o especies de hongos en los hospedantes estudiados: Blepharocalyx salicifolius: Alternaria sp., Discosia artocreas, Monochaetinula ceratoniae, Periconia byssoides, Tripospermum myrti.
Eugenia uniflora: Alternaria sp., Cladosporium oxysporum, Discosia lauricola, Microsphaeropsis arundinis. Myrcianthes pungens: Alternaria sp., Cladosporium oxysporum, Discosia lauricola, Periconia byssoides, Pestalotiopsis neglecta, Phoma glomerata, Tripospermum myrti.
Las especies fúngicas encontradas con mayor frecuencia son Tripospermum myrti (B. salicifolius); Colletotrichum gloeosporioides (E. uniflora) y Puccinia psidii (M. pungens). Alternaria sp. fue el único hongo presente en los tres hospedantes.
La composición fúngica asociada a las tres especies arbóreas estudiadas fue diferente a la citada para otros países. Colletrotichum gloeosporioides en E. uniflora de Estados Unidos y Puccinia psidii en M. pungens de Uruguay, fueron las especies en común con este trabajo.
Agradecimientos
A la Facultad de Ciencias Naturales e Instituto Miguel Lillo (Universidad Nacional de Tucumán) y a la Fundación Miguel Lillo. Esta investigación fue financiada por el proyecto PIUNT G524 y formó parte de las Becas Estímulo a las Vocaciones Científicas, Convocatoria 2013, otorgadas por el Consejo Interuniversitario Nacional (CIN), al primer autor.
Bibliografía
1. ALFIERI JR., S. A., K. R. LANGDON, C. WEHLBURG & J. W.KIMBROUGH. 1984. Index of Plant Diseases in Florida (Revised). Florida Dept. Agric. and Consumer Serv., Div. Plant Ind. Bull. 11: 1-389. [ Links ]
2. ALVES, E. S., E. TRESMONDI & E. L. LONGUI. 2008. Análise estrutural de folhas de Eugenia uniflora L. (Myrtaceae) coletadas em ambientes rural e urbano, SP, Brasil. Acta Botânica Brasileira 22 (1): 241-248. [ Links ]
3. ARAMBARRI, A. M., S. E. FREIRE, M. N.COLARES, N. D. BAYÓN, M. C. NOVOA, C. MONTI & S. A. STENGLEIN. 2006. Leaf anatomy of Medicinal Shrubs and Trees from Gallery Forests of the Paranaense Province (Argentina). Part 1. Bol. Soc. Argent. Bot. 41 (3-4): 233-268. [ Links ]
4. ARAMBARRI, A. M., S. E. FREIRE, M. N. COLARES, N. D. BAYÓN, M. C. NOVOA, C. MONTI & S. A. STENGLEIN. 2008. Leaf anatomy of medicinal shrubs and trees from Misiones forest of the Paranaense Province (Argentina). Part 2. Bol. Soc. Argent. Bot. 43 (1-2): 31-60. [ Links ]
5. ARAMBARRI, A. M., S. E. FREIRE, N. D. BAYÓN, M. N. COLARES, C. MONTI, M. C. NOVOA & P. M. HERNÁNDEZ. 2009. Micrografía foliar de arbustos y pequeños árboles medicinales de la Provincia Biogeográfica de las Yungas (Argentina). Kurtziana 35 (1): 15-45. [ Links ]
6. AVESKAMP, M. M., J. DE GRUYTER & P. W. CROUS. 2008. Biology and recent developments in the systematics of Phoma, a complex genus of major quarantine significance. Fungal Diversity 31: 1-18. [ Links ]
7. BAISWAR, P., S. CHANDRA, T. K. BAG, R. K. PATEL, S. V. NGACHAN & B. C. DEKA. 2011. Cladosporium oxysporum on Prunus nepalensis in India. Australasian Plant Disease Notes 6: 3-6. [ Links ]
8. BARRIOS, L. M. & I. O. PÉREZ. 2005. Nuevos registros de hongos en semillas de Oryza sativa en Cuba. Manejo Integrado de Plagas y Agroecología 75: 64-67. [ Links ]
9. BENSACI, O. A., H. DAOUD, N. LOMBARKIA & K. ROUABAH. 2015. Formulation of the endophytic fungus Cladosporium oxysporum Berk. & M.A. Curtis, isolated from Euphorbia bupleuroides subsp. luteola, as a new biocontrol tool against the black bean aphid (Aphis fabae Scop.). Journal of Plant Protection Research 55 (1): 80-87. [ Links ]
10. BETTUCCI, L., S. SIMETO, R. ALONSO & S. LUPO. 2004. Endophytic fungi of twigs and leaves of three native species of Myrtaceae in Uruguay. Sydowia 56: 8-23. [ Links ]
11. BRAUN, U. 2001. Taxonomic notes on some species of the Cercospora complex (VII). Fungal Diversity 8: 41-71. [ Links ]
12. BROWN, A. D., S. PACHECO, T. LOMÁSCOLO & L. MALIZIA. 2006. Situación ambiental en los Bosques Andinos Yungueños. En: BROWN, A., U. MARTÍNEZ ORTÍZ, M. ACERBI, & J. CORCUERA (eds.). La situación ambiental argentina 2005, pp. 53-61. Fundación Vida Silvestre Argentina, Buenos Aires, Argentina. [ Links ]
13. BULACIO, E. DEL V., N. MURUAGA & M. E. CRISTÓBAL DE HINOJO. 2001. Árboles del jardín Botánico. Guías Botánicas Nº 1, pp. 1-55. Fundación Miguel Lillo, Argentina. [ Links ]
14. CABRERA, A. L. 1976. Regiones Fitogeografías Argentinas. Enciclopedia Argentina de Agricultura y Jardinería, pp. 85. Acme, Argentina. [ Links ]
15. CARRILLO FASIO, J. A., R. S. GARCÍA ESTRADA, M. D. MUY RANGEL, A. SAÑUDO BARAJAS, I. MÁRQUEZ ZEQUERA, R. ALLENDE MOLAR, Z. DE LA GARZA RUIZ, M. PATIÑO VERA & E. GALINDO-FENTANES. 2005. Control biológico de antracnosis [Colletotrichum gloesporioides (Penz.) Penz. y Sacc.] y su efecto en la calidad poscosecha del mango (Mangifera indica L.) en Sinaloa, México. Revista Mexicana de Fitopatología 23: 24-32. [ Links ]
16. CARRIZO, J. J., S. E. GOMEZ & P. G. ACEÑOLAZA. 1991. Guía de árboles del Jardín Botánico Miguel Lillo. Serie Monográfica y Didáctica Nº 13. Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Argentina. [ Links ]
17. CATANIA, M. DEL V. & A. I. ROMERO. 2011. Microcallis negii (Chaetothyriales, Ascomycota) primer registro para la Argentina y sobre Podocarpus parlatorei. Lilloa 48 (2): 131-135. [ Links ]
18. CATANIA, M. DEL V., P. L. ALBORNOZ & A. I. ROMERO. 2012. Auerswaldiella puccinioides (Botryosphaeriaceae, Ascomycota) sobre Prunus tucumanensis en el Noroeste Argentino. Lilloa 49 (1): 17-21. [ Links ]
19. CORTADI, A., O. DI SAPIO & M. GATTUSO. 1996. Caracteres anatómicos de tres especies medicinales de la familia Myrtaceae. Acta Farm. Bonaerense 15 (2): 109-123. [ Links ]
20. CROUS, P. W. 1999. Species of Mycosphaerella and related anamorphs occurring on Myrtaceae (excluding Eucalyptus). Mycological Research 103: 607-621. [ Links ]
21. CROUS, P. W., A. C. ALFENAS & R. W. BARRETO. 1997. Cercosporoid fungi from Brazil. 1. Mycotaxon 64: 405-430. [ Links ]
22. CROUS, P. W., J. Z. GROENEWALD, B. A. SUMMERELL, B. D. WINGFIELD & M. J. WINGFIELD. 2009. Co-occurring species of Teratosphaeria on Eucalyptus. Persoonia 22: 38- 48. [ Links ]
23. D´AMBROGIO DE ARGÜESO, A. 1986. Manual de técnicas de histología vegetal, pp. 83. Editorial Hemisferio Sur S. A., Buenos Aires, Argentina. [ Links ]
24. DIXON, L. J., R. L. SCHLUB, K. PERNEZNY & L. E. DATNOFF. 2009. Host specialization and phylogenetic diversity of Corynespora cassiicola. Phytopathology 99: 1015-1027. [ Links ]
25. ELLIS, M. B. 1971. Dematiaceous Hyphomycetes. Commonwealth Mycological Institute, pp. 608. Kew, Surrey, England. [ Links ]
26. ELLIS, M. B. 1976. More Dematiaceous Hyphomycetes. Commonwealth Mycological Institute, pp. 507. Kew, Surrey, England. [ Links ]
27. FARR, D. F. & A. Y. ROSSMAN. 2016. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA [online]. Disponible en http://www.nt.ars-grin.gov/fungaldatabases [Acceso: 10 Mayo 2016]. [ Links ]
28. GALLO, M. C., G. ROBLEDO, A. I. ROMERO & M. del V. CATANIA. 2014. New records of Ascomycota in the northwestern Argentinean Yungas. Check List 10 (3): 621-631. [ Links ]
29. GOMES, S. M., N. S. D. N. SOMAVILLA, K. M. GOMES BEZERRA, S. COUTO DE MIRANDA, P. S. DE CARVALHO & D. GRACIANO RIBEIRO. 2009. Anatomia foliar de espécies de Myrtaceae: contribuições à taxonomia e filogenia. Acta Botânica Brasileira 23 (1): 123-238. [ Links ]
30. GONZÁLEZ, A. B. & A. M. GONZÁLEZ. 2011. Anatomía foliar de especies arbóreas del Chaco Húmedo. Rojasiana 10 (2): 15-30. [ Links ]
31. GRABOWSKI, M. 2004. Etiology of sooty blotch in selected regions of southern Poland. Phytopathol. Pol. 34: 5-12. [ Links ]
32. GRABOWSKI, M. 2007. The study of new fungus species causing apple sooty blotch. Folia Horticulturae 19: 89-97. [ Links ]
33. GRAÇA, R. N., A. C. ALFENAS, A. L. ROSS DAVIS, N. B. KLOPFENSTEIN, M. S. KIM, T. L. PEEVER, P. J. CANNON, J. Y. UCHIDA, C. Y. KADOOKA & R. D. HAUFF. 2011. Multilocus genotypes indicate differentiation among Puccinia psidii populations from South America and Hawaii. In: FAIRWEATHER M. L. & P. PALACIOS (eds), Proceedings of the 58th Annual Western International Forest Disease Work Conference, pp. 131-134. Valemount, British Columbia. [ Links ]
34. GUANTAY, M. E. 2004. Morfoanatomía y arquitectura foliar de Blepharocalyx salicifolius (Kunth) O. Berg (Myrtaceae). Lilloa 41 (1-2): 85-92. [ Links ]
35. HENNEN, J. F., M. B. FIGUEIREDO, A. A. DE CARVALHO & P. G. HENNEN. 2005. Catalogue of the species of plant rust fungi (Uredinales) of Brazil [online]. Disponible en: http://www.jbrj.gov.br. [Acceso: 15 Julio 2016]. [ Links ]
36. HUGHES, S. J. 1976. Sooty Moulds. Mycologia 68 (4): 693-820. [ Links ]
37. KIRK, P. M., P. F. CANNON, D. W. MINTER & J. A. STALPERS. 2008. Dictionary of the Fungi, 10th Edition. CAB International, pp. 771. Wallingford. [ Links ]
38. LANGRELL, S. R. H., M. GLEN & A. C. ALFENAS. 2008. Molecular diagnosis of Puccinia psidii (guava rust) – a quarantine threat to Australian eucalypt and Myrtaceae biodiversity. Plant Pathology 57: 687-701.
39. LARRAN, S., J. VERA BAHIMA & G. DAL BELLO. 2011. First report of Colletotrichum gloeosporioides causing anthracnose on Blepharocalyx salicifolius in Argentina. Australasian Plant Dis. Notes 6: 18-19. [ Links ]
40. LUO, J., X. LIU, E. LI, L. GUO & Y. CHE. 2013. Arundinols A-C and arundinones A and B from the plant endophytic fungus Microsphaeropsis arundinis. Journal of Natural Products 76 (1): 107-12. [ Links ]
41. MAHARACHCHIKUMBURA, S. S. N., L. GUO, E. CHUKEATIROTE, A. H. BAHKALI & K. D. HYDE. 2011. Pestalotiopsis morphology, phylogeny, biochemistry and diversity. Fungal Diversity 50: 167-187. [ Links ]
42. NAG RAJ, T. R. 1993. Coelomycetous anamorphs with appendage-bearing conidia. Mycologue Publications, pp. 1001. Waterloo, Ontario. [ Links ]
43. PARDO, E. M., C. F. GRELLET, S. M. SALAZAR, A. P. CASTAGNARO, J. P. DÍAZ RICCI & M. E. ARIAS. 2012. Histopathology of the resistance to Colletotrichum gloeosporioides of wild strawberries and species related to commercial strawberry. Australian Journal of Crop Science 6 (7): 1147-1153. [ Links ]
44. PEEVER, T. L., G. SU, L. CARPENTER BOGS & L. W. TIMMER. 2004. Molecular systematics of citrus-associated Alternaria species. Mycologia 96 (1): 119–134.
45. PEREIRA-CARVALHO, R. C., C. A. INÁCIO & J. C. DIANESE. 2010. Plurispermiopsis: a new capnodiaceous genus from the Brazilian Cerrado. Mycologia 102 (5): 1163-1166. [ Links ]
46. PEREZ, C. A., M. J. WINGFIELD, B. SLIPPERS, N. A. ALTIER & R. A. BLANCHETTE. 2010. Endophytic and canker-associated Botryosphaeriaceae occurring on non-native Eucalyptus and native Myrtaceae trees in Uruguay. Fungal Diversity 41: 53-69. [ Links ]
47. PÉREZ, C. A., M. J. WINGFIELD, N. A. ALTIER, S. SIMETO & R. BLANCHETTE. 2011. Puccinia psidii infecting cultivated Eucalyptus and native Myrtaceae in Uruguay. Mycol. Progr. 10: 273-282. [ Links ]
48. PONESSA, G. I. 2007. Morfoanatomía foliar y etnofarmacobotánica de diez especies arbóreas autóctonas de la REHM, provincia de Tucumán, pp. 174. Tesis Doctoral, Universidad Nacional de Buenos Aires, Argentina. [ Links ]
49. QIU-YUE, Q., L. HONG-WEI, L. ER-WEI, H. JUN-JIE, P. YUN-FEI, M. KE, B. LI, H. YING & Z. FENG. 2015. New ambuic acid derivatives from the solid culture of Pestalotiopsis neglecta and their nitric oxide inhibitory activity. Scientific Reports 5: 1-7. [ Links ]
50. QUAEDVLIEG, W., M. BINDER, J. Z. GROENEWALD, B. A. SUMMERELL, A. J. CARNEGIE,T. I. BURGESS & P. W. CROUS. 2014. Introducing the Consolidated Species Concept to resolve species in the Teratosphaeriaceae. Persoonia 33: 1-40. [ Links ]
51. RUBIAL, C., C. GUEIDAN, L. SELBMANN, A. A. GORBUSHINA, P. W. CROUS, J. Z. GROENEWALD, L. MUGGIA, M. GRUBE, J. T. STALEY, F. LUTZONI & G. S. DE HOOG. 2009. Phylogeny of rock-inhabiting fungi related to Dothideomycetes. Studies in Mycology 64: 123- 133S7. [ Links ]
52. SANDOVAL, R. I. & V. G. ESTRADA. 2003. Primer registro de Periconia atropurpurea (Berk. & Curt.) Litvinov en el cultivo del arroz (Oryza sativa L.). Fitosanidad 7 (3): 65. [ Links ]
53. SANDOVAL, R. I., M. O. LÓPEZ & B. T. BONILLA. 2003. Especies de Periconia sobre las semillas de arroz (Oryza sativa L.). Fitosanidad 7 (3): 17-19. [ Links ]
54. SEIFERT, K., G. MORGAN JONES, W. GAMS & B. KENDRICK. 2011. The genera of Hyphomycetes. CBS-KNAW Fungal Biodiversity Centre, pp. 997. Utrecht, The Netherlands. [ Links ]
55. SHARMA, D., A. PRAMANIK & P. K. AGRAWAL. 2016. Evaluation of bioactive secondary metabolites from endophytic fungus Pestalotiopsis neglecta BAB-5510 isolated from leaves of Cupressus torulosa D. Don. 3 Biotech 6: 210-223. [ Links ]
56. SIR, E. B., M. F. PARRADO, A. I. HLADKI & A. I. ROMERO. 2012. Biodiversity of Xylariaceae (Ascomycota) and their hosts in protected areas from Tucumán (Argentina). Kurtziana 37 (2): 35- 48. [ Links ]
57. SUTTON, B. C. 1980. The Coelomycetes fungi imperfecti with picnidia, acervuli and stroma. Commonwealth Mycological Institute, pp. 696. Kew, Surrey. [ Links ]
58. TANAKA, K., M. ENDO, K. HIRAYAMA, I. OKANE, T. HOSOYA & T. SATO. 2011. Phylogeny of Discosia and Seimatosporium, and introduction of Adisciso and Immersidiscosia genera nova. Persoonia 26: 85-98. [ Links ]
59. THIERS, B. 2016. Index herbariorum: a global directory of public herbaria and associated staff. [online]. Disponible en: http://www.sweetgum.nybg.org/ih/ [Acceso: 20 Octubre 2016]. [ Links ]
60. VANEV, S. G. 1991. Species conception and sections delimitation of genus Discosia. Mycotaxon 41 (2): 387-396. [ Links ]
61. WANDERLEY COSTA, I., L.COSTA MAIA, M. A. CAVALCANTI. 2012. Diversity of leaf endophytic fungi in mangrove plants of northeast Brazil. Brazilian Journal of Microbiology 1165-1173. [ Links ]
62. WOUDENBERG, J. H. C., J. Z. GROENEWALD, M. BINDER & P. W. CROUS. 2013. Alternaria redefined. Studies in Mycology 75: 171-212. [ Links ]
63. WRONA, B. & M. GRABOWSKI. 2004. Etiology of apple sooty blotch in Poland. Journal of Plant Protection Research 44 (4): 293-297. [ Links ]
64. ZULOAGA, M., O. MORRONE, M. BELGRANO, C. MARTICORENA & E. MARCHESI. 2014. Catálogo de Plantas Vasculares del Cono Sur [online]. Disponible en: http://www.darwin.edu.ar/Proyectos/FloraArgentina [Acceso: 12 Abril 2016]. [ Links ]
Recibido el 18 de septiembre de 2016,
aceptado el 25 de octubre de 2016.














