Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.53 no.4 Córdoba dic. 2018
http://dx.doi.org/10.31055/1851.2372.v53.n4.2198
DOI: http://dx.doi.org/10.31055/1851.2372.v53.n4.2198
Biología reproductiva
Aspectos reproductivos de Schinusareira (Anacardiaceae)
MARÍA A. ZAPATER1, MARÍA M. ALEMÁN, EVANGELINA C. LOZANO, VICTOR H. AQUINO, CAROLINA B. FLORES, MIRIAM N. GIL, JOHANA VILLADA y GUSTAVO ARAYA
Summary: Reproductive aspects of Schinu7 ar8ira (Anacardiaceae). Schinu7 ar8ira is a naturalized tree in northwestern and western Argentina, and extensively cultivated in the country. Our goals were (1) to determine the floral and reproductive biology of S. ar8ira, (2) to compare different pregerminative treatments, and (3) to analyze the morphology of the seedlings during the development for their correct taxonomical identification. Analyses of floral biology and reproductive system, fruit and seed morphology, and different pregerminative treatments were carried out. Seedlings development was recorded at 90, 180, and 270 days. As a result, it was found that the fruit/flower ratio was low, and the pollen/ovules ratio was very high. On the other hand, pregerminative treatments gave very low results that agree with fruit morphology. Seedlings had a normal growth reaching an average of 43 cm height at 270 days, and they developed simple basal leaves with a compuond leaves from approximatelly 180 days. We proposed that the species is dioecious and polygamomonoecious, mainly gynomonoecious, the pollination is ambophyly with predominance of entomophyly, and the seedlings development is phanerocotyledonar epigeous.
Key words: Fruit morphology, pregerminative treatment, reproductive system, seedling.
Resumen: Schinu7 ar8ira es un árbol naturalizado en el noroeste y oeste de Argentina y extensamente cultivado en el país. Nuestros objetivos fueron (1) determinar la biología floral y reproductiva de S. ar8ira, (2) comparar diferentes tratamientos pregerminativos para la especie y (3) analizar la morfología de las plántulas durante el desarrollo para su correcta identificación taxonómica. Se realizaron análisis de biología floral y del sistema reproductivo, de morfología del fruto y semilla, y diferentes tratamientos pregerminativos. Se registró el desarrollo de plántulas a los 90, 180 y 270 días. Como resultado se obtuvo que la proporción frutos/flores fue baja, y la proporción polen/óvulo muy alta. Por otro lado, los tratamientos pregerminativos dieron resultados muy bajos lo cual concuerda con la morfología del fruto. Las plántulas tuvieron un crecimiento normal alcanzando un promedio de 43 cm de altura a los 270 días, y desarrollaron hojas basales simples con hojas compuestas a partir aproximadamente de los 180 días. Se propone que la especie es dioica y polígamo-monoica, mayormente ginomonoica, la polinización es ambófila con predominio de entomofilia, y el desarrollo de las plántulas fanerocotiledonar epígeo.
Palabras clave: Morfología del fruto, plántula, sistema reproductivo, tratamiento pregerminativo.
La especie Schinus areira L. (Anacardiaceae, Anacardioideae) fue descripta por Linneo en el año 1753 junto con Schinus molle L., morfológicamente muy afín. A partir de entonces ambos taxones han sido tratados como un único taxón o como variedades de la misma especie por diferentes autores, generándose conflictos respecto a su circunscripción taxonómica. En la actualidad son entidades independientes con rango específico. En un estudio reciente ambas especies se diferenciaron por el número total de folíolos y su disposición, además del tipo de márgen de los folíolos que varía en S. areira según la posición de las hojas en las ramas péndulas (Zapater et al., 2018).
Hasta el momento, solo existen descripciones en su mayoría incompletas de S. areira sin mención de flores perfectas (Cabrera, 1938; Barkley, 1957; Legname, 1982; Muñoz, 2000), salvo Juárez de Varela & Novara (2007). Para Demaio et al. (2002, 2015) la especie tiene flores imperfectas dispuestas en pies separados (especie dioica). Bachelier & Endress (2009) realizaron un estudio de morfología y anatomía floral comparativo de Anacardiaceae y Burseraceae teniendo en cuenta la estructura y evolución del gineceo, y analizaron a S. molle L. entre otras especies de Anacardioideae. Por otra parte, existen estudios con resultados muy variables tanto para S. areira como S. molle, vinculados principalmente a tratamientos pregerminativos y viverización (Anderson, 2000; Paladini, 1992; Pereira et al., 2016). Sin embargo, el conocimiento de los aspectos reproductivos de la especie es aún escaso. Por lo expuesto, esta investigación tiene como objetivos: 1) determinar la biología floral y reproductiva de S. areira, 2) comparar diferentes tratamientos pregerminativos con la finalidad de relacionarlos con la morfología del fruto, 3) conocer la morfología de las plántulas durante el desarrollo para la correcta identificación y como base para estudios de regeneración y dinámica poblacional.
Morfología floral
Se trabajó durante el período 2016-2017 en una población de S. areira con 35 individuos cultivados en el campus de la Universidad Nacional de Salta, los que se preclasificaron en pistilados y estaminados mediante un muestreo preliminar. El muestreo consistió en tomar de cada árbol 30 flores al azar de 10 inflorescencias diferentes y mediante observación en lupa se determinó la dominancia de flores pistiladas y estaminadas en cada individuo, que resultó coincidente con la presencia/ausencia de frutos de la temporada anterior en los diferentes pies. Posteriormente sobre la base de este muestreo se embolsaron con voile las inflorescencias en estado de botón floral en pies pistilados y estaminados. Para determinar las características florales (cualitativas y cuantitativas) se colectaron por separado 60 flores (20 flores pistiladas, 20 flores estaminadas y 20 flores perfectas) en antesis provenientes de individuos diferentes, tomadas al azar. Diez flores fueron diseccionadas bajo lupa y cada una de sus piezas fueron medidas con un calibre digital, las otras 10 flores fueron conservadas y fijadas en alcohol 70 y FAA (formol, alcohol y ácido acético) para su posterior análisis más detallado en el Microscopio Electrónico de Barrido (MEB; JEOL JSM-6480 LV). Para ello las flores se deshidrataron en una serie creciente de alcoholes (60, 70, 80 y 96%) y posteriormente fueron secadas por punto crítico (D'Ambrogio de Argüeso, 1986) en DCP-1 Critical Point-Denton Vacuum. Finalmente, las muestras fueron montadas en tacos de aluminio y recubiertas con oro con un equipo Denton Vacuum Desk IV.
Biología floral y reproductiva
Ciclo floral. Las características más relevantes del ciclo de las flores de diferente sexualidad se determinaron a partir de 30 pimpollos de cada uno de los tipos de flores elegidos al azar provenientes de pies pistilados y de pies estaminados, los cuales fueron excluidos con una bolsa de voile (Dafni, 1992). Se registró el horario de apertura y cierre de las mismas, la receptividad estigmática y la dehiscencia de las anteras (Dafni, 1992). Las observaciones se realizaron por 15 minutos cada dos horas, desde el inicio de la antesis hasta la senescencia de la flor. La receptividad estigmática se midió a través de la producción de peroxidasas mediante el ensayo con peróxido de hidrógeno. El burbujeo intenso del estigma fue considerado receptivo (Kearns & Inouye, 1993) y se realizó en laboratorio, mientras que el momento de la dehiscencia de las anteras se registró en el campo y bajo lupa.
Viabilidad de los granos de polen. Para determinar la viabilidad de los granos de polen de las flores estaminadas fueron seleccionadas al azar 30 flores, a las cuales se les extrajeron por separado las anteras largas y las cortas. Luego fueron aplastadas en un portaobjeto con agua glicerinada, sobre las que se colocó una gota de azul de algodón. Los granos de polen adquirieron un aspecto más turgente, uniforme y se colorearon de azul intenso (D'Ambrogio de Argüeso, 1986). Idéntico tratamiento pero sin diferenciar en anteras cortas y largas se realizó con los estaminodios de las flores pistiladas. El porcentaje de granos de polen viables se calculó en base al conteo total en un hemocitómetro (Dafni, 1992).
Sistema reproductivo. Para conocer el sistema reproductivo se aplicaron, a principios de setiembre del 2016, dos tratamientos sobre 10 individuos coetáneos (25-35 cm de Diámetro Altura de Pecho: DAP) seleccionados al azar y previamente clasificados cinco como estaminados y cinco como pistilados, con base en el relevamiento previo. Los tratamientos fueron: Autopolinización Espontánea (APE) y Polinización Libre (PL). Para el primer tratamiento se embolsaron con bolsas de voile seis inflorescencias por árbol en estado de botón floral, circundando la copa a nivel medio externo (Dafni, 1992; adaptación para este trabajo por la forma de la copa). Para el tratamiento libre se marcaron al azar en los mismos individuos otras seis inflorescencias con cintas plásticas en posiciones similares. Producida la fructificación a comienzos de noviembre, se extrajeron las muestras embolsadas y libres para efectuar los recuentos de número de flores producidas y de número de frutos logrados. Por último se calculó el Éxito Reproductivo Relativo (ERR) de cada tratamiento a través de la relación (N° de frutos/N° de flores) x (N° de semillas /N° de óvulos) x 100 (Dafni, 1992) sobre la base de que los frutos son uniseminados.
Polinización. A fin de determinar el tipo de polinización, en el año 2017 se embolsaron cinco inflorescencias con bolsas de tul en tres individuos pistilados distanciados entre sí. En esta etapa también se colectaron muestras de los individuos en estado de floración y fructificación, que se guardaron en FAA para estudios al MEB. Por otra parte, se registraron y determinaron los visitantes florales. Las observaciones se realizaron en cinco árboles ubicados en el campus de la Universidad Nacional de Salta, durante cuatro días diferentes en el pico de floración. Las mismas fueron en períodos de 15 minutos, distribuidos a lo largo del día. Se recolectaron los visitantes mas frecuentes y se determinaron con una colección entomológica de referencia.
La proporción P/O (polen/óvulo) se determinó en laboratorio a partir de 10 botones florales. Se extrajeron separadamente los estambres de cada ciclo (cortos y largos), se maceraron en 0,5 ml de una solución de detergente, agua y alcohol, y se homogeneizaron en vortex. Luego se extrajo una pequeña alícuota que fue colocada en un hemocitómetro para el conteo de granos de polen. El índice P/O resultante del promedio de las 10 flores se comparó con los valores indices de la tabla de Cruden (1977) y de Dafni (1992), obteniendo la clasificación del sistema reproductivo correspondiente a la especie.
Morfología del fruto. Para el estudio de los frutos se seleccionaron al azar 25 drupas maduras de la misma población, a las que se les registró el diámetro por su forma esférica y el peso específico con exocarpo, empleando calibre digital y balanza de precisión. También fue determinado el peso de 100 frutos con y sin exocarpo. La anatomía del fruto y la semilla se observó y dimensionó al MEB.
Germinación y desarrollo de plántulas
Se determinó el Poder Germinativo (PG) y la Energía Germinativa (EG) en siete tratamientos pregerminativos utilizando semillas con cinco meses de colección y conservadas en bolsas de papel a temperatura ambiente, sobre la base de que esta especie conserva el PG por largo tiempo, hasta dos años, como S. molle (Anderson, 2000). Los experimentos se realizaron en cajas de Petri con cuatro repeticiones y 25 semillas con agar como sustrato usando cámara de germinación a 28° C y fotoperíodo 12/12. Los tratamientos fueron (1) y (2) : Testigos con y sin exocarpo respectivamente; (3) y (4): Agua a 80° C y enfriamiento gradual por tres días, con y sin exocarpo respectivamente; (5): Lijado con lija de agua 120; (6): Lijado e inmersión en agua a temperatura ambiente por tres días; y (7): Escarificación con mortero y agua a 80° C por tres días. Se calculó el PG% realizando un promedio de las repeticiones x 100; la EG% se calculó mediante el conteo de las semillas que germinaron en un lapso prescripto (hasta 10 días); teniendo en cuenta que un lote de semillas se considera bueno si germinan el 50% en la tercera parte del tiempo total de germinación, en este caso 30 días (Willan, 1991; Ottone, 2005). La viabilidad de los fruto-semillas se determinó a partir de los resultados obtenidos de la aplicación de los métodos pregerminativos teniendo en cuenta el número de plántulas obtenidas más el número de frutos no germinados, posteriormente diseccionados con semilla en su interior (viables) o frutos con semillas afectadas, huecos o con brúquidos (no viables) (Normas ISTA, 2016; adaptadas para el trabajo).
Las plántulas obtenidas en los ensayos de germinación se repicaron a bandejas con sustrato de mantillo y, posteriormente, a los 90 días con una altura de 3-4 cm a envases individuales previa caracterización y medición de raíz, hipocótilo, cotiledones, epicótilo, protófilos, tallo, entrenudos y nomófilos. Las plántulas fueron registradas en su desarrollo hasta los 270 días.
Morfología floral
Los árboles resultaron ser dioicos y polígamo-monoicos, predominantemente gimnomonoicos (Fig. 1 A). Las ramas floríferas son péndulas de 1260 cm long., compuestas por una panícula terminal y 2-15 panículas basales, todas de posición axilar, muy ramificadas, con desarrollo acrófugo (Fig. 1B-C). La panícula apical es más o menos piramidal, de 7-14 cm long., con 5-9 ramificaciones y 40-90 flores. Las panículas basales son frecuentemente de 6-8 cm long. (raro con valores mínimos de 3-5 cm y un máximo de 9 cm) con generalmente 4 ramificaciones y 5-30 flores. Las inferiores presentan menor número de flores.
Las flores son pentámeras, las pistiladas (Fig. ID) con los sépalos triangulares de 0,57-0,6 x 0,4-0,42 mm, los pétalos oblongos de 2-2,2 x 0,8-1,2 mm y el disco nectarífero interestaminal con lóbulos de 0,24-0,26 mm long. y abundantes estomas (Fig. 1F). Los estaminodios son 10, cada uno de 0,8 mm long. El gineceo posee una longitud de 1,5 mm, el ovario es de 0,86-0,93 mm diám., con un único estilo corto de 0,29-0,3 x 0,26-0,27 mm y tres cabezas estigmáticas grandes de 0,210,34 x 0,31-0,39 mm. las cuales son muy papilosas y cubiertas parcialmente por una membrana (Fig.
IE) . Cada óvulo es de 0,43-0,47 x 0,23-0,26 mm. Las flores estaminadas (Fig. 1G) presentan sépalos triangulares de 0,8-0,83 x 0,4-0,5 mm, los pétalos obovados de 1,5-1,8 x 0,88-0,9 mm y los lóbulos del disco nectarífero de 0,8-0,9 mm long. con abundantes estomas. El androceo está formado por dos ciclos pentámeros con el ciclo externo largo de 2,4-2,52 mm long. y el ciclo interno corto de 1,7-1,79 mm long. Los granos de polen son esféricos de 0,02 mm diám. y esculturados (Fig. 1I) del tipo Schinopsis balansae Engl. con la exina supraestriada-infrarreticulada presentando estrías largas, angostas y muros bajos (Anzoátegui, 2001). El pistilodio es ovado de 0,65-0,7 mm long. con el ovario de 0,49-0,5 x 0,42-0,43 mm, tres estilos cilíndricos de 0,2-0,22 x 0,072-0,09 mm, huecos y con hendiduras laterales (Fig. 1H). Las flores perfectas (Fig. 1J) están ausentes o son muy escasas por panícula pistilada y raras en panículas estaminadas. Estas flores presentan características intermedias entre las descriptas para las flores pistiladas y estaminadas. El androceo presenta una longitud similar al gineceo y el disco nectarífero abundantes estomas (Fig. 1L). El gineceo es de 1,31-1,33 x 0,8-0,83 mm con tres estilos cilíndricos de 0,3-0,32 x 0,17-0,18 mm y cabezas estigmáticas del mismo diámetro que el estilo (Fig. 1K).
Biología floral y reproductiva
Ciclo floral. La apertura floral se produjo en horas de la mañana o de la tarde dependiendo de la cantidad de luz solar y de la temperatura. La apertura a la mañana fue entre las 9-11 h, a la tarde entre las 14-16 h y la antesis en los tres tipos de flores fue de aproximadamente 28 h.
En las flores estaminadas y perfectas, las anteras del ciclo externo fueron las primeras en abrirse en estadio de pimpollo y se vaciaron aproximadamente a las 18 h luego de la apertura de la flor. Las anteras del ciclo interno se abrieron en el momento de la antesis y la disponibilidad de granos de polen se registró hasta el final de la misma. Ambas presentaron dehiscencia longitudinal introrsa. Las tres ramas estigmaticas de las flores perfectas y pistiladas fueron de color verde claro brillante en el momento de la antesis y su receptividad estigmática fue nula o mínima en el primer día. A medida que las ramas estigmáticas se tornaron de color oscuro la receptividad estigmática fue incrementándose, siendo máxima en la tarde del segundo día, cuando las anteras de ambos ciclos estaban vacías.
Los estaminodios del ciclo externo de las flores pistiladas fueron los primeros en abrirse. Luego lo hicieron los del ciclo interno y en ambos casos la dehiscencia fue longitudinal introrsa. No se registró receptividad estigmática en los pistilodios de las flores analizadas.
Viabilidad de los granos de polen. La viabilidad de los granos de polen fue variando a lo largo del ciclo floral. En el momento de la apertura de la flor, las anteras largas presentaron el 80% de los granos viables. En las anteras cortas el 90% eran no viables, tornándose viables un 80% al día siguiente de la apertura floral cuando las anteras largas se vaciaron. El 100% de los granos de polen provenientes de los estaminodios no fueron viables en todos los estadios registrados.
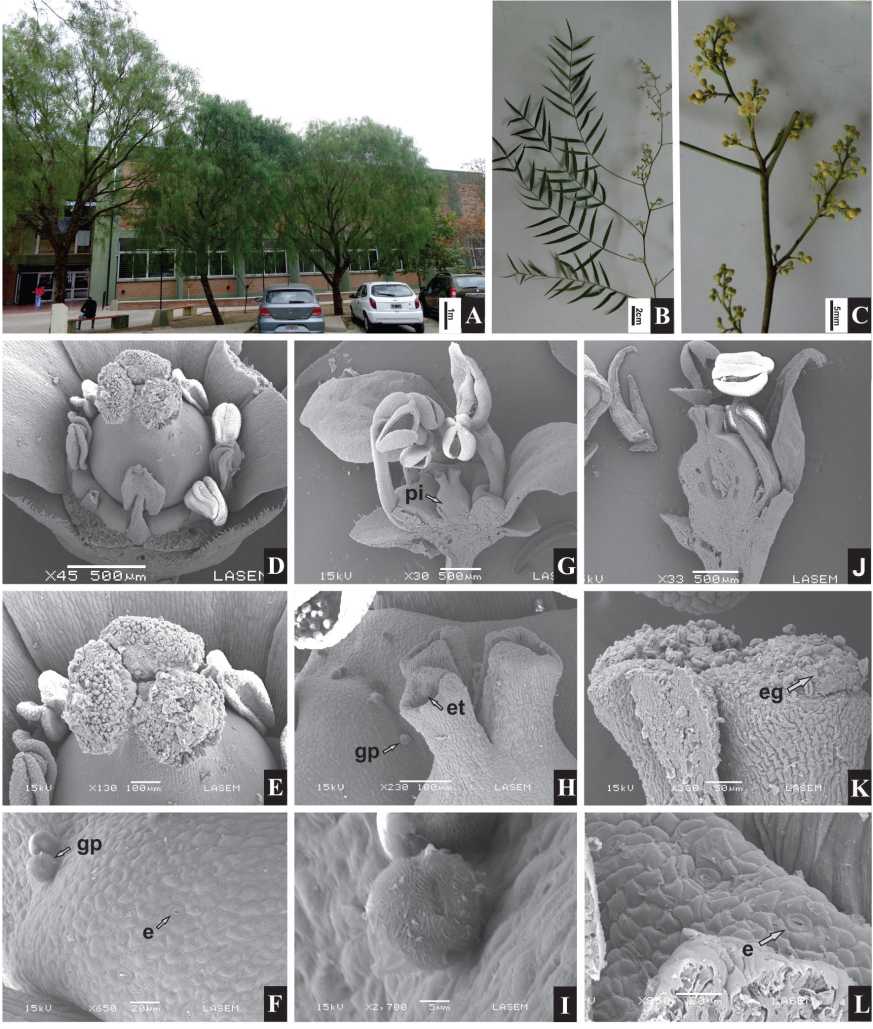
Fig. 1. Schinus areira. A: Árboles de la población estudiada. B: Parte terminal de una rama florífera. C: Parte terminal de una panícula. D: Flor pistilada con los ciclos fértiles expuestos, vista superior (MEB). E: Detalle del estigma de la flor pistilada y cabezas estigmáticas con membrana (MEB). F: Detalle del disco nectarífero de la flor pistilada con estomas y granos de polen (MEB). G. Flor estaminada con los dos ciclos del androceo y el pistilodio, corte longitudinal (MEB). H: Detalles del pistilodio de la flor estaminada con los estilos huecos y el disco nectarífero con granos de polen (MEB). I: Grano de polen (MEB). J: Flor perfecta, corte longitudinal (MEB). K: Detalle del estigma reducido de la flor perfecta con papilas y restos de membrana. L: Detalle del disco nectarífero de la flor perfecta con estomas (MEB). Abreviaturas: e: estomas; eg: estigma; et: estilos; gp: grano de polen; pi: pistilodio. Escalas = A: 1 m; B: 2 cm; C: 5 mm; D, G, J: 500 jm; E, H: 100 |jm; F, L: 20 jm; I: 5 jm; K: 50 jm (A-C: fotos de V. Aquino).
Número de granos de polen
Sistema reproductivo. La proporción de fruto/ flor fue muy baja por APE (1,4-8,8%) en pies estaminados y pistilados, respectivamente, en tanto que en PL fue cercana al 50% en los individuos diclino-pistilados y ginomonoicos. El número de granos de polen fue mayor en los estambres del ciclo externo y menor en los del ciclo interno. La especie se caracteriza por tener solo un óvulo por lo que los valores de P/O en las flores estaminadas fue muy elevado (Tabla 1).
Éxito reproductivo. El éxito reproductivo fue mayor en los pies pistilados y ginomonoicos. En polinización libre fue del 44%, a pesar del número elevado de flores producidas por inflorescencia (90-380). En el tratamiento de APE la producción de fr/fl fue muy baja (9%). Solo en uno de los pies estaminados se generaron frutos con un éxito reproductivo del 1,4% en APE y 1,9% en PL. Esto se debió probablemente a que la producción de flores perfectas es muy rara y escasa, o que algunas flores estaminadas puedan generar frutos por desarrollo del pistilodio (excepcional). Se destacó un pie estaminado (el ejemplar 19) que formó flores y algunos frutos hasta 4-5 por panícula con posterioridad al período normal de fructificación (Fig. 2A-B). Estos frutos fueron colectados para su estudio (Fig. 2E). También las flores fueron colectadas y observadas al MEB. El análisis al MEB del corte longitudinal de las flores estaminadas en este período mostró que el pistilodio podía presentar un óvulo (Fig. 2D). Otras flores, aún al estado de botón floral, ya se encontraban con un óvulo de 0,14-0,15 x 0,094-0,095 mm llenando completamente el lóculo (Fig. 2C). Las cabezas estigmáticas del pistilodio tenían estigmas reducidos del mismo diámetro que el estilo y aparentemente con muy pequeñas papilas, no huecas. En algunos frutos se comprobó la existencia de semilla (Fig. 2F) y en otros las semillas estaban ausentes o infectadas por brúquidos como los otros individuos de la población. Al germinar los frutos, previamente escarificados mediante corte apical de la drupa, se obtuvieron plántulas anómalas con hipocótilo y cotiledones sin apreciable formación de radícula (Fig. 2G-H-I).
Polinización. Como resultado del embolsamiento con tul de inflorescencias pistiladas se obtuvieron valores de producción de frutos de 12%, 19% y 25% en promedio en los tres individuos estudiados. Por otra parte como resultado de la observación de los visitantes florales en esta población solo se registró la presencia de abejas (i.e. Apis melífera), principalmente en los individuos estaminados y menos en los pistilados.
Morfología del fruto. El fruto, definido como una drupa de forma esférica (Fig. 3A-B), alcanzó en la población estudiada un diámetro promedio de 3,61 mm con rango de 3-4,5 mm. El peso específico obtenido fue de 26,692 kg/dm3 y el peso por 100 frutos de 3,74 g. Hacia el interior del exocarpo, se observó al MEB un mesocarpo parenquimático con aproximadamente 1,08 mm de espesor en promedio con seis o más conductos resiníferos de aproximadamente 0,6 mm de diámetro, asociados a haces vasculares. El mesocarpo se encontró externamente recubierto por una capa resinosa color ámbar resultante de la secreción de los conductos que forman un depósito muy delgado y adhesivo (Fig. 3C-D). El endocarpo presentó tres capas de esclereidas en empalizada: la capa externa delgada con un espesor de 0,05 mm formada por oesteoesclereidas; la intermedia muy delgada constituida por braquiesclereidas de 0,02 mm de espesor y la interna gruesa de 0,15 mm de espesor con macroesclereidas lignificadas (Fig. 3E). Una cuarta capa celular, la capa cristalífera externa muy delgada y uniseriada que menciona la bibliografía, no pudo ser observada con claridad en este estudio. La semilla se mostró integumentada e imposible de separar del endocarpo. En relación a la viabilidad de los frutos-semilla se registró un bajo porcentaje de semillas viables (27%) y un elevado número de no viables (73%).
Tratamientos pregerminativos
Los resultados de la aplicación de los siete tratamientos pregerminativos se muestran en Tabla 2. El tratamiento con mayor éxito germinativo (PG 35%) y energía germinativa (8%) fue la aplicación de agua caliente a 80° C sobre frutos sin exocarpo e imbibición durante tres días. Este mismo tratamiento sobre frutos con exocarpo muestra un valor muy bajo de PG (4%). La aplicación de lija de agua sobre el mesocarpo resultó ineficiente con un bajo PG (10%) debido a que no se pudo eliminar la cubierta pastosa tornando ineficiente el tratamiento.

Fig. 2. Schinus areira, árbol 19 (Universidad Nacional de Salta). A: Parte de una panícula estaminada con frutos en desarrollo. B: Detalle del extremo de la panícula con un fruto en desarrollo. C: Botón floral estaminado, corte longitudinal (CL) con óvulo desarrollado (MEB). D: Flor estaminada en antesis (CL), pistilodio con óvulo péndulo (MEB). E: Drupas. F: Drupa seccionada apicalmente, con semilla. G: Drupa seccionada con semilla germinando, vista de hipocótilo curvado. H: Estadio más avanzado con cotiledones emergentes. I: Plántula en su máximo desarrollo con hipocótilo y cotiledones, sin formación de radícula. Abreviaturas: co: cotiledones; fr: fruto; hi: hipocótilo; ov: óvulo; pi: pistilodio; se: semilla. Escalas = A-B, F-I: 1 mm; C: 200 |jm; D: 500 |jm; E: 1 cm (A-B, E-I: fotos de V. Aquino).
Tabla 2. Resultados de los tratamientos pregerminativos.
| Tratamientos | PG (%) | EG (10 d) |
| Testigo c/exocarpo | 1% | 0% |
| Testigo s/exocarpo | 0% | 0% |
| Agua caliente (80°C) s/exocarpo x 3 días | 35% | 8% |
| Agua caliente (80°C) c/exocarpo x 3 días | 4% | 0% |
| Lijado | 10% | 0% |
| Lijado y en agua a t° ambiente x 3 días | 9% | 0% |
| Mortero y en agua caliente (80°C) x 3 días | 7% | 1% |
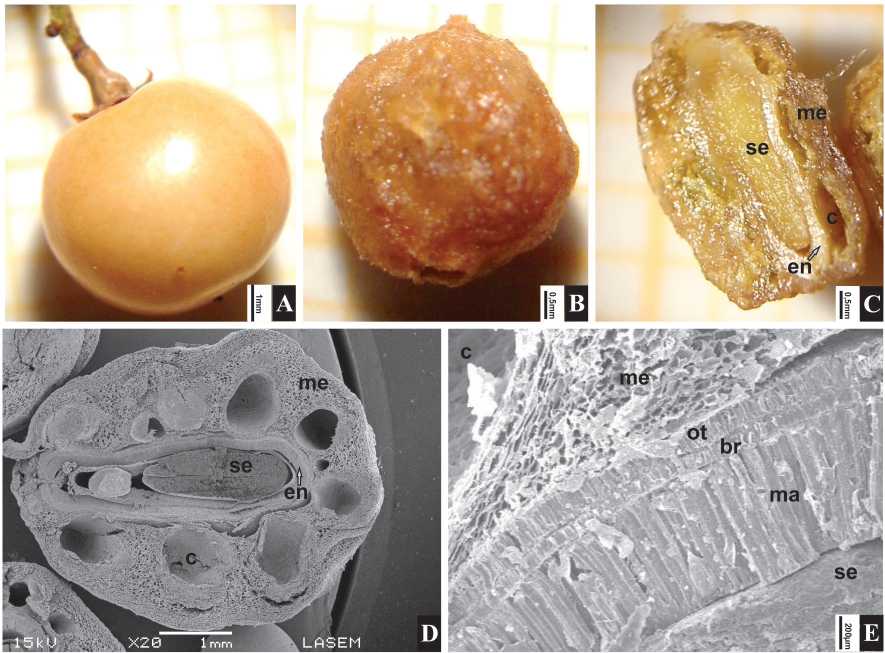
Fig. 3. Schinus areira. A: Drupa con exocarpo. B: Drupa sin exocarpo. C: Drupa, corte transversal. D: Drupa, corte transversal (MEB). E: Detalle del endocarpo con las tres capas de esclereidas en empalizada (MEB). Abreviaturas: br: braquiesclereidas; c: conducto resinífero; en: endocarpo; ma: macroesclereidas; me: mesocarpo; ot: osteoesclereidas; se: semilla. Escala = A, D: 1 mm; B-C: 0,5 mm; E: 200 pm (A-C: fotos de V. Aquino).
Análisis morfológico y de desarrollo de plántulas
A los 90 días las plántulas alcanzaron una altura promedio de 10,34 cm incluida la raíz la cual midió 4,7 cm de largo con nueve raíces secundarias. El hipocótilo de 2 cm de largo superó ampliamente al epicótilo de 0,65 cm de largo. Los cotiledones tuvieron un corto pecíolo de 1 mm de largo y fueron oblongos u ovados de 0,37 x 0,22 cm. Los protófilos opuestos fueron simples, ovados y lanceolados, aproximadamente de 2 x 0,8 cm, de borde levemente aserrado, con pecíolos de 3 mm de largo. El tallo presentó tres nudos, los dos inferiores cortos de 0,5 y 0,45 cm de largo. La primera hoja fue muy similar en tamaño y forma a los protófilos. La segunda hoja, de 2,6 x 1 cm, fue apenas mayor que la primera y los protófilos, y la tercera aún se encontraba incompletamente desarrollada, con menores dimensiones, presentando todas margen completamente aserrado (Fig. 4A). A los 180 días la altura promedio sin raíz fue de 21 cm, con 9-13 hojas simples (Fig. 4B-D), ovadas y con margen aserrado. En algunos individuos las hojas apicales presentaron 1-2 lóbulos basales y lámina compuesta imparipinnada con 1-2 yugas, siendo el folíolo terminal de gran tamaño (Fig. 4E-F). A los 270 días la altura promedio alcanzada fue de 43 cm sin raíz (Fig. 4C), con 19-25 hojas de las cuales 11-18 fueron simples y enteras con 2-lóbulos basales, y las apicales compuestas imparipinnadas, uni o biyugadas (Fig. 4D-G). Los valores mencionados son el promedio de varias observaciones. En el caso del ejemplar estaminado 19 se obtuvieron plántulas anómalas con hipocótilo y cotiledones sin apreciable formación de radícula (Fig. 2I).

Fig. 4. Schinus areira. A: Plántula de 90 días. B: Plántula de 180 días. C: Plántula de 270 días. D: Hoja simple de plántula B. E-F: Hojas apicales pinnadas de plántula B. G: Hoja apical de plántula C. Escala = A, D, F: 5 mm; B: 2 cm; C: 3 cm; E, G: 1 cm (A-G: fotos de G. Araya y J. Villada).
Biología floral y reproductiva
Ciclo floral. Schinus areira es una especie dicógama con diferente momento de maduración entre los ciclos fértiles de la flor. Además es protandra con polen disponible en las flores estaminadas y perfectas, antes que el estigma de las flores pistiladas y perfectas esté receptivo. Un resultado similar se obtuvo en otra especie de Anacardiaceae (Barberis et al., 2012). Esto impediría que el polen autógamo fertilice el estigma evitando la autopolinización y, de esta manera, los polinizadores tendrían acceso al polen maduro desde un comienzo de la antesis. La variación en la antesis de ambas flores es común en especies dioicas tropicales (e.g. Opler & Bawa, 1978; Piratelli et al., 1998). En el caso de S. areira la duración de las flores masculinas fue mayor que la de las flores femeninas en contraste con los resultados obtenidos en Schinus terebinthifolia Raddi por Lenzi & Ortie (2004), quienes reportaron que las flores masculinas tendrían una duración de 12 h aproximadamente y las flores femeninas de 32 h aproximadamente. Con relación al ejemplar estaminado N° 19, que extendió su floración en dos períodos del año, sería coincidente con S. terebinthifolia (Lenzi & Ortie, 2004) y otras especies dioicas (Antos & Allen, 1999). Según Delph (1999) los pies estaminados florecen más a menudo que los pies pistilados, un 63% de los casos estudiados.
Viabilidad de los granos de polen. La viabilidad y germinabilidad del polen depende de diversos factores como el fotoperíodo, la temperatura, la humedad y la polución ambiental, entre otros (Bellani & Paoletti, 1992; Cecich, 1997). Se observó que la viabilidad de los granos de polen en S. areira coincidió con la dehiscencia de las anteras, característica ya mencionada por Kearns & Inouye (1993), según los cuales la viabilidad es máxima en el momento de la dehiscencia de las anteras, decreciendo con el tiempo si es expuesto a las condiciones del ambiente.
Sistema reproductivo. Nuestros resultados indican que se trata de una especie diclinodioica y también polígamo-monoica (predominatemente ginomonoica), datos coincidentes parcialmente con Demaio et al. (2002, 2015) quienes describen a la especie como dioica. Se observó la formación de frutos y semillas por ambos tratamientos de PL y APE. La baja producción en esta última podría ser explicada al menos parcialmente por la presencia de una gruesa membrana estigmática como ocurre en otras especies en las cuales es necesaria la ruptura de la misma por parte de los polinizadores. Esta característica correspondería a rasgos funcionales o barreras mecánicas para evitar la autopolinización en flores hermafroditas y autocompatibles (Barrett, 2002, 2010). El número de granos de polen fue muy elevado y teniendo en cuenta los resultados del P/O, según Cruden (1977) y Dafni (1992), S. areira tiene un sistema xenógamo obligado. Dicho dato es coincidente con los experimentos a campo siendo necesario el traslado de los granos de polen entre los pies estaminados y los pistilados. Además las especies con pocos óvulos o uniovuladas pueden presentar una relación P/O elevada, independientemente del sistema de apareamiento (Ramírez & Seres, 1994).
Éxito reproductivo. El bajo éxito reproductivo registrado en ambos tratamientos podría deberse a que antes de alcanzar el cuajado de los frutos las flores se caen formando una extensa deposición amarilla densa al pie de los árboles, a pesar de la elevada producción de flores de los pies estaminados. Esta absición de flores es una característica que fue registrada en otras especies de Anacardiaceae (Jordano, 1988). Por otra parte, la baja producción de frutos en especies dioicas es mencionada en otras especies y estaría relacionada con la ausencia de los polinizadores o bien porque estos visitarían más las flores estaminadas que les ofrecen mayor número de recompensas además de ser mas vistosas (Eckhart, 1999; Álvarez et al., 2014), lo que reduciría la posibilidad de la fecundación de los óvulos en las flores femeninas (Bawa, 1980b). Otra causa podría estar asociada con la gran perturbacion registrada en el ambiente como fue analizado en otras especies dioicas como Fuchsia parviflora Lindl. con polinización biótica (Álvarez et al., 2014). En el caso de la planta N° 19 su baja producción de frutos fuera del período de floración de la población, podría ser en parte explicado a que se trata de un individuo aislado temporalmente, lo cual disminuye las probabilidades de ser polinizado (Lienert, 2004; Álvarez et al., 2014).
Polinización. De los experimentos de exclusión de polinizadores con bolsa de tul se infiere que la polinización es en parte anemófila, con caracteres típicos de este tipo de polinización: flores unisexuales expuestas fuera de la masa de hojas, perianto insignificante, anteras y estigmas expuestos, bajo número de óvulos por flor (Faegri & van der Pijl, 1979). Por otro lado, presenta polinización entomófila ya que los visitantes mas frecuentes en esta población fueron Apis melífera, mencionado también por Fragoso & Varanda (2011) para una población de S. terebinthifolia. Esto es coincidente con las características morfológicas de las flores como la existencia de un disco nectarífero con abundantes estomas secretores, membrana en los estigmas, presentación secundaria del polen en disco y abundante producción de polen esculturado por lo que habría recompensas de néctar y polen. La especie es ambófila aunque con predominio de entomofilia como ocurre en S. longifolia (Lindl.) Speg. (Torreta & Basilio, 2009).
Morfología del fruto. Tratamientos pregerminativos
La presencia de frutos carnosos (drupas) en S. areira confirma la hipótesis expuesta por muchos investigadores sobre la existencia de una relación entre dioecia, frutos carnosos y dispersión zoocórica (Bawa, 1980a; Thomson & Brunet, 1990). Respecto al tamaño de las drupas de la población estudiada fueron muy pequeñas con relación a las de otras poblaciones en las que se ha registrado que pueden alcanzar diámetros mayores de hasta 6 mm (Barkley, 1957; Múlgura, 2003). El endocarpo se correspondió al definido por Wannan & Quinn (1990) para el Grupo A del tipo Anacardium y la Tribu Rhoeae; también por Copeland (1959) para su afín S. molle y por Carmello-Guerreiro & Sartori Paoli (2002) para S. terebinthifolia.
En relación a los tratamientos pregerminativos, los resultados obtenidos con los tratamientos sin ácidos muestran muy bajos valores de viabilidad (27%) lo que se asociaría al menos en parte a los problemas de sanidad de las drupas debido principalmente a la infestación por brúquidos. Resultados similares se obtuvieron en otros trabajos con Anacardiaceae y pareciera ser una característica común en especies de esta familia debido al aborto de embriones, partenocarpia o predación de las semillas por algunos invertebrados (Jordano, 1988).
Por otra parte la semilla posee el embrión integumentado mecánicamente protegido por el fruto duro. En éste el endocarpo está compuesto por tres capas de esclereidas en empalizada determinando una dormancia física (PY) que concuerda con lo expuesto por Baskin et al. (2000). Dichos autores además mencionan que en el endocarpo, particularmente en la capa interna de macroesclereidas, existe una discontinuidad (i.e, el micrópilo carpelar) que admitiría el ingreso de agua al embrión. Sin embargo esta discontinuidad no existiría en las capas mas externas del endocarpo con osteoesclereidas y braquiesclereidas, que bloquearían la entrada de agua al micrópilo carpelar en las semillas durmientes.
La escarificación mecánica del endocarpo promueve la rápida germinación de la semilla (Baskin et al., 2000), lo que no pudo ser evaluado adecuadamente en esta investigación por el empastamiento de la lija con la cubierta del mesocarpo al no haber sido eliminada previamente. Varios autores coinciden en que la cubierta pastosa es inhibitoria para la germinación, siendo imprescindible su remoción mediante la maceración en agua durante 72 h o hasta 4 días (Paladini, 1992; Pereira et al., 2016). Los tratamientos pregerminativos sugeridos como exitosos para la ruptura de la dormición física una vez eliminada la cubierta inhibitoria, son la inmersión en agua hervida, la escarificación mecánica o la escarificación mecánica seguida por la inmersión en agua caliente (Paladini, 1992; Anderson, 2000). Para su afín S. molle, el pretratamiento con ácido sulfúrico de baja concentracción (10%) por 5 minutos se menciona como muy efectivo para una buena germinación (Pereira et al., 2016), lo que avalaría la dispersión exitosa por medio de aves migratorias que ha sido mencionada para esa especie en México por Corkidi et al. (1991). Si bien en la población estudiada no se observaron dispersores, es muy probable que también en S. areira ésta sea la forma predominante de dispersión.
Germinación y desarrollo de plántulas
El desarrollo de las plántulas es del tipo fanerocotiledonar epígeo donde el hipocótilo está bien desarrollado y el epicótilo está reducido, coincidiendo con S. terebinthifolia y con la mayoría de las especies arbóreas de Brasil (Alves Lobo et al., 2013). Una vez establecidas las plántulas continuan su desarrollo con buen vigor y crecimiento normal. En sus primeras etapas las plántulas son difíciles de identificar a campo porque hasta los 90 días al menos se mantienen con hojas simples, ovadas, alargadas y con margen completamente aserrado, muy semejantes a los protófilos, por lo que podrían confundirse con otras especies herbáceas y malezas, razón que torna importante su reconocimiento. Inclusive hasta los 270 días, aunque ya se encuentran hojas compuestas, son imparipinadas uni y biyugadas y todavía no se asemejan a las hojas adultas; tampoco a las hojas producidas en los rebrotes de fuste. Estos, que se generan abundantemente en la base, tienen hojas semejantes a las del follaje adulto, con 7-10 pares, pero son opuestos y con márgenes regularmente aserrados. Según Alves Lobo et al. (2013) una plántula se considera normal cuando posee raíz primaria por lo que las plántulas originadas del ejemplar 19 son consideradas anómalas y ello podría deberse a un efecto de endogamia (Alvarez et al., 2014).
Esta investigación permitió clarificar los sistemas sexuales existentes en S. areira así como variados aspectos de la morfología, biología floral y reproductiva, que no habían sido estudiados previamente. También permitió relacionar la anatomía del fruto con las posibilidades germinativas, la forma de dispersión de los mismos y el establecimiento de las plántulas, datos indispensables para plantear estrategias de manejo y conservación de esta especie en los ambientes naturales.
Dedicamos esta producción a quien fue nuestra compañera la Dra. Patricia Hocf, investigadora de la UBA y el CONICET, quien nos asesoró en las etapas iniciales de la investigación como codirectora del Proyecto de Investigación sobre las Anacardiaceae de Argentina. Este trabajo se realizó con el financiamiento del Consejo de Investigación de la Universidad Nacional de Salta en el marco del proyecto tipo A N° 2283.
ÁLVAREZ, A., M. DE LOS Á. PÉREZ & E. CUEVAS. 2014. Efecto de la fragmentación del hábitat en el éxito reproductivo de Fuchsia parviflora, una especie dioica. Biológicas 16: 30-32.
ALVES LOBO, G., D. GARCÍA DE SANTANA, A. NASSIF SALOMAO, L. SALAZAR REHBEIN & A. POLENZ WIELEWICKI. 2013. A technological approach to the morphofunctional classification of seedlings of 50 Brazilian forest species. J. Seed Sci.36: 87-93.
ANDERSON, P. 2000. Schinus molle L. En: VOZZO, J. A. (ed.), Manual de semillas de arboles tropicales, pp. 695-696. Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Washington.
ANTOS, J. A. & G. A. ALLEN. 1999. Patterns of reproductive effort in male and female shrubs of Oemleria cerasiformis a 6 year study. J. Ecol. 87: 77-84.
ANZOÁTEGUI, L. M. 2001. Anacardiaceae. En: PIRE S. M., L. M. ANZOÁTEGUI & G. A. CUADRADO (eds.), Flora Polínica del Nordeste Argentino 2: 1926. EUDENE-UNNE, Corrientes.
BACHELIER, J. B. & P. K. ENDRESS. 2009. Comparative floral morphology and anatomy of Anacardiaceae and Burseraceae (Sapindales), with a special focus on gynoecium structure and evolution. Bot. J. Linn. Soc. 159: 499-571.
BARBERIS, I. M., V. MOGNI, L. OAKLEY, C. ALZUGARAY, J. L. VESPRINI & D. E. PRADO. 2012. Biología de especies australes: Schinopsis balansae Engl. (Anacardiaceae). Kurtziana 37: 59-86.
BARKLEY, F. A. 1957. Schinus L. Lilloa 28: 4-109.
BARRETT, S. C. H. 2002. The evolution of plant sexual diversity. Nature Rev. Genet. 4: 274-284.
BARRETT, S. C. H. 2010. Undesrtanding planta reproductive diversity. Philos. Trans. R. Soc. Lond. B Biol. Sci. 365: 99-109.
BASKIN, J. M., C. C. BASKIN & X. LI. 2000. Taxonomy, anatomy and evolution of physical dormancy in seeds. Plant Species Biol. 15: 139-152.
BAWA, K. S. 1980a. Evolution of dioecy in flowering plants. Ann. Rev. Ecol. Syst. 11: 15-39.
BAWA, K. S. 1980b. Mimicry of male by female owers and intrasexual competition for pollinators in Jacaratia dolichaula (D. Smith) Woodson (Caricaceae). Evol. 34: 467-474.
BELLANI, L. & E. PAOLETTI. 1992. New type of damage to Quercus ilex: pollen germination and hydration ability. Eur. J. Forest Pathol. 22: 284290.
CABRERA, A. L. 1938. Revisión de las Anacardiáceas austroamericanas. Revista Mus. La Plata 2: 3-65.
CARMELLO-GUERREIRO, S. M. & A. A. SARTORI PAOLI. 2002. Ontogeny and structura of the pericarp of Schinus terebinthifolius Raddi (Anacardiaceae). Braz. Arch. Biol. Technol. 45: 73-79.
CECICH, R. 1997. Pollen tube growth in Quercus. Forest Sci. 43: 140-146.
COPELAND, H. F. 1959. The reproductive structuras of Schinus molle (Anacardiaceae). Madroño 15: 14-24.
CORKIDI, L., S. CACHO & A. BURQUEZ. 1991. Dispersión del pirú (Schinus molle L., Anacardiaceae) por aves en Teotihuacán, México. Acta Bot. Mex. 15: 17-22.
CRUDEN, R. W. 1977. Pollen-ovule ratios: a conservative indicator of breeding. Evol. 31: 32-46.
DAFNI, A. 1992. Pollination ecology. A practical approach. Princeton Univ. Press, Princeton.
D'AMBROGIO DE ARGÜESO, A. 1986. Manual de técnicas en histología vegetal. Ed. Hemisferio Sur, Buenos Aires.
DELPH, L. F. 1999. Sexual dimorphism in life history. En: GEBER, M. A., T. E. DAWSON & L. F. DELPH (eds.), Gender and sexual dimorphism in flowering plants, pp. 149-173. Springer-Verlag, Heidelberg.
DEMAIO, P., U. O. KARLIN & M. MEDINA. 2002. Arboles Nativos del Centro de Argentina. L.O.L.A., Buenos Aires.
DEMAIO, P., U. O. KARLIN & M. MEDINA. 2015. Árboles nativos de Argentina, tomo 1: Centro y Cuyo. Ecoval Ediciones, Buenos Aires.
ECKHART, V. M. 1999. Sexual dimorphism in owers and in orescences. En: GEBER, M. A., T. E. DAWSON & L. F. DELPH (eds.), Gender and sexual dimorphism in owering plants, pp. 123-148. Springer-Verlag, Berlin.
FAEGRI, K. & L. VAN DER PIJL. 1979 The principles of pollination ecology, 3rd edition. Pergamon Press, Oxford.
FRAGOSO, F. P. & E. M. VARANDA. 2011. Flower visiting insects of five tree species in a restored area of semideciduous seasonal forest. Neotrop. Entomol. 40: 431-435.
JORDANO, P. 1988. Polinización y Variabilidad de la producción de semillas en Pistacia lentiscus L. (Anacardiaceae). Anales Jard. Bot. Madrid 45: 213231.
JUÁREZ DE VARELA, F. & L. J. NOVARA. 2007. Anacardiaceae Lindl. Aportes Botánicos de Salta, Serie Flora 8: 1-27.
KEARNS, C. A. & D. W. INOUYE. 1993. Techniques for pollination biologists. University Press of Colorado, Niwot.
LEGNAME, P. R. 1982. Arboles indígenas del Noroeste Argentino. Opera Lilloana 34: 65-66.
LENZI, M. & A. I. ORTIE. 2004 Fenologia reprodutiva, morfologia e biologia floral de Schinus terebinthifolius Raddi (Anacardiaceae), em restinga da Ilha de Santa Catarina, Brasil. Biotemas 17: 6789.
LIENERT, J. 2004. Habitat fragmentation effects on fitness of plant populations a review. J. Nat. Conserv. 12: 53-72.
MÚLGURA, M. E. 2003. Anacardiaceae. En: KIESLING, R. (ed.), Flora de San Juan 2: 90. Estudio Sigma, Buenos Aires.
MUÑOZ, J. de D. 2000. Anacardiaceae. En: HUNZIKER J. & A. ANTON (eds.), Flora Fanerogámica Argentina 65: 16-17.
OPLER, P A. & K. S. BAWA. 1978. Sex ratios in tropical forest trees. Evol. 32: 812-821.
OTTONE, J. R. 2005. Árboles forestales: prácticas de cultivo. 1ra ed. Orientación Gráfica Editora, Buenos Aires.
PALADINI, E. F. 1992. Observaciones culturales en vivero de árboles forestales en Mendoza. Multequina 1: 123-146.
PEREIRA, M., F. F. CORREA, M. POLO, E. M. DE CASTRO, A. A. CARDOSO & F. J. PEREIRA. 2016. Seed germination of Schinus molle L. (Anacardiaceae) as related to its anatomy and dormancy alleviation. Seed Sci. Res. 1: 1-11.
PIRATELLI J., E. C. M. PINA-RODRIGUES, E. GANDARA, B. SANTOS & L. G. S. COSTA. 1998. Biologia da polinizado de Jacaratia spinosa (AUBL) ADC. (Caricaceae) em mata residual do sudeste brasileiro. Revista Brasil. Biol. 58: 671-679.
RAMÍREZ, N. & A. SERES. 1994. Plant reproductive biology of herbaceous monocots in Venezuelan tropical cloud forest. Pl. Syst. Evol. 190: 129-142.
REGLAS INTERNACIONALES PARA EL ANÁLISIS DE SEMILLAS. 2016. Introducción a las Reglas ISTA. International Seed Testing Association (ISTA), Bassersdorf.
THOMSON, J. D. & J. BRUNET. 1990. Hypotheses for the evolution of dioecy in seed plants. Tree 5: 11-16.
TORRETA, J. P & A. M. BASILIO. 2009 Dispersión polínica y éxito reproductivo de cuatro especies arbóreas de un bosque xerófito de Argentina. Revista biol. trop. 57: 1-2.
WANNAN, B. S. & C. J. QUINN. 1990. Pericarp structure and generic affinities in the Anacardiaceae. Bot. J. Linn. Soc. 103: 225-252.
WILLAN, R. L. 1991. Guía para la manipulación de semillas forestales con especial referencia a los trópicos. FAO, Roma.
ZAPATER, M. A., V. H. AQUINO, C. B. FLORES & E. C. LOZANO (2018). Clarificaciones nomenclaturales y circunscripción taxonómica de Schinus areira (Anacardiaceae) en Argentina. Bol. Soc. Argent. Bot. 53: 665-671.
Recibido el 9 de agosto de 2018, aceptado el 10 de octubre de 2018. Editor: Diego Gutiérrez.
Facultad de Ciencias Naturales y Consejo de Investigación, Universidad Nacional de Salta, Av. Bolivia 5150, 4400 Salta, Argentina. aliciazapater@yahoo.com.ar














