Introducción
Polystichum Roth (Dryopteridaceae), con ca. 500 especies (Zhang & Barrington, 2013; PPG I, 2016), es uno de los géneros más grandes de helechos. Se extiende preferentemente en regiones subtropicales, templadas y templado-frías de casi todo el planeta, siendo el sudeste de Asia (con ~70% de las especies) el área de mayor riqueza específica. Sin embargo, una importante diversidad del género también se encuentra en América Central y Sudamérica; en esta última, habitan alrededor de 40 especies, la mayoría en ambientes montanos de los Andes del Norte y Centrales (Kessler et al, 2005; McHenry & Barrington, 2014; Condack, 2015).
En Argentina y Chile crecen 11 especies de Polystichum (Morero, 2016; Rodríguez et al., 2018) que pertenecen, al menos, a dos linajes con diferencias en la morfología, número cromosómico y relaciones biogeográficas. Así, las especies que habitan el norte y centro de Argentina están incluidas en el linaje “Andino exindusiado ”, grupo con entidades en su mayoría diploides, soros desnudos y ancestros en América tropical y neotropical (McHenry & Barrington, 2014). En tanto, las siete especies endémicas del sur de Argentina y Chile, constituyen el “Clado Sudamericano Austral”. Este grupo está filogenéticamente relacionado con los Polystichum de Australia y Nueva Zelanda, con quienes conforman el “Clado Austral”, caracterizado por la presencia de especies poliploides y soros cubiertos por un indusio (Morero et al, 2019).
Polystichum cuenta con estudios sobre la morfología y anatomía de especies representativas de Asia (Chandra, 1977; Khullar & Gupta, 1979; Chandra & Nayar, 1982; Shah et al., 2018), África (Roux 2000, 2001, 2004; Roux & Van Wyk, 2000) y Norteamérica (Wagner, 1979). Un set de unos pocos caracteres morfológicos sirvió de base para la circunscripción de secciones en Asia (Daigobo, 1972; Fraser-Jenkins, 1997; Zhang & Barrington, 2013) y África (Roux, 2000, 2001, 2004). La mayoría de las secciones propuestas para las especies de Japón, China y Sudáfrica han sido recuperadas posteriormente en trabajos moleculares-filogéneticos (Little & Barrington, 2003; Driscoll & Barrington, 2007; Lu et al., 2007; Li et al, 2008; LePechón et al., 2016). Sin embargo, la morfología de las especies sudamericanas ha sido abordada parcialmente en el contexto de las floras de diferentes regiones y países (Tryon & Stolze, 1991; Kessler et al., 2005; Smith et al., 2005; Condack, 2015; Morero, 2016; Rodríguez et al., 2018) y no se han encontrado trabajos anatómicos publicados hasta el momento.
Los miembros de Polystichum pueden ser reconocidos por sus rizomas usualmente erectos; frondes monomórficas, escamosas; láminas 1-4-pinnadas; pinnas y pínnulas con la base estrecha y asimétrica, últimos segmentos con una aurícula acroscópica y espínulas en los márgenes de desarrollo variable o ausentes; nerviación libre; soros generalmente circulares, exindusiados o cubiertos por un indusio redondeado y peltado (Barrington, 1995, 2011).
En cuanto a los atributos anatómicos, los más estudiados en el género han sido de carácter cualitativo, por ejemplo: la organización del mesofilo de la hoja y la vascularización de los pecíolos y rizomas, teniendo en cuenta el número, forma y configuración de las meristelas (Roux, 2004; Vasheka et al., 2017). Además, los tipos de estomas y los aeróforos, comunes en Dryopteridaceae, pueden aportar información útil para distinguir taxones en Polystichum (Lin & DeVol, 1977, 1978; Shah et al., 2018). En cuanto a los apéndices epidérmicos, el margen, forma y color de las escamas de las frondes y rizomas resultan de gran valor para distinguir las especies (Kessler et al., 2005; Barrington, 2011). Finalmente, en relación a las estructuras reproductivas de valor diagnóstico se destacan la morfología e indumento de los indusios (Barrington, 1985; Soltis et al., 1987) y algunos aspectos palinológicos como lo es la ornamentación del perisporio (Zhang & He, 2010, 2011; Han et al., 2016). Entre los aspectos cuantitativos se estudiaron el tamaño de las esporas, los estomas y otras células epidérmicas, relacionándolos con el nivel de ploidía de las especies (Morero et al., 2015; Vasheca et al., 2017; Shah et al., 2018, 2021).
La taxonomía tradicional basada solamente en la morfología y anatomía no permite resolver, en muchos casos, la delimitación de las especies de Polystichum, debido a la escasez de sinapomorfías fenotípicas y la convergencia de caracteres morfológicos (Kessler et al., 2005; Barrington, 2011). Asimismo, la hibridación frecuente, la poliploidía (especialmente alopoliploidía) y la apomixis dificultan aún más la delimitación taxonómica a nivel de especie (Barrington, 1985, 1990). Los Polystichum Sudamericanos Australes no escapan a esta problemática; este grupo de alopoliploides exhibe una amplia variación morfológica que dificulta la delimitación de los taxones (Morero et al., 2021), tal es el caso de P. chilense var. dusenii (C.Chr.) R.Rodr., taxón que fuera reconocido por Rodríguez Ríos (1987, 1989) y posteriormente pasado a la sinonimia de P. chilense (H.Christ) Diels (Morero et al., 2016). Estos autores argumentaron que los rasgos morfológicos propuestos para esta variedad caen dentro del rango de variación fenotípica de las poblaciones de la especie. En este aspecto, el análisis de datos morfométricos continuos empleando técnicas multivariadas de ordenación puede contribuir a esclarecer la delimitación taxonómica de especies, variedades e híbridos en el género (Barrington, 1985, 2003; Mayer & Mesler, 1993). En este contexto, los objetivos de este trabajo fueron: (1) definir caracteres morfo-anatómicos que aporten una evidencia consistente para la delimitación de las siete especies de Polystichum del clado Sudamericano Austral y dos del clado Andino [P montevidense (Spreng.) Rosenst. y P pycnolepis (Kunze ex Klotzsch) Hieron.] y (2) proporcionar una revisión de los límites interespecíficos de las especies de Polystichum del clado Sudamericano Austral basada en métodos de ordenación multivariados de datos morfométricos.
Materiales y Métodos
Para la localización, reconocimiento a campo y recolección del material de estudio, se efectuaron dos viajes al sur argentino (Provincias de Neuquén y Río Negro) y dos viajes a Chile, (Provincia de Osorno, X Región de Los Lagos y en la Isla Robinson Crusoe, Archipiélago Juan Fernández). Los esporofitos fueron recolectados de poblaciones naturales y cultivados en el invernáculo de la Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba (Argentina). Para analizar las variaciones en los caracteres morfométricos se seleccionaron 7-13 especímenes de herbario representativos de cada taxón de los Polystichum Sudamericanos Australes, recolectados a lo largo de la distribución geográfica (se detallan en el Anexo 1). Para el análisis de los microcaracteres se emplearon dos frondes maduras y el rizoma, se enlistan a continuación los especímenes estudiados: Polystichum andinum Phil. ARGENTINA. Prov. de Chubut. Dpto. Cushamen, Lago Puelo, nacientes del arroyo Aguja Sur, 42°10’44.25’’ S, 71°42’30.66’’ W, 1106 msnm, 30-V-2013, Morero 380 (CORD). Prov. Río Negro. Dpto. Bariloche, Parque Nacional Nahuel Huapi, pasando 200 m el refugio del Cerro Otto, camino hacia “La Olla”, 40°24’44.55’’ S, 71°38’30.68’’ W, 1496 msnm, 24-I-2010, Morero 291 (CORD).
Polystichum chilense (H.Christ) Diels, ARGENTINA. Prov. Neuquén. Dpto. Los Lagos, Parque Nacional Nahuel Huapi, Cascada Santa Ana, 40°41’00’’S, 71°56’00’’W, 1155 msnm, 27- I-2010, Morero 308 (CORD).
Polystichum montevidense (Spreng.) Rosenst. ARGENTINA. Prov. Córdoba. Dpto. Punilla, Los Gigantes, Sierras Grandes, 31°23’99” S, 64°47’99” W, 1858 msnm, 27-111-2011, Morero 339 (CORD). Prov. Tucumán. Dpto. Chicligasta, Cuesta del Clavillo, 27°16’32” S, 65°58’27.97” W, 1938 msnm, 07-VII-2011, Morero 349 (CORD). Polystichum mohrioides (d’Urv.) C.Presl, ARGENTINA. Islas Malvinas. Isla Soledad. Lewis & Block 1596 (VT).
Polystichum multifidum (Mett.) T.Moore. ARGENTINA. Prov. Chubut. Dpto. Cushamen, El Hoyo, Paraje El Pedregoso, Cascada Escondida, 42°08’44’’ S, 71°25’23’’ W, 320 msnm, 16- VII-2012, Morero & Vidoz 370 (CORD). Prov. Neuquén. Dpto. Los Lagos, Parque Nacional Nahuel Huapi, Cascada Santa Ana, 40°41’00’’ S, 71°56’00’’ W, 1155 msnm, 27-I-2010, Morero 306 (CORD).
Polystichum platyphyllum (Willd.) C.Presl. ARGENTINA. Prov. Tucumán. Dpto. Chicligasta, Cuesta del Clavillo, 27°16’32’’ S, 65°58’27.97’’ W, 1938 msnm, 07-VI-2011, Morero 352 (CORD).
Polystichum plicatum (Poepp. ex Kunze) Hicken ex Hosseus. ARGENTINA. Prov. Neuquén. Dpto. Bariloche, Parque Nacional Nahuel Huapi, Cerro López, sobre margen del camino de acceso vehicular, 41°05’38,55’’ S, 71°32’56,23’’ W, 1213 msnm, 24-I-2010, Morero 293 (CORD). Dpto. Los Lagos, Villa La Angostura, Cerro Bayo, en las márgenes del arroyo, 40°44’58,22’’ S, 71°36’17,03’’ W, 1454 msnm, 28-I-2014, Morero 387 (CORD).
Polystichum pycnolepis (Kunze ex Klotzsch) Hieron. ARGENTINA. Prov. Córdoba. Dpto. Punilla, Los Gigantes, camino al refugio del Club Andino Córdoba, 31°23’48.69’’ S, 64°45’17.59’’ W, 1736 msnm, 4-II-2015, Morero & C-X Li 427 (CORD). Polystichum tetragonum Fée. CHILE, Archipiélago de Juan Fernández, Isla Robinson Crusoe, en sendero a El Mirador, 33038'17" S, 78o50'45" W, 247 msnm, 01/XII/2010, Morero 323 (CORD).
Caracteres anatómicos
Preparaciones histológicas permanentes: se realizaron cortes transversales del rizoma, pecíolo (porción basal y apical) y de las pinnas medias o de sus últimas divisiones. En material previamente fijado en FAA (formol, alcohol etílico 95%, ácido acético glacial y agua) se aplicaron las técnicas clásicas de deshidratación, inclusión en Histoplast, cortes microtómicos de 10 a 14 gm, doble coloración con azul de astra-fucsina básica y posterior montaje con bálsamo de Canadá (D’Ambrogio de Argüeso, 1986; Krauss et al, 1998). Las fotomicrografías se realizaron con microscopio óptico Zeiss Axiophot y cámara Leica digital DFC300FX.
Preparados semipermanentes: se efectuaron cortes a mano alzada de frondes (lámina y pecíolo) y rizomas en material fresco. Algunos de los cortes se montaron y observaron directamente sin tinción previa; el resto de los cortes fueron examinados después de proceder a su clarificación con hipoclorito de sodio al 30% y coloración con safranina y azul de astra. Para evidenciar paredes celulares y contenidos, se efectuaron pruebas histoquímicas mediante la técnica de coloración directa, utilizando los siguientes reactivos: sudán III y IV (lípidos), lugol (almidón), cloruro férrico (compuestos fenólicos) y fluoroglucina clorhídrica (lignina). A posteriori se realizó el montaje en glicerina acuosa al 50% (Sandoval Zapotitla, 2005; Zarlavsky, 2014). Extendidos de epidermis: para observar las células epidérmicas propiamente dichas, apéndices epidérmicos (pelos y escamas), células anexas y estomas, se obtuvieron las epidermis de rizomas y frondes (pecíolo, raquis y pinnas o pínnulas) por desprendimiento del material vivo o en FAA. Posteriormente se clarificaron con hipoclorito de sodio al 30% o hidróxido de sodio al 3%, durante aproximadamente 5 minutos, luego se colorearon con safranina y azul de astra, montándose en glicerina al 50%.
Análisis del tipo de estomas y células epidérmicas: la terminología utilizada se basó en la literatura revisada para helechos (Ogura, 1972; Van Cotthem, 1970a, b, 1973; Lin & DeVol, 1977, 1978; Lellinger, 2002). Para la tipología de los estomas, se utilizó la clasificación de Van Cotthem (1970a, b, 1973). A los fines de comparar el tamaño de los estomas y las células epidérmicas propiamente dichas de la lámina, entre los diferentes taxones, se hicieron 15 mediciones del largo de las células en vista paradermal, por carácter señalado, por individuo, con la ayuda del programa ImageJ (Schneider et al., 2012). Únicamente se sintetizan los valores cuantitativos a través de la media, debido a que el número de muestras fue escaso y no permitió realizar ningún análisis estadístico. Las fotomicrografías se tomaron con un microscopio Axiophot Zeiss.
Análisis de caracteres morfométricos Selección de caracteres: Se usaron plantas secas, porque los estados de los caracteres pueden presentar cambios significativos cuando están frescos. Las mediciones se realizaron sobre la fronde fértil más grande de cada individuo. Se analizaron un total de 77 individuos y se computaron o midieron 13 caracteres cuantitativos (10 continuos y 3 discretos), que se detallan en la Tabla 1, Anexo 1.
Análisis estadísticos: A fin de seleccionar las variables morfo-anatómicas más informativas, se realizó un análisis de correlación entre ellas. De las variables que tuvieron una correlación mayor al 0.7, se seleccionaron aquellas que fueran biológicamente más informativas y fáciles de observar (Tabla 1, Anexo 1). Con las primeras variables seleccionadas se realizó un análisis de Componentes Principales (ACP) a fin de conocer el ordenamiento espacial de los individuos analizados para cada uno de los taxones estudiados. Se siguió el criterio taxonómico de Rodríguez et al. (2018) para determinar los especímenes como P chilense var. chilense y P. chilense var. dusenii. Posteriormente, para identificar las variables morfo-anatómicas que permiten diferenciar mejor los grupos taxonómicos se efectuó un análisis discriminante canónico para variables métricas (ADL). Finalmente, se realizó una tabla de clasificación cruzada entre la clasificación previa y la clasificación resultante del análisis discriminante. Tanto el ACP como el ADL se implementaron con el Software Infostat Versión profesional (Di Rienzo et al, 2011).
Resultados
Caracterización morfo-anatómica
Las frondes: Cada rizoma reúne entre 5-25 frondes. Las hojas se disponen desde erectas a curvadas (Fig. 1A-F). Polystichum mohrioides y P andinum presentan frondes que tienden a estar rígidamente erguidas (Fig. 1A, D), con las pinnas más apretadas y ascendentes, mientras que las frondes de las especies restantes, son más curvadas y laxas, con las pinnas más separadas y horizontales (Fig. 1C, F). Según el hábitat que colonice, P. plicatum exhibe ambas formas de disposición de las frondes (Fig. 1B).

Fig. 1: Hábito y morfología de las frondes. A: Polystichum mohrioides. B: P. plicatum. C: P. tetragonum. D: P. andinum. E: P. subintegerrimum. F, K: P. montevidense. G, H, J: P. chilense. I: P. multifidum. A-F: plantas en su hábitat. G: sector del haz de la lámina 2-3-pinnada. H: bulbillos en el raquis primario. I: sector adaxial de la lámina 3-4-pinnada. J: cara abaxial con soros indusiados. K: lámina, sector abaxial con soros exindusiados. Escalas= A-F: 10 cm; G-K: 1 cm.
Polystichum montevidense, P. plicatum, P. pycnolepis y P. subintegerrimum presentan frondes 2-pinnadas y de tamaño frecuentemente mediano (30-75 cm long.). P andinum y P mohrioides tienen las frondes más pequeñas (5-25 cm) y con menores divisiones (1-pinnadas a 1-pinnada-pinnatífidas) y, en contraposición, P chilense, P multifidum y P. tetragonum presentan frondes más largas (30-120 m) y láminas más divididas (hasta 4-pinnadas) (Fig. 1A-I, Tabla 2). La textura de la lámina varía desde algo carnosa en P. andinum y P. mohrioides hasta membranácea en P. multifidum; en el resto de las especies es cartácea o papirácea. Las pinnas o pínnulas tienen siempre la base estrecha y asimétrica, siendo el lado acroscópico más desarrollado que el basiscópico (Fig. 1E, G, J). Los márgenes pueden estar provistos de espínulas, que están notablemente más desarrolladas en las especies Andinas (P montevidense y P pycnolepis), en tanto, están ausentes en las especies Sudamericanas Australes o las presentan débiles en el extremo de cada segmento (Fig. 1I-K, Tabla 2). En P. andinum, P. mohrioides y P. plicatum, la lámina es estrecha (relación ancho/largo: 1/6-1/8), con el extremo corto y acuminado, las pinnas basales se disponen perpendiculares al raquis, no superando los 3 cm long. (Fig. 1A, B, D), mientras que en las especies Sudamericanas Australes restantes (P chilense, P. multifidum, P. subintegerrimum y P. tetragonum) y en las Andinas, la lámina es más ancha (relación ancho/ largo: V2 -1/5), la porción apical es larga y pinnatífida, las pinnas basales son divergentes y descendentes y sobrepasan los 5 cm de largo en las frondes maduras (Fig. 1C, F, Tabla 2). Polystichum chilense es la única especie que ocasionalmente desarrolla bulbillos (yemas capaces de desarrollar nuevos individuos), que se ubican a lo largo del raquis primario, en la base de cada pinna (Fig. 1H).
El patrón de nerviación en todos los taxones estudiados es abierto, a partir del nervio medio se originan nervios secundarios 1-2-furcados. Los soros siempre se ubican asociados a las venillas. Pueden localizarse preferentemente a lo largo de las mismas, como en Polystichum multifidum y P subintegerrimum, o bien en el extremo (“soros terminales”), como ocurre en P. chilense. Las especies restantes presentan una combinación de ambas topologías del receptáculo soral. Sólo entre las especies Sudamericanas Australes, con excepción de P. tetragonum, las pinnas soríferas están restringidas a un sector, que puede ser, la mitad o el cuarto superior de la lámina (P andinum, P. mohrioides y P plicatum), o bien, hasta la 34 parte de la misma (P chilense y P multifidum). En P tetragonum, generalmente, todas las pinnas son soríferas al igual que en las especies Andinas estudiadas (Tabla 2). Los soros se encuentran protegidos por un indusio en las especies Sudamericanas Australes, que está ausente en las especies Andinas. Los indusios difieren en el margen (inciso, lacerado, lobulado, ondulado) y enla presencia de pelos glandulares, como los de P.
andinum, P mohrioides y P tetragonum (Fig. 2ATabla 2).

Tabla 2: Caracteres morfológicos y anatómicos de los rizomas y frondes de los Polystichum Sudamericanos Australes y Andinos basados en las especies estudiadas. Especies Andinas.
En todas las especies, el indumento de la lámina comprende pelos y microescamas, y en los raquis y pecíolos, pelos y escamas (Fig. 2B, C, Tabla 2). Salvo en Polystichum andinum, P plicatum y P. subintegerrimum, fueron observados pelos glandulares sobre las escamas y microescamas de diferentes órganos (Fig. 2D).
La organización de los tejidos de la lámina es similar en todas las especies. Las células epidérmicas del hipofilo (en vista superficial) son 3-4 veces más largas que anchas, con paredes radiales sinuosas; salvo los márgenes foliares, donde las células son isodiamétricas y menos sinuosas. El epifilo presenta células alargadas (con relación largo/ancho 5-7:1), las paredes radiales tienen sinuosidades irregulares; en contraste, las células de los márgenes foliares y las ubicadas a lo largo de los nervios son alargadas y de paredes rectas o levemente curvadas y carecen de estomas. La lámina es hipostomática y la distribución de los estomas es homogénea en todo el hipofilo; los estomas son del tipo anomocítico, polocítico y estaurocítico, predominando los dos últimos tipos (Fig. 2E, G-I, Tabla 2).
Todas las especies exhiben, en corte transversal, la epidermis (superior e inferior) unistrata, cubierta exteriormente por una cutícula lisa y delgada, las células epidérmicas son rectangulares o más o menos isodiamétricas, de paredes delgadas y se observan los estomas al mismo nivel que el resto de las células epidérmicas, en todas las especies (Fig. 2E, F). En las láminas coriáceas de Polystichum plicatum, P pycnolepis, P. subintegerrimum y P. tetragonum ambas epidermis presentan células con paredes más gruesas y lignificadas. Tanto en la epidermis superior como en la inferior, se observaron pelos glandulares unicelulares y más raramente bicelulares.
En corte transversal, el hacecillo vascular principal y los secundarios, se sitúan equidistantes entre la epidermis adaxial y la abaxial. En los hacecillos vasculares, el xilema está compuesto por traqueidas helicoidales y escalariformes. Los hacecillos son concéntricos y están rodeados por una endodermis y una vaina parenquimática. La última, está constituida por 1-2 capas de tejido parenquimático en los nervios secundarios o, varias capas más, a nivel de la costa, donde generalmente se extienden de la epidermis abaxial a la adaxial, pudiendo ser reemplazadas a este nivel por grupos de fibras esclerenquimáticas (Fig.2F. J). El mesofilo es heterogéneo, mostrando diferenciación entre el parénquima en empalizada y el parénquima esponjoso con células braciformes; el primero consta de 1-4 capas de células cuadrangulares a rectangulares, relativamente ordenadas y con escasos espacios intercelulares entre ellas; hacia la cara abaxial, el parénquima esponjoso se caracteriza por células redondeadas con proyecciones que delimitan lagunas (Fig. 2K); sólo en Polystichum tetragonum el mesófilo es homogéneo, si bien las células clorenquimáticas disminuyen levemente en tamaño desde la cara adaxial hacia la cara abaxial, presentan formas regulares (cuadrangulares a redondeadas) y escasos espacios intercelulares en todo el mesofilo.
El pecíolo es cilíndrico, surcado dorsalmente, verde a verde amarronado, con la base más oscura y escamosa. El diámetro y la longitud de los pecíolos varían notablemente entre las especies, siendo los menores de 1-2 mm de diám. y 2-5 cm de long. (Polystichum andinum), en tanto, los mayores pueden alcanzar ca. 20 mm de diám. y 70 cm de long. (en P chilense y P multifidum). En relación a la long. de la fronde, los pecíolos proporcionalmente más largos (1/2 long. de la fronde) se presentan en P andinum, P mohrioides, P subintegerrimum y P tetragonum, en tanto, los más cortos (ca. 1/5 de la long. de la fronde) se observan en P chilense y P. plicatum (Tabla 2).
En vista superficial del pecíolo las células epidérmicas son alargadas y los estomas siempre están restringidos a dos aeróforos laterales. En cada aeróforo, los estomas funcionales se disponen en varias (2-5) series paralelas flanqueando el pecíolo (Fig. 3A, B); en algunas especies (p. ej. P plicatum), las células oclusivas del estoma se deforman y el poro colapsa, especialmente en los pecíolos de hojas maduras (Fig. 3B).
En transcorte del pecíolo, se observó una cutícula delgada y lisa y, subyacente, la epidermis uniestratificada formada por células isodiamétricas, con paredes igualmente engrosadas y lignificadas. La corteza se inicia en un tejido hipodérmico mecánico que constituye el estereoma (Fig. 3C). El estereoma consiste en fibras esclerenquimáticas de paredes engrosadas y lignificadas, organizadas en varias capas, de 5-6 en la base de los pecíolos más delgados (Polystichum andinum y P. mohrioides) y alrededor de 15 (hasta 18), en la base de los pecíolos de mayor grosor, donde las paredes celulares suelen pigmentarse de castaño oscuro por la presencia de compuestos fenólicos (P montevidense, P multifidum y P. tetragonum, Tabla 2). A nivel de los aeróforos, el estereoma siempre se interrumpe y es reemplazado por parénquima con espacios intercelulares amplios, facilitando así el intercambio gaseoso con el medio (Fig. 3D). En contacto con las capas internas del estereoma, se encuentra tejido parenquimático (Fig. 3C, D). Los cloroplastos están presentes por lo menos en las capas más superficiales, pero pueden hallarse más internamente llegando hasta la médula (p. ej. P multifidum).
El parénquima medular siempre está presente y consta de células isodiamétricas, con paredes delgadas y abundantes granos de almidón. El tipo de estela del pecíolo es una dictiostela (Fig. 3E, F), denominado “Aspidium”, propuesto por Ogura (1972) para Polystichum y otros géneros afines. En este modelo, las dos meristelas más grandes se localizan en la posición dorsal, a ambos lados del surco medio del pecíolo y, hacia la cara abaxial, las meristelas menores se disponen en forma de “U” abierta (Fig. 3F). Cada meristela se compone del hacecillo vascular y el periciclo (Fig. 3G, H). El hacecillo es anfifloico, de manera que el xilema está completamente rodeado de floema. A su vez, el floema y el xilema son exarcos, pues la diferenciación de estos tejidos es centrípeta y procede hacia el interior de la meristela, localizándose el protoxilema, principalmente, en el extremo delgado y el metaxilema en la base de la región ensanchada; en el caso del floema, el metafloema se halla en contacto con el xilema. El periciclo, está constituido por 1-3 estratos de células parenquimáticas de paredes delgadas y de mayor tamaño que las células endodérmicas y floemáticas que lo rodean (Fig. 3H, K). Por fuera de cada meristela se encuentra la endodermis, formada por uno o dos estratos de células especializadas. Las células endodérmicas, son más pequeñas que las circundantes y muestran una forma rectangular, tangencialmente alargada, con las paredes de grosor uniforme (Fig. 3H, I, K). En ellas, la banda de Caspary no sólo está restringida a las paredes radiales, sino que la suberización también se extiende a las tangenciales (interna y externa). La tinción con Sudán IV fue positiva para suberina en la banda de Caspary (Fig. 3I). El número de meristelas (generalmente 2-8) y la forma del xilema en corte transversal, presentan variantes según la especie (Tabla 2). Así, en la base del pecíolo, P andinum y P. mohrioides exhiben el menor número de meristelas, dos y tres, respectivamente (Fig. 3E). En el primero, el xilema de cada hacecillo tiene forma deltoide (Fig. 3E), en tanto en el segundo, las dos meristelas dorsales tienen el xilema en forma de kitasato y es elíptico, en la meristela más pequeña opuesta a las anteriores. En el resto de las especies se distinguieron de 4-8 meristelas siendo la forma del xilema en las meristelas dorsales y ventrales similar al patrón de P. mohrioides (Fig. 3F). El número de meristelas varía a lo largo del pecíolo y ejes foliares debido a la fusión entre sí de las meristelas menores, quedando en algunos casos, sólo una o las dos meristelas mayores, en el extremo de los raquis de mayor orden.

Fig. 2: Lámina de las frondes. A: Polystichum mohrioides. B, C: P. andinum. D: P. montevidense. E: P. multifidum. F, J: P. subintegerrimum. G: P. plicatum. H: P. montevidense. I, K: P. chilense. A: pelo glandular unicelular del pecíolo. B: escama del raquis. C: microescama del hipofilo. D: pelo glandular bicelular en la superficie de la escama rizomática. E: corte transversal de una pínnula. F: corte transversal de una pínnula a nivel del hacecillo medio. G: estoma anomocítico y estoma polocítico. H: estoma estaurocítico. I: estoma polocítico. J: detalle del hacecillo vascular medio del corte mostrado en F. K: detalle de células parenquimáticas. Abreviaturas= anom: estoma anomocítico; *: endodermis; est: estoma estaurocítico; pol: estoma polocítico; st: estoma; vp: vaina parenquimática. Escalas= A, D, G-K: 50 µm; E, F: 100 µm; B, C: 1
Asimismo, las especies estudiadas presentan banda circumendodermal (analizada en este trabajo a nivel de la base del pecíolo), excepto en Polystichum chilense y P. multifidum donde está ausente. Esta estructura está representada por 1-3 capas de células parenquimáticas con paredes engrosadas que rodean exteriormente la endodermis (Fig. 3J- M). Los engrosamientos se ubican en las paredes radiales y tangencial interna, adoptando la forma
de “U” en transcorte, y se hallan pigmentados de color castaño a negruzco, siendo positiva en las pruebas histoquímicas para los compuestos fenólicos (Fig. 3J, K). Los engrasamientos pueden llegar a ocupar el lumen completo de las células, como es el caso de P. tetragonum, único taxón con banda circumendodermal discontinua y desigual (Fig. 3L, M). En P. chilense y P multifidum se detectaron engrasamientos en las células que rodean la endodermis, pero no contienen compuestos fenólicos, sustancias características de la banda circumendodermal (Fig. 3G, H).

Fig. 3: Pecíolo y raquis. A, D: Polystichum subintegerrimum. B, F: P. plicatum. C: P. chilense. E, I: P. andinum. G, H: Polystichum multifidum. J: P. mohrioides. K: Polystichum montevidense. L, M: P. tetragonum. A: aeróforo en vista superficial del raquis. B: aeróforo en vista superficial del pecíolo, con estomas no funcionales. C: corte transversal del pecíolo (sector apical). D: estoma en transcorte de pecíolo (véase el estereoma interrumpido y reemplazado por parénquima). E: estela del pecíolo con dos meristelas. F: dictiostela del pecíolo. G: meristela con el cordón xilemático en forma de kitasato. H: sector de la meristela mostrada en G. I: meristela, tinción Sudan IV. J: banda circumendodermal continua (tinción cloruro férrico). K: detalle de la banda circumendodermal continua con engrosamientos en U. L: Meristela mayor con banda circumendodermal discontinua. M: Meristela menor. Abreviaturas= bc: banda circumendodernal; *: endodermis; es: estereoma; et: estoma; fl: floema; mf: metafloema; mx: metaxilema; pc: parénquima cortical; pe: periciclo; pf: protofloema; px: protoxilema. Escalas= A-D, H, I, K: 50 µm; E, F: 500 µm; G, J, L, M: 250 µm.
En cuanto a los apéndices epidérmicos se observaron, en todas las especies, pelos y escamas. Los pelos son notablemente uniformes, del tipo glandular 1-celular con el extremo globoso (pelos glandulares clavados) y también pelos 2-celulares (cabezuela 1-celular, pie 1-celular), estos últimos se encontraron mayoritariamente en Polystichum andinum. Las escamas varían en coloración, margen, forma y tamaño en las distintas especies (Tabla 2). En relación a la forma, las escamas de la base de los pecíolos son, generalmente, ovadas o anchamente lanceoladas, con los márgenes enteros o con algunos dientes o cilios basales en las especies Australes Sudamericanas y con numerosos dientes o cilios largos, en las especies Andinas analizadas. Todas las especies presentan una combinación de escamas bicoloras y concoloras (Tabla 2).
La coloración y el aspecto de los raquis en las especies analizadas no difieren de la porción apical del pecíolo en donde se originan, siendo generalmente verdes, surcados dorsalmente disminuyendo en diámetro a medida que se ramifican en los raquis de mayor orden; los aeróforos se prolongan desde el pecíolo y se extienden en los laterales de los raquis, pueden verse a simple vista, más oscuros o más claros que el tejido circundante. El número de meristelas disminuye progresivamente a lo largo de estos ejes foliares, pudiendo quedar sólo una de las dorsales más grandes, en los raquis de mayor orden.
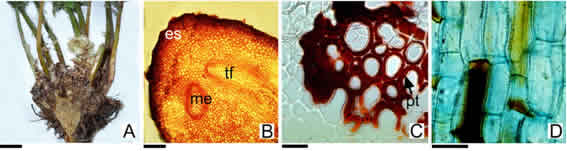
Fig. 4: Rizoma. A: Polystichum plicatum. B: P. andinum. C, D: P. montevidense. A: Rizoma de tipo erecto en corte longitudinal. B: Rizoma en transcorte. C, D: médula del rizoma. C: transcorte de una zona con células esclerificadas. D: vista lateral de las células en proceso de esclerificación y pigmentación. Abreviaturas= es: estereoma; me: meristela; pt: puntuación; tf: traza foliar. Escala= A: 1 cm; B= 500 µm; C, D: 100 µm.
El rizoma: en P andinum es decumbente, en las especies restantes es erecto (Fig. 4A, Tabla 2). P. andinum y P mohrioides exhiben los rizomas más delgados (0,2-0,5 cm de diámetro), en el resto de las especies el diámetro oscila entre 1- 4,5 cm (Tabla 2). En P chilense, P. multifidum y P tetragonum, los individuos más viejos forman como un pequeño tronco con las bases de los pecíolos persistentes, llegando el conjunto a medir hasta 35 cm de altura y 10-15 cm de diámetro. La organización anatómica del rizoma en todas las especies es similar; carecen de cutícula, la epidermis es unistrata y las capas subepidérmicas constituyen el estereoma. Los estomas están ausentes o son evidentes en rizomas jóvenes de P plicatum y P montevidense, constituyendo dos aeróforos a ambos lados del órgano, que se continúan en los laterales de pecíolos y raquis. La zona más interna de la corteza junto a la médula, están conformadas por varias capas concéntricas de tejido parenquimático de relleno y de reserva (Fig. 4B). En la médula parenquimática se presentan las meristelas, generalmente de 2-8. En ambas zonas, pero sólo en las especies con rizomas erectos (P. chilense, P. montevidense, P multifidum, P. plicatum y P. tetragonum), son frecuentes pequeñas manchas oscuras (de 1-4 mm de diámetro). Éstas corresponden a grupos de células esclerenquimáticas, con paredes secundarias engrosadas, atravesadas por puntuaciones y pigmentadas de color pardo-anaranjado o pardo- rojizo oscuro, hasta negro (Fig. 4C, D). La prueba histoquímica con cloruro férrico reveló que se trata de un compuesto fenólico. El pigmento responsable fue reportado como “flobafene”, una sustancia formada por oxidación y condensación a partir de compuestos fenólicos, capaz de retener agua (Ogura, 1972; Derzhavina, 2020). Estas estructuras también fueron observadas en la médula de los pecíolos de las especies antes mencionadas. La estela corresponde a una dictiostela. El diámetro de las meristelas es de 1-2 mm y el número varía de 2-3 en Polystichum andinum y P mohrioides y de 4-8 en el resto de las especies, sin contar las trazas o rastros menores que divergen a los pecíolos y raíces (Fig. 4B).
Los apéndices epidérmicos, en todas las especies examinadas, son las escamas, las que generalmente se solapan e imbrican, cubriendo casi totalmente el área superficial del rizoma. La densidad y los tipos de escamas presentes varían según las especies en coloración, forma, margen y tamaño (Tabla 2).
Límites interespecíficos del ciado Sudamericano Austral de Polystichum
El componente principal 1 explicó el 65% de la variabilidad de los caracteres morfométricos analizados, mientras que el componente principal 2 solo explicó el 15%. La longitud de las pinnas basales, la longitud de la fronde, y la longitud y ancho de las escamas peciolares fueron las principales variables que se asociaron positivamente con el eje 1, en tanto el número de pinnas soríferas fue la variable relacionada positivamente con el eje 2 (Fig. 5A, Tabla 3). A lo largo del primer componente se observa un gradiente continuo de las especies analizadas (Fig. 5A). En el extremo negativo de este eje se encuentran Polystichum andinum seguido, por P. mohrioides, taxones que poseen las frondes, las pinnas basales y las escamas peciolares más pequeñas, mientras que con estados de caracteres opuestos y en el extremo positivo del primer componente 1, se localizan P. multifidum y P tetragonum. A lo largo del componente principal 2 no se identifica una separación de los taxones analizados (Fig. 5A). Sin embargo, la mayoría de los individuos de P. andinum y P. mohrioides tienden a ubicarse en el extremo positivo del mismo, por presentar escamas peciolares pequeñas.
En el análisis discriminante, el eje canónico 1 explicó el 68,19 % de la variación mientras que el eje 2 sólo absorbió el 22,74 %, totalizando entre ambos el 90,93% (Fig. 5B). La discriminación de las especies en el eje 1 estuvo principalmente relacionada de forma positiva a la longitud de las pinnas basales y negativamente al número de pares de pinnas; el eje 2, por su parte, se asoció mayoritariamente al número de pares de pinnas y al número de pares de pinnas sorderas, de forma positiva y negativa, respectivamente (Tabla 4). A lo largo del eje 1, en el extremo negativo se sitúan Polystichum andinum, P. mohrioides y P. plicatum, por ser los taxones cuyas frondes presentan menor número de pares de pinnas y las pinnas basales más pequeñas. En el extremo positivo del eje 1 se encuentran P multifidum y P tetragonum quienes tienen la longitud de las pinnas basales más grandes y la mayor cantidad de pares de pinnas (Fig. 5B). Con valores intermedios en el eje 1, se encuentran P chilense var. chilense, P chilense var. dusenii y P. subintegerrimum (Fig. 5B), indicando que tienen las frondes con número de pares de pinnas intermedios entre P. andinum, P. mohrioides y P. plicatum, por un lado, y P multifidum y P tetragonum, por el otro. Además, de estos tres taxones con frondes intermedias, P. subintegerrimum, tiende a separarse de los restantes con valores más bajos en el eje 2, indicando que los individuos de esta especie tienen una menor cantidad de pinnas y, a la vez, menor número de pinnas fértiles que los de P. chilense var. chilense y P. chilense var. dusenii.

Fig. 5: Biplots. Basados en 6 variables morfometricas de 77 especímenes pertenecientes a 8 taxones de Polystichum Sudamericanos Australes (según el criterio taxonómico de Rodríguez et al., 2018). A: Biplot resultante del análisis de componentes principales. B: Biplot resultante del análisis discriminante.
La tabla de clasificación cruzada mostró que los individuos pre-clasificados de Polystichum andinum, P. plicatum, P. subintegerrimum y P. tetragonum fueron asignados correctamente a sus respectivas especies (tasa de error del 0 %, Tabla 5), por lo que estos taxones pueden diferenciarse con las variables utilizadas. Sin embargo, se obtuvo una tasa de error del 22,2% al diferenciar los individuos de P mohrioides y del 30,8%, al discriminar los especímenes de P chilense var. dusenii de la variedad tipo. En el caso de P multifidum, el porcentaje de error (9%) es sensiblemente menor que en los anteriores y las variables podrían ser de todos modos útiles para discriminar los individuos de esta especie
Referencias. Pa: Polystichum andinum, Pcvc: P chilense var. chilense, Pcvd: P chilense var. dusenii, Pm: P mohrioides, Pmu: P multifidum, Pp: P plicatum, Ps: P subintegerrimum y Pt: P tetragonum. Clave para diferenciar los taxones de Polystichum
Soros con indusio; láminas fértiles con los soros ocupando V a % de la parte superior o toda la lámina; margen de los últimos segmentos entero o con algunas espínulas poco desarrolladas (< 1mm long); escamas del pecíolo y raquis con margen entero o dentado en la base
1'. Soros sin indusio; láminas fértiles con los soros ocupando toda la lámina; margen de los últimos segmentos con espínulas muy desarrolladas (>3mm long); escamas del pecíolo y raquis con margen provisto de cilios largos y ramificados
Láminas lanceoladas o anchamente elípticas, 2-4 veces más largas que anchas, ápice largamente pinnatífido; último par de pinnas basales mayores de 5 cm long., divergentes y descendentes; últimos segmentos con espínulas (<1mm) en el margen o sólo en el ápice; soros ocupando más de la mitad superior o toda la lámina
2'. Láminas lineares o angostamente elípticas, 5-8 veces más largas que anchas, ápice entero, corto, acuminado; último par de pinnas basales menores de 3 cm long., perpendiculares al raquis; últimos segmentos sin espínulas en el margen; soros en el cuarto o mitad superior de la lámina
Láminas con 18-25 pares de pinnas, distanciadas en el raquis, las pinnas medias y basales hasta con 8(12) pares de pínnulas; base del pecíolo con 4-5 meristelas, estereoma con 4-8 capas de esclerénquima
P. subintegerrimum
3'. Láminas con 22-38 pares de pinnas contiguas en el raquis, las medias con más de 12 pares de pínnulas; base del pecíolo con 6-8 meristelas, estereoma con 12-18 capas de esclerénquima
Frondes de 50-80 cm long. Escamas peciolares basales de 1-1,5 cm long., pinna media 7-10 x 1,50-2,5 cm
P chilense
4'. Frondes de 40-150 cm long. Escamas peciolares basales de 1,8-2,5 cm long., pinna media 7-20 x 1,60-4 cm
Láminas con mesofilo heterogéneo; últimos segmentos espatulados, margen sin espínulas; soros en % parte superior de la lámina; meristelas de la base del pecíolo sin banda circumendodermal
P multifidum
5'. Láminas con mesofilo relativamente homogéneo; últimos segmentos romboidales, margen con una espínula poco desarrollada (< 1mm long) en el ápice; soros en toda la lámina; meristelas de la base del pecíolo con banda circumendodermal
P tetragonum
Frondes medianas, de (20) 30-70 (80) cm long.; láminas 2-pinnadas, porción apical acuminada; pecíolo con 4-6 meristelas en la base; pinnas con ápice acuminado, las basales reducidas a menos de la mitad de las pinnas medias; raquis con escasas escamas lineares, amarillo pajizo; base del pecíolo con escamas de 10-20 mm long., bicolores, centro atropurpúreo y margen castaño-anaranjado; indusio sin pelos glandulares
P plicatum
6'. Frondes pequeñas, de (5) 8-20 (35) cm long.; láminas 1-pinnadas a 1-pinnada- pinnatisectas, porción apical obtusa; pecíolo con 2-3 meristelas en la base; pinnas con ápice redondeado,
las basales iguales en longitud a las pinnas medias; raquis con abundantes escamas lanceoladas, castaño-anaranjadas; base del pecíolo con escamas menores de 10 mm long., concoloras o algo oscurecidas en el centro; indusio con pelos glandulares
Pinnas medias de 4-12 mm long., ovado-deltoides, margen crenado o pinnatífido, indusio con pelos glandulares en el margen
P. andinum
7'. Pinnas medias de 10-20 mm long.; triangular-deltoides, pinnatisectas hacia la base; indusio con pelos glandulares en toda la superficie
P. mohrioides
Frondes rígidas; pinnas coriáceas, ascendentes; margen de los últimos segmentos revoluto; escamas del pecíolo cobrizas a castaño-rojizo oscuro
P pycnolepis
8'. Frondes laxas; pinnas cartáceas, horizontales o levemente ascendentes en los extremos; margen de los últimos segmentos plano; escamas del pecíolo castaño-oscuro y bicoloras, centro oscuro y bordes anaranjado pálido
P montevidense
Discusión
Variabilidad y valor taxonómico de los caracteres morfológicos y anatómicos
Los caracteres morfológicos informativos de la lámina que han permitido distinguir claramente dos grupos en los Polystichum Sudamericanos Australes son: forma de la lámina y porción apical, presencia/ ausencia de espínulas débiles y disposición y longitud de pinnas basales. Así, P. multifidum, P. chilense y P. tetragonum conforman un grupo homogéneo que se distingue por las láminas anchamente elípticas, el extremo pinnatífido, los segmentos con espínulas débiles en el margen y las pinnas basales descendentes, mayores de 5 cm de long.; por otra parte, P andinum, P plicatum y P. mohrioides comparten las láminas lineares y el extremo acuminado, las pinnas basales perpendiculares al raquis, menores de 5 cm de long. y los segmentos sin espínulas en el margen. Ambos grupos de especies corresponden a linajes recuperados en análisis filogenéticos recientes, con excepción de P andinum, que divergió tempranamente en el Clado de los Polystichum Sudamericanos Australes (Morero et al, 2019).
Asimismo, la presencia/ausencia de indusios, las espínulas del margen foliar y su grado de desarrollo, permiten diferenciar las especies Sudamericanas Australes de las Andinas, pues las primeras presentan indusio y carecen de espínulas o, si están presentes, son débiles y se restringen al extremo de la aurícula y de la pinna. En tanto, en los congéneres Andinos analizados los indusios están ausentes y presentan las espínulas muy desarrolladas en todo el margen. Estos caracteres, que no están influenciados por el hábitat o edad de la planta, también se han empleado en la taxonomía de las especies de Polystichum de los Andes (McHenry & Barrington, 2014).
La división de la lámina es uno de los caracteres morfológicos de la fronde taxonómicamente más informativo a nivel de especie. Los Polystichum del clado Sudamericano Austral, presentan láminas 1-4 pinnadas y los andinos examinados, 2-pinnadas. Si bien, la división de la lámina puede incrementarse con la edad de la planta (Barrington, 2011), siendo las plantas más juveniles menos divididas que las maduras, las comparaciones realizadas en individuos adultos muestran que la división de la lámina es un carácter bastante conservado y no está afectado por el hábitat.
Por otro lado, la epidermis de la lámina en las especies de Polystichum sigue el patrón básico reportado para otras especies del género (Chandra, 1977; Mehra & Sony, 1983; Shah et al, 2018), con células epidérmicas alargadas y paralelas a las venas, usualmente de mayor tamaño en la epidermis adaxial. Los estomas se ubican exclusivamente en la cara inferior de la lámina (lámina hipostomática) y a nivel de la epidermis o algo elevados, en los aeróforos, como es característico en Polystichum (Kondo, 1962; Zhang, 1996; Shah et al., 2018). Estomas anomociticos, polocíticos, copolocíticos y estaurocíticos han sido reportados para otras especies del género (Kondo, 1962; Van Cotthen, 1970a, b, 1973; Chandra, 1977; Mehra & Soni, 1983; Zhang, 1996; Roux & Van Wyk, 2000; Shah et al, 2018). En las especies examinadas, predominan los estomas polocíticos y estaurocíticos, seguidos por los anomocíticos; el tipo de estoma es un carácter polimórfico, observándose hasta tres tipos diferentes y adyacentes en la misma fronde. En P andinum, es común la presencia de estomas contiguos compartiendo las mismas células acompañantes. El tamaño de las células oclusivas es muy variable entre las especies. Se ha observado que la especie diploide P montevidense presenta células oclusivas pequeñas (en vista superficial), con longitudes de 64,91-85,02 pm, mientras que en los tetraploides (P andinum, P chilense, P. mohrioides, P multifidum y P plicatum) el rango observado es 99,8-234,97 pm y en el octoploide P subintegerrimum el rango es de 109,46-189,26 pm. El tamaño de los estomas (usualmente el largo de las células guardianas) ha sido correlacionado positivamente con el nivel de ploidía en Asplenium (Moran, 1982; Akhter et al., 2018), Dryopteris (Schneller, 1974; Roux, 2012) y Polystichum (Barrington et al., 1986; Roux & Van Wyk, 2000). Sin embargo, sería necesario contar con extendidos de epidermis de más ejemplares por especie para confirmar los resultados obtenidos en este trabajo. El análisis del tejido epidérmico ha permitido corroborar la información existente para el género, no obstante, los datos obtenidos tienen relativa significancia taxonómica en el grupo de especies de Polystichum estudiado.
El indumento en las especies de Polystichum analizadas comprende pelos y escamas. En todos los taxones se observaron pelos glandulares unicelulares y también 2-celulares. Los primeros son los más frecuentes y han sido denominados “pelos unicelulares clavados o glándulas unicelulares clavadas” en trabajos anatómicos de otras especies de Polystichum y en Dryopteris (Roux, 1997; Roux & Van Wyk, 2000; Roux, 2012). Si bien es escasa la diversidad de tipos de pelos, la distribución en la superficie de la planta, difiere entre las especies, por lo cual resultaría un carácter informativo. En los escasos estudios anatómicos de Polystichum, la presencia de pelos ha sido reportada como un carácter raro y observado en los indusios y en plantas jóvenes y de escaso valor taxonómico (Chandra & Nayar, 1982; Roux & Van Wyk, 2000). Sin embargo, en este trabajo, los pelos se han hallado en los ejemplares adultos de todas las especies y ampliamente distribuidos en los órganos (pecíolos, ejes foliares, lámina e indusios); resultaron especialmente útiles para diferenciar a P. mohrioides, P. andinum y P. tetragonum, los únicos taxones que presentan pelos glandulares en los indusios, el primero en toda la superficie y, los últimos, sólo en el margen. Además, resulta interesante destacar que la presencia de estos pelos glandulares en otros géneros de Dryopteridáceas, fundamentalmente en Dryopteris, Arachnoides y Elaphoglossum, está asociada a la producción de acilfloroglucinoles, compuestos polifenólicos que tienen propiedades antihelmínticas (Socolsky et al., 2012).
Un carácter taxonómico informativo importante en Polystichum son las escamas (Barrington, 2011). Se las encuentra cubriendo densamente la superficie del rizoma y la base del pecíolo o, regularmente esparcidas, en los raquis y en la cara abaxial de la lámina, donde están generalmente asociadas a los nervios; en este último caso, por ser más pequeñas (2 15 mm long.), suelen denominarlas microescamas. Resulta interesante señalar que el margen de las escamas en las especies del clado Sudamericano Austral es liso o presenta pequeños dientes; en tanto, las especies andinas, P montevidense y P. pycnolepis, además de dientes marginales, presentan cilios largos. En cuanto a la estructura, en todas las especies, se observó el entramado celular del tipo “conforme” pues las células del margen se orientan del mismo modo que las del área media, en series paralelas al eje mayor de la escama. Según la distribución del color, las hay concoloras o bicoloras, y la tonalidad cambia del castaño anaranjado y amarillento (escamas rizomáticas de P andinum) hasta el marrón oscuro casi negro lustroso (escamas del rizoma de P. plicatum). La forma de las escamas varía desde lineares (escamas rizomáticas de P. plicatum) hasta anchamente elípticas y ovado lanceoladas (escamas rizomáticas de P andinum). También pueden encontrarse pelos glandulares asociados al borde de la escama (P andinum y P. pycnolepis), o bien sobre la superficie (P. chilense, P mohrioides y P tetragonum), o en ambos (P montevidense). Generalmente las escamas se insertan en la epidermis mediante un corto pedicelo.
La lámina de las especies examinadas (excepto Polystichum tetragonum) presenta el mesofilo heterogéneo, con diferenciación en parénquima clorofiliano en empalizada y clorofiliano braciforme, similar a lo informado para otras especies del género (Ogura, 1972). La presencia de parénquima con células braciformes también ha sido reportado en géneros de Pteridaceae (Gragano et al., 2001). El espesor del mesofilo puede variar ligeramente entre las especies, así P mohrioides exhibe el mayor grosor (~460,73 pm), especialmente porque presenta mayor número de capas de parénquima en empalizada y, P multifidum caracterizado por su lámina membranácea, es el que posee el mesofilo más delgado (-133,13 pm).
La variación en los patrones de la estela de los pecíolos es un carácter taxonómico importante en Polystichum (Lin & DeVol, 1977, 1978; Hernández- Hernández et al, 2012; Pittermann et al, 2015). La estructura estelar de los rizomas y ejes foliares en las especies de Polystichum estudiadas, es una dictiostela, patrón ya mencionado para todos los géneros de Dryopteridáceas (Ogura, 1972; Pittermann et al., 2015). En los taxones examinados, se reconocieron de 2 a 7 (raramente ocho) meristelas en transcortes de la base del pecíolo. Datos previos para otros miembros del género fueron similares al rango obtenido para las especies estudiadas, se reportaron hasta nueve hacecillos en P biaristatum y escasamente dos en P obliquum (Khullar & Gupta, 1979). El número de meristelas en la base del pecíolo, permite distinguir a P. andinum y P. mohroides del resto de las especies, pues se observan dos hacecillos en el primero y tres en el segundo; en las restantes especies la cantidad varía entre 4-8, siendo P multifidum y P chilense los taxones con el mayor número de hacecillos (6-8). Cabe destacar que se pudo determinar una correlación positiva entre el número de meristelas de la dictiostela y el tamaño de las plantas, correspondiendo a las especies con individuos más grandes, las estelas con hacecillos más numerosos, probablemente por necesitar éstos últimos un mayor aprovisionamiento y distribución de nutrientes. Asimismo, en relación a la evolución de las dictiostelas en helechos, resulta interesante destacar el trabajo de Pittermann et al. (2015). Según estos autores, los patrones de vascularización con varios hacecillos de conducción, como las dictiostelas, están presentes en los linajes de helechos más derivados como es el caso de Dryopteridaceae (Schneider et al, 2004; Schuettpelz & Piyer, 2009; Liu et al., 2014), sugiriendo que la estructura del xilema (especialmente el aumento del número de cordones xilemáticos) estuvo bajo una fuerte presión de selección para resistir la sequía, durante la diversificación de los helechos Eupoliploides en el Cenozoico. Según Lin & DeVol (1977) el tipo más frecuente de configuración del cordón del xilema en las dictiostelas es el “hipocampo”, término acuñado por Ogura (1972) en alusión a la forma típica del xilema con los dos extremos curvados (semejante a un caballito de mar) en transcorte; otros autores (Hernández et al., 2006; Pitterman et al., 2015) han aplicado el mismo término para Dryopteris y Polystichum, pero en estos géneros el xilema adopta una forma diferente, con un solo extremo delgado y curvo y el opuesto ancho y recto, por ello es denominado en este trabajo forma de “kitasato” (Fig. 3G). En todas las especies estudiadas, el xilema de las dos meristelas mayores presenta la configuración en “kitasato”, con excepción de P. andinum, que tiene el xilema en forma deltoide en sus dos únicas meristelas.
Todas las especies analizadas de Polystichum presentan un estereoma hipodermal en los pecíolos. El estereoma está ampliamente difundido entre los helechos. Según Mahley et al. (2018), la presencia del estereoma, específicamente su posición periférica dentro del pecíolo y la elasticidad del esclerénquima, permite el desarrollo de pecíolos más fuertes y resistentes a las tensiones de tracción y compresión. En concordancia con los autores mencionados, observamos que el espesor absoluto (en números de capas) del estereoma, varía proporcionalmente con el diámetro del pecíolo y el tamaño de la hoja, por lo que es un atributo útil para discriminar las especies o grupos de especies de Polystichum.
Otro atributo vascular polimórfico de importancia taxonómica y filogenética es la banda circumendodermal en la zona basal del pecíolo. Se halla presente en todas las especies estudiadas, salvo en los especímenes analizados de Polystichum chilense y P. multifidum. Por lo tanto, este carácter no permitiría diferenciar a los Polystichum del grupo Sudamericano Austral de las especies Andinas;
sin embargo, resultó especialmente útil para distinguir a P tetragonum pues es el único taxón con una banda circumendodermal discontinua y con engrasamientos que ocluyen el lumen celular. La función de la banda circumendodermal aún no se conoce con claridad (Hernández-Hernández et al, 2012) y podría atribuírsele una función protectora pues la presencia de compuestos fenólicos serviría de barrera contra patógenos; además, proporcionaría una mayor rigidez y resistencia mecánica a las frondes. La exclusiva presencia de esta banda en la mayoría de las familias más derivadas de helechos soporta la hipótesis de un origen evolutivo único de la banda circumendodermal, correlacionado con la evolución de las dictiostelas (Hernández-Hernández et al., 2012).
Estudios morfo-anatómicos de Polystichum (Chandra & Nayar, 1982; Mayer & Mesler, 1993; Roux & Van Wyk, 2000) y la información aportada por diversas floras y trabajos florísticos (Barrington, 1995; Roux, 2000, 2001, 2004; Brownsey & Smith- Dodsworth, 2000; Barrington, 2011; Zhang & Barrington, 2013), muestran que la mayoría de las especies presentan dos tipos básicos de rizomas: erectos y decumbentes. El tipo erecto es corto y generalmente no ramificado con un largo número de frondes originadas en la región apical, mientras que el tipo decumbente es usualmente largo y ramificado, naciendo las hojas a lo largo del mismo. Ambas formas están presentes en las especies de Polystichum estudiadas, siendo la primera de ellas la más frecuente. Sin embargo, en P tetragonum y P. plicatum, los rizomas de las plantas grandes suelen inclinarse lateralmente (rizomas ascendentes). Sólo en una especie del clado Sudamericano Austral, P. andinum, los rizomas son decumbentes, naciendo apretadamente varias plantas a lo largo de él. Según Roux y Van Wyk (2000), las especies con este tipo de rizoma a menudo se encuentran en hábitats más expuestos creciendo en densos clones, como es precisamente el caso de P. andinum, que habita gregariamente en los intersticios rocosos de ambientes de alta montaña. En contraste con el tipo de rizoma decumbente, el rizoma erecto del resto de las especies analizadas, se presenta generalmente en individuos que viven aislados y raramente forman agrupamientos densos. En cuanto a los caracteres anatómicos del rizoma, se observó que son histológicamente muy similares en todas las especies estudiadas.
Caracteres morfométricos en la delimitación de las especies de Polystichum del ciado Sudamericano Austral
La longitud de las pinnas basales, el número de pares de pinnas de la lámina y la cantidad de ellas con soros, fueron los caracteres más importantes que permitieron diferenciar los taxones del clado Sudamericano Austral. En líneas generales, se pueden diferenciar tres grandes grupos; por un lado, Polystichum andinum, P. mohrioides y P. plicatum con pinnas basales menores, que oscilan entre 5-20 mm de largo, en el extremo opuesto, P. tetragonum y P multifidum cuyas pinnas alcanzan un rango de 65-140 mm; entre ambos, con fenotipos intermedios, se encuentra el tercer grupo integrado por: P. chilense var. chilense, P. chilense var. dusenii y P. subintegerrimum. Dentro del primer grupo es posible la separación de P. plicatum pues mostró el mayor número de pares de pinnas (20 33) y el menor número de pinnas fértiles (8-17); valores considerablemente menores para el número de pares de pinnas exhiben en conjunto P. andinum y P mohrioides (10-23 pares de pinnas). Asimismo, en el segundo grupo, la combinación de mayor número de pares de pinnas, menos pinnas soríferas y escamas del pecíolo más anchas distingue a P. multifidum de P. tetragonum. Finalmente, P. subintegerrimum y ambas variedades de P. chilense, taxones muy similares a campo, pueden diferenciarse por presentar el primero, menor cantidad de pinnas y, a la vez, menor número de pinnas fértiles.
Es importante destacar que en el caso de Polystichum chilense, los especímenes de la variedad típica y los de la var. dusenii muestran solapamiento en ambos ejes canónicos y una elevada tasa de error de clasificación, sugiriendo que no es posible diferenciarlos entre sí, con base en los caracteres morfométricos analizados. Tampoco se han encontrado diferencias sustanciales al comparar caracteres cualitativos, tanto anatómicos como exomorfológicos. Históricamente, la var. dusenii ha causado confusión en su circunscripción e identificación (Christensen, 1910; Looser, 1968; Rodríguez Ríos, 1987, 1989); consecuentemente, teniendo en cuenta el conjunto de evidencias morfológicas y citológicas (ambas variedades son tetraploides), se refuerza lo propuesto por Morero et al. (2016) al considerar la var. dusenii como un sinónimo de P. chilense.
Las evidencias morfológicas sugieren que no hay un único carácter que permita separar los taxones estudiados, más bien es necesario una combinación de varios caracteres para su correcta identificación. Esta conclusión resulta consistente con la extrema labilidad morfológica que presentan las especies Polystichum (Barrington, 2011).
Contribución de los autores
REM y MAG recolectaron los especímenes a campo, REM identificó los especímenes, efectuó las mediciones de los ejemplares, realizó y analizó los preparados, tomó las fotomicrografías, y confeccionó las láminas. MG realizó el análisis estadístico de los datos. REM redactó el manuscrito con la participación de MG y GEB.
Agradecimientos
Las autoras agradecen al Herbario del Museo Botánico (CORD), especialmente a P. Hick, J. Ponce y P. Wiemer por su asistencia permanente durante el desarrollo de este trabajo. Asimismo, hacemos extensivo nuestro reconocimiento a los curadores de los herbarios BA, BCRU, CONC, LIL, LP, MCNS, SGO, SI y VT por facilitarnos sus colecciones de Polystichum para los estudios morfométricos. Agradecemos también a la Biól. Adriana Pérez por su constante colaboración en el laboratorio y al guardaparque Félix Vidoz (Parque Nacional Lago Puelo, provincia de Chubut) por proveer fotografías y material de varias especies. Asimismo, hacemos extensivo nuestro agradecimiento a la Editora y los revisores anónimos por los valiosos comentarios y sugerencias que permitieron mejorar sustancialmente este trabajo. Este estudio fue financiado por la Secretaría de Ciencia y Tecnología, Universidad Nacional de Córdoba (SeCyT-UNC, Res. 203/14, 2014-2015).












 uBio
uBio 


