Introducción
Las áreas naturales protegidas tienen la misión esencial de conservar la diversidad biológica y cultural de una región, proporcionando bienes y servicios ecosistémicos para la sociedad (SIFAP, Sistema Federal de Áreas Protegidas, https://sifap. gob.ar, 2022). La biodiversidad de un país o región es considerada un bien estratégico cuya conservación garantiza el buen funcionamiento y el equilibrio de los ecosistemas. Conservar la biodiversidad implica considerar aspectos de composición, estructura y función de los ecosistemas (Zuloaga et al., 1999). Para ello, es básico e indispensable conocer la riqueza y composición taxonómica (ligada a la estructura filogenética) y el origen nativo o exótico de la biota presente en las áreas protegidas. Las especies exóticas invasoras son consideradas como una de las principales causas de la pérdida de biodiversidad y de funciones ecosistémicas en áreas protegidas (Strayer, 2012; Schulze et al., 2018; Hulme et al., 2018; Moodley et al., 2020; Richardson et al., 2022). En estas áreas, la presencia de especies exóticas genera gran preocupación ya que pueden poner en riesgo los objetivos de conservación de la biodiversidad, y demanda acciones para mitigar su establecimiento y evitar su dispersión (Liu et al., 2020). Para ello, la Plataforma Intergubernamental de Políticas Científicas sobre Biodiversidad y Servicios de Ecosistemas, indica la necesidad de mejorar la documentación sobre la naturaleza a través, por ejemplo, de inventarios (IPBES, 2019). Asimismo, la Guía Europea sobre Áreas Protegidas y Especies Exóticas Invasoras resalta que los inventarios sobre especies exóticas realizados con criterios científicos son una herramienta esencial para prevenir y controlar la invasión de especies exóticas en áreas protegidas (Pysek et al., 2009; Monaco & Genovesi, 2014).
Los Parques Nacionales argentinos del noroeste de la Patagonia (PNNP) se encuentran entre los más antiguos y de mayor área del país. Comprenden, de norte a sur, los Parques Lanín, Nahuel Huapi, Los Arrayanes (originalmente parte del PN Nahuel Huapi), Lago Puelo y Los Alerces, y constituyen las principales áreas núcleo de la Reserva de la Biósfera Andino Norpatagónica, reconocida por la UNESCO. En conjunto abarcan un área climática y geográficamente muy diversa del oeste de las provincias de Neuquén, Río Negro y Chubut que comprende bosques húmedos, bosques de transición, estepas herbáceas y/o arbustivas, humedales (localmente llamados mallines) y ambientes altoandinos. El terreno es montañoso, con altitudes comprendidas entre aprox. 100 y 4000 msnm, y con numerosos lagos de origen glaciario y ríos importantes por sus aportes hídricos a toda la Patagonia norte de la Argentina. La región se caracteriza, además, por un abrupto gradiente de precipitación resultante de la sombra de lluvias producida por los Andes del sur al recibir los vientos húmedos provenientes del Océano Pacífico. Las precipitaciones ocurren principalmente de abril a septiembre y varían entre aproximadamente 3000 mm/año al oeste, a 500 mm/año al este. Incluye porciones de dos provincias fitogeográficas diferentes, Subantártica y Patagónica, con alta diversidad florística (Cabrera & Willink, 1973; Speziale et al., 2010). Actualmente, la ciudad más grande en la región es San Carlos de Bariloche, con unos 146.000 habitantes, a la que le siguen en tamaño San Martín de los Andes, Villa La Angostura y Esquel. En conjunto, todas estas ciudades junto con otras localidades y parajes de la región suman una población de 500.000 habitantes aproximadamente. La mayoría de estas ciudades han duplicado o triplicado su tamaño en los últimos 30 años y son centros de las principales actividades económicas de la región, incluyendo el turismo, la tecnología aplicada, la ganadería y la silvicultura. Este incremento notable de la población humana y de las actividades productivas se asocia a un aumento de especies exóticas que pueden tornarse invasoras, constituyendo una amenaza a la biodiversidad de estos Parques Nacionales (Ezcurra & Brion, 2005; Speziale & Ezcurra, 2011).
El proceso de planificación de uso y conservación de los recursos de los Parques Nacionales de Argentina debe contar con información actualizada y confiable sobre la diversidad de especies. Este trabajo tiene como objetivo principal actualizar la información sobre la flora de los PNNP Lanín, Nahuel Huapi (incluyendo al PN Los Arrayanes), Lago Puelo y Los Alerces para brindar información generada con bases científicas para su utilización en la actualización de los planes de manejo de estos Parques. Se propone: 1) proveer una base de datos respaldada por ejemplares de herbario de las especies nativas y exóticas de los PNNP, 2) destacar la singularidad de los Parques examinando la riqueza y composición de especies nativas y exóticas totales y por Parque, y 3) analizar la incidencia de las especies exóticas en las áreas protegidas de la región.
Materiales y Métodos
Base de datos de la flora de los PNNP
Se realizaron listados de especies de los siguientes PNNP: Lanín, Nahuel Huapi incluyendo al PN Los Arrayanes, Lago Puelo y Los Alerces, actualizados a junio de 2022. Para ello, se revisó bibliografía taxonómica y se analizaron los ejemplares de herbario registrados en las bases de datos “Documenta Florae Australis” y del Herbario BCRU. Estas bases de datos incluyen, entre muchas otras, colecciones realizadas por los autores en los últimos 40 años dentro de los PNNP. La nomenlatura de familias, géneros, especies y categorías infraespecíficas (subespecies o variedades) se actualizó con los nombres y clasificaciones de la Flora Vascular de la República Argentina (vols. 2, 3, 7, 8, 13, 14, 15, 17, 19 y 20 publicados a junio de 2022 o consulta online http://www.floraargentina.edu.ar para los volúmenes en preparación; Zuloaga & Anton, 2012-2022).
A partir de los listados de los Parques con la nomenclatura actualizada se elaboró una base de datos de nombres de especies, subespecies y variedades presentes en los PNNP. La presencia de cada especie (de aquí en adelante incluyendo subespecies y variedades) en cada Parque fue validada con un ejemplar de herbario (testigos o “vouchers”). Estos ejemplares provienen principalmente de los siguientes herbarios que poseen colecciones importantes de plantas de Patagonia: BA, BAA, BAB, BAF, BCRU, CORD, CTES, SI (abreviaturas según Thiers, 2022). Los ejemplares que se consideraron como testigos de la presencia de cada especie en cada Parque fueron coleccionados dentro de los respectivos Parques e identificados por botánicos especialistas de las instituciones mencionadas. El PN Nahuel Huapi circunda completamente al PN los Arrayanes por lo que en este trabajo fueron tratados juntos y designados de aquí en adelante como PN Nahuel Huapi-Los Arrayanes cuando se hace referencia al conjunto de datos aquí presentados. Para todos los Parques se incluyeron las especies exóticas asilvestradas que fueron coleccionadas dentro de los ejidos municipales que se encuentran adyacentes a un Parque o circundados por un Parque sin que medien barreras geográficas, como San Carlos de Bariloche, Dina Huapi y Villa la Angostura para el PN Nahuel Huapi-Los Arrayanes, y San Martín de los Andes para el PN Lanín. Se tomó esta decisión por considerarse que las especies exóticas invasivas presentes en zonas aledañas podrían extenderse dentro del Parque, por lo cual puede ser de gran utilidad contar con información de base para monitorear su presencia y distribución a través del tiempo (Speziale & Ezcurra, 2011; Spear et al., 2013; Holenstein et al., 2021). En el caso de la flora de alta montaña del Parque Nacional Los Alerces, cuando no se dispuso de material de herbario, las especies se validaron con la información de Rafael (2008). También se utilizó la lista de especies de alta montaña del Parque Nacional Lago Puelo que figura en Ferreyra & Vidoz (2007).
Para cada especie y cada Parque se registraron: familia botánica, nombre científico, carácter nativo o exótico para Argentina, nombre común, y hábito y ambiente más frecuentes, según bibliografía pertinente (ej. Wiersema & León, 1999; Ezcurra & Brion, 2005; Zuloaga et al., 2008; Zuloaga & Anton, 2012-2022). Para los tipos de hábito se consideraron las siguientes categorías: árboles, arbustos, enredaderas, hemiparásitas y herbáceas (incluyendo sufrútices). Como tipos de ambiente, y siguiendo a Ezcurra & Brion (2005), se consideraron: bosque húmedo, bosque de transición (incluyendo bosques de altura), estepa, altoandino y acuático (incluyendo humedales). También se consideró como tipo de ambiente alterado a cualquiera de los anteriores que haya sido modificado por acción humana. Esto incluye, por ejemplo, las zonas habitadas, las modificadas por rutas o caminos, las sujetas a plantaciones o ganadería y las modificadas por efecto de actividades recreativas, de deportes o de turismo.
Análisis de la riqueza y composición de la flora
A partir de la base de datos se analizó la riqueza de especies nativas y de especies exóticas de cada Parque, y la frecuencia de cada una de estas especies cuantificada en valores de 1 a 4 según el número de Parques en los que se la registró. Estos valores diferencian a las especies nativas y exóticas por grado de ubicuidad en los Parques. El valor 1 ayuda a detectar las especies nativas de valor especial, ya sea por ser endémicas estrictas de un solo Parque Nacional (es decir, no encontradas fuera de ese
Parque) o por haber un único Parque donde se las protege, aunque estén presentes fuera de los Parques (especies nativas exclusivas). En cuanto a las especies exóticas, el valor 4 permite detectar las especies con mayor área de distribución en el noroeste de Patagonia (especies exóticas generales), lo que identifica a las que puedan implicar mayor impacto sobre los ambientes naturales por ser abundantes y entre las que probablemente estén las invasivas. Esta información base acerca de la amplitud de la distribución de las especies exóticas en general se correlaciona con la abundancia de las mismas en las áreas protegidas (Brown, 1984).
La base de datos generada también se utilizó para determinar los números de especies nativas y exóticas por ambiente y por hábito, y para calcular coeficientes de Sorensen para estimar la similitud en la composición de especies entre pares de Parques. El coeficiente de S0rensen se calculó como 2a/(b+c), donde b y c corresponden al número de especies presentes en dos de los Parques y a corresponde al número de especies compartidas entre ambos Parques (Sorensen, 1948).
Para comparar las riquezas de especies nativas y exóticas de los PNNP entre sí y teniendo en cuenta la superficie de los mismos, se realizaron regresiones lineales. Para estos análisis, se incorporaron, además, datos de riqueza y superficie de los restantes PN de Patagonia (PN Bosques Petrificados Jaramillo, PN Laguna Blanca, PN Lihuel Calel, PN Los Glaciares, PN Monte León, PN Patagonia, PN Perito Moreno y PN Tierra del Fuego) y de las provincias patagónicas Neuquén, Río Negro, Chubut, Santa Cruz y Tierra del Fuego. Los datos de riqueza de especies nativas y exóticas de los PN de Patagonia se obtuvieron a partir del Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina (SIB) (https:// sib.gob.ar/index.html#!/areas-protegidas), y los de las provincias patagónicas de Zuloaga et al. (1999). Los datos de riqueza y superficie fueron transformados a escala logarítmica, ya que la relación especies-área adopta la forma lineal log10 especies = log10 a + z log10 superficie (MacArthur & Wilson, 1967; Rosenzweig, 1995). Para esto se utilizó la función lm (regresión de cuadrados mínimos) del código R en RStudio v.2022.02.3 (R Core Team 2022; RStudio Team 2022); los gráficos se generaron con el paquete ggplot2 en el mismo entorno (Wickham, 2016).
Resultados
La base de datos de las especies registradas en este estudio para los PNNP Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces se encuentra disponible en el Repositorio Institucional CONICET digital (http://hdl.handle.net/n336/180506).
Riqueza de especies nativas y exóticas
En los PNNP analizados se registró un total de 1304 especies, subespecies y variedades de plantas vasculares, 975 nativas de Argentina y 329 exóticas (25% del total). En la Tabla 1 se indican los números de especies totales, nativas y exóticas de cada Parque Nacional y sus porcentajes respecto del total de especies de cada uno. Los cinco PNNP muestran un alto número de especies exóticas en relación al total de especies (17-31% exóticas; Tabla 1). El PN Lago Puelo posee la mayor proporción de especies exóticas.
La relación del número de especies en función del área (en escala logarítmica) en general se ajustó a una función lineal para las especies nativas (nativas: ln sp = 3,23 + 0,23 ln superficie, P= 2e-7, R2 = 0,75; Fig. 1A) y para las exóticas (ln sp = 1,84 + 0,2 ln superficie, P= 0,03, R2 = 0,21; Fig. 1B). En general los PN de Patagonia Norte muestran mayor riqueza de especies (tanto nativas como exóticas) que los PN de Patagonia Austral teniendo en cuenta sus tamaños (Fig. 1). De los PNNP, los PN Puelo y Nahuel Huapi-Los Arrayanes poseen mayor número de especies nativas y/o exóticas en relación a sus tamaños. La figura 1 también muestra que, respecto de los valores de nuestra base de datos, los datos de riqueza del SIB estarían sobreestimados en los PNNP. Tal sobreestimación podría deberse a errores de identificación en trabajos sobre vegetación sin vouchers de respaldo, o a la incorporación de datos procedentes de áreas más abarcativas que los Parques Nacionales y sus ejidos urbanos cercanos.
Composición de la flora de los PNNP
Las cinco familias con mayor número de especies nativas en los PNNP son Asteraceae (184 especies), Poaceae (130), Cyperaceae (53), Fabaceae (39) y Apiaceae (30) que, en conjunto, representan un 45% de la riqueza total de la flora nativa. Las seis familias más representadas por especies exóticas son Poaceae (58 especies), Asteraceae (41), Brassicaceae (31), Fabaceae (25), Rosaceae (23) y Caryophyllaceae (19). Las mismas incluyen el 60% del total de exóticas. Esta composición de familias con mayor número de especies nativas y exóticas se mantiene para cada Parque individual (Tablas 2 y 3, respectivamente), excepto en los PN Lago Puelo y Los Alerces, donde las familias Hymenophyllaceae (en ambos Parques) y Juncaceae (en Lago Puelo) u Orchidaceae (en Los Alerces) superan a Fabaceae y Apiaceae en número de especies nativas (Tabla 3). Esto es esperable ya que Fabaceae y Apiaceae son familias más diversificadas en zonas abiertas y las otras en zonas boscosas.

Tabla 1: Comparación entre las floras de los Parques Nacionales argentinos del noroeste de Patagonia: Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces. Para cada Parque y cada característica analizada, se indica el número de especies en valores absolutos y en porcentajes (%).
La Tabla 4 muestra el número de especies compartidas entre pares de Parques y los coeficientes de Sorensen. El PN Nahuel Huapi-Los Arrayanes y el PN Lanín son los más similares en cuanto a la composición de especies (coef. S0rensen = 0,66). El PN Lago Puelo es el más disímil en relación a los demás Parques (coef. S0rensen = 0,45-0,56); comparte más especies con el PN Los Alerces. El PN
Nahuel Huapi-Los Arrayanes es el que tiene mayor número y porcentaje de especies nativas registradas exclusivamente en esa área protegida (193 nativas exclusivas; 18% del total; Tabla 1). El número de especies exóticas presentes en todos los PNNP (exóticas generales) es de 45 (14% del total de la flora de todos estos Parques). El PN Lago Puelo es aquel con mayor porcentaje de exóticas generales (10% del total; Tabla 1).
Hábito y ambiente
Las hierbas constituyen el 80% de las especies registradas en los PNNP; tienen hábito arbóreo un 5% del total de las especies (Tabla 1). Las exóticas registradas presentan todos los tipos de hábito, excepto hemiparásitas de las cuales no se registró ninguna. Las especies de árboles exóticos constituyen el 55% de la riqueza total para ese hábito, mientras que las demás exóticas representan un 11-26% de cada tipo de hábito (Fig. 2).
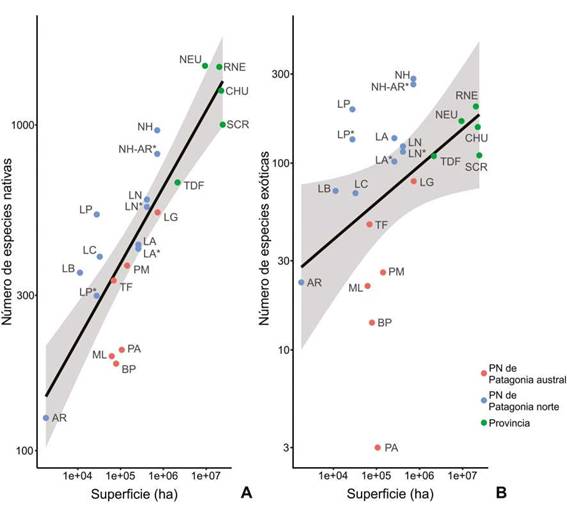
Fig. 1: Riqueza de especies de los Parques Nacionales argentinos del noroeste de la Patagonia en función del área. A: especies nativas de Argentina. B: especies exóticas. Se incluyen también los números de especies y las áreas de las provincias y resto de los Parques Nacionales de Patagonia. Abreviaturas= AR: Parque Nacional (PN) Los Arrayanes; BP: PN Bosques Petrificados Jaramillo; CHU: Chubut; ha: hectáreas; LA: PN Los Alerces; LB: PN Laguna Blanca; LC: PN Lihuel Calel; LG: PN Los Glaciares; LN: PN Lanín; LP: PN Lago Puelo; ML: PN Monte León; NEU: Neuquén; NH: PN Nahuel Huapi; NH-AR: PN Nahuel Huapi, incluyendo al PN Los Arrayanes; PA: PN Patagonia; PM: PN Perito Moreno; RNE: Río Negro; SCR: Santa Cruz; TDF: Tierra del Fuego; TF: PN Tierra del Fuego. El asterisco indica valores de riqueza a partir de la base de datos de los Parques Nacionales argentinos del noroeste de la Patagonia generada en este trabajo. Los restantes datos de riqueza y los de superficie fueron obtenidos a partir del Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina o de Zuloaga et al. (1999).
En los PNNP los ambientes abiertos son levemente más ricos en especies (estepa y altoandino, 31%) que los bosques (bosque húmedo y bosque de transición, 28%; Tabla 1). Las especies exóticas se encuentran mayormente en ambientes alterados. El PN Lago Puelo se diferencia del resto por poseer su mayor riqueza de especies en el bosque húmedo (23%; Tabla 1).

Tabla 2: Composición de la flora nativa en los Parques Nacionales argentinos del noroeste de Patagonia: Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces. Se muestra el número de especies nativas de las cinco familias con mayor riqueza. En los PN Lago Puelo y Los Alerces, la riqueza de las familias señaladas con asterisco no se encuentran dentro de las cinco más representadas, en su lugar, se ubican Hymenophyllaceae (PN Lago Puelo 16 especies; PN Los Alerces 11 especies), Juncaceae (PN Lago Puelo 11 especies) y Orchidaceae (PN Los Alerces 22 especies).

Tabla 3: Composición de la flora exótica en los Parques Nacionales argentinos del noroeste de Patagonia: Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces. Se indica el número de especies exóticas de las seis familias con mayor riqueza por Parque.

Tabla 4: Similitud en la composición taxonómica entre los Parques Nacionales argentinos del noroeste de Patagonia: Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces. La diagonal de la matriz muestra el número total de especies registradas en cada Parque; por encima de la diagonal, el número de especies compartidas entre pares de Parques; por debajo de la diagonal los coeficientes de

Fig. 2: Porcentajes relativos de especies exóticas y nativas por hábito en los Parques Nacionales argentinos del noroeste de la Patagonia: Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces. Abreviaturas= ARBO: árboles; ARBU: arbustos; ENRE: enredaderas; HEMI: hemiparásitas; HERB: herbáceas.
Discusión
Flora de los PNNP
Los resultados de este estudio muestran que los PNNP Lanín, Nahuel Huapi-Los Arrayanes, Lago Puelo y Los Alerces con los ejidos de sus ciudades colindantes comprenden una flora taxonómicamente muy diversa, con un total de 1304 especies pertenecientes a 479 géneros y 127 familias de plantas vasculares. El 25% de las especies nativas de esta flora están protegidas por un solo Parque (especies exclusivas), lo que resalta la singularidad de cada uno de ellos.
La riqueza de especies registrada resultó similar entre bosques y ambientes abiertos como estepas y regiones altoandinas (28% y 31%, respectivamente). Esto último indica que los esfuerzos de conservación claramente deben procurar la conservación de todos estos ambientes. En cuanto a las formas de vida, a pesar de que todos los PNNP comprenden grandes superficies de bosques, solamente el 19% de las especies son leñosas (árboles, arbustos y enredaderas) siendo la mayoría herbáceas (81%, incluyendo a los sufrútices). Es destacable que el número de especies de árboles exóticos registrados superó al número de nativos (Fig. 2), lo que representa un enorme riesgo para la diversidad nativa de los bosques y demás ambientes donde estas especies puedan establecerse. Las especies de árboles exóticos fueron introducidas en la región por su valor forestal u ornamental. Aunque sus cultivos se iniciaron, en gran medida, dentro de los ejidos urbanos, la mayoría de las especies exóticas arbóreas asilvestradas actualmente también se encuentran dentro de las áreas protegidas. Preocupantemente, se han registrado procesos de invasiones en diferentes grados de avance para varias especies arbóreas en la región que incluye a los PNNP (Simberloff et al., 2010; Lediuk et al., 2014, 2016).
Todos los PNNP y sus áreas colindantes presentaron especies exóticas, siendo el porcentaje alto (25%) respecto del total de especies que allí crecen. Este porcentaje es elevado en relación a los porcentajes obtenidos en otras áreas protegidas del mundo (Moodley et al., 2020). Las especies exóticas generales (presentes en todos los PNNP) son 45 (14% del total de especies exóticas). Dadas sus extensas distribuciones, y porque muchas de ellas son invasoras o potencialmente invasoras, estas especies exóticas (ej., Cytisus scoparius, Juníperas communis, Rosa rubiginosa, Salix fragilis y Ulex europaeus) podrían tener mayor impacto sobre los ambientes naturales. Esto parece ser un problema en numerosas áreas protegidas del mundo (ej. Moodley et al., 2020) y requiere de la toma urgente de medidas de manejo para proteger la biodiversidad nativa. El listado de especies exóticas puede ser un punto de partida para quienes investigan la dinámica de avance de las especies invasoras y para la toma de decisiones en pos de su control. En relación a los PNNP, los PN de Patagonia Austral parecen estar más protegidos de la amenaza que implica la presencia de exóticas ya que sus Parques muestran menos exóticas que las esperadas por sus superficies. Esto podría deberse al menor impacto de las actividades humanas en varios de los PN de Patagonia Austral y abre la posibilidad de actuar en forma temprana. Sin embargo, los bajos números de especies exóticas registradas también pueden deberse a un menor estudio de las floras de estos Parques, incluyendo un menor registro de las especies exóticas presentes. Sería importante corroborar los valores de riqueza con listados actualizados y respaldados por ejemplares de herbario, lo que implica, en muchos casos, aumentar los esfuerzos de recolección de plantas y preparación de colecciones botánicas.
Flora del PN Lanín
El PN Lanín es el segundo en superficie (412.000 ha) y cantidad de especies de los PNNP analizados. Del total de especies (711), 588 (83%) son nativas y 123 (17%) exóticas. En relación a su área, presenta un número de especies nativas que no excede la relación de otros Parques Nacionales y provincias de la región patagónica.
Especies nativas: El PN Lanín se destaca por el alto porcentaje de especies exclusivas. Del total de las especies nativas, 87 especies (12% del total de especies del PN) son exclusivas de este Parque (Tabla 1), es decir que se registraron para el PN Lanín y no para otros del noroeste de Patagonia, aunque sus distribuciones pueden exceder los límites del Parque. La riqueza de especies de ambiente de bosque de transición y la singularidad de la flora del Parque lo hacen especialmente valioso en cuanto a su conservación. Entre sus especies exclusivas se encuentran la emblemática araucaria (Araucaria araucana) y especies de Nothofagus de distribución limitada en Argentina como el raulí (N. alpina) y el roble pellín (N. obliqua), todas ellas muy representativas de los bosques templados de Sudamérica, con importantes roles ecológicos y con alto valor cultural, ornamental y económico (Donoso Zegers, 2006; Barthélémy et al., 2008). Además, tienen distribución restringida y pueden estar amenazadas por la invasión de algunas especies exóticas, sobre todo por efecto de cultivos forestales (Sarasola et al., 2006). El PN Lanín también posee importancia por la alta proporción de especies de ambiente altoandino, varias de ellas con distribución restringida a este Parque y zonas aledañas.
Especies exóticas: El número total de especies exóticas registrado para el PN Lanín es relativamente bajo entre los PNNP, y el porcentaje de exóticas respecto del total de especies es el mínimo entre estos Parques, y cercano al del PN Los Alerces (Tabla 1; Fig. 1B). El menor porcentaje de especies exóticas probablemente se relacione con las distancias mayores de este Parque a las ciudades más cercanas, que en general son fuentes de propágulos de exóticas, y/o a la menor cantidad de rutas pavimentadas que cruzan este Parque, las que son fuente de disturbios recurrentes y propagación de esas especies (Speziale & Ezcurra, 2011; Spear et al., 2013; Holenstein et al., 2021). Sería importante que estas características del PN Lanín se mantengan. Sin embargo, es de notar que algunas de sus especies exóticas ya han invadido amplios sectores del mismo (Funes et al., 2006).
Flora de los PN Nahuel Huapi y Los Arrayanes
El PN Nahuel Huapi-Los Arrayanes se destaca por la riqueza de su flora y el alto porcentaje de especies exclusivas. Se registraron 1095 especies de plantas vasculares (Tabla 1) de las cuales 64 (ca. 6% del total) son novedades respecto del Catálogo de Plantas del Nahuel Huapi realizado hace 17 años (Ezcurra & Brion, 2005, y que también incluyó al PN Los Arrayanes). Sin dudas, es el PNNP más estudiado en cuanto a la composición y riqueza de su flora (ej. Cabrera, 1939; Ezcurra & Brion 2005 y referencias citadas en ambos). Del total de especies, 812 (74%) son nativas y 283 (26%) son exóticas (Tabla 1).
El alto número de especies de este PN supera lo esperado en función de su superficie (717.261 ha), siendo una de las áreas protegidas más ricas de la región (Fig. 1). La alta riqueza de especies del mismo probablemente se relacione con la gran heterogeneidad de su paisaje, que incluye altitudes desde aproximadamente 400 msnm en el valle del río Manso Inferior hasta 3491 m en el cerro Tronador, determinando amplias diferencias en temperatura y varios pisos altitudinales de vegetación. El PN también presenta grandes diferencias en cuanto a precipitación entre sitios: Puerto Blest, al oeste, recibe unos 3000 mm anuales y Anfiteatro, al este, unos 500 mm; este gradiente también produce cambios marcados en la vegetación y la flora asociada (Ezcurra & Brion, 2005; Speziale et al., 2010). La invasión de innumerables especies exóticas, que crecen especialmente en el ecotono entre la estepa y el bosque de transición (Speziale & Ezcurra, 2011), conforman una amenaza importante a la conservación de esta flora singular y de gran riqueza.
Especies nativas: Una alta proporción de las especies nativas, 193 especies (18% del total de especies del PN), son exclusivas del PN Nahuel Huapi-Los Arrayanes (Tabla 1). La singularidad de la flora del PN Nahuel Huapi-Los Arrayanes, junto con su riqueza en especies, lo hace especialmente valioso en cuanto a su conservación.
De todas las formas de vida presentes en este PN, las especies de hábito herbáceo están representadas en mayor proporción que en los otros PNNP (Tabla 1). Esto se relaciona con una mayor representación de especies de estepa y de humedales (ambiente acuático en la Tabla 1) que de especies de los otros ambientes (altoandino, bosque húmedo y bosque de transición). Por lo tanto, es prioritaria la protección de ambientes de estepa y mallines en este PN, ambientes ricos en especies herbáceas que en varios casos son endémicas regionales.
Especies exóticas: El número total de especies exóticas registrado para los PN Nahuel Huapi-Los Arrayanes es el más alto de todos los PNNP, y el porcentaje de exóticas respecto del total de especies es solamente superado por el PN Lago Puelo (Tabla 1). En la región que rodea al lago Nahuel Huapi existe un impacto antrópico importante relacionado con los usos turístico, forestal y ganadero de la tierra, el asentamiento de ciudades, y la introducción de gran cantidad de plantas ornamentales y alimenticias (Ezcurra & Brion, 2005); todo ello se refleja en la cantidad de especies exóticas asilvestradas. Desde el último catálogo de plantas vasculares del PN Nahuel Huapi (que también incluye al PN Los Arrayanes, Brion & Ezcurra, 2005), el número de exóticas aumentó en 26, es decir que hay más de una especie exótica nueva por año. Cabe destacar que dentro de los límites del PN Nahuel Huapi existe la ciudad más extensa y poblada de la región (Bariloche), que es fuente importante de disturbios y de propágulos que inciden en la instalación de exóticas (Speziale & Ezcurra 2011). Un género exótico que reviste mucha importancia en la región es Pinus. Varias especies de este género y otras coníferas como Pseudotsuga menziesii se encuentran asilvestradas. Algunas de estas especies ya están invadiendo o podrían resultar en invasiones peligrosas, especialmente en ambientes de estepa y altoandinos, a los que pueden modificar notablemente (Sarasola et al., 2006; Paritsis et al., 2008; Dezzoti et al., 2009; Simberloff et al., 2012; Orellana & Raffaele, 2016). Por otra parte, las especies del género Salix presentan un gran avance a lo largo de ríos y arroyos (ej. Datri et al., 2017), debiéndose manejar su rebrote para reducir sus impactos negativos a nivel ecosistémico. Estas especies arbóreas deberían ser monitoreadas y, de ser posible, controladas.
Flora del PN Lago Puelo
El PN Lago Puelo, el menor de las áreas protegidas analizadas (27.674 ha), presentó 449 especies de plantas vasculares, de las cuales 310 fueron nativas y 139 exóticas. Si bien el número de especies de plantas que lo habitan es menor que el de los restantes Parques (Tabla 1), incluye muchas más especies exóticas de las que sería esperable encontrar suponiendo una proporcionalidad con su superficie (Fig. 1B).
Especies nativas: El PN Lago Puelo es singular en cuanto a su composición florística; comparado con el resto de los PNNP mostró los menores índices de similitud (Tabla 4), con 27 especies nativas exclusivas que no se encuentran en ninguno de los restantes PNNP (Tabla 1). Inciden significativamente en la exclusividad florística del PN Lago Puelo las áreas ubicadas a baja altitud (196-400 msnm), inexistentes en los restantes Parques incluidos en este estudio, donde pueden desarrollarse especies mesotérmicas de amplia distribución en Chile, pero muy poco frecuentes en Argentina. Algunas de estas especies corresponden a árboles valdivianos tales como Aextoxicon punctatum (Aetoxicaceae), Eucryphia cordifolia (Cunoniaceae), Persea lingue (Lauraceae), Caldcluvia paniculata (Cunoniaceae) y Gevuina avellana (Proteaceae), la primera de las cuales es monotípica a nivel de familia y género y uno de los pocos endemismos de la Patagonia a nivel de familia. También se asocian a estos bosques varias especies de arbustos que en los restantes Parques están ausentes o en frecuencia muy baja, como es el caso de Escallonia leucantha (Escalloniaceae, que puede alcanzar porte arbóreo), Ugni molinae (Myrtaceae), Gaultheria insana (Ericaceae) y Griselinia racemosa (Griseliniaceae).
Especies exóticas: El PN Lago Puelo es el que presenta el porcentaje más elevado de especies exóticas respecto del total de especies (31%). Por otro lado, este Parque presenta un número alto de especies exóticas que no se encuentran en ninguno de los otros Parques (31 especies). Sufre un importante impacto antrópico debido a la intensidad de uso, especialmente de su área norte por parte de residentes y turistas. Estos usos involucran desmontes, movimientos de tierra, pisoteo y tránsito en áreas costeras, introducciones accidentales de especies exóticas y mayor incidencia del fuego. A esto se suman los cultivos de especies frutales y ornamentales que se realizaron cuando la superficie que actualmente se encuentra bajo su jurisdicción formaba parte de chacras. Como consecuencia, en este Parque habita un conjunto de especies que hoy en día se reproducen espontáneamente pero que en su momento fueron introducidas como ornamentales o por sus frutos comestibles. Un argumento adicional mediante el cual explicar la sobreabundancia de especies exóticas en el PN Lago Puelo es la presencia de un paso a baja altitud que se emplea con frecuencia para el tránsito de peatones desde y hacia Chile, lo cual facilitaría el ingreso de especies exóticas desde áreas pobladas de ese país.
Flora del PN Los Alerces
El PN Los Alerces es el tercero en superficie de los PNNP analizados (259.822 ha). Se han registrado 518 especies de plantas vasculares (Tabla 1). Del total de especies, 416 (80%) son nativas y 102 (20%) son exóticas (Tabla 1). El número de especies nativas y exóticas de este PN corresponde a lo esperado en función de su área (Fig. 1). Se destaca por el alto porcentaje de especies altoandinas (22%) y de bosques (36%); junto con el PN Lago Puelo, es el que posee menor porcentaje de especies de ambientes de estepa (9% en PN Los Alerces).
Especies nativas: El PN Los Alerces y el PN Lanín son los PNNP que presentaron mayor porcentaje de especies nativas (80% y 83%, respectivamente). Pese a esta alta proporción, sólo el 5% de estas especies (24 especies) son exclusivas del PN Los Alerces (Tabla 1). De estas especies exclusivas, dos son arbustivas y las restantes son herbáceas; no hay especies de árboles que crezcan exclusivamente en el PN Los Alerces. El alerce (Fitzroya cupressoides), especie emblemática del PN y a la que debe su nombre, posee alto valor ecológico, evolutivo, cultural y económico (Kitzberger et al., 2000). La explotación forestal a la que ha sido sometida esta especie en el pasado, tanto en Chile como en la Argentina, condujo a la fragmentación de sus poblaciones. Actualmente, un porcentaje alto de las poblaciones de alerce que crecen en la Argentina se encuentran en áreas protegidas (Kitzberger et al., 2000), siendo las más destacadas las de este PN, que lo llevaron a ser reconocido como Patrimonio de la Humanidad.
Especies exóticas: El número total de especies exóticas registrado para el PN Los Alerces es el menor de todos los PNNP analizados, encontrándose dentro de la riqueza esperada para su superficie (20%; Tabla 1). Una proporción importante de la superficie de este Parque tiene poco impacto de turismo ya que la mayor parte de esta actividad se centra en áreas bien delimitadas, y es en éstas donde se registró la mayor proporción de especies exóticas (ej. Kutschker et al., 2018). Las forestaciones de distintas especies de Pinus cercanas al Parque pueden ser fuentes de invasión, ya que algunas especies son reconocidas por sus características invasoras en otras partes del noroeste patagónico (ej. Sarasola et al., 2006; Dezzotti et al., 2008; Paritsis et al., 2008).
Conclusiones
Los PNNP poseen una flora nativa diversa y singular y su biodiversidad puede verse fuertemente amenazada por el alto porcentaje de especies de plantas exóticas presentes en todos los PNNP y en áreas colindantes. El monitoreo, control y manejo adecuado de especies potencialmente invasoras, principalmente árboles y arbustos, que tienen capacidad de generar importantes modificaciones en cuanto a diversidad, estructura y función de los ecosistemas, deberían ser prioridades para la gestión de estas áreas naturales protegidas en los próximos años.
La base de datos generada en este estudio es una herramienta fundamental para planificar políticas de conservación y manejo sostenible de los PNNP. La información objetiva, fiable y comparable sobre su biodiversidad es importante tanto desde un punto de vista científico como educativo, siendo un elemento esencial para la toma de decisiones en la gestión de estas áreas protegidas.
Contribución de los Autores
Todos los autores contribuyeron con la obtención de colecciones de herbario, con la determinación de ejemplares pre-existentes, y/o con la alimentación de la base de datos a partir de la cual se realizaron los análisis. CE y CB realizaron la base de datos del PN Nahuel Huapi que se actualizó y amplió al resto de los PNNP para una evaluación de la flora solicitada por la Administración de Parques Nacionales a CE y en la que participaron todos los autores hasta 2012. La actualización de la nomenclatura y contenidos de la base de datos en 2022 fue realizada por CE, CB, CIC y JP. CIC realizó los análisis y gráficos y CIC, CE y JP redactaron el presente manuscrito. Todos los autores revisaron el manuscrito e hicieron aportes.
Agradecimientos
Al Lic. Claudio Chehebar y a la Dra. Cecilia Nuñez de la Delegación Técnica de Parques Nacionales de Patagonia Norte por el apoyo para realizar este trabajo y los permisos para coleccionar en los PNNP. A los organismos que financian nuestras investigaciones: ANPCyT-FONCyT [PICT 2019 0770]; CONICET [PIP 112-201301-00357]; Universidad Nacional del Comahue [PIN B245]; Universidad Nacional de Río Negro [B663].












 uBio
uBio 

