Introducción
La creación de áreas protegidas (AP) es una de las principales herramientas para la conservación de la biodiversidad a nivel global. Estrictamente las AP representan un espacio geográfico claramente diseñado, definido y administrado, con el principal objetivo de lograr la conservación de la biodiversidad a largo plazo y de los servicios ecosistémicos asociados a ella (Dudley & Stolton, 2008). Las investigaciones en los sistemas de AP resultan clave para conocer y comprender la efectividad de estas áreas para la conservación de la biodiversidad y, en función de esto, realizar acciones adecuadas de manejo (Borsellino et al., 2022).
Argentina fue el primer país latinoamericano en establecer áreas protegidas y actualmente cuenta con 52 áreas protegidas de jurisdicción nacional, de las cuales 38 son Parques Nacionales (PN) terrestres que cubren una superficie aproximada de 44.103 km2 (https://sib.gob.ar). Los PN de Argentina, regulados por la Administración de Parques Nacionales (APN), están ubicados en diferentes ecorregiones del país y difieren en su fecha de creación (antigüedad) y superficie, aspectos que posiblemente influyen en el número e identidad de especies dentro de dichas áreas, como fue observado para otras áreas protegidas (Durán et al., 2015). Los PN se caracterizan por tener no solo el rol de proteger la biodiversidad y los servicios ecosistémicos derivados de la naturaleza, sino también de proporcionar oportunidades científicas, educativas, espirituales y recreativas para las personas (Gissibl et al., 2012).
Actualmente, la APN cuenta con un Sistema de Información de Biodiversidad (SIB) (https:// sib.gob.ar/), donde se pueden encontrar listas de especies de diferentes organismos para cada PN. Esta información de acceso público representa un gran potencial para diferentes tipos de estudios (e.g.Gantchoff et al., 2018). Contar con listas o base de datos de especies que sean sistemáticamente revisadas y actualizadas es un paso esencial para el desarrollo de estrategias de manejo y conservación en cualquier AP. Por lo tanto, para que estas listas de especies sirvan de base para estudios filogenéticos, modelado de distribución de especies, monitoreo de biodiversidad, monitoreo y control de especies no nativas invasoras, entre otros, resulta fundamental que estén lo más completas posible. Una manera de explorar la cantidad de biodiversidad protegida por los PN podría ser analizando la relación entre el número de especies registradas en cada PN y el número de especies registradas en la/s provincia/s donde se encuentra cada PN. Este tipo de evaluación permitiría además conocer si existen sesgos taxonómicos, por ejemplo, un mayor registro de taxones de interés económico o de formas de vida fácilmente reconocibles (árboles) (Yang et al., 2021) o más carismáticas para el ser humano (aves y mamíferos) (Troudet et al., 2017). La importancia de este tipo de estudios es cada vez mayor, dada la acelerada pérdida que experimenta la biodiversidad a nivel mundial como consecuencia de diferentes disturbios antrópicos, entre ellos, las invasiones biológicas (Bellard et al., 2016; IPBES, 2019).
Las invasiones biológicas ocurren cuando las especies son transportadas de manera accidental o intencional fuera de su rango original de distribución (denominadas entonces “especies no nativas”), donde sus descendientes proliferan, se dispersan, se establecen y su abundancia se incrementa (denominadas entonces “especies no nativas invasoras”) (Richardson et al., 2000; Blackburn et al., 2011). Las invasiones biológicas son un problema creciente debido al aumento, tanto del número, como del área de distribución de las mismas (Seebens et al., 2017; Seebens et al., 2021). Las AP no están exentas a este problema, numerosas investigaciones han demostrado el incremento del número de especies no nativas, no nativas invasoras y de sus impactos negativos tanto ecológicos (Foxcroft et al., 2017; Liu, 2020; Shackleton et al., 2020) como económicos (Moodley et al., 2022).
La presión de propágulos (frecuencia y número de individuos introducidos en un área dada) influye en la primera etapa del proceso de invasión, y se estima que solo un 10% de las especies no nativas que llegan a una nueva región logran saltar todos los filtros y volverse invasoras (Williamson & Fitter, 1996). La magnitud de la presión de propágulos depende de diferentes variables, entre ellas las características de las AP como ser antigüedad y superficie, de la matriz circundante al AP (e.g. cercanía a ciudades) y del número de personas que visiten el AP (Hulme et al., 2013; Spear et al., 2013; Barros et al., 2014; Holenstein et al., 2021). Otros factores importantes que pueden limitar la dispersión y el establecimiento de especies no nativas dentro de las AP son las características de las especies no nativas, de la biodiversidad nativa, características ambientales del área receptora y la interacción entre ellos (Richardson & Pysek, 2006). Existe una clara necesidad de conocer cuáles son esos factores y de mejorar el monitoreo y reporte de las especies no nativas en áreas protegidas, con el fin de reducir los numerosos impactos negativos asociados a las invasiones biológicas (Pysek et al., 2020; Shackleton et al., 2020).
En este contexto, los objetivos de nuestro estudio fueron: I) evaluar la proporción de taxones registrados en el SIB para los PN terrestres respecto a los registrados en la provincia donde se localiza el PN, II) analizar posibles variables explicativas del número de registros en dichas listas y III) caracterizar en forma detallada la vegetación registrada en tres PN icónicos a fin de guiar futuras investigaciones en estas áreas protegidas.
Materiales y Métodos
Para el primer objetivo, comparamos el número de registros de plantas vasculares y de animales vertebrados tetrápodos (mamíferos, aves, reptiles, anfibios) en cada PN, según los listados del SIB, con el número de registros en la provincia geográfica a la cual pertenece según Zuloaga et al. (2019) para plantas vasculares y Bauni et al. (2022) para vertebrados. Para el segundo objetivo, se analizó la relación entre el número de registros en cada PN y variables macroecológicas (latitud y riqueza de la región) y características del PN (superficie y año de creación). Además, para el caso de las plantas no nativas se incorporaron variables relacionadas con la presión de propágulos (i.e. distancia a la ciudad y número de visitantes del PN). Para el tercer objetivo, se analizaron en detalle las listas de plantas vasculares de tres PN que consideramos icónicos por su gran biodiversidad, su antigüedad mayor a 40 años y su ubicación en regiones distintas: Nahuel Huapi en región Patagonia, Iguazú en región Noreste y Calilegua en región Noroeste (https://sib. gob.ar). Específicamente en estos tres PN evaluamos el número y porcentaje de plantas vasculares según: I) la familia botánica, II) el origen (nativa vs. no nativa) y grado de endemismo de Argentina, III) la forma de vida, IV) el estado de conservación según lo categorizado por la Unión Internacional para la Conservación de la Naturaleza (UICN) y V) la invasividad de las no nativas en otros lugares del mundo.
Area de estudio
El área de estudio de los objetivos I y II abarca los 36 PN terrestres de Argentina creados hasta el 2021 (Fig. 1, Tabla 1). Estas áreas protegidas difieren en numerosas características como ser año de creación, superficie, clima y accesibilidad. El área de estudio del objetivo III incluye los PN Calilegua (PNC), Iguazú (PNI) y Nahuel Huapi (PNNH). El origen del PNNH se remonta al año 1903 con la creación del Parque Nacional del Sur, pero, como tal, fue creado por la Ley N° 12.103 de 1934 que también creó al PNI. El PNNH se encuentra en las provincias de Río Negro y Neuquén cubriendo una superficie de 717.261 ha de las ecorregiones Estepa Patagónica y Bosques Patagónicos. El PNI se encuentra en la provincia de Misiones cubriendo una superficie de 67.698 ha de la ecorregión Selva Paranaense. Finalmente, El PNC fue creado en 1979, se encuentra en la provincia de Jujuy cubriendo una superficie de 76.306 ha de la ecorregión Yungas. Vale aclarar que el término “Parque Nacional” en sentido amplio, se refiere al conjunto territorial que agrupa o incluye diferentes categorías de conservación, según la Ley N° 22.351 y diferentes Decretos del Poder Ejecutivo Nacional. De hecho, tanto PNNH como el PNI, por Ley, cuentan con dos categorías de conservación diferentes, Parque Nacional (stricto sensu) y Reserva Nacional, mientras que el PNC fue creado con solo una categoría de conservación (PN strito sensu).
Obtención de datos
La información sobre los registros de plantas vasculares y de vertebrados tetrápodos (mamíferos, aves, reptiles y anfibios), así como la antigüedad (año de creación), la superficie, la latitud y el número de visitantes de cada PN se obtuvo a partir de las bases de datos disponibles en la plataforma del Sistema de Información de Biodiversidad de la Administración de Parques Nacionales, Argentina (https://sib.gob.ar/), descargados el día 22 de julio de 2022. En el proceso de revisión de estas listas se eliminaron los taxones duplicados, es decir, taxones identificados solo hasta género y cuyo género ya contara con especies en la base de datos; taxones que incluyeran los términos aff., cf. o cfr. y que ya estuvieran nombrados de forma completa en las listas; taxones identificados solo hasta especie y que tuvieran categorías infraespecíficas ya listadas como subespecie, variedad o forma. Luego de este procedimiento, el número de registros disminuyó entre 0 y 32% en las listas de vertebrados, y entre 0 y 19% en las listas de plantas vasculares. Por otra parte, el número de plantas vasculares (especies y taxones infraespecíficos) y de vertebrados (especies) para cada provincia fueron obtenidos a partir de Zuloaga et al. (2019) y Bauni et al. (2022), respectivamente.
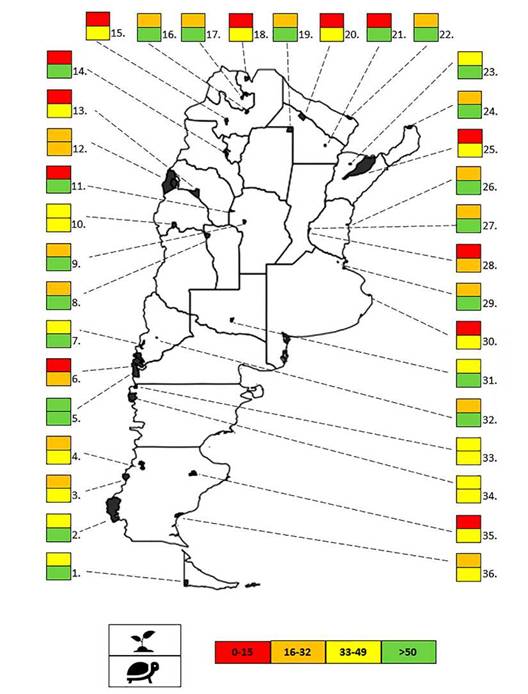
Fig. 1: Relación entre el número de plantas vasculares y animales vertebrados (anfibios, reptiles, aves, mamíferos) registrados en 36 Parques Nacionales (PN) de Argentina y el número total de taxones de plantas y vertebrados respectivamente registrados en la provincia a la cual pertenece cada PN (en el caso del PN Nahuel Huapi, se usó el promedio del número de taxones de Neuquén y Río Negro). La relación se ilustra según cuatro categorías de porcentajes (rojo=0-15%; naranja: 16-32%; amarillo: 33-49% y verde: >50%). La parte superior de cada rectángulo muestra el porcentaje de plantas y la parte inferior la de animales. Números: 1-36= PN de Argentina (según Tabla 1).
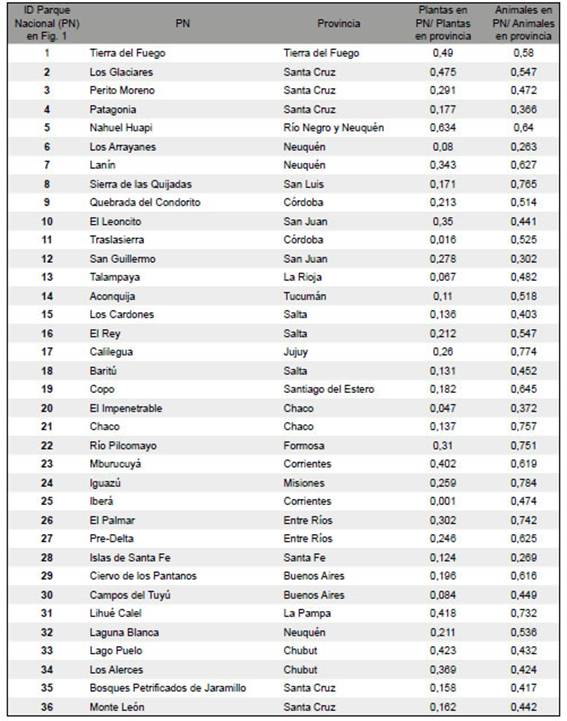
Tabla 1: Número de identificación de los PN de acuerdo a la Fig. 1, nombres de los PN, provincia/s donde se encuentra cada PN y proporción de plantas y animales de cada PN en relación a la provincia donde se sitúan.
Específicamente, para el PNC, PNI y PNNH, se realizó una revisión más exhaustiva de las listas de plantas vasculares. Para ello, se verificó la nomenclatura de las especies y sus respectivas familias siguiendo la base de datos online Flora Argentina (http://www.floraargentina.edu.ar/). Se eliminaron los registros con identificaciones dudosas o incompletas a nivel específico, los registros duplicados, los taxones excluidos de Flora Argentina, y las especies nativas cuya distribución no estuviera registrada en la región biogeográfica o provincia del PN analizado (e.g., si una especie crece exclusivamente en Misiones, se excluye de PNNH). Por otra parte, las especies fueron clasificadas según su origen en nativas y no nativas de Argentina. Se consideró nativa a aquellas especies cuyo rango de distribución natural comprende cualquier región de Argentina, mientras que se consideró no nativa a aquellas especies citadas como cosmopolitas, adventicias, introducidas, naturalizadas o exóticas para Argentina y cuyo rango de distribución natural no incluyera Argentina. Para ello se realizó un doble control en las bases de datos Flora Argentina y POWO (http://www.plantsoftheworldonline.org/). Además, usando dichas bases, clasificamos a las especies nativas según su distribución en endémicas y no endémicas de Argentina. Asimismo, se definió si las especies no nativas se registraron como invasoras en otras partes del mundo usando las bases de datos Invasive Species Compendium (https://www.cabi.org/isc) y POWO (https://powo.science. kew.org/). Las formas de vida de las especies fueron consultadas en Flora Argentina y reclasificadas en: árboles, árboles o arbustos, arborescentes (para el caso de helechos), arbustos, enredaderas, epífitas, hierbas acuáticas, hierbas anuales, hierbas perennes, palmeras. Además, se consultó las categorías de la Lista Roja de UICN (http://www.iucnredlist.org/) para las diferentes especies.
Análisis de datos
Para el objetivo I, se calculó la proporción de plantas vasculares y vertebrados registrados en cada PN respecto al número total de taxones, de plantas y vertebrados respectivamente, en la provincia a la cual pertenece cada uno de ellos (en el caso del PNNH, se usó el promedio del número de taxones de Neuquén y Río Negro). Consideramos que esta proporción es un indicador potencial de la cantidad de biodiversidad de la región conservada en estas áreas protegidas y a la vez representa una medida del estado de relevamiento/ estudio de especies en los PN. No obstante, es importante aclarar que esta proporción debe ser interpretada y usada con cautela y sólo en términos comparativos entre PN, ya que algunos PN pueden llegar a tener pocos ambientes representados de la provincia donde se encuentra y por lo tanto, tener de por sí un número menor de especies en relación a toda la provincia. Para el objetivo II, se evaluó el efecto de diferentes variables explicativas en el número total de registros de plantas o vertebrados en cada PN utilizando modelos lineales generalizados (GLM) con una distribución binomial negativa y función log-link. En estos modelos se consideró como variables explicativas la latitud, antigüedad y superficie de cada PN y número de taxones en cada provincia donde se sitúa cada PN. Dichos modelos también se usaron para evaluar el número de plantas no nativas registradas en cada PN, considerando además de las variables mencionadas anteriormente, el número de visitantes y la distancia a la ciudad más cercana (más de 25.000 habitantes). Para esta última variable se tomaron los datos del censo 2010 y se calculó la distancia lineal entre el punto medio del PN y de la ciudad con el programa QGIS. En todos los modelos, solo incluimos a las variables explicativas que tuvieran una correlación menor a 0,7 para así minimizar la colinealidad entre dichas variables (Dormann et al., 2013). Debido a la alta correlación positiva entre latitud y número de taxones en la provincia, se seleccionó a la segunda variable para realizar los GLM. Los PN Iberá y Traslasierra fueron excluidos en los modelos para analizar plantas ya que el número de plantas registradas es evidentemente incompleto, contando con solo 2 y 36 especies, respectivamente. Evaluamos la validez de los supuestos del modelo mediante análisis de los residuos. Los análisis se realizaron con los paquetes MASS (Venables & Ripley, 2002) y DHARMa (Hartig, 2022) del software R versión 4.1.3 (R Core Team, 2022).
Resultados
Registros de plantas vasculares y de vertebrados tetrápodos en los PN
El número de registros de plantas vasculares (especies y taxones infraespecíficos) en las listas revisadas del SIB de los 36 PN de Argentina varió entre 2 (en PN Iberá) y 1359 (en PN Mburucuyá) con una media de 458 registros, mientras que el número de registros de vertebrados tetrápodos varió entre 113 (en PN Los Arrayanes) y 670 (en PN Iguazú) con una media de 312 registros. En cuanto a los taxones no nativos en los PN de Argentina se registraron en promedio 50 plantas vasculares no nativas, con un mínimo de 0 (en PN Iberá y Traslasierra) y un máximo de 265 especies (en PN Nahuel Huapi). En promedio, el número de plantas no nativas representa el 10% del total de plantas registradas en cada PN, siendo los PN Campos del Tuyú (25%) y Lago Puelo (27%) los que registraron la mayor proporción de plantas no nativas. El promedio de registros de vertebrados no nativos entre todos los PN fue de ocho especies; el menor número de registros se observó en el PN Islas de Santa Fe con solo una especie y el mayor en el PN Nahuel Huapi (21 spp). En promedio, el número de vertebrados no nativos representa el 3% del total de vertebrados registrados en cada PN, siendo los PN Los Alerces, Tierra del Fuego, Nahuel Huapi y Lanín (7%) los que registraron la mayor proporción de vertebrados no nativos.
Encontramos que la proporción de los registros de plantas vasculares y vertebrados de los PN con respecto a los registros de cada provincia fue muy variable (Fig. 1, Tabla 1). La proporción para plantas vasculares varió entre 0,1% y 63% con una media de 24% mientras que para vertebrados varió entre 26% y 78% con una media de 54%. El PN Nahuel Huapi fue el único que mostró una proporción de plantas vasculares superior al 50%, mientras que la proporción de especies en los PN Iberá, Traslasierra, El Impenetrable, Talampaya, Los Arrayanes y Campos del Tuyú en relación a los registros de la provincia donde se encuentran estos PN fue menor al 10%. En cuanto a los vertebrados, 20 de los 36 PN tuvieron una proporción de especies registradas en relación a la provincia donde se encuentran de más del 50%. De estos últimos, los PN Iguazú,
Calilegua, Sierra de las Quijadas, Chaco, Río Pilcomayo, El Palmar y Lihué Calel contaron con una proporción superior al 70% mientras que los parques con menor proporción fueron los PN Los Arrayanes e Islas de Santa Fe con el 26% y 27%, respectivamente.
Variables explicativas del número de taxones registrados en los PN
La riqueza de plantas vasculares de la provincia donde se sitúa cada PN y la antigüedad del PN fueron las variables que se relacionaron de manera significativa y positiva con el número de plantas vasculares registradas en los PN (devianza del GLM 41%; Tabla 2, Fig. 2A). De la misma manera, la riqueza de vertebrados de la provincia donde se sitúa cada PN y la antigüedad del PN fueron las variables que explicaron de manera positiva y significativa el número de vertebrados registrados en los PN, aunque en este caso, la antigüedad del PN contribuyó en menor medida a explicar el número de vertebrados registrados en los PN (devianza del GLM 64%; Tabla 2, Fig. 2B). En ambos modelos, la superficie del PN no mostró una relación significativa con el número de plantas ni con el de vertebrados registrados.
Con respecto a las plantas no nativas registradas en los PN, la antigüedad del PN y la distancia a las ciudades fueron las variables que explicaron el número de plantas no nativas registradas en los PN (devianza del GLM 25%; Tabla 2, Fig. 3). La antigüedad del PN fue la variable que contribuyó en mayor medida y de manera positiva a explicar el número de plantas no nativas registradas en los PN, mientras que el efecto de la distancia a la ciudad fue negativo. La superficie del PN, la riqueza de plantas vasculares de la provincia y la cantidad de visitantes a los PN no influyeron significativamente en el número de plantas no nativas registradas en cada PN.
Plantas vasculares de los PN Calilegua, Iguazú y Nahuel Huapi
Luego del procedimiento de revisión exhaustiva de las bases de datos, las listas de plantas vasculares originales de los tres PN disminuyeron un 26%, 19% y 24%, para PNC, PNI y PNNH, respectivamente. El número y porcentaje de plantas vasculares registradas según el origen y endemismo, la familia botánica, la forma de vida, el estado de conservación categorizado por la UICN y la invasividad de las especies no nativas en otros lugares del mundo se sintetiza en la Tabla 3 (para información más detallada de cada PN, ver la base de datos revisada y curada disponible en datos primarios).

Tabla 2: Resumen de los modelos para el número de plantas vasculares, de animales vertebrados (anfibios, reptiles, aves, mamíferos) y de plantas vasculares no nativas registradas en los Parques Nacionales (PN) de Argentina, usando GLMs con una distribución binomial negativa una función log-link.
Del total de plantas registradas en los PNC y PNI menos de 10% fueron no nativas, mientras que en el PNNH la proporción de estas especies fue del 25%. Asteraceae y Poaceae son las familias con mayor número de especies nativas en PNC y PNNH, mientras que, en PNI se destacan Orchidaceae y Fabaceae. Poaceae es la familia con más registros de plantas no nativas común a los tres PN, mientras que el resto de las familias difiere entre los PN. Las hierbas perennes fueron las formas de vida predominantes en los tres PN. Solo el 16% de las plantas nativas registradas en estos tres PN se encuentra categorizada por la UICN, de las cuales 21 especies están incluidas en categorías amenazadas (4 en PNNH y PNI y 13 en PNC). Ninguna de las 65 endémicas de Argentina, registradas en los PNC y PNNH, ha sido evaluada por la UICN. Finalmente, encontramos que el 98,5% de las especies de plantas no nativas registradas en el PNNH y el 100% de estas especies en los PNI y PNC fueron registradas como invasoras en otras partes del mundo.
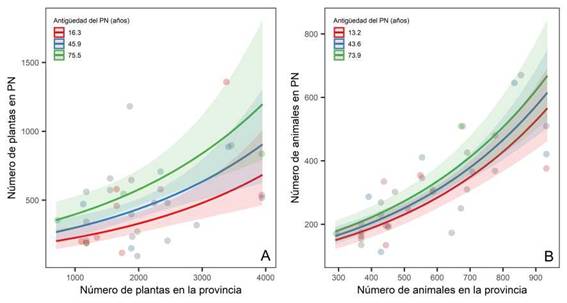
Fig. 2: Relación entre el número de taxones registrados en Parques Nacionales (PN) de Argentina, el número de taxones registrados en la provincia a la cual pertenece el PN y la antigüedad del PN. Las líneas sólidas representan el modelo binomial negativo ajustado y las áreas sombreadas representan los intervalos de confianza del 95%. A: Relación calculada para registros de plantas vasculares (incluye especies y taxones infraespecíficos). B: Relación calculada para registros de especies de animales vertebrados (anfibios, reptiles, aves, mamíferos).

Fig. 3: Relación entre el número de plantas vasculares no nativas (especies y taxones infraespecíficos) registradas en Parques Nacionales (PN) de Argentina, la antigüedad del PN y la distancia a la ciudad más cercana. Las líneas sólidas representan el modelo binomial negativo ajustado y las áreas sombreadas representan los intervalos de confianza del 95%.
Discusión
Registros de plantas vasculares y vertebrados tetrápodos en los PN
La Administración de Parques Nacionales de Argentina representa el sistema de mayor protección de áreas naturales en el país, con un estricto régimen de monitoreo para minimizar impactos antrópicos (Marinaro et al., 2012). Este sistema, conformado por 36 parques terrestres hasta el 2021, que fueron considerados en este estudio, protege alrededor del 1,5% del territorio nacional y constituye una importante estrategia para la conservación de la biodiversidad nativa y de los servicios ecosistémicos. El actual Sistema de Información de Biodiversidad (https://sib.gob.ar/) de los PN de Argentina representa un gran paso para la sistematización de la información generada en proyectos de investigación, informes y relevamientos realizados en cada PN. Sin embargo, al igual que lo reportado para áreas protegidas de otros países (e.g. Brasil, Trochez et al., 2017; Ecuador, Espinoza-Amén et al., 2021), nuestros resultados advierten que la información disponible para los PN estaría sub-representada para plantas vasculares, ya que casi la mitad (17) de los PN registra solo entre un 0,1 y 20% de las plantas reportadas para toda la provincia. En la página del SIB no encontramos una descripción de los criterios utilizados para la curación y actualización de datos, al igual que no está publicado el criterio que usan para establecer el origen nativo o no nativo de un taxón. Esto es un problema común a numerosas bases de datos (Richarson et al., 2000) lo que limita el uso potencial de estas listas para diferentes actividades de investigación, manejo y conservación. Esto es especialmente relevante dado el contexto actual, donde distintas áreas protegidas del mundo son cada vez más susceptibles a invasiones biológicas (Foxcroft et al., 2017; Liu, 2020).
En este trabajo observamos que, en la mayoría de los PN, las plantas tuvieron un mayor número de registros que los animales vertebrados. Este resultado coincide con el patrón general global de riqueza relativa de especies entre estos dos grupos, donde la cantidad de vertebrados terrestres es ampliamente inferior al de plantas vasculares (Jenkins et al., 2013; Christenhusz & Byng, 2016). Sin embargo, la proporción de plantas registradas en los PN con respecto a la riqueza de plantas de la región donde se ubica cada PN fue la mitad del porcentaje observado para animales vertebrados. En promedio, las plantas registradas en PN no llegan a un 25% de las especies registradas en la provincia donde se encuentran los PN mientras que los vertebrados registrados en los PN representan más del 50% de la riqueza de vertebrados registrada en la región. Este patrón se debería a que el número de vertebrados es menor al número de plantas, aunque también es posible que se relacione con un sesgo hacia un mayor número de estudios y especialistas interesados en grupos de vertebrados (e.g. Haene et al., 2001; Merino et al., 2009; Chatellenaz et al., 2010) o bien por registros de aficionados y ONG influenciados por el mayor carisma para el ser humano que poseen ciertos vertebrados, principalmente las aves y mamíferos de gran tamaño (Jaric et al., 2020).
En cuanto a los taxones no nativos registrados en los PN, encontramos que en general fue muy bajo, siendo solo el 10,1% del total de plantas registradas y el 2,9% del total de vertebrados registrados en los PN. El porcentaje de plantas vasculares no nativas registradas en los PN es similar al descrito a nivel nacional, ya que la riqueza de plantas introducidas en Argentina constituye el 9,6% del total de plantas registradas en el país (Zuloaga et al., 2019). Mientras que el porcentaje de vertebrados no nativos registrados en los PN es levemente mayor que el reportado a nivel nacional (1,7%, Bauni et al., 2022). Sin embargo, es posible que los taxones no nativos están sub-representados tanto dentro de los PN como a nivel nacional ya que, tanto en las listas SIB como en otras bases de datos, no se indican explícitamente los criterios utilizados para definir el origen nativo o no nativo de un taxón, lo cual puede influir en la clasificación y el registro de especies no nativas.
Variables explicativas del número de taxones registrados en los PN
El número de plantas vasculares y vertebrados registrados en los PN estuvo influenciado por la riqueza de taxones de la región donde se ubica el PN y por la antigüedad del PN, observándose un aumento de la cantidad de registros mientras más antiguo es el PN, probablemente debido a un esfuerzo de muestreo acumulado, y mientras mayor es la riqueza regional. Este resultado evidencia que los PN más recientemente creados están sub-muestreados. Por lo tanto, el año de creación del PN es una variable que no debe ser eludida al momento de usar o realizar inferencias a partir de las listas de plantas vasculares y vertebrados actualmente disponibles en el SIB.
Mientras que la importancia de la antigüedad del PN para explicar el número de plantas no nativas registradas en los PN fue inconsistente en otros PN (Spear et al., 2013), en nuestro caso esta fue la variable que explicó el número de plantas no nativas registradas en los PN de Argentina. Esto resultó evidente en los PN ubicados en una misma provincia y con una marcada diferencia en su antigüedad; por ejemplo, en la provincia del Chaco el PN El Impenetrable creado en el año 2014 y el PN Chaco creado en 1954 registraron tres y 46 plantas no nativas, respectivamente; otro ejemplo ocurre en Santa Cruz, donde el PN Patagonia creado en 2015 y el PN Los Glaciares creado en 1937 registraron tres y 74 plantas no nativas, respectivamente. No obstante, si bien nuestro modelo incluye variables que se usan típicamente en modelos para predecir la riqueza de taxones no nativos por su relación con la presión de propágulos, la interpretación de los alcances de nuestro modelo es limitada porque la variable de respuesta (i.e., número de plantas no nativas registradas) está sub-representada en las listas disponibles del SIB. En este sentido, es probable que dicho sesgo en los registros de plantas no nativas en los PN haya sido una de las causas por las cuales nuestros resultados difieren de Gantchoff et al. (2018), quienes encontraron que la temperatura y la riqueza de plantas nativas de los PN fueron las principales variables explicativas del número de plantas no nativas registradas en los PN. Teniendo en cuenta lo mencionado, queremos destacar que las inferencias que se realicen a partir de los datos disponibles actualmente en el SIB, del número de plantas no nativas registradas en los PN, deben ser realizadas con cautela pues dicho número carece de una estimación robusta.
Debemos mencionar que nuestra comparación entre la proporción de especies registradas en cada PN respecto a las registradas en cada provincia tiene dos limitaciones importantes. En primer lugar, el tipo de cobertura de un PN puede no coincidir con el tipo de cobertura o tipo de vegetación dominante en la provincia (por ej., PN Los Alerces está dominado por bosques mientras que el tipo de vegetación dominante en la provincia de Chubut es la estepa (Oyarzabal et al., 2018). En segundo lugar, es esperable que provincias que tengan una mayor heterogeneidad en la vegetación (por ej., selvas y bosques montanos, bosques de xerófitas y estepa como en la provincia de Tucumán) tengan un mayor número de especies registradas, y si el PN solo tiene uno de esos tipos de vegetación presentes en la provincia esperaríamos una menor proporción de especies registradas dentro del PN con respecto a la lista de la provinca. Futuros estudios podrían considerar la heterogeneidad de la vegetación en cada provincia y el grado de representatividad de cada tipo de vegetación dentro de cada PN y usar esta información como otra variable explicativa.
Plantas vasculares de los PN Calilegua, Iguazú y Nahuel Huapi
El análisis detallado de las listas de plantas vasculares registradas en estos tres PN icónicos evidenció que los registros requieren una mayor revisión, ya que un porcentaje considerable presenta identificaciones incompletas (es decir, identificados solo hasta género o que incluyen los términos aff., cf. o cfr., los cuales indican especie affinis o confróntese con). Además, es posible que la identificación de varias especies nativas sea errónea ya que su rango de distribución conocido está muy alejado del PN donde se la menciona. Por ejemplo, Schinus marchandii F.A. Barkley es una especie patagónica pero aparece registrada en PNI, Hieracium mandonii (Sch. Bip.) Arv.-Touv. crece solo en el noroeste argentino pero aparece en la lista del PNNH y Blechnum magellanicum (Desv.) Mett. es un helecho patagónico pero aparece en la lista del PNC.
En general, las familias botánicas registradas en PNNH son representativas de las familias más numerosas para esa región (según Zuloaga et al., 1999). Sin embargo, es evidente que las Poaceae están sub-representadas en las listas de los PNC y PNI, mientras que la familia Orchidaceae parece haber tenido un mejor muestreo en estos parques. Como se ha encontrado en otros trabajos, la gran mayoría de las especies de plantas nativas que crecen en los PN aún no ha sido categorizada por la UICN, lo cual resulta especialmente importante para aquellas que son endémicas de Argentina. Si bien existe una evaluación del estado de conservación de todas las plantas vasculares endémicas de Argentina (Salariato et al., 2021), esta clasificación no está publicada aún en UICN.
La proporción de plantas vasculares no nativas registradas en los tres PN fue muy variable, siendo alta (25%) en PNNH y muy baja en los PN localizados al norte de Argentina (3% en PNI y 5% en PNC) indicando que en estos últimos dos PN existiría un sub-muestreo de las especies no nativas de plantas vasculares. Aunque el PNNH haya mostrado una mayor proporción, consideramos que el registro de especies de plantas vasculares no nativas en este parque también está subestimado dado que Ezcurra & Brion (2005) reportaron incluso una especie no nativa más que la lista del SIB actualizada. De hecho, varias especies no nativas que han sido reportadas para diferentes PN no aparecen en las listas disponibles en el SIB. Tal es el caso de coniferas de los géneros Abies Mill., Cedrus Trew, Cupressus L. y otros árboles de géneros Eucalyptus L’Hér., Fraxinus L., Ulmus L. en el PNNH (Simberloff et al., 2002) y especies del género Pinus L. en el PNI (Gongalves et al., 2017).
Casi la totalidad (98% en PNNH) de las plantas no nativas registradas en los tres PN fueron reportadas como invasoras en otros lugares del mundo. En particular, Arundo donax L. (“caña común”, “caña de Castilla”) registrada en PNC y Ulex europaeus L. (“tojo”) en PNNH, se encuentran en la lista de las 100 especies no nativas invasoras más dañinas del mundo (Global Invasive Species Database, 2022). Durante las últimas décadas se han desarrollado numerosos esfuerzos para determinar las caracteristicas que le permiten a las especies no nativas transformarse en invasoras (Pysek & Richardson, 2008; Pysek et al., 2009; Moravcová et al, 2015). Si bien, no hay un síndrome exclusivo o una característica única que determine la invasividad de una especie (Pysek & Richardson, 2008), el hecho de que una especie no nativa ya esté registrada como invasora en algún lugar del mundo puede servir para alertar sobre su potencial de invasión en el nuevo sitio donde se registra (Rejmánek, 2000; Richardson & Thuiller, 2007). En otras palabras, el registro de una especie no nativa como invasora en algún sitio constituye una razón suficiente para no introducirla en una nueva área o para priorizar estrategias de control para limitar su expansión en el área donde está colonizando. Esto indica la importancia de monitorear en el espacio y tiempo a las especies no nativas ya que tienen el potencial de causar problemas para la biodiversidad si se convierten en invasoras, con los consecuentes problemas económicos debido a los altos costos que conllevan los daños y el control de especies invasoras, tal como la APN lo plantea en diferentes documentos (APN, 2007, 2018).
Conclusiones
A partir de lo observado en este trabajo, consideramos que es muy importante priorizar el relevamiento activo de especies vegetales y animales en todos los PN, particularmente de plantas vasculares en PN Iberá, Traslasierra, El Impenetrable y Talampaya, y de animales vertebrados en PN Los Arrayanes e Islas de Santa Fe. Una manera posible de lograr esto podría ser mediante la generación de convenios entre la ANP y las Universidades Nacionales y Provinciales y/o las Unidades Ejecutoras de CONICET para avanzar en la sistematización de relevamientos de especies en los PN. Como ejemplo de acciones de cooperación entre la APN y la academia podemos nombrar la reciente incorporación de la APN al Consejo Interinstitucional de Ciencia y Tecnología (CICYT) perteneciente al Ministerio de Ciencia, Tecnología e Innovación de la Nación (MINCyT) y la aprobación del Directorio de la APN para crear un Consejo Asesor Científico Tecnológico (CACiT) (Borsellino et al., 2022).
Por otro lado, sería muy importante que las bases de datos del SIB cuenten con revisiones y actualizaciones taxonómicas periódicas, lideradas por especialistas en diferentes grupos de organismos, para así obtener bases de datos más completas y de calidad. En esta linea, seria recomendable que tanto los criterios para la inclusión de registros en cada PN como para definir el origen de las especies (i.e. nativas y no nativas) sean explícitamente definidos y publicados en el SIB. Sería importante que toda la comunidad científica, que realiza relevamientos de diversidad en PN cumpla con el requisito de entregar a las delegaciones correspondientes los informes con la lista de especies junto con los articulos resultantes de los muestreos realizados en estas áreas protegidas para contribuir en la actualización de las listas de biodiversidad de los PN. Además, siguiendo el ejemplo de Borsellino et al. (2022), se podrian realizar encuestas a científicos que hayan estudiado la diversidad en PN del país y cuenten con listas de especies. De esa manera, se podría recopilar, estandarizar y visibilizar mejor todos los datos existentes para estas áreas protegidas. Por otro lado, mediante una revisión bibliográfica se podrían reclutar los trabajos publicados sobre especies presentes en los PN, para cotejar e incorporar registros que aún no hayan sido incluidos. Estas estrategias para mejorar la calidad de las bases de datos de los PN redundarían en un conocimiento más detallado sobre el número y la identidad de especies nativas y no nativas presentes en los PN y permitiría establecer prioridades de monitoreo y control de las especies no nativas potencialmente invasoras.
Contribución de los autores
RDF, R. Aguilar y MAG diseñaron la investigación. MVP, MLB y MAG realizaron la limpieza y curación de las bases de datos. MVP y MAG realizaron los análisis de datos. RDF, MVP, R. Aguilar, R. Aragón y MAG redactaron el primer borrador. Todos los autores contribuyeron en la interpretación de los datos y en la edición del manuscrito final.
Agradecimientos
Este trabajo tuvo el apoyo de FONCyT (PICT 2019-1897) a R. Aguilar. Los autores agradecen a los revisores anónimos que contribuyeron a mejorar el manuscrito.
Recibido: 15 Ago 2022
Aceptado: 17 Ene 2023
Publicado impreso: 31 Mar 2023












 uBio
uBio 

