Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.93 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2012
SECTOR CASOS CLÍNICO-PATOLÓGICOS
Enfermedad injerto vs hospedero postransfusional en un paciente con leucemia linfoblástica aguda
Graft vs host disease after transfusion in a patient with acute linfoblastic leukemia
TR Nijamin *, LJ Jaime **, JA Laffargue ***, G Cao ****, D Navacchia ***** y SA Grees ******
* Jefa de Residentes de Dermatología Pediátrica.
** Residente de 3° Año de Dermatología Pediátrica.
*** Médico de Planta.
**** División Patología.
***** Jefe de Anatomía Patológica.
****** Jefa de Unidad Académica y Asistencial de Dermatología Pediátrica. Directora de la Carrera de Especialistas en Dermatología Pediátrica. Facultad de Medicina. Universidad de Buenos Aires.
Hospital General de Niños Dr. Pedro de Elizalde. Av. Montes de Oca 40. Ciudad Autónoma de Buenos Aires.
E-mail: tamaranijamin@hotmail.com
RESUMEN
La enfermedad injerto vs hospedero (EICH) es un proceso inmunológico, desencadenado por linfocitos T de un donante inmunocompetente, que reaccionan contra los tejidos de un receptor inmunocomprometido. Esto origina daño multiorgánico severo en el agente receptor. Las manifestaciones cutáneas son un signo clínico relevante en períodos tempranos. La EICH postranfusional (EICH-PT) es una entidad poco frecuente y con alta tasa de mortalidad, que se observa en pacientes luego de transfusiones con hemoderivados no irradiados.
Los corticoides son el pilar fundamental del tratamiento, una vez instalado el cuadro. La prevención con leucorreducción e irradiación de los componentes sanguíneos, constituye el sustento primordial para evitar su desarrollo. Presentamos un paciente de 5 años de edad, con un diagnóstico de leucemia linfoblástica aguda de alto riesgo, de múltiples transfusiones de glóbulos rojos sin tratamiento radiante previo, a quien se le realiza el diagnóstico dermatológico e histopatológico de EICH aguda postransfusional.
PALABRAS CLAVE: Enfermedad injerto contra hospedero postransfusional; EICH; Transfusión de glóbulos rojos.
SUMMARY
Graft vs host disease (GVHD) is a process triggered by immune T cells, that react immunocompetent donor tissue against a recipient immunocompromised. This causes severe multiorgan damage in the receiving agent. Cutaneous manifestations are an important clinical sign in early periods. Postranfusional GVHD (GVHD-PT) is a rare entity with high mortality rate, observed in patients after transfusion with blood products not previously irradiated. Corticosteroids are the mainstay of treatment after installation of the box, however prevention with leukoreduction and irradiation of blood components remains the mainstay to prevent its development. We present a patient 5 years of age, diagnosed with acute lymphoblastic leukemia at high risk with a history of multiple transfusions of red blood cells without prior radiation treatment, who is performed dermatological and histopathological diagnosis posttransfusion acute GVHD.
KEY WORDS: Postransfusion graft versus host disease; GVHD; Red blood cells transfusion.
INTRODUCCIÓN
La EICH ocurre secundariamente, a la introducción de células T inmunocompetentes a un huésped inmunocomprometido. La causa más frecuente de esta entidad es el trasplante alogénico de médula ósea. La transfusión de glóbulos rojos (TGR) no irradiados y el transplante de órganos sólidos, son también causa de EICH agudo. Los órganos blanco principales son: la piel, el tracto gastrointestinal, el hígado y la médula ósea. La EICH postransfusional se presenta en el 0.002 al 0,005%, de los pacientes transfundidos y tiene una mortalidad del 80 al 90% alrededor de los veintiun días posteriores. El tratamiento se realiza con corticoides a altas dosis, siendo la mejor estrategia la prevención, utilizando transfusiones con glóbulos rojos irradiados.
CASO CLÍNICO
Paciente de 5 años de edad, en plan de trasplante de médula ósea por leucemia linfoblástica aguda tipo B de tres años de evolución, con alto riesgo por recaída medular. Realizó su última quimioterapia seis meses previos a la consulta dermatológica. Como antecedentes a destacar durante la evolución de su enfermedad, requirió múltiples transfusiones de plaquetas y glóbulos rojos, que no tuvieron tratamiento ionizante; la última de ellas, siete días previos al desarrollo de las lesiones cutáneas.
Al examen físico, se vislumbró la presencia de múltiples pápulas foliculares eritematovioláceas en: cabeza, tronco, extremidades superiores (Fig 1)y raíz de muslos, algunas ampollas destechadas en pabellones auriculares (Fig 2) y cuero cabelludo. Presentó inyección conjuntival y eritema en mucosa yugal.
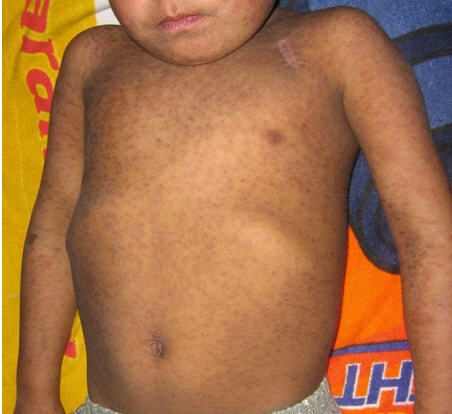
Fig 1: pápulas foliculares eritematovioláceas generalizadas.
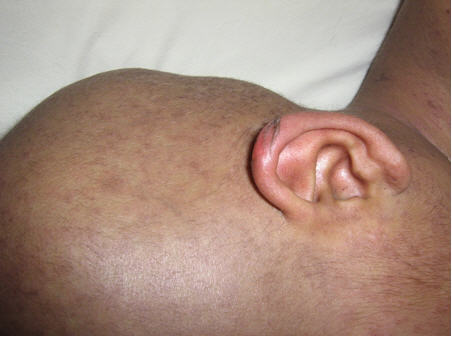
Fig 2: ampollas destechadas en pabellones auriculares.
Ante la sospecha de enfermedad de injerto vs hospedero, por transfusión de glóbulos rojos no irradiados, se realizó rutina de laboratorio completa, donde se constató aumento de transaminasas y biopsia de piel, notándose epidermis con extensa necrosis de queratinocitos, numerosos cuerpos apoptóticos en estrecho contacto con linfocitos intraepidérmicos (fenómeno de necrosis satélite) y vacuolización basal difusa. En dermis superficial se ven moderados infiltrados linfocitarios, epidermotropismo y escasos eritrocitos extravasados (Fig 3). Estos hallazgos histológicos corresponden al grado III de reacción injerto versus hospedero.

Fig 3: HE 400x: epidermis con queratinocitos necróticos, cuerpos apoptóticos rodeados de linfocitos intraepidérmicos (fenómeno de necrosis satélite); vacuolización de células de la capa basal; moderados linfocitos con epidermotropismo y melanófagos en la dermis superficial.
Se instauró un tratamiento con tres pulsos de metilprednisolona y luego continuó con corticoides por vía oral, como mantenimiento. El paciente presentó resolución gradual de las lesiones cutáneas, con máculas hipercrómicas e hipocrómicas residuales (Fig 4). Como complicación de la EICH-PT fallece a los 30 días por descompensación hemodinámica, motivada por un sangrado gastrointestinal agudo.
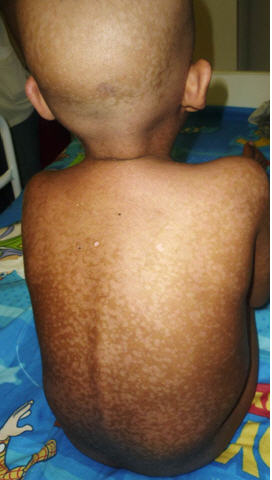
Fig 4: máculas hipercrómicas e hipocrómicas residuales.
DISCUSIÓN
La EICH es un cuadro que se desencadena, cuando se trasplanta un tejido con células T inmunocompetentes a un receptor inmunocomprometido y antigénicamente distinto al donante. Se presenta más frecuentemente en casos de trasplante autólogo o heterólogo de médula ósea1 y de progenitores hematopoyéticos2. Otras situaciones que predisponen al desarrollo de este cuadro es la TGR no irradiados, el trasplante de órganos sólidos y la transferencia pasiva de células inmunocompetentes maternas a fetos con inmunodeficiencias1.
La EICH-PT sucede por la presencia de linfocitos T presentes en hemoderivados. Estas células T incorporadas por el huésped, desencadenan una respuesta inmune celular y afectan principalmente piel, hígado, tracto gastrointestinal y médula ósea3. Nuestro paciente presentó en forma temprana, la aparición de pápulas queratósicas eritematovioláceas en polo cefálico, tronco y miembros superiores, que progresaron hacia raíz de miembros inferiores. Además se evidenciaron ampollas a nivel de pabellones auriculares y cuero cabelludo. La prevención es la única estrategia segura, para evitar este tipo de reacción4. Se debe tener presente que el paciente que recibe una transfusión, se expone a un trasplante alogénico de vida media corta. Los pacientes que se encuentren en plan de trasplante de médula ósea o que requieran transfusiones de glóbulos rojos o plaquetas, deben recibir glóbulos rojos (GR) desleucocitados para prevenir la inmunización con antígenos HLA. Esta irradiación previene tanto la aparición de EICH como el fracaso del trasplante medular5. La EICH-PT se estima que sucede en 0.002 al 0.005% de todas las transfusiones. Sin embargo, puede aumentar dependiendo del grupo de pacientes considerado, como en aquellos sometidos a trasplante de médula ósea en quienes asciende hasta el 1%4. LA EICH-PT tiene peor pronóstico que la postransplante, con una mortalidad del 80-90% alrededor de los veintiun días4 posteriores. El paciente presentado progresó al óbito en treinta días, posteriores al cuadro cutáneo por un sangrado intestinal agudo y descompensación hemodinámica. Además, el fracaso del trasplante medular es constante en los pacientes con EICH-PT, por lo que la mortalidad llega al 100%, representando la tercera causa de muerte asociada a transfusión, según consta en el registro de la SHOT (por sus siglas en inglés de "Serious hazards of transfusión")6 , ya que padecen aplasia medular y pancitopenia progresiva con un riesgo alto de sepsis y muerte4,7. El EICH-PT también sucede en pacientes inmunocompetentes por mecanismos no bien aclarados. Se observa con mayor frecuencia en aquellos, que son sometidos a tratamientos de bypass coronario u otros procedimientos cardiovasculares. Se cree, que la transfusión durante el procedimiento y la inmunosupresión transitoria posterior a la cirugía, podrían ser factores desencadenantes8. El inicio del cuadro clínico en esta forma, es más rápido que la asociada a progenitores hematopoyéticos. Entre los tres y treinta días postransfusión, aparece el compromiso cutáneo, junto con anorexia, náuseas, vómitos, diarrea e ictericia. El aspirado de médula ósea generalmente se observa hipoplásico.
Las manifestaciones cutáneas de la EICH aguda, se observan entre el 50 y el 80% de los pacientes trasplantados, siendo el prurito a predominio palmo plantar el primer síntoma cutáneo, seguido por la aparición de un exantema eritematoso o máculopapuloso de tronco, cuello, miembros superiores e inferiores, palmas y plantas. Un dato que orienta al diagnóstico de EICH aguda son las pápulas foliculares, ya que, son un marcador importante de severidad, como en este caso. Puede encontrarse a su vez compromiso de las mucosas con eritema, edema, erosiones y úlceras3. En este niño se observó inyección conjuntival marcada y queilitis. Si se controla la enfermedad, el prurito y el eritema desaparecen con descamación y manchas hiperpigmentadas residuales. Si progresa el cuadro clínico se puede observar eritrodermia y lesiones ampollares con signo de Nikolsky positivo3.
En cuanto a la clasificación histológica se describen cuatro grados, siendo los cambios en los linfocitos y en los queratinocitos los más significativos9. Es característico el hallazgo de linfocitos enclaustrados alrededor de queratinocitos disqueratóticos, fenómeno conocido como necrosis satélite junto con vacuolización basal difusa9,10. En formas más severas, se observa desprendimiento dermoepidérmico secundario a necrosis de queratinocitos9,12. En el grado I, se vislumbra una degeneración vacuolar basal. En el II, se agregan aislados queratinocitos necróticos. En el III, existen hendiduras supraepidérmicas y numerosos queratinocitos necróticos, fenómeno observado en nuestro paciente. El grado IV, es el más severo, con necrosis total de la epidermis y desprendimiento dermoepidérmico9.
La fisiopatogenia de la EICH aguda, se puede dividir en tres etapas o fases. La primera ocurre antes del trasplante, en donde las células del receptor dañadas por la enfermedad de base, los tratamientos previos al trasplante o las infecciones generan la activación del sistema inmune, con liberación de citoquinas y exposición de antígenos de superficie. En la fase dos, las células T del donante reconocen los antígenos sobreexpresados en el huésped y desencadenan una respuesta tipo TH1, con liberación de interferón gamma e IL2. En la fase tres, las células TH1 de la etapa anterior, promueven la activación de linfocitos T citotóxicos y Natural Killer que reaccionan contra las células del donante. Conociendo este mecanismo fisiopatogénico, se comprende que la terapéutica esté dirigida a disminuir la respuesta inmune de la etapa dos. Los corticoides, la ciclosporina, el tacrolimus, el micofenolato mofetil13 y el factor estimulante de colonias granulocíticas6, constituyen algunos de los tratamientos propuestos. La prevención, está dirigida a inactivar la capacidad proliferativa de los linfocitos T, en los hemoderivados por medio de la radiación ionizante.
CONCLUSIONES
La EICH postransfusional, se presenta en el 0.002 al 0,005% de los pacientes transfundidos y tiene una mortalidad del 80 al 90%. Las manifestaciones cutáneas son un signo clínico relevante en períodos tempranos. Si bien el tratamiento de elección es con corticoides a altas dosis, destacamos la importancia de la prevención, utilizando transfusiones con glóbulos rojos irradiados especialmente, en la población con riesgo aumentado de padecer EICH-PT6,7.
1. Noceti JN. Enfermedad injerto contra huésped. En: Larralde M, Abad E y Luna P. Dermatología Pediátrica. Ed Journal 2010; 463-465. [ Links ]
2. Ortega CM, O'Brien A, Berríos CG, Álvarez M y Salazar I. Enfermedad injerto vs huésped: manifestación enterocolítica y diagnóstico diferencial. Rev Chil Radiol 2005; 1 (3): 134-137. [ Links ]
3. Cardoza Torres MA. Enfermedad injerto contra huésped y sus manifestaciones cutáneas. Med Cutan Iber Lat Am 2011; 39 (3): 95-105. [ Links ]
4. Wegner A, Pacheco S, Céspedes P, Guevara R, Mallea L, Darras E y Yañes L. Enfermedad injerto vs huésped asociada a transfusión. Rev Chil Pediatr 2007; 78 (5): 500-510. [ Links ]
5. Larrondo M y Figueroa G. Terapia transfusional: criterios de indicaciones de componentes sanguíneos. Rev Hosp Clin Chile 2007; 208-219. [ Links ]
6. Lozano MM. Complicaciones no infecciosas graves de la transfusión. Med Clin (Barc) 2002; 119 (14): 550-554. [ Links ]
7. Sun X, Yu H, Xu H, Zhang W, Lai R, Xie L, Zhu X y Yang Y. Transfusion associated graft-vs-host disease: case report and review of literature. Transfusion and Apheresis Science 2010; 43: 331-334. [ Links ]
8. Patel KK, Patel AK, Ranjan RR y Shah AP. Transfussion associated graft versus host disease following whole blood transfusion from an unrelated donor in a inmunocompetent patient. Indian J Hematol Blood Transfuse 2010; 26 (3): 92-95. [ Links ]
9. Stringa MF. Enfermedad de injerto contra huésped cutánea en el transplante alogénico de médula ósea. Dermatol Argent 2010; 16 (4): 552-261. [ Links ]
10. Aractingi S y Chosidow O. Cutaneous graft-versus-host disease. Arch Dermatol 1998; 134: 602-612. [ Links ]
11. Cendales LC, Kanitakis J, Schneeberger S, Burns C, Ruiz P, Landin L, Remmelink M, Hewitt CW, Landgren T, Lyons B, Drachenberg CB, Solez K, Kirk AD, Kleiner DE y Racusen L. The Banff 2007 Working Classification of Skin-Containing Composite Tissue Allograft Pathology. Am J Transpl 2008; 8:1396-1400. [ Links ]
12. Iwasaki T. Recent advances in the treatment of graft versus host disease. CM & R 2004; 2: 243-252. [ Links ]














