Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.94 no.3 Ciudad Autónoma de Buenos Aires set. 2013
SECTOR CASOS CLÍNICO-PATOLÓGICOS
Síndrome Dress. Presentación de un caso y actualización
Dress syndrome. A case report and a review
L Ramos *
* Médica Adscripta
Hospital "San Martín". Presidente Perón 450. Paraná (3100) Entre Ríos. Argentina.
E-mail: loreleyramos@hotmail.com
RESUMEN
El síndrome de sensibilidad a drogas con eosinofília y síntomas sistémicos, (DRESS) es una reacción grave de hipersensibilidad a drogas, caracterizada por: exantema, fiebre, adenopatías, afectación de órganos internos y alteraciones hematológicas.
Se presenta el caso de un hombre de 30 años con antecedentes de episodios convulsivos, quien estaba medicado con carbamazepina, presentó un cuadro de siete días de evolución, con exantema máculo-papular confluente que se generalizó, hasta comprometer casi toda la superficie corporal, acompañado de conjuntivitis, fiebre, cefalea y poliadenopatías. Los parámetros clínicos demostraron leucocitosis con células atípicas y alteraciones de las pruebas de función hepática. La biopsia de piel fue compatible con reacción medicamentosa, que confirmó el diagnóstico de síndrome DRESS, suspendiéndose el fármaco desencadenante, presentando franca mejoría clínica y de laboratorio, luego de la administración de corticoides.
Se describe su patogenia, criterios diagnósticos, características clínicas y terapéutica existente en la actualidad.
PALABRAS CLAVE: Síndrome DRESS; Síndrome de hipersensibilidad a drogas; Eosinofilia.
SUMMARY
DRESS syndrome is a severe hypersensitivity reaction to drugs, characterized by: rash, fever, lymphadenopathy, involvement of internal organs and blood disorders.
In this work we present the case of a 30 years old man, with a history of seizures that had been receiving carbamazepine and presented during seven days confluent maculo-papular exanthema that spread to almost the entire body, accompanied by conjunctivitis, fever headache, and lymphadenopathy, these clinical parameters showed leucocytosis with atypical cells and alterations in liver function tests. The skin biopsy was consistent with the drug reaction that confirmed the diagnosis of DRESS syndrome. When the drug treatment was interrupted, the patient presented clinical and laboratory improvements, after corticosteroid administration.
We describe the pathogenesis, diagnostic criteria, clinical features and therapeutics available today.
KEY WORDS: DRESS syndrome; Drug hypersensitivity; Eosinophilia.
INTRODUCCIÓN
Las reacciones adversas cutáneas medicamentosas afectan el 2,2 % de los pacientes hospitalizados, que reciben algún tipo de tratamiento sistémico. Su incidencia real es difícil de precisar, ya que, para aseverar que un fármaco es responsable de determinada reacción, se debe cumplir una serie de criterios en base a variables a comprobar.
De los fármacos, los que más frecuentemente se vinculan a farmacodermias son: antibióticos, antiinflamatorios no esteroideos (AINES), anticonvulsivantes y el alopurinol.
Las farmacodermias generan en la piel cuadros muy diversos, que en ocasiones imitan entidades dermatológicas y provocan confusión con ellas.
El síndrome de DRESS, también llamado anteriormente síndrome de hipersensibilidad a la difenil-hidantoína y luego a los anticonvulsivantes, por ser éstos los que con más frecuencia lo producen, es una entidad rara y severa caracterizada por lesiones cutáneas, fiebre, linfadenopatía y compromiso sistémico, que se presenta entre dos a seis semanas luego de la administración del antiepiléptico o la droga culpable.
El objetivo de este trabajo es realizar una búsqueda bibliográfica, que permita actualizar los conocimientos sobre esta entidad, en cuanto a su fisiopatología, clínica, criterios diagnósticos, dificultades diagnósticas y tratamientos disponibles en la actualidad.
Se presenta al caso de un hombre de 30 años, en tratamiento con carbamazepina por episodios de convulsiones, que consultó por un cuadro de siete días de evolución, caracterizado por un exantema máculo-papular confluente, con buena respuesta al tratamiento instaurado.
CASO CLÍNICO
Paciente masculino de 30 años, oriundo de la ciudad de Paraná, ex etilista, ex tabaquista, en rehabilitación por adicción a drogas, con antecedentes de dos episodios convulsivos, tratado con carbamazepina. Sin antecedentes familiares de importancia.
Consulta por un cuadro de siete días de evolución, caracterizado por exantema máculo-papular confluente (morbiliforme), pruriginoso, que compromete cara, miembros superiores y rápidamente se extiende en sentido céfalo-caudal, hasta tomar toda la superficie corporal (eritrodermia). Acompañado de edema facial, conjuntivitis, cefalea, fiebre y poliadenopatías; tres días después se agrega descamación generalizada.
Al ingreso se realizan los siguientes estudios complementarios:
• Laboratorio al ingreso: GB:17300 (0/23/0/0/74/2 mm, de linfocitos con características atípicas, GR: 5040000, Hto: 43%, Hb: 15 g%, VCM: 85,32 fl, HCM: 29,76 pg, CHCM: 34,88 g %, plaquetas: 123000 / mm, eritrosedimentación: 2 mm, glucosa: 118 mg/ dl, urea: 23 mg/dl, creatinina: 0,70 mg/dl, Na: 121 meq/ l, K: 3 meq /l, CPK : 70 mu/ ml, LDH 776 U/l,TGP: 559 U/l, TGO 174 U/l, FA: 421 UI/L, bilirrubina total: 4 mg/dl, bilirrubina directa: 3,38 mg/dl, bilirrubina indirecta: 0,52 mg/dl, albumina: 3,46 g/dl, GGT 1597 UI/l, 5 nucleotidasa: 23 UI/l, pseudocolinesterasa: 5202 UI/l, ASTO 161 UI/ml, orina: s/p.
• Hemocultivos: negativos
• Serología para HIV, Hepatitis B, C, VDRL, CMV, Sarampión, Paul- Burell: no reactivas.
• Rx de tórax: normal.
• Ecografía de abdomen: hepatomegalia moderada, esplenomegalia.
• Histopatología: Protocolo 6590 (Dra. Risso): infiltrado linfohistiocitario perivascular superficial.
Frente a la clínica, exámenes complementarios y la biopsia se interpreta el cuadro como síndrome DRESS; se comienza con un manejo multidisciplinario entre Clínica Médica, Psiquiatría y Dermatología. Se decide suspender la carbamazepina, reemplazándose la misma por clonazepam, ya que, el paciente presentaba síntomas de síndrome de abstinencia, por lo que debía ser tratado con psicofármacos, para contrarrestar los mismos. Además se comienza con el manejo de su medio interno y tratamiento local con emolientes.
En el transcurso de su internación el paciente continúa elevando los valores de transaminasas, con empeoramiento de su cuadro sistémico, por lo que se decide comenzar con prednisona a 1mg/kg/d, presentando franca mejoría luego de 48 horas de la administración de los corticoides.
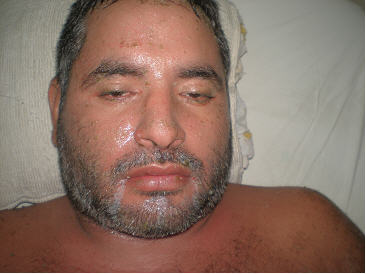
Fig 1: edema facial, con eritema y descamación.

Fig 2: exantema máculo papular confluente generalizado (morbiliforme).
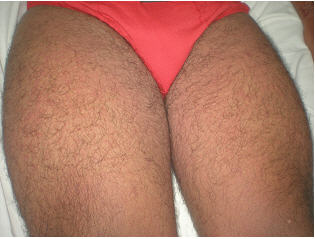
Fig 3: exantema que compromete miembros inferiores.
HISTORIA
Las primeras descripciones de reacciones sistémicas a las sulfonamidas y a los anticonvulsivantes (fenitoína), datan de 1930 y fueron publicadas con diferentes denominaciones tales como: fiebre medicamentosa, síndrome mononucleoide, pseudolinfoma inducido por drogas, síndrome pseudo-Sézary. En 1988, Shear y col definieron el síndrome de hipersensibilidad a los anticonvulsivantes.
En 1996, Bocquet y col propusieron el acrónimo DRESS (Drug Rash with Eosinophilia and Systemic Symtoms) y establecieron los criterios diagnósticos, debiendo estar presentes tres de ellos para llegar al diagnóstico.
Criterios diagnósticos:
1. Erupción cutánea.
2. Anormalidades hematológicas: eosinofilia, linfocitosis atípica.
3. Compromiso sistémico: adenopatías mayores de 2 cm de diámetro o hepatitis (transaminasas mayores dos veces su valor normal), nefritis intersticial, neumonitis intersticial, carditis.
El Registro Europeo de Reacciones Adversas cutáneas severas, amplió los criterios para el diagnóstico: los tres primeros son rash agudo, la sospecha que se debe a drogas y la necesidad de internación. Para confirmar el diagnóstico se deberán cumplir tres de los cuatro criterios siguientes:
1- fiebre de 38º C o más;
2- linfadenopatía de dos o más sítios anatómicos;
3-afectación de al menos un órgano interno y
4- alteraciones hematológicas, que incluyen linfocitos por arriba o por debajo de las cifras normales, eosinofilia o plaquetas menores a lo normal.
El Comité de Estudio e Investigación Japonés de las Reacciones Adversas a Drogas, enfatiza en la importancia de la reactivación del herpes vírus 6, sugiere siete criterios:
1- erupción morbiliforme luego de 21 días de iniciada la droga culpable,
2- síntomas que se prolongan luego de haber suspendido la misma,
3- fiebre de 38º C o más,
4-anormalidades hepáticas u otros órganos afectados,
5- alteraciones leucocitarias o eosinofilia,
6- adenopatías y
7- reactivación del VH-6;
si están los siete diagnostican DRESS si solo llegan a cinco DRESS atípico.
En 1998, Sontheimer y col proponen otra denominación: Drug Induced Deleyed Multiorgan Hypersensitivity Syndrome (DIDMOHS), aunque no ha tenido la difusión ni la aceptación del acrónimo acuñado por Bocquet. Además, dicha denominación no incluye la eosinofilia o linfocitosis atípica, que son útiles para reconocer el síndrome y cruciales para la inducción de lesiones en piel y otros órganos, motivo por el que el acrónimo DRESS, sería el más apropiado para describir este patrón de reacción de hipersensibilidad.
EPIDEMIOLOGÍA
Las reacciones adversas cutáneas medicamentosas, afectan aproximadamente del 2 al 3 % de los pacientes hospitalizados, que reciben algún tratamiento sistémico. Se estima que uno de cada 1.000 a 10.000 nuevos usuarios de medicamentos, se ven afectados.5 En nuestro país no existen estadísticas en cuanto a su verdadera incidencia; a nivel de la población general, se estima que el riesgo de padecer DRESS varía entre 1:1.000 a 1:10.000, exposiciones a drogas.
Se cree que las formas graves son más frecuentes en las mujeres y en la raza negra5, probablemente por mutaciones específicas en los genes que detoxifican drogas, en estos grupos étnicos. Los pacientes pediátricos tienen mayor riesgo de desarrollarlo, debido a la mayor incidencia de convulsiones en la primera década de la vida, al igual que los acetiladores lentos y los pacientes con hipersensibilidad in vitro a metabolitos de hidroxilamina, los que son más susceptibles a desarrollar DRESS inducido por sulfonamidas.6
También presentan un riesgo aumentado a desarrollar DRESS los pacientes alcohólicos, los usuarios de medicación hepatotóxica concomitante, embarazadas y puérperas.
Los pacientes con antecedentes personales o familiares de DRESS, así como la presencia de inmunodeficiencias primarias o adquiridas y las neoplasias, constituyen los factores de riesgo más frecuentes para desarrollar este tipo de farmacodermias.
Se estima una mortalidad del 10 al 30 %, siendo la falla hepática (hepatitis fulminante) la causa más frecuente de muerte.
Los fármacos que con mayor frecuencia se vinculan a farmacodermias son: los antibióticos (41 %), principalmente derivados penicilínicos y sulfonamidas, los antiinflamatorios no esteroides (11%) y los anticonvulsivantes (10 %).
ETIOPATOGENIA
El síndrome de DRESS es una reacción adversa a medicamentos grave e idiosincrática, que no muestra relación con la dosis. La patogenia no se conoce con exactitud, aunque se cree que intervienen factores inmunológicos, metabólicos e inflamatorios tanto constitucionales como adquiridos.
Se han planteado varios mecanismos de acción:
1. Reacción de hipersensibilidad alérgica, en la que los medicamentos actuarían directamente como antígenos o indirectamente como haptenos, desencadenando la producción de anticuerpos.5 Esta respuesta de hipersensibilidad retardada mediada por linfocitos, produciría en un primer momento la activación de CD4+ y CD8+ por las células presentadoras de antígenos, que previamente estuvieron en contacto con el fármaco, luego se produciría la liberación de citoquinas como IL4 e IL5 con la consiguiente inflamación de la piel.
2. Ausencia o deficiencia de la enzima epóxido hidrolasa, necesaria para detoxificar los óxidos arenes, metabolitos de la fenitoína, que son altamente reactivos y potencialmente citotóxicos.5 El sistema de la citocromo p450, es el encargado de metabolizar los anticonvulsivantes en metabolitos tóxicos y la enzima epóxido hidrolasa, la encargada de la detoxificación de ellos. Individuos genéticamente susceptibles pueden tener una menor actividad de esta enzima. Esta susceptibilidad podría estar mediada por el complejo de histocompatibilidad (MCH), como se informa en un estudio de pacientes chinos, donde todos los casos de hipersensibilidad a carbamazepina compartirían el marcador genético HLA-B 1502. Por la deficiencia enzimática se acumularían intermediarios reactivos, que actuarían como neo-antígenos e iniciarían la reacción inmune sobre los órganos, que producen las enzimas de la CYP 450 como la piel, hígado, estómago, intestino y pulmones.10 Los eosinófilos serían culpables del daño cutáneo y de órganos internos debido a sus granulaciones tóxicas3. Las infecciones jugarían un papel en la patogenia, tal como es el caso de la asociación de este síndrome con el virus herpes humano tipo 6 11,12, el que se reactivaría y podría interferir con las enzimas responsables de la detoxificación, perpetuando la clínica o siendo responsable de las recurrencias sin re-exposición al fármaco. También la infección por el VIH, VEB y CMV, herpes 4 y 7, podían ser posibles factores predisponentes para el mismo.10,3,13
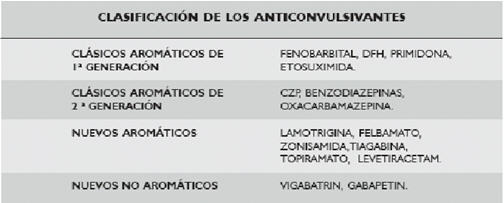
Los fármacos implicados con mayor frecuencia son: los anticonvulsivantes aromáticos (Cuadro I) como la carbamazepina, fenobarbital, fenitoína, primidona y lamotrigina, aunque también esta descrito por anticonvulsivantes no aromáticos como el ácido valproico. Además puede ser causado por sulfonamidas (dapsona, sulfasalazina, etc), betabloqueantes, inhibidores de la enzima convertidora de angiotensina (IECA), alopurinol, antirretrovirales (nevirapina, zalcitabine y abacabir), minociclina, antiinflamatorios no esteroides (AINES) y fármacos antituberculosos10. Se han comunicado casos secundarios a efalizumab, imatimib, amlodipina, antidepresivos como bupriopion y fluoxetina, entre otras drogas. En el reciente "75 Summer Meeting de la Academia Americana de Dermatología", se comunicó un caso de DRESS con muerte del paciente, a los dos meses de iniciado el mismo por arritmia severa; la droga causante fue la minociclina.
CUADRO I: CLASIFICACIÓN DE LOS ANTICONVULSIVANTES
CLÍNICA
Las manifestaciones clínicas se producen de dos a ocho semanas, luego del inicio de la droga o dentro de las primeras horas, si existe sensibilización previa. El primer signo en aparecer es la fiebre, los pacientes pueden tener síntomas inespecíficos como un cuadro pseudo-gripal, malestar general y faringitis. De 24 a 48 horas de la fiebre, aparece el exantema máculo-papular morbiliforme localizado en cara y parte superior del tronco, se extiende caudalmente, se va tornando más indurado e infiltrado y aparece el edema dérmico, sobre todo a nivel facial y peri-orbitario (importante signo clínico para el diagnóstico), también en manos y pies.10,6 Este último es variable, desde una acentuación de los orificios foliculares hasta la formación de ampollas, que pueden confundir el cuadro con el complejo SSJ/NET. En ocasiones hay pústulas foliculares, lesiones en diana atípicas, púrpura, eritrodermia (50 % de los casos) y descamación.6 La afectación de las mucosas es poco frecuente, pudiendo manifestarse como conjuntivitis, queilitis, erosiones de la cavidad bucal y genital. El edema facial puede desfigurar al paciente.
Entre las manifestaciones extracutáneas, los pacientes presentan adenopatías bilaterales y simétricas, mayores de 2 cm de diámetro y también hepato-esplenomegalia.
En cuanto a las hematológicas se destacan la anemia, linfocitosis, que puede presentar linfocitos atípicos y eosinofilia (70 % de los casos); estas dos últimas son las más frecuentes.10 También puede presentar agranulocitosis, anemia aplásica o hemolítica y /o trombocitopenia e hipoalbuminemia.
En relación a la afectación de órganos internos, el más frecuentemente afectado es el hígado en un 64 % de los casos (aunque algunos trabajos señalan hasta un 95% de los afectados con síntomas-signos hepáticos), que pueden presentar desde una leve elevación de las transaminasas asintomática, hasta una hepatitis tóxica aguda o colestática, pudiendo evolucionar a la necrosis total. La elevación de las transaminasas puede alcanzar de 10 a 20 veces su valor normal, también la GGT y la fosfatasa alcalina estarán elevadas en el 50 a 60 % de los casos. En estos casos graves solo el trasplante es útil para salvar la vida del paciente. Los valores de transaminasas pueden tardar en volver a la normalidad varios meses, si coexiste una infección hepática viral, el pronóstico es malo, al igual que en pacientes añosos, inmunosuprimidos o que ya recibían drogas hepato-tóxicas; la difenil-hidantoína, minociclina y dapsona están frecuentemente implicadas.
La afectación pulmonar es poco frecuente, se caracteriza por disnea, tos seca, broncoespasmo, hipoxemia, infiltrados pulmonares bilaterales.6 También se han descrito casos de neumonitis, bronquiolitis obliterante y neumonía, la minociclina es la droga más frecuente como causante; en ocasiones el distrés respiratorio es grave obligando a la respiración mecánica.
Otra afectación posible es la del riñón, alrededor de un 11%, siendo el alopurinol, carbamazepina y dapsona en ese orden, las drogas causantes más comunes, manifestándose con nefropatía túbulo-intersticial asociada a elevación de la creatinina, hematuria microscópica, proteinuria e incluso insuficiencia renal aguda.10 La ecografía suele ser normal, un 14% de los pacientes necesitan diálisis transitoria, especialmente con nefritis intersticial severa.
En cuanto a la afectación cardíaca, la misma puede manifestarse como carditis y pericarditis. La miocarditis se presenta en ocasiones, semanas o meses luego del episodio de DRESS; el paciente manifiesta dolor torácico, disnea, taquicardia e hipotensión con cardiomegalia, derrame pleural y arritmias; en ocasiones aparece varias semanas o meses luego de suspender la droga. Se han descrito dos formas de miocarditis: por hipersensibilidad y necrotizante eosinofílica aguda, esta última se acompaña de un 50% de mortalidad.
Otras manifestaciones inespecíficas son: artritis, miositis, pancreatitis, meningoencefalitis, alteraciones tiroideas (hipotiroidismo, tiroiditis), síndrome de secreción inapropiada de hormona antidiurética, orquitis y parotiditis.10
HISTOPATOLOGÍA
La anatomía patológica del síndrome DRESS suele ser inespecífica, mostrando a nivel epidérmico necrosis de queratinocitos y a nivel dérmico, edema y un infiltrado inflamatorio linfocitario superficial de tipo eccematoso o liquenoide y eosinófilos. Puede haber epidermotropismo con linfocitos atípicos, simulando un linfoma cutáneo de células T (pseudo-linfoma).6,14
Los ganglios linfáticos pueden mostrar dos patrones histológicos definidos:
a) Hiperplasia linfoide benigna.
b) Aspecto de pseudo-linfoma con presencia de células atípicas, plasmocitos, histiocitos y eosinófilos, con áreas de necrosis, edema y mitosis pero sin células Reed-Sternberg o invasión capsular. Este último patrón puede simular un linfoma maligno.
A nivel hepático suele haber un infiltrado eosinófilo o granulomas, lo que se acompaña de necrosis de hepatocitos y colestasis.3
DIAGNÓSTICO
El diagnóstico del síndrome DRESS se realiza con la clínica, el antecedente de ingesta a ciertas drogas, exámenes complementarios e histopatología, aunque esta última puede confundir con otros cuadros y retardar el diagnóstico - tratamiento sistémico precoz.
Las pruebas complementarias obligatorias ante una sospecha de síndrome DRESS incluyen: hemograma, perfil hepático y renal, orina completa, radiografía de tórax, cultivos y serologías necesarios para descartar otros cuadros infecciosos.10
Se han propuesto criterios diagnósticos basados en la clínica cutánea, las alteraciones hematológicas y la afectación sistémica. Estos criterios aunque no han sido consensuados, pueden ser útiles para identificar el síndrome.
A continuación se exponen los mismos, siendo necesario cumplir al menos tres de ellos para establecer el diagnóstico:

Algunos autores consideran la fiebre como cuarto criterio diagnóstico.15,10 Lo que si se sabe es que la misma, constituye un síntoma importante y el primero en aparecer en la mayoría de los casos.
Uno de los principales problemas que plantea este síndrome es el de realizar un diagnóstico precoz, ya que, la suspensión inmediata del fármaco es la principal medida terapéutica para evitar la progresión del daño orgánico, pero también es necesario realizar un buen diagnóstico diferencial, con múltiples procesos que pueden ocasionar una clínica similar.
DIAGNÓSTICOS DIFERENCIALES
En el diagnóstico diferencial del síndrome DRESS, es importante excluir numerosos procesos infecciosos con características clínicas similares, tales como: hepatitis víricas, CMV, virus Epstein-Barr, toxina de estreptococo β hemolítico, parvovirus B19, VHH6 y primoinfección del VIH. También debe ser descartado el lupus eritematoso inducido por drogas, el síndrome hipereosinofílico, la enfermedad de Kawasaki, la enfermedad de Still y el síndrome de shock tóxico. Dichas entidades presentan características clínicas similares, como la afectación de piel y órganos internos; en este caso resulta imprescindible realizar exhaustivos análisis complementarios, para su diagnóstico diferencial con el síndrome DRESS.16
Los linfomas cutáneos y los pseudo-linfomas medicamentosos, también plantean diagnóstico diferencial, ya que pueden producir placas, nódulos, eritrodermias, adenopatías y alteraciones sistémicas 17. Algunos autores consideran (ya aceptado por los onco-hematólogos) que la linfoadenopatía angioinmunoblástica, que es un subtipo de linfoma T periférico, tiene una clínica similar al síndrome DRESS, siendo necesaria la biopsia ganglionar para diferenciar ambas entidades.6
En ocasiones, las manifestaciones cutáneas pueden simular otras farmacodermias graves, como el complejo síndrome Stevens Johnson / Necrolisis Epidérmica Tóxica y la pustulosis exantemática generalizada aguda (PEGA). El síndrome de Stevens Johnson y la necrosis epidérmica tóxica cursan con vesículas y desprendimiento de la piel, lo que no es frecuente de ver en el DRESS, no hay eosinofilia y /o linfocitos atípicos en sangre periférica, siendo más frecuente en estas entidades la leucopenia y la linfopenia. En el PEGA las pústulas predominan en los pliegues cutáneos, no siendo así en el DRESS, donde las mismas son más frecuentes en otras localizaciones.10
TRATAMIENTO
El pilar fundamental en el tratamiento del síndrome DRESS es la suspensión del fármaco que desencadenó al mismo, junto con un buen manejo de su medio interno (balance hidroelectrolítico), vigilancia estricta de las funciones hepáticas y hematológicas; además evitar la reactividad cruzada, en caso de ser necesario adicionar otra droga, para reemplazar el tratamiento suspendido.
La mayoría de la bibliografía consultada, coincide en que para el manejo de las lesiones cutáneas, están indicados los corticoides tópicos de mediana potencia y los emolientes.10
El uso de corticoides sistémicos es controvertido, si bien en los últimos años se ha difundido su uso como droga de primera línea y se han informado mejorías muy satisfactorias, luego de su utilización.
El efecto beneficioso de los corticoides, se debería a que los mismos producirían la inhibición de la IL5, en el proceso de acumulación de eosinófilos.6 También las dosis a utilizar son diferentes según los autores, algunos recomiendan dosis de 0,5 a 1mg/kg/día, indicando descenso luego de cuatro semanas, con franca mejoría de los parámetros clínicos en 48 hs10, otros prednisona de 1-2 mg/kg/día y en casos graves, utilizan pulsos de metilprednisolona de 1g /día por tres días, lo que ayuda a detener la progresión de los síntomas.5
Es importante destacar que la supresión prematura del tratamiento con corticoides, puede exacerbar las lesiones dermatológicas y la hepatitis 18. Su uso dependerá de la evolución y deben ser usados no menos de tres a seis meses, disminuyendo la dosis lentamente.
Los detractores del uso de glucocorticoides, postulan que su empleo en otras toxidermias graves como el complejo SSJ/NET, aumentan la mortalidad. Sin embargo, parece que este aumento de mortalidad es secundario a complicaciones sépticas, en pacientes con grandes áreas de epidermis denudada. Sí se sabe, que el uso de corticoide podría reactivar infecciones virales latentes, como el VHH6, lo que podría aumentar el daño tisular y prolongarse la duración del cuadro.6
Como segunda línea terapéutica algunos proponen el interferón alfa, el que se utilizaría en casos de DRESS de larga evolución5; otros, las inmunoglobulinas humanas i/v en dosis de 1g /kg/ día durante dos a tres días.10
Algunos proponen en casos de toxidermias secundarias a anticonvulsivantes, el uso de N-acetilcisteína a altas dosis por cuatro a seis días, con el fin de reponer la capacidad antioxidante debido a que el mismo es un precursor del glutatión, molécula implicada en la vía de detoxificación de múltiples fármacos y además, tendría efecto inmunomodulador al inhibir la producción de citoquinas inflamatorias y la expresión de las ICAM-1 en los queratinocitos.5,6
Otros fármacos utilizados en forma anecdótica son: la ciclosporina, ciclofosfamida y la talidomida y la plasmaféresis.6
Aunque no existan pruebas clínicas que permitan determinar si un fármaco va a desencadenar un síndrome DRESS, se ha sugerido la utilidad de las pruebas epicutáneas, sobre todo si el fármaco tiene metabolismo cutáneo. La exposición in vitro de linfocitos del paciente, al fármaco susceptible para predecir el grado de sensibilización, se ha comenzado a utilizar en forma experimental por muchos autores. Esta técnica podría ser útil para prevención primaria, sobre todo en familiares de primer grado de pacientes con síndrome de DRESS, ya que, cabe destacar que ellos presentan un riesgo cuatro veces mayor, que la población general de desencadenar DRESS.6,5
EVOLUCIÓN Y PRONÓSTICO
Los síntomas luego de suspender el fármaco pueden persistir por semanas. Puede presentarse un recrudecimiento después de la mejoría, con erupción cutánea, fiebre e incluso compromiso de órganos internos, luego de la suspensión del corticoide o incluso sin realizar esto último. La hepatitis puede empeorar y tardar meses en resolver completamente, aunque en la mayoría de los casos evoluciona sin secuelas.
La mortalidad puede llegar al 10%, falleciendo la mayoría por insuficiencia hepática, alteraciones de la coagulación y sepsis. Otras causas de deceso son: la insuficiencia renal y la reexposición accidental a la droga, que es extremadamente peligrosa.5
Un grupo minoritario de pacientes, continuará presentando erupciones inespecíficas y malestar general, hasta un año después de la reacción inicial. Dichos pacientes tienen riesgo de desarrollar posteriormente enfermedades autoinmunes.3
CONCLUSIONES
El síndrome Dress (Drug Rush with Eosinophilia and Systemic Symtoms) es una farmacodermia grave con alto grado de mortalidad (10 al 30%), vinculado a ciertas drogas, siendo las más frecuentes los antibióticos, los anticonvulsivantes y los AINES.
La patogenia es desconocida aunque se acepta que intervienen factores inmunológicos, metabólicos e inflamatorios tanto constitucionales como adquiridos.
Todo paciente que presente erupción cutánea con fiebre, con antecedentes de ingesta a drogas, debe ser examinado cuidadosamente en búsqueda de adenopatías y compromiso de órganos internos, sospechándose de esta entidad.
Criterios clínicos y de laboratorio:
- Erupción cutánea
- Fiebre
- Anormalidades hematológicas
- Linfadenopatías y compromiso de órganos internos.
El diagnóstico diferencial debe efectuarse con otras entidades como: VEB, hepatitis, CMV, VHH6, entre otros, sospechando sobre la presencia de linfomas y pseudo-linfomas.
La suspensión precoz del fármaco involucrado, es la medida terapéutica más efectiva.
Tratamiento: el uso de corticoides es discutido, pero en general hay acuerdo en que son necesarios para evitar la progresión del daño sistémico, además de las medidas de soporte correspondientes, de acuerdo con los órganos comprometidos.
Cabe destacar, que bajo ninguna circunstancia está indicada la reexposición del paciente al fármaco desencadenante y que los familiares de primer grado, deben ser advertidos sobre el riesgo de desencadenar este síndrome, ya que, presentan un riesgo cuatro veces mayor que la población general.
1. Estrella V, Baroni E, Leroux MB, Sánchez A, Bergero A y Fernández Bussy R. Síndrome de hipersensibilidad a anticonvulsivantes (SHA). Rev Argent Dermatol 2007; 88: 46-54. [ Links ]
2. Meik S, Arias M, Fernández Mego L, López Santora MC, Abeldaño A y Pellerano G. Síndrome de hipersensibilidad a anticonvulsivantes (síndrome de DRESS): comunicación de 4 casos. Dermatol Argent 2010; 16 (4): 272- 277. [ Links ]
3. Ticse Aguirre T, Huayanay Falconi L, Malaga Rodríguez G, Ferrufino LLach JC y Ramos Aguilar C. Síndrome de hipersensibilidad por uso de Trimetroprim/ Sulfametoxazol. Reporte de un caso. Rev Med Hered 2006; 17: 109-114. [ Links ]
4. Moreno M, Díaz M, Dancziger E y Kaminsky A. Síndrome de hipersensibilidad. Dermatología Peruana 2004; 14 (1): 44-51. [ Links ]
5. Shear NH y Spielberg SP. Anticonvulsivants Hypersensivity Syndrome in vitro Assessment of Risk. Am Soc Clin Invest Inc 1988; 82: 1826- 1832. [ Links ]
6. Sánchez X, Merlano C y Cruz CM. Síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS). Rev Asoc Col Dermatol 2008; 16 (3): 208-210. [ Links ]
7. Cervigón González I, Sandín Sánchez S, Pérez Hortet C, Bahillo Monné C, Vélez Pérez C y García Almagro D. Síndrome de DRESS (Drug Rash with Eosinophilia and Systemic Symptoms) por sulfonamidas. Med Cutan Iber Lat Am 2006; 34 (3): 120-126. [ Links ]
8. Paucar K, Del Solar M, Bravo F, Salomón M, Puell L, Feria K, Ramos C y Giglio P. Reacción a drogas con eosinofilia y compromiso sistémico (DRESS). Follia Dermatol Peru 2011; 22 (1): 41- 45. [ Links ]
9. Salas A, Mechán V, Llanos F y Yoshihiro Nako J. Síndrome DRESS inducido por fármacos antituberculosos en un paciente con diabetes mellitus tipo 2. An Fac Med 2012; 73 (2): 159-164. [ Links ]
10. Nogales MA, Samela PC, Buján MM, Cervini AB, Bocian M, Lanoél A y Pierini AM. Síndrome de DRESS Experiencia en un hospital pediátrico. Arch Argent Dermatol 2010; 60: 47-51. [ Links ]
11. Magliano J, Álvarez M y Salmentón M. Síndrome DRESS por carbamazepina. Arch Pediatr Urug 2009; 80 (4): 291-295. [ Links ]
12. Aouam K, Bel Hadj Ali H, Youssef M, Chaabane A, Amri M, Boughattas N y Zilli JE. Carbamazepine - induced DRESS and HHV6 primary infection: The importance of skin test. Epilepsia 2008; 49 (9): 1630- 1633. [ Links ]
13. Rojas C, Méndez L, Arab JP, Barrera F, Soza A, Nervi F, Duarte I, Pulgar MA, Paredes N, Molgó M, Amador R, Cariqueo M y Riquelme A. Síndrome de DRESS. Eritema cutáneo, fiebre y hepatitis asociado a lamotrigina. Reporte de dos casos y revisión de la literatura. Gastroenterol Latinoam 2010; 21 (3): 357-362. [ Links ]
14. Cacoub P, Musette P, Descamps V, Meyer O, Speirs C, Finzi L y Roujeau JC. The DRESS Syndrome: A Literature Review. Am J Med 2011; 124: 588-597. [ Links ]
15. Bocquet H, Bagot M y Roujeau JC. Drug - Induced Pseudolymphoma and Drug Hypersensitivity Syndrome (Drug Rash with Eosinophilia and Systemic Symptoms: DRESS). Sem Cutan Med Surg 1996; 15: (4): 250- 257. [ Links ]
16. Cuellar L, Sehtman A, Del Sel JM, Allevato M y Cabrera H. Síndrome DRESS desencadenado por psicofármacos. Act Terap Dermatol 2007; 30: 304-309. [ Links ]
17. Felgueiras P, Guerreiro E, Pereira E y López R. Síndrome de DRESS. Galicia Clin 2011; 72 (4): 185-187. [ Links ]
18. Lobo I, Ferreira M, Velho G, Sanches M y Selores M. Erupçao a fármaco com eosinofilia e sintomas sistémicos (Síndome DRESS). Acta Med Port 2008; 21: 367-372. [ Links ]
19. Castro R, Ballona R, Gallosa ME, Febres S, Silva D y Catacora J. Manifestaciones cutáneas de las reacciones adversas a medicamentos: revisión de 41 pacientes hospitalizados en el Servicio de Dermatología del Instituto Especializado de la Salud Nio durante 1995-2003. Dermatol Pediatr Lat 2004; 2 (1): 11-20. [ Links ]
20. Santiago F, Gonçalo M, Viera R, Coelho S y Fegueido A. Epicutaneous patch testing in drug hypersensitivity syndrome (DRESS). Contact Dermatitis 2010; 62: 47- 53. [ Links ]













