Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.94 no.4 Ciudad Autónoma de Buenos Aires dic. 2013
ARTÍCULOS ORIGINALES
Micosis mucocutáneas en pacientes con VIH-Sida de la ciudad de Valparaíso, Chile
Mucocutaneous fungal infections in patients with HIV-Aids of Valparaíso, Chile
RM Cruz Choappa *, PA Herman Rodríguez ** y RE Novoa Arias ****
* Cátedra de Micología de la Universidad de Valparaíso. Hospital Carlos van Buren de Valparaíso.
** Alumna de Medicina. Universidad de Valparaíso.
*** Alumno de Medicina. Universidad de Valparaíso.
Dirección: Hontaneda 2356. Valparaíso.
Autor para correspondencia: Rodrigo Mauricio Cruz Choappa
Dirección: Hontaneda 2356. Valparaíso. Chile.
Teléfono: 32-2507370
Fax: 32-2507371
E-mail: rcruzchoappa@gmail.com
Fuente de financiamiento: fondos propios de la Cátedra de Micología de la Universidad de Valparaíso.
Los autores declaran no tener conflictos de interés.
RESUMEN
Introducción: la pandemia del VIH-SIDA continúa en aumento en todo el mundo. Las dermatomicosis en este grupo son más frecuentes que en la población general, destacando la candidiasis oral y la onicomicosis.
Métodos: se evaluaron 100 pacientes adultos con diagnóstico de VIH-SIDA y micosis mucocutáneas, en control en el Hospital Carlos van Buren de Valparaíso, Chile, durante los años 2011 y 2012. La identificación de los hongos filamentosos y levaduras se realizó por morfofisiología y pruebas bioquímicas. Para el análisis estadístico se utilizaron los programas Microsoft Excel y Stata 10.
Resultados: el promedio de edad fue de 39.37 años. El 88% eran hombres. Las localizaciones más frecuente fueron uña de pie (29,03%), cavidad oral (21,77%) y tronco (17,74%). Las especies más comunes fueron: Trichophyton rubrum (33,06%), Candida albicans (25,8%), Malassezia pachydermatis (9,68%) y Trichophyton mentagrophytes (4,83%).
Conclusiones: las dermatomicosis en pacientes VIH-SIDA se presentaron principalmente en hombres. La localización más frecuente fue la onicomicosis de pie y T rubrum, la especie más aislada. Además se destaca el aislamiento de Malassezia pachydermatis en pitiriasis versicolor, en tronco de hombres.
PALABRAS CLAVE: Micosis superficial; Dermatofitosis; Onicomicosis; VIH.
SUMMARY
Introduction: HIV-AIDS pandemic continues to increase worldwide. Dermatomycoses in this group are more frequent than in the general population, emphasizing oral candidiasis and onychomycosis.
Methods: we evaluated 100 adult patients diagnosed with HIV-AIDS and mucocutaneous fungal infections, in control at the Hospital Carlos van Buren of Valparaiso, Chile, during the years 2011 and 2012. Identification of filamentous fungi and yeast was performed by morphophysiology and biochemical tests. For statistical analysis programs used Microsoft Excel and Stata 10.
Results: the mean age was 39.37 years. 88% were men. The most common locations were fingernail foot (29,03%), oral cavity (21,77%) and trunk (17,74%). The most common species were Trichophyton rubrum (33,06%), Candida albicans (25,8%), Malassezia pachydermatis (9,68%) and Trichophyton mentagrophytes (4,83%).
Conclusions: dermatomycoses in HIV-AIDS patients occurred mainly in men. The most common was foot onychomycosis and Trichophyton rubrum the most commonly isolated. Also highlights the isolation of Malassezia pachydermatis in tinea versicolor on the trunk of man.
KEY WORDS: Superficial mycosis; Dermatophytosis; Onychomycosis; HIV.
INTRODUCCIÓN
La pandemia de VIH/SIDA continúa en aumento y el número de casos estimados a diciembre de 2011 llegó a 34 millones en el mundo1. En Chile, el primer caso de SIDA fue notificado en 1984 y desde entonces, la incidencia de la infección ha ido en aumento, llegando a 20.099 casos notificados hasta el 31 de diciembre de 20082. En más del 90% de estos pacientes se han observado - en cualquier etapa de la enfermedad - distintas manifestaciones mucocutáneas, las que pueden ser de origen neoplásico, reacciones adversas a medicamentos o infecciosas3. Por otra parte, entre el 10 y 25% de los pacientes que inician terapia antirretroviral, cursan con síndrome de reconstitución inmunológica y más de la mitad de las manifestaciones ocurren en la piel y/o mucosas4,5.
Entre las infecciones cutáneas se encuentran las dermatomicosis, cuya frecuencia de aparición es tres a cuatro veces mayor que en la población general, afectando principalmente a los hombres con una razón 3:1, pero con una distribución topográfica similar entre ambos sexos 6.
La candidiasis oro-faríngea es la localización más común y Candida albicans su principal agente, la que ocurre principalmente cuando el número de linfocitos TCD4 es inferior a 500 cel/mcl 6,7. Las dermatofitosis o tiñas, pueden ocurrir en cualquier etapa de la enfermedad y Trichophyton rubrum suele ser el agente más aislado, sin embargo, distintos mohos ambientales también pueden ser diagnosticados, principalmente en onicomicosis de pies8,9. Tanto la pitiriasis versicolor como la dermatitis seborreica tienen a Malassezia como agente etiológico, siendo T furfur y M globosa las especies más reportadas10,11.
El objetivo de este estudio fue conocer las especies que causan micosis mucocutáneas, además de analizar el estado inmunológico y las diferencias según sexo, edad y localización de pacientes con infección VIH-SIDA en control, en el Policlínico de Infectología del Hospital Van Buren durante los años 2011 y 2012.
MÉTODOS
Estudio de tipo descriptivo y prospectivo. Se evaluaron 100 pacientes adultos con diagnóstico de VIH-SIDA y micosis mucocutáneas, en control en el Policlínico de Infectología del Hospital Van Buren de Valparaíso, Chile, durante los años 2011 y 2012. Se contó con consentimiento informado de cada paciente ingresado al estudio.
Criterios de inclusión: pacientes con diagnóstico de VIH-SIDA confirmado, en cualquier estadio de la enfermedad, con lesiones sugerentes de micosis mucocutáneas, más examen microscópico directo con estructuras fúngicas y/o cultivo, con desarrollo de hongos filamentosos o levaduras, a partir de la lesión. Si el resultado del examen microscópico directo (hifas o levaduras) fue concordante con el cultivo (dermatofitos, Candida spp u otra levadura), se asumió como agente etiológico a la especie desarrollada en éste. El diagnóstico de onicomicosis de pie por hongos ambientales, se realizó con tres exámenes microscópicos directos con presencia de hifas, más tres cultivos a 37°C con desarrollo del mismo hongo, tomadas las muestras en tiempos distintos.
Diagnóstico micológico: se realizó en la Cátedra de Micología de la Escuela de Medicina de la Universidad de Valparaíso. Las muestras de las lesiones fueron obtenidas por personal entrenado y depositadas en placas de Petri estériles, para evitar contaminación. El examen microscópico directo se realizó con KOH al 20%, para detectar la presencia de elementos fúngicos mediante microscopio de luz (Zeiss® Axiostar Plus, Alemania). El cultivo se realizó en agar Sabouraud (glucosa, 20 g; peptona, 10 g; agar-agar, 20 g; cloranfenicol, 0,25 g; agua destilada, 1000 ml) y agar Lactrimel (harina de trigo, 14 g; miel, 7 g; leche de vaca desnatada, 14 g; agar, 14 g; cloranfenicol, 0,25 g; agua destilada, 1000 ml), ambos preparados en el laboratorio. La identificación de los hongos filamentosos fue en base a su morfo-fisiología. En el caso de Candida, se empleó agar Sabouraud, CHROMagar Candida® (Becton Dickinson, Francia) y agar harina de maíz (harina de maíz, 50 g; agar, 15g; agua destilada, 1000 ml), además de pruebas bioquímicas con ID32C ® (bioMérieux, Francia). En pitiriasis versicolor, se empleó la técnica de muestreo de cinta adhesiva, tinción con safranina al 0,5%, observación microscópica directa, además del cultivo en agar Sabouraud y Agar Sabouraud oliva (agar Sabouraud, 6,5 g; Tween 80, 2 ml; aceite de oliva, 2 ml; vitamina A, 10 gotas; cloranfenicol, 0,25 g; agua destilada 100 ml), ambos preparados en el laboratorio. Las muestras de cultivo fueron mantenidas en cámaras de cultivo a 27°C y 37°C en el caso de los dermatofitos, 37°C y 45°C para Candida y 32°C para Malassezia.
El análisis estadístico se realizó utilizando el programa Microsoft Excel y Stata10. Para determinar asociación entre dos variables cualitativas se utilizó la Prueba Exacta de Fisher. En todos los casos se determinó si la relación entre dos variables, es estadísticamente significativa utilizando un nivel de significancia de 95% y una potencia estadística del 80%. Para la distribución de edades por rango se utilizó la prueba "T" de Student.
RESULTADOS
El promedio de edad de los pacientes fue de 39.37 años (±12,03), donde el 88% fueron hombres. El grupo más afectado estuvo entre 40-49 años de edad, con un 33% (Grafico I); sin embargo, no se encontró asociación estadísticamente significativa con la edad (p=0.904).
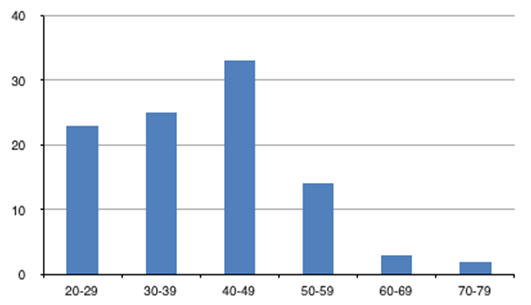
GRÁFICO I: distribución de los pacientes por grupo etario.
El 50% tenía CD4 sobre 500 cel/mcl, 40% entre 200 y 300 cel/mcl y solo un 10% menos de cel/mcl. El 80% de ellos estaba en terapia antirretroviral al momento del diagnóstico.
De los 100 pacientes estudiados, en 78 se diagnosticó infección en 1 localización, 20 presentaron 2 y 2 pacientes 3. La localización más frecuente fue la uña de pie (36%) (Fig 1), seguido de la cavidad oral (27%) y tronco (22%) (Tabla I). No se encontró asociación estadísticamente significativa entre el sexo y localización de la micosis (p=0.086), solo en pitiriasis versicolor de tronco la mayor frecuencia en hombres fue significativa (p=0.047) (Fig 2).
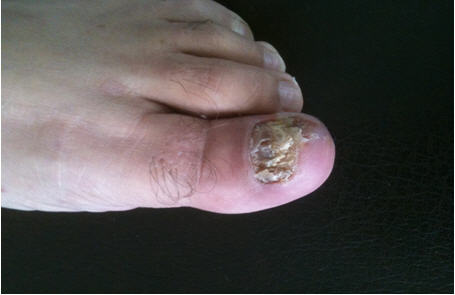
Fig 1: onicomicosis del primer ortejo de pie izquierdo por Trichophyton rubrum.
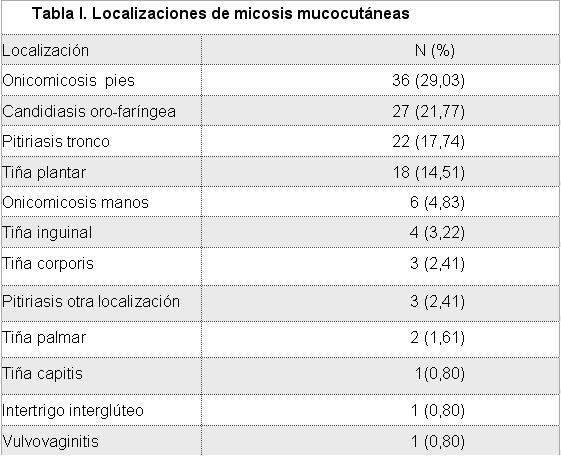
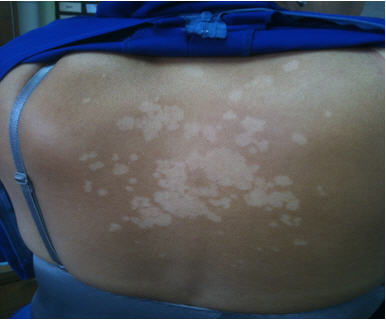
Fig 2: lesiones hipopigmentadas de pitiriasis versicolor dorsal.
De las 124 muestras tomadas, 120 (96,77%) resultaron positivas en el examen microscópico directo y en 105 (84,06 %) se identificó la especie en el cultivo. Las especies más comunes fueron T rubrum (33,06%), C albicans (25,8%), M pachydermatis (9,68%) y T mentagrophytes (4,83%) (Tabla II). En hombres el género más frecuentemente encontrado fue Trichophyton (38,89%), mientras que en las mujeres fue Candida (50,00%), sin embargo, no existió diferencia significativa entre el sexo y la especie identificada (p=0.558). La especie de Candida que presentó una mayor frecuencia fue C albicans (84,21%), seguida de C dubliniensis (5,26%) y C parapsilosis (5,26%).
La tiña unguium de pie fue causada principalmente por T rubrum (55,55%), mientras que en mano, se aisló tanto C albicans (33,33%) como T rubrum (44,44%). Sólo en onicomicosis de pie se encontraron hongos filamentosos ambientales como Scopulariopsis y Aspergillus (Tabla II).
Tiña plantar fue causada en su gran mayoría por T rubrum (83%) y el otro 17% por hongos filamentosos que no se desarrollaron en el cultivo. Tiña corporis por T rubrum (2/3) y T mentagrophytes (1/3), mientras que la tiña inguinal fue por T rubrum (3/4). Por otra parte, la micosis oral fue causada por C albicans y sólo se encontró un caso de intertrigo candidiásico (Tablas I y II).
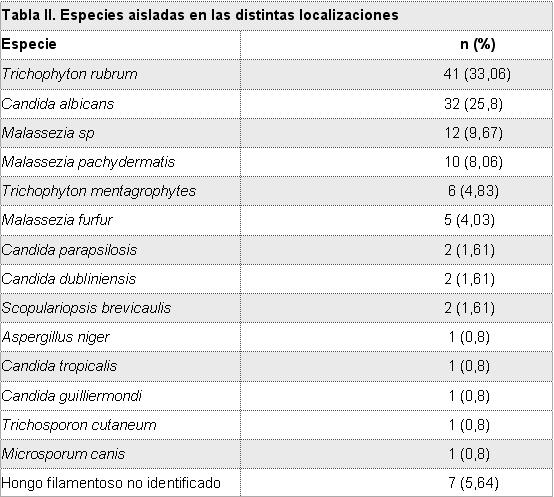
En cuanto a Malassezia, la localización más afectada por este género fue tronco (88%), mientras que cabeza, cara, antebrazo y mano fueron comprometidas en un 3% cada una (Tabla II). Las especies más frecuentes fueron M pachydermatis (37,03%) (Figs 3 y 4) y luego M furfur (18,51%). En un 44,44 % no hubo desarrollo de las levaduras para poder identificarlas.
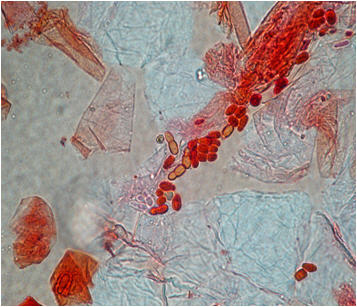
Fig 3: levaduras de Malassezia pachydermatis al examen microscópico directo. Tinción de safranina 0,5 %. 100 X.
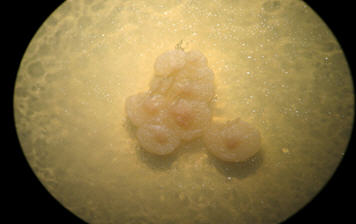
Fig 4: colonias de Malassezia pachydermatis en agar Sabouraud.
El 70% de los pacientes fue tratado con antifúngicos orales (terbinafina, itraconazol o fluconazol) y los restantes con clotrimazol tópico.
DISCUSIÓN
Los pacientes con infección por VIH incluidos en el estudio, presentaron una distribución heterogénea de edad y al igual que en otras publicaciones, el número de hombres afectados por micosis mucocutáneas fue superior al de mujeres, ocurriendo en todos los estadios de la enfermedad6,12.
La mayoría de los estudios sobre micosis mucocutáneas en pacientes VIH, tanto nacionales como extranjeros, se centran en localizaciones específicas o en algunos agentes particulares9,13,14,15. En nuestro estudio el 22% de los pacientes presentó más de una localización, siendo la onicomicosis de pie la más frecuente, seguido por candidiasis oral y la pitiriasis versicolor de tronco.
La confirmación de una micosis mucocutánea, puede realizarse con examen microscópico directo o con cultivo de las lesiones16,17. En este trabajo, el rendimiento del examen directo y del cultivo fue alto, lo que corrobora que son exámenes complementarios y que deben realizarse de rutina en el diagnóstico de estas infecciones.
En los estudios analizados6,18,19,20, se describe que la especie que con mayor frecuencia produce infecciones mucocutáneas en los pacientes VIH es C albicans, sin embargo, en nuestra muestra fue Trichophyton rubrum. Esto se debe probablemente a que la mayoría de estos trabajos, se han centrado en la candidiasis oro-faríngea y no en otras dermatomicosis, que también pueden afectar a la población con VIH-SIDA.
En onicomicosis de pie, T rubrum fue el agente más aislado, sin embargo también se aislaron algunos hongos ambientales pertenecientes a los géneros Aspergillus, Fusarium y Scopulariopsis, situación que coincide con lo reportado en población general8,21,22. En onicomicosis de mano, C albicans y T rubrum fueron aislados con frecuencias similares, lo que también coincide con otros trabajos8,23.
La pitiriasis versicolor de tronco se asoció significativamente al género masculino y en relación a las especies del género, M pachydermatis fue la más frecuente. Esto es distinto a lo reportado24,25, donde M furfur y M globosa son las más comúnmente aisladas, existiendo sólo un caso de M pachydermatis publicado en Chile26. Esto es de importancia, ya que esta levadura es zoofílica, presente principalmente en animales domésticos, posible fuente de infección de estos pacientes.
En su gran mayoría los tratamientos fueron sistémicos, ya que en onicomicosis, candidiasis oral y vulvo-vaginitis es de elección esta vía de administración27,28. Las tiñas, pitiriasis e intertrigo candidiásico fueron tratados con clotrimazol tópico, lo que concuerda con diversas recomendaciones28,29. Las dermatomicosis son infecciones frecuentes en pacientes con VIH-SIDA, donde el diagnóstico etiológico es de suma importancia para poder elegir un tratamiento adecuado y tomar las medidas necesarias de prevención.
1. WHO. VIH/AIDS. [Consultado 16/7/2013] Disponible en http://www.who.int/hiv/en/. [ Links ]
2. Ministerio de Salud de Chile. Síndrome de Inmunodeficiencia Adquirida VIH/SIDA. Serie Guías Clínicas MINSAL 2010. Rev Chil Infect 2010; 27 (3): 239-276. [ Links ]
3. Raju PVK, Rao GR, Ramani TV, Vandana S. Skin disease: clinical indicator of immune status in human immunodeficiency virus (HIV) infection. Int J Dermatol 2005; 44: 646-649. [ Links ]
4. Lehloenya R, Meintjes G. Dermatologic manifestations of the immune reconstitution inflammatory syndrome. Dermatol Clin 2006; 24: 549-570. [ Links ]
5. Murdoch DM, Venter WDF, Feldman C, Van Rie A. Incidence and risk factors for the immune reconstitution inflammatory syndrome in HIV patients in South Africa: a prospective study. AIDS 2008; 22: 601-610. [ Links ]
6. Arenas R, Vásquez del Mercado E, Moreno G, Fernández R. Micosis superficiales en pacientes que viven con VIH/SIDA. Revisión 2010 del Consenso Nacional de Micosis superficiales. Dermatol Rev Mex 2010; 54 (5): 259-266. [ Links ]
7. Baccaglini L, Atkinson JC, Patton LL, Glick M, Ficarra G, Peterson DE. Management of oral lesions in HIV-positive patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007; 103 (S): 1-23. [ Links ]
8. Cruz R, Ponce E, Calderón L, Delgado N, Vieille P, Piontelli E. Micosis superficiales en la ciudad de Valparaíso, Chile. Período 2007-2009. Rev Chil Infect 2011; 28 (5): 404-409. [ Links ]
9. Salim R, Runco R. Onicomicosis en pacientes con infección por VIH (Tucumán Argentina). Bol Micol 2002; 17: 89-94. [ Links ]
10. Rincón S, Celis A, Sopó L, Motta A, Cepero de García M. Especies de Malassezia aisladas de pacientes con lesiones dermatológicas. Biomédica 2005; 25 (2): 189-195. [ Links ]
11. Celis A, Cepero de Garciía M. Polimorfismos geneíticos de aislamientos del geínero Malassezia obtenidos en Colombia de pacientes con lesión dermatológica y sin ella. Biomeídica 2005; 25: 481-487. [ Links ]
12. Rodwell GEJ, Bayles CL, Towersey L, Aly R. The prevalence of dermatophyte infection in patients infected with human immunodeficiency virus. Int J Dermatol 2008; 47: 339-343. [ Links ]
13. Diíaz MC, Fich F, Acevedo I. Candidiasis oro-faríngea: hallazgos clínicos y micológicos en pacientes VIH positivos. Bol Micol 2003; 18: 101-104. [ Links ]
14. Brevis P, Coronado C, Cantin M, Abaca P. Distribución de lesiones bucales producidas por Candida albicans en pacientes VIH/SIDA. Bol Micol 2012; 27: 24- 28. [ Links ]
15. Ceballos A, Gaitán L, Ruesga MT, Ceballos L, Quindós G. Prevalencia de lesiones orales por Candida en una población con SIDA sometida a terapia antirretroviral altamente activa. Rev Iberoam Micol 1998; 15: 141-145. [ Links ]
16. Arenas R. Dermatofitosis. Arenas R, Editor. Micología Médica Ilustrada. Primera Edición. Editorial McGraw-Hill. Ciudad de México. 2004; 61-94. [ Links ]
17. Velasco M, García-Melgares L, Gimeno E, Roche E, Vilata JJ. Dermatofitosis. Vilata JJ, Editor. Micosis Cutáneas. Primera Edición. Editorial Médica Panamericana. Madrid. España. 2006; 49-72. [ Links ]
18. Prieto LM, Illnait MT, Ramos E, Lazcano B, Márquez N, Cantelar de Francisco N, Manzur J, Martínez G. Candidiasis oral en pacientes seropositivos al VIH y casos SIDA: Aspectos clínicos, micológicos y terapéuticos. Rev Cubana Med Trop 2006; 58 (3): 173-180. [ Links ]
19. Campo J, del Romero J, Castilla J, García S, Rodriíguez C, Bascones A. Oral candidiasis as a clinical marker related to viral load, CD4 lymphocyte count and CD4 lymphocyte percentage in HIV-infected patients. J Oral Pathol Med 2002; 31: 5-10. [ Links ]
20. Vargas KG, Joly S. Carriage frequency, intensity of carriage, and strains of oral yeast species vary in the progression of oral candidiasis in Human Immunodeficiency Virus-positive individuals. J Clin Microbiol 2002; 40: 341-350. [ Links ]
21. Cavallera E, Asbati M. Onicomicosis por hongos filamentosos no dermatofitos. Dermatol Venez 2006; 44: 4-10. [ Links ]
22. Escobar ML, Carmona-Fonseca J. Onicomicosis por hongos ambientales no dermatofíticos. Rev Iberoam Micol 2003; 20: 6-10. [ Links ]
23. Medina J, Bejar V, Cortez F, Betanzos A. Superficial fungal infections: clinical and epidemiological study in adolescents from marginal districts of Lima and Callao, Perú. J Infect Dev Ctries 2009; 3 (4): 313-317. [ Links ]
24. Giusiano G, Sosa M, Rojas F, Toma S, Mangiaterra M. Prevalence of Malassezia species in pityriasis versicolor lesions in northeast Argentina. Rev Iberoam Micol 2010; 27: 71-74. [ Links ]
25. Rendic E, Diíaz C, Fich F. Caracterización de especies del geínero Malassezia en pacientes con dermatitis seborreica y en controles. Rev Med Chil 2003; 131: 1295-1300. [ Links ]
26. Cruz R, Vieille P, Giusiano G, Sosa M. Pitiriais versicolor por Malassezia pachydermatis: caso clínico. Bol Micol 2010; 25: 37- 41. [ Links ]
27. Sandoval N, Arenas R, Giusiano G, García D, Chávez L, Zúniga P. Diagnóstico y tratamiento de dermatofitosis y pitiriasis versicolor. Rev Med Hondur 2012; 80 (2): 66-74. [ Links ]
28. Crawford F, Young P, Godfrey C, Bell-Syer SE, Hart R, Brunt E, Russell I. Oral treatments for toenail onychomycosis: a systematic review. Arch Dermatol 2002; 138 (6): 811-816. [ Links ]
29. Weinstein A, Berman B. Topical Treatment of Common Superficial Tinea Infections. Am Fam Physician 2002; 65 (10): 2095-2103. [ Links ]














