Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.95 no.1 Ciudad Autónoma de Buenos Aires ene./mar. 2014
REVISIÓN
El folículo piloso: una importante fuente celular en ingeniería tisular
Hair follicle: an important cellular source in tissue engineering
ML Porriño *, J Sánchez *, A Almodóvar *, JM García **, S Arias ***
y V Carriel **
* Servicio de Dermatología. Hospital Universitario San Cecilio. Avenida Dr. Olóriz, 16. CP 18012 Granada. España.
** Departamento de Histología (Grupo de Ingeniería Tisular). Universidad de Granada. España. Avenida de Madrid, 11. CP 18012.
*** Servicio de Dermatología. Hospital Universitario Virgen de las Nieves. Avenida de las Fuerzas Armadas, 2. CP 18014. Granada. España.
E-mail:mporrinobustamante@gmail.com
Recibido: 20.01.2014
Aceptado para su publicación: 24.02.2014
RESUMEN
El folículo piloso-sebáceo o unidad folículo-sebácea-apócrina es un órgano microscópico complejo funcional y estructuralmente. Consta de un segmento superior, estable y un segmento inferior, que se regenera en cada ciclo piloso. El folículo piloso contiene una gran diversidad de tipos celulares, entre los que se encuentran células madre. De hecho, supone el nicho más importante de células madre en la piel, con la ventaja añadida de su fácil accesibilidad. Estas células madre se localizan en una prominencia a nivel de la inserción del músculo erector del pelo, llamada "bulge" (promontorio). Son las encargadas de regenerar el folículo en cada ciclo y también intervienen en la reconstitución de las glándulas sebáceas y de la epidermis interfolicular, en caso de lesión epidérmica. El conocimiento de la estructura del folículo piloso, está haciendo posible cada vez más el empleo de los distintos tipos celulares, especialmente, las células madre, en la ingeniería tisular de la piel. Asimismo, estudios recientes han diferenciado las células madres foliculares a diferentes estirpes, como por ejemplo: células nerviosas, hematopoyéticas y vasculares. Además, se ha estudiado la construcción de folículos pilosos, con resultados satisfactorios en ratones, aunque no del todo superponibles a humanos, en los que se precisan más investigaciones. La posibilidad de generar folículos pilosos humanos, supondría una revolución en el amplio campo de las alopecias. El objetivo de esta revisión es describir la estructura anatómica e histológica del folículo piloso, enfatizando en la importancia del mismo como nicho de células madre y su potencial utilidad en el campo de la ingeniería tisular, para la construcción de diversos tipos de tejidos.
PALABRAS CLAVE: Folículo piloso; Células madre; Ingeniería tisular; Promontorio tricogénesis.
SUMMARY
The hair follicle is a microscopic organ, functionally and structurally complex. It can be divided into two distinct segments, the upper portion, stable and the lower portion, that undergoes regeneration every hair cycle. The hair follicle contains a variety of cells types, including stem cells. It fact, it is the most important niche of stem cells in the skin, with the added advantage of its easy accessibility. These stem cells are located in a prominence at the level of the insertion of the arrector pili muscle, called bulge. They are responsible of hair follicle regeneration each hair cycle, and also can form sebaceous glands and help in repopulation of the interfollicular epidermis after injury. The knowledge of hair follicle structure is making possible the use of different types of cells, especially stem cells, in skin tissue engineering. Furthermore, recent studies have differentiated follicle stem cells into different strains, for example: nervous, hematopoietic and vascular cells. Moreover, other late studies have focused on the hair follicle construction, with satisfactory results in mice, but not completely transferable to humans, which further research is needed. The possibility of human hair follicle regeneration would suppose a revolution in the broad world of alopecia. The aim of this review is to describe the anatomical and histological structure of the hair follicle, emphasizing the importance as stem cell niche, and its potential usefulness in the field of tissue engineering for the construction of various types of tissues.
KEY WORDS: Hair follicle; Stem cells; Tissue engineering; Bulge; Trichogenesis.
INTRODUCCIÓN
Los folículos pilosos (FPs) se encuentran en toda la superficie corporal, exceptuando palmas, plantas y delgadas áreas de la cara peri-labiales y pre-auriculares. El folículo piloso (FP) consta de componentes epidérmicos (epiteliales), derivados del ectodermo y dérmicos (mesenquimales), derivados del mesodermo, junto con células madre (CM) 1. Embriológicamente, los brotes epiteliales derivan de la epidermis fetal y se proyectan hacia abajo, interactuando con las células mesenquimales que forman la vaina y la papila dérmicas. La interacción de estos dos componentes es crucial en la morfogénesis y desarrollo del FP 1. En general, se considera que las células dérmicas son las inductoras y las epiteliales las responsables en el proceso de formación folicular, aunque la señal entre ambos tipos celulares es recíproca. Esta interacción entre células dérmicas y epiteliales ha sido estudiada mediante numerosos modelos, con el objetivo de lograr la construcción de FPs 2. La mayoría de estos estudios se ha realizado in vivo en ratones inmuno-deficientes, en los que se han obtenido buenos resultados. No obstante, los mismos en la obtención de FP humano no son tan satisfactorios y se precisan más estudios.
El ser humano tiene unos cinco millones de FPs, con dos tipos de pelos: pelo terminal, más largos, gruesos y pigmentados, que habitualmente se extienden hasta el tejido celular subcutáneo y el pelo velloso, más finos, cortos, no pigmentados, que sólo llegan a la dermis reticular superficial o media. Se distinguen también pelos indeterminados, con características intermedias.
El ciclo de crecimiento del pelo 3 consta de tres fases: anagen o de crecimiento activo (2-7 años de duración);catagen o de involución (2-3 semanas); y telogen, o de reposo (100 días). Después de telogen, la parte inferior del folículo regenera, lo que marca el inicio de una nueva anagen. En general, en paralelo al inicio de anagen tiene lugar el desprendimiento del pelo (fase exógena). Del total de pelos, sólo un 20% están en telogen (100 pelos/día), 80-100% en anagen y 1% en catagen.
El hecho que el FP sea capaz de regenerar múltiples líneas celulares, al inicio de cada fase anágena apoya la existencia de un reservorio de CM en el mismo 4. Las CM se caracterizan por su capacidad de auto-renovación y por diferenciarse en distintas estirpes celulares. Dada su importancia en la regeneración tisular, se ha sugerido que se localizan en un microambiente protector (nido o nicho), donde se dividen con baja frecuencia. El objetivo de este estudio es una descripción de la estructura y componentes celulares del FP, enfatizando en las CM que lo constituyen y la utilización de los distintos tipos de células, que lo componen en ingeniería tisular.
ESTRUCTURA DEL FOLÍCULO PILOSO
En conjunto, las glándulas sebáceas, el músculo erector del pelo y el FP se conocen como unidad folículo-pilo-sebácea.
El FP puede dividirse anatómica y funcionalmente en dos segmentos 3 (Fig 1): una porción superior, estable, que no se afecta por la maduración y desprendimiento del pelo y una porción inferior, activamente implicada en los mismos, que se regenera completamente durante cada ciclo. La porción superior está formada por el ostium folicular, el infundíbulo y el istmo. El infundíbulo se extiende desde el ostium hasta la apertura del conducto de la glándula sebácea, mientras que el istmo se prolonga desde dicha apertura hasta la inserción del músculo erector del pelo, a nivel del "bulge" del mismo. La porción inferior, comienza en la parte caudal de la inserción del músculo erector hasta el bulbo piloso y contiene las CM, que se extienden desde la inserción del músculo erector hasta la franja de Adamson y la parte inferior llamada bulbo.
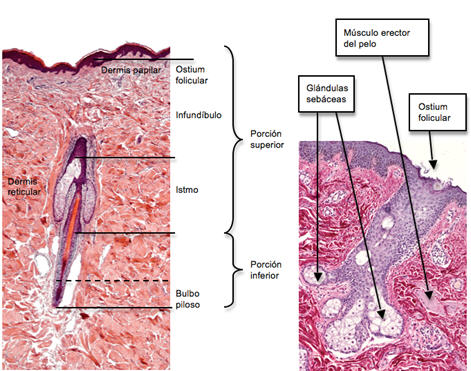
Fig 1: corte histológico de folículo piloso con hematoxilina-eosina, en el que se observan las porciones constituyentes del mismo. 20X.
El FP maduro (Fig 2) contiene un eje o tallo piloso central, compuesto de tres capas concéntricas 4: una central o médula, inconstante en humanos, rodeada del córtex, la capa más gruesa responsable de la fortaleza del pelo, que a su vez está envuelto por la cutícula (superficie del pelo). En un corte del segmento inferior, el tallo piloso está envuelto del centro a periferia por la vaina radicular interna (VRI) con sus tres subcapas (cutícula, capa de Huxley y capa de Henle), por la vaina radicular externa (VRE, su capa más interna, en contacto con la capa de Henle, se llama capa acompañante), la capa vítrea o membrana basal y una capa fibrosa externa (tejido conectivo perifolicular). A nivel del istmo, la VRI está ausente.
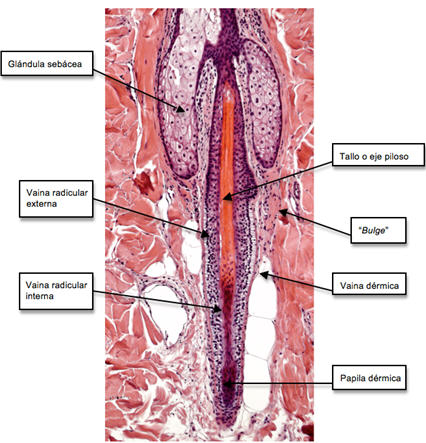
Fig 2: corte histológico, en el que se pueden observar las estructuras que constituyen un folículo piloso. H&E, 40X.
La porción dérmica del FP puede dividirse en dos compartimentos, la papila folicular (PF), localizada en la base del folículo y la vaina dérmica o vaina de tejido conectivo 5, ambas separadas de la porción epitelial del folículo por la membrana basal. La vaina dérmica se extiende desde el epitelio del FP hasta el nivel del "bulge" y es contiguo con la base de la PF.
COMPONENTES CELULARES DEL FOLÍCULO PILOSO
El FP está compuesto por una gran cantidad de células epiteliales y mesenquimatosas, dispuestas en las diversas capas constituyentes, que comprenden más de veinte diferentes poblaciones celulares, las que aparecen y desaparecen o sufren cambios sustanciales, en función de la fase del ciclo o del estímulo hormonal presente en ese momento 6. A grandes rasgos se distinguen: CM, queratinocitos y melanocitos. Además, contiene neuronas, vasos sanguíneos y derivados de precursores de células mastocíticas 7, células inmunitarias y CM neuronales 8.
Una característica importante de las células del "bulge" es su quiescencia, que se mantiene mientras las células circundantes proliferan a un ritmo mucho más alto 1. Las infrecuentes divisiones de estas CM originan células hijas, que retienen el fenotipo de CM y experimentan una rápida proliferación y diferenciación terminal para repoblar el tejido; estas células hijas son conocidas como células de amplificación de tránsito. Las células madre foliculares (CMf) están localizadas precisamente a nivel del "bulge", porción de la VRE, en el punto de inserción del músculo erector del pelo y no en el bulbo piloso como se pensaba anteriormente. Son células con características de CM mesenquimales, con alto potencial proliferativo, multipotentes, encargadas de regenerar no sólo el FP, sino también las glándulas sebáceas y la epidermis interfolicular. Estas células del "bulge" son las encargadas de renovar la porción inferior del folículo en cada fase anágena y por tanto, de ella derivan todos los tipos celulares epiteliales en dicha región 1. En caso de interrupción de la superficie cutánea, CM epidérmicas del "bulge" migran a la epidermis, para contribuir a la reparación tisular 1, pero no contribuyen a la homeostasis normal de la epidermis de piel no lesionada. Debido a la larga vida de estas células y su quiescencia, son más susceptibles a mutaciones y carcinogénesis. El "bulge" folicular supone el nido más importante caracterizado de CM en la piel. Se identifica como un engrosamiento excéntrico unilateral de la VRE, claramente apreciable en ratones y en embriones humanos; sin embargo, su distinción es difícil en folículos humanos adultos. Dentro de la zona del "bulge" se han identificado células melanocíticas, células mesenquimatosas primitivas, precursores de mastocitos, células de Langerhans inmaduras, células de Merkel y células neurales 9,10,11. El microambiente del "bulge" contribuye en el mantenimiento de las diferentes líneas celulares, en un estado relativamente indiferenciado.
En el FP maduro se pueden encontrar tres compartimentos del linaje melanocítico 12, CM melanocíticas, células melanocíticas progenitoras o melanoblastos y melanocitos diferenciados. Los melanocitos son células derivadas de la cresta neural, especializadas en la producción de pigmento. Los melanoblastos, precursores de los melanocitos, emigran durante el desarrollo embrionario a los FPs en desarrollo. En la región del "bulge", los melanoblastos pueden diferenciarse a melanocitos o permanecer como CM melanocíticas. Las CM melanocíticas fueron las primeras en identificarse y se localizan quiescentes en la región del "bulge", donde tienen su nicho. Los melanocitos del FP se forman en el "bulge", a partir de células madre melanocíticas, al inicio del ciclo del pelo (fase anágena), migran al bulbo piloso en anágena para conferir color al pelo y mueren por apoptosis al final del ciclo (catágeno).
En la base del folículo, las células de la matriz forman el bulbo, que incluye un grupo de células mesenquimatosas, la PF (papila folicular). Mediante la interacción con la PF, las células de la matriz mantienen su estado proliferativo indiferenciado. Esta interacción induce a las células de la matriz (sobre todo queratinocitos) a ascender y diferenciarse, durante la fase de anágeno, en una de las líneas celulares de las capas concéntricas del FP 4. Las células de la PF determinan el grosor del pelo, su longitud y su ciclo. Tanto la papila como la vaina dérmica están compuestas por fibroblastos especializados, de origen mesenquimatoso. No obstante, la expresión de marcadores neuronales en células de la PF, sugiere que una porción de células de la misma derivarían de la cresta neural 13.
El FP es un lugar de gran interacción inmune por la solución de continuidad que representa en la superficie cutánea 6. Las células presentadoras de antígenos se encuentran en muy alta densidad en la piel que tenga FPs; se localizan fundamentalmente en el segmento superior del folículo y disminuyen en cantidad hacia el segmento inferior.
OBTENCIÓN DE CÉLULAS Y CULTIVO
1. Células del "bulge": la micro disección manual basada en la morfología ha sido utilizada para aislar estas células, pero el costosay se añade a la incertidumbre sobre la pureza de la muestra obtenida.
Marcadores de células del "bulge", como CD34 y el promotor de actividad Keratina15 (K15), permiten un aislamiento más preciso 1. Probablemente, CD34 es el marcador más específico de células del "bulge" del FP de ratón hasta la fecha, aunque no se expresa en el "bulge" de folículos humanos. Sin embargo, sí se expresa CD34 en las células de la VRE de la porción inferior de folículos humanos en anágeno. Curiosamente, CD34 es un marcador de células madre hematopoyéticas en médula ósea humana, pero no en ratones 1.
La proteína K15 se expresa preferentemente en las células del "bulge" de folículos humanos, mientras que las células de la porción inferior del folículo son débilmente positivas para la misma. Los estudios realizados sugieren que las células positivas para CD34 son descendientes inmediatos de las CM del "bulge" positivas para K15.
Mediante análisis con "microarrays" (micro agrupación) se puede obtener el perfil de expresión génica de estas células. Estudios realizados en humanos 14 han demostrado que las células del "bulge", expresan altos niveles de los marcadores de superficie CD200 y CD59, comparados con otras regiones del folículo, mientras que CD24, CD34, CD71 y CD146 se expresan sólo débilmente. En particular, CD200 se localiza preferentemente en el "bulge" y representa probablemente el mejor marcador de superficie de las células del "bulge", de los folículos humanos. Las células aisladas teniendo en cuenta estos marcadores, muestran una alta capacidad proliferativa in vitro, lo que sugiere su utilidad para aislar CMf.
Inmediatamente, por encima del área del "bulge", debajo de la desembocadura de la glándula sebácea, se localiza un área de CM pluri-potenciales, positivas para el marcador específico de células madre neuronales, nestina 15. Estas células son K15 y CD34 negativas, a diferencia de las del "bulge" (área de células progenitoras queratinocíticas), que son nestina negativas y K15 positivas.
2. Células de la papila folicular (llamada dérmica) y vaina dérmica: el método más empleado para aislar células de la PD es la micro-disección quirúrgica 5, que también posibilita aislar células de la vaina dérmica adyacentes a la papila, pero es un proceso laborioso. Entre los marcadores de las células dérmicas se encuentran la fosfatasa alcalina (FA), la alfa-actina del músculo liso (αAML), el proteoglicano versican, la proteína corin y la prominina-1 (CD133). La expresión de unos u otros de estos marcadores, permiten distinguir las células de la PD de las de la vaina dérmica, por ejemplo, las de la vaina tienen una baja actividad de FA y alta expresión de αAML, tanto in vivo como in vitro; sin embargo, las células de la PD muestran una elevada expresión de FA e indetectable de αAML in vivo, pero fuerte actividad de αAML in vitro.
Para obtener células de la papila y vaina dérmica se han empleado varios protocolos, que incluyen el explante y la disociación enzimática 16. Mediante el explante el rendimiento es bajo, probablemente por la pobre adhesión del mismo. No obstante, la disociación enzimática con colagenasa tipo IV, diaspasa o combinación de colagenasa tipo I y diaspasa, ha demostrado ser más efectiva en poco tiempo, en la obtención de una cantidad considerable de células viables de la PD, con el problema de los daños enzimáticos a las células aisladas y sus proteínas de superficie. Algunos autores han intentado facilitar la adhesión y el crecimiento de células de PD de un explante folicular, mediante digestión breve con colagenasa tipo I 17. Aún se precisan mejoras en la eficiencia del aislamiento celular.
En cultivo, las células de la PD forman agregados multicapa en los primeros pases, tendencia que parece estar relacionada con su capacidad de inducir la formación del pelo 18; pero esta característica desaparece gradualmente en cultivo prolongado. Una vez aisladas las células, si se pretende regenerar pelo, el objetivo es mantener su capacidad tricogénica. El cultivo con suplementos de factor de crecimiento de fibroblastos tipo 2, puede prolongar el tiempo de pérdida de este potencial, lo que ha sido demostrado en células de ratas y humanas 19; el cocultivo con queratinocitos posee un efecto similar 20.
La evidencia experimental disponible indica que, tanto las células del "bulge" como las de la PD cultivadas y expandidas in vitro, presentan características de CM en cuanto a su auto-renovación continuada y alta capacidad proliferativa: alcanzan la confluencia en poco tiempo y preservan sus marcadores de CM.
3. Queratinocitos: los queratinocitos autólogos pueden aislarse de la VRE de FPs de cuero cabelludo, desprendidos en anágeno. Así pues, la VRE representa una fuente fácilmente disponible de queratinocitos con alta capacidad proliferativa 20,21, incluso en caso de donantes añosos 22. Los queratinocitos foliculares tienen un potencial de diferenciación similar a los queratinocitos inter-foliculares.
Células madre y alopecia: las alopecias se pueden clasificar en cicatriciales y no cicatriciales (Olsen y col, 2003). La localización de las células madre del FP en la región del "bulge", puede explicar por qué algunos tipos de alopecias inflamatorias dan lugar a una pérdida permanente del FP (como liquen plano pilar y lupus eritematoso discoide), mientras que otras (como alopecia areata) son reversibles 1. En las alopecias cicatriciales, la inflamación afecta a la porción superior del FP, incluyendo la región del "bulge", de forma que las CM necesarias para la regeneración del folículo son dañadas. Por el contrario, el infiltrado inflamatorio en la alopecia areata, especialmente en lesiones tempranas, afecta a la región bulbar del folículo, que está compuesta por la progenie celular del "bulge". Dado que el bulbo es responsable inmediato de la producción del eje piloso, su destrucción lleva a la pérdida de pelo, pero como el "bulge" permanece intacto, una nueva porción inferior del folículo es creada en anágeno y por tanto, el consiguiente tallo piloso. Incluso los pacientes con alopecia areata de muchos años de evolución, pueden conseguir la repoblación del cabello espontáneamente o en respuesta a inmuno-moduladores.
Regeneración folicular: el término tricogénesis hace referencia a la habilidad de las células de formar un nuevo FP. Las células con mayor capacidad tricogénica, son aquellas precoces en los estadios de desarrollo del FP 16, aunque las células de los folículos adultos aún la mantienen. Durante la embriogénesis, las CM mesenquimales forman condensaciones en la dermis, por debajo de la epidermis. En un proceso mediado por diversos factores, estos agregados inducen la proliferación y diferenciación de las células epidérmicas en células foliculares. La inyección de células tricogénicas de ratón en la hipodermis de un ratón, ha permitido la creación de nuevos FPs en el mismo 23.
Las CMf podrían utilizarse para generar nuevos folículos en las alopecias 1. Para que esto ocurra, las células aisladas del "bulge" deberían ser capaces de generar nuevos FPs. Al menos dos grupos (Blanpain y col, 2004; Morris y col, 2004) han mostrado que células del "bulge" recién aisladas de un ratón adulto, cuando se combinan con células dérmicas neonatales (inductoras), forman FPs tras inyección en un ratón inmuno-deficiente.
Las células de la vaina dérmica desempeñan un importante papel en el mantenimiento de la PD, ya que, actúan como reservorio de células de la misma 16. Así pues, las células de la vaina dérmica son capaces de diferenciarse en células de la PD en caso de pérdida y viceversa, lo que sugiere una funcionalidad similar y comparable potencial de formación de pelo. Realmente, ambas pueden producir FPs, como se ha visto en ratones 24. No obstante, sin células epidérmicas, ninguna de las dos puede desarrollar FPs, lo que demuestra la necesidad de la interacción epitelio-mesénquima.
El objetivo del tratamiento de la alopecia en ingeniería tisular, incluye aumentar el número de folículos existentes, por ejemplo, mediante ampliación del número de queratinocitos y células de la PD in vitro, previo al trasplante. Durante muchos años, se han empleado cultivos de queratinocitos de epidermis neonatal para generar FP. Más recientemente, han comenzado a emplearse con el mismo fin células aisladas del "bulge" de los FP de ratones adultos.
Sin embargo, el uso de ratones inmunodeficientes en estos modelos in vivo tiene inconvenientes. Se conoce muy poco sobre la influencia de los factores del huésped, en el neo-génesis del FP. Por otro lado, la falta de inmunosupresión absoluta de los ratones puede modificar los resultados. Además, en estos modelos in vivo se precisan varios miles a millones de células para regenerar un único FP 5. Aunque los estudios disponibles, muestran la consecución de folículo-génesis in vivo en ratones o ratas, los inconvenientes mencionados se ponen de manifiesto al intentar regenerar FPs humanos, en los que se precisan más estudios.
Otras aplicaciones en ingeniería tisular: estudios recientes (Takahaski y col, 2007) han demostrado que la adición de cuatro factores de transcripción, (Oct4, Sox2, Myc y Klf4) permite reprogramar células fibroblásticas diferenciadas maduras en CM similares a las embrionarias pluripotentes, con la habilidad de diferenciarse de cualquier tipo celular 25. También se ha sugerido que las células del "bulge" u otras CM queratinocíticas, pueden constituir una fuente ideal de células para su reprogramación en CM embrionarias pluripotentes y su re diferenciación en diferentes tipos celulares como: células cardíacas, neuronas, hepatocitos, células pancreáticas, etc, que podrían utilizarse para el tratamiento de una multitud de enfermedades humanas 26.
Así pues, tras una apropiada estimulación de las CM epidérmicas, estas expresan antígenos característicos de las CM embrionarias y CM hematopoyéticas. Estudios recientes demuestran que es posible construir córnea utilizando trasplante autólogo de CM epidérmicas 27,28. También ha sido posible mediante células dérmicas foliculares, dar lugar a células hematopoyéticas y reconstituir el sistema hematopoyético de un ratón letalmente irradiado 29 o contribuir a la repoblación hematopoyética en animales, con dosis de radiación subletal 30.
Además, se ha logrado crear células de músculo liso a partir de CM de folículos humanos 31. En esta misma línea de investigación, recientemente ha sido posible construir injertos vasculares, mediante el empleo de CM mesenquimales derivadas de FPs de ovejas y un biomaterial natural des-celularizado, llamado SIS (small intestinal submucosa) 32. Estas células foliculares constituyen pues una nueva fuente de células de músculo liso, para la creación de una capa media vascular resistente y funcional, con potencial incluso para la implantación arterial.
Por otro lado, la población de CM epidérmicas exhibe capacidad de generar epitelio humano, lo que supone una gran oportunidad en la creación de piel artificial para reparación de úlceras cutáneas. Recientemente, un equivalente de piel construido con queratinocitos alogénicos y fibroblastos derivados de prepucio, ensamblados en una estructura bicapa con matriz de colágeno bovino, ha demostrado ser más eficaz en la curación de las úlceras venosas de piernas que sólo la terapia compresiva 33.
También se ha estudiado en diversos ensayos clínicos el potencial de las CMf, para mejorar la curación en pacientes quemados. En uno de ellos, los FPs fueron implantados en el sustituto dérmico comercial Integra TM 34, con una técnica novedosa de microinjerto, con el resultado de reepitelización completa y cuero cabelludo con cabello, sin la necesidad de injertos de piel de espesor parcial. En el mismo camino, un ensayo clínico emplea equivalentes epidérmicos autólogos completamente diferenciados, derivados de queratinocitos/CM epidérmicas de la VRE de FPs en anágeno desprendidos, para demostrar la efectividad de autoinjertos de piel de espesor parcial, en promover la curación de úlceras vasculares recalcitrantes de piernas 35.
Las cicatrices cutáneas son a menudo hipopigmentadas 9, debido a la destrucción del FP. Se han desarrollado eficientes sustitutos de piel por ingeniería tisular 36. Sin embargo, estos sustitutos carecen de pigmentación. La ingeniería tisular de la piel debe ir encaminada no sólo a la incorporación e inducción de estructuras diferenciadas, sino también a insertar sistemas de pigmentación en los sustitutos de piel. De ahí la importancia de incorporación de melanocitos. La repigmentación perifolicular en el vitiligo tras la fototerapia, se debe a la migración de CM melanocíticas desde el FP a la piel de alrededor. Por eso, el cultivo de melanocitos humanos se utiliza cada vez más en el tratamiento del vitiligo.
Por otro lado, la terapia génica es otra vía que permitiría abordar el tratamiento de enfermedades cutáneas. Como las células del "bulge" intervienen en la reparación de la epidermis interfolicular, en caso de heridas epidérmicas, la transferencia del gen diana en las células del área del "bulge", podría suponer un avance importante en la terapéutica de trastornos genéticos cutáneos, como la epidermolisis bullosa 37. No sería útil para genodermatosis sin heridas severas, ya que, las células del "bulge" no intervienen en la homeostasis normal de la piel.
Las células nestina positivas y K15 negativas del FP, forman colonias celulares y se diferencian de neuronas, células gliales, queratinocitos, melanocitos y células del músculo liso 8. La red de vasos sanguíneos de la piel también procede de estas células 38. El trasplante de estas células de FP de ratón, en un nervio ciático o médula espinal seccionadas de un ratón inmunocompetente, ha demostrado la diferenciación de las mismas a células de Schwann y la consiguiente formación de vainas de mielina 39,40, con recuperación de la función nerviosa. Parece que las células implantadas promueven el crecimiento axonal de neuronas pre-existentes. Además, esto también se ha observado al implantar células nestina positivas de folículos humanos a ratones 41.
Implicaciones terapéuticas de las células madre foliculares: existen numerosas ventajas que resultan de la aplicación de la plasticidad de CM cutáneas 42. En primer lugar, las células de los FPs son fácilmente accesibles, mediante biopsia cutánea, lo que evita procedimientos más invasivos y agresivos.
En segundo lugar, hay evidencia creciente que el FP tiene un perfil inmunológico único y supone una entidad inmuno-privilegiada. A esto contribuyen la ausencia virtual de CMH tipo I y la poca cantidad de células inmunes, especialmente cerca de la PD. En un estudio, se trasplantó tejido de la vaina dérmica folicular de una persona a otra y se observó que no sólo había inducción de folículos y crecimiento de pelo, sino que no hubo rechazo 43.
En tercer lugar, las CM cutáneas pueden servir como diana de terapia génica. Una de las características que las hace atractivas para tal fin, es la renovación cutánea a través de proliferación de CM. Estas células pueden modificarse con el gen que interese y la expresión del mismo continuará en la vida adulta.
CONCLUSIÓN
El empleo de un medio de inducción adecuado, permite que las CMf se diferencien a distintos tipos celulares, lo que abre una amplia ventana para la creación de injertos titulares, encaminados a la resolución de multitud de procesos patológicos. Además, la posibilidad de crear sustitutos cutáneos que incluyan FPs y melanocitos capaces de pigmentar el injerto, suponen una aproximación futura a la consecución de tejidos casi idénticos a los nativos. Se necesitan más estudios sobre la regeneración de FPs en humanos, con el objetivo de solventar las múltiples patologías que afectan al FP y conllevan alopecias cicatriciales.
La piel, con sus ventajas específicas, constituye una nueva fuente de CM adultas para la medicina regenerativa. En este sentido, el FP como centro de diversas poblaciones celulares, está ganando interés, debido a su riqueza en CM y a su fácil accesibilidad y aislamiento.
1. Cotsarelis G. Epithelial Stem Cells: A Folliculocentric View. J Invest Dermatol 2006; 126: 1459-1468. [ Links ]
2. Chuong CM, Cotsarelis G, Stenn K. Defining hair follicles in the age of stem cell bioengineering. J Invest Dermatol 2007; 127: 2098-2100. [ Links ]
3. Restrepo R, McKee PH, Calonje E. Diseases of the hair. In: Pathology of the skin. McKee PH, Calonje E, Granter SR. Elsevier Mosby. 2008; 1061-1068. [ Links ]
4. Pasolli HA. The Hair Follicle Bulge: A Niche for Adult Stem Cells. Microsc Microanal 2011; 17: 513-519. [ Links ]
5. Yang CC, Cotsarelis G. Review of hair follicle dermal cells. J Dermatol Sci 2010; 57 (1): 2. [ Links ]
6. Restrepo R. Anatomía microscópica del folículo piloso. Rev Asoc Colomb Dermatol 2010; 18: 1-38. [ Links ]
7. Jahoda CA. Cell movement in the hair follicle dermis - more than a two -way street? J Invest Dermatol 2003; 121: 1267. [ Links ]
8. Amoh Y, Li L, Katsuoka K, Penman S, Hoffman RM. Multipotent nestin-positive, keratin-negative hair-follicle bulge stem cells can form neurons. Proc Natl Acad Sci USA 2005; 102 (15): 5530-5534. [ Links ]
9. Narisawa EK, Jordan SA, Oshima H. Dominant role of the niche in melanocyte stem-cell fate determination. Nature, 2002; 416: 854-860. [ Links ]
10. Lako M, Armstrong L, Cairns PM. Hair follicle dermal cells repopulate the mouse haematopoietic system. J Cell Sci 2002; 115: 3967-3974. [ Links ]
11. Kumamoto T, Shalhevet D, Matsue H. Hair follicles serve as local reservoirs of skin mast cell precursors. Blood 2003; 102: 1654-1660. [ Links ]
12. Gola M, Czajkowski R, Bajek A, Dura A, Drewa T. Melanocyte stem cells: Biology and current aspects. Med SciMonit 2012; 18 (10): RA155-159. [ Links ]
13. Fernandes KJ, McKenzie IA, Mill P, Smith KM, Akhavan M, Barnabé-Heider F, Biernaskie J, Junek A, Kobayashi NR, Toma JG, Kaplan DR, Labosky PA, Rafuse V, Hui CC, Miller FD. A dermal Niche for multipotent adult skin-derived precursor cells. Nat Cell Biol 2004; 6: 1082-1093. [ Links ]
14. Ohyama M, Terunuma A, Tock CL, Radonovich MF, Pise-Masison CA, Hopping SB, Brady JN, Udey MC, Vogel JC. Characterization and isolation of stem cell-enriched human hair follicle bulge cells. J Clin Invest 2006; 116: 249-260. [ Links ]
15. Amoh Y, Katsuoka K, Hoffman RM. The advantages of hair follicle pluripotent stem cells over embryonic stem cells and induced pluripotent stem cells for regenerative medicine. J Dermatol Sci 2010; 60 (3):131-137. [ Links ]
16. Mahjour SB, Ghaffarpasand F, Wang H. Hair follicle regeneration in skin grafts: current concepts and future perspectives. Tissue Eng Part B Rev 2012; 18 (1): 15-23. [ Links ]
17. Li Y, Li GQ, Lin CM, Cai XN. One-step collagenase I treatment: an efficient way for isolation and cultivation of human scalp dermal papilla cells. J Dermatol Sci 2005; 37 (1): 58-60. [ Links ]
18. Osada A, Iwabuchi T, Kishimoto J, Hamazaki TS, Okochi H. Long-term culture of Mouse vibrissa derma papilla cells and de novo hair follicle induction. Tissue Eng 2007; 13: 975-982. [ Links ]
19. Osada A, Kobayashi K, Masui S, Hamazaki TS, Yasuda K y Okochi H. Cloned cells from the murine dermal papilla have hair-inducing ability. J Dermatol Sci 2009; 54 (2): 129-131. [ Links ]
20. Inamatsu M, Matsuzaki T, Iwanari H y Yoshizato K. Establishment of rat dermal papilla cell lines that sustain the potency to induce hair follicles from a follicular skin. J Invest Dermatol 1998; 111 (5): 767-775. [ Links ]
21. Moll I. Proliferative potential of different keratinocytes of plucked human hair follicles. J Invest Dermatol 1995; 105: 14-21. [ Links ]
22. Limat A, Hunziker T. Cultivation of keratinocytes from the outer root sheath of human hair follicles. In: Jones GE, Editor. Methods in molecular medicine. Human cell culture protocols. Totowa (NJ): Humana Press Inc 1996; 21-31. [ Links ]
23. Zheng Y, Nace A, Chen W, Watkins K, Sergott L, Homan Y, Vandeberg JL, Breen M, Stenn K. Mature Hair Follicles Generated from Dissociated Cells: A Universal Mechanism of Folliculo-neogenesis. Dev Dyn 2010; 239 (10): 2619-2626. [ Links ]
24. Driskell RR, Giangreco A, Jensen KB, Mulder KW, Watt FM. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development 2009; 136 (16): 2815-2823. [ Links ]
25. Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell.2007; 131: 861-872. [ Links ]
26. Li J, Greco V, Guasch G, Fuchs E, Mombaerts P. Mice cloned from skin cells. Proc Natl Acad Sci 2007; 104: 2738-2743. [ Links ]
27. Blazejewska EA, Schlotzer-Schrehardt U, Zenkel M, Bachmann B, Chankiewitz E, Jacobi C, Kruse FE. Corneal limbal microenvironment can induce trans-differentiation of hair follicle stem cells into corneal epithelial-like cells. Stem Cells 2009; 27: 642-652. [ Links ]
28. Yang K, Jiang Z, Wang D, Lian X, Yang T. Corneal epithelial-like trans-differentiation of hair follicle stem cells is mediated by pax6 and beta- catenin/Lef-1. Cell Biol Int 2005; 33: 861-866. [ Links ]
29. Lako M, Armstrong L, Cairns PM, Harris S, Hole N, Jahoda CA. Hair follicle dermal cells repopulate the mouse haematopoietic system. J Cell Sci 2002; 115 (Pt 20): 3967-3974. [ Links ]
30. Shi CM, Cheng TM, Su YP, Mai Y, Qu JF, Ran XZ. Transplantation of dermal multipotent cells promotes the hematopoietic recovery in sublethally irradiated rats. J Radiat Res 2004; 45 (1): 19-24. [ Links ]
31. Liu JY, Peng HF, Gopinath S, Tian J, Andreadis ST. Derivation of functional smooth muscle cells from multipotent human hair follicle mesenchymal stem cells. Tissue Eng Part A 2010; 16 (8): 2553-2564. [ Links ]
32. Peng HF, Liu JY, Andreadis ST, Swartz DD. Hair follicle-derived smooth muscle cells and small intestinal submucosa for engineering mechanically robust and vasoreactive vascular media. Tissue Eng Part A. 2011; 17 (7-8): 981-990. [ Links ]
33. Falanga V, Margolis D, Alvarez O, Auletta M, Maggiacomo F, Altman M, Jensen J, Sabolinski M, Hardin-Young J. Rapid Ealing of venous ulcers and lack of clinical rejection with an allogenic cultured human skin equivalent. Arch Dermatol 1998; 134: 293-300. [ Links ]
34. Navsaria HA, Ojeh NO, Moiemen N, Griffiths MA y Frame JD. Reepithelialization of a full-thickness burn from stem cells of hair follicles micrografted into a tissue-engineered dermal template (Integra). Plast Reconstr Surg 2004; 113 (3): 978-981. [ Links ]
35. Tausche AK, Skaria M, Böhlen L, Liebold K, Hafner J, Friedlein H, Meurer M, Goedkoop RJ, Wollina U, Salomon D, Hunziker T. An autologous epidermal equivalent tissue-engineered from follicular outer root sheath keratinocytes is as effective as split-thickness skin autograft in recalcitrant vascular leg ulcers. Wound Repair Regen 2003; 11 (4): 248-252. [ Links ]
36. Carriel V, Garzón I, Jiménez JM, Oliveira AC, Arias-Santiago S, Campos A, Sánchez-Quevedo MC y Alaminos M. Epithelial and stromal developmental patterns in a novel substitute of the human skin generated with fibrin-agarose biomaterials. Cells Tissues Organs 2012; 196 (1): 1-12. [ Links ]
37. Sugiyama-Nakagiri Y, Akiyama M y Shimizu H. Hair follicle stem cell-targeted gene transfer and reconstitution system. Gene Ther 2006; 13: 732-737. [ Links ]
38. Amoh Y, Li L, Yang M, Moossa AR, Katsuoka K, Penman S, Hoffman RM. Nascent blood vessels in the skin arise from nestin-expressing hair-follicle cells. Proc Natl Acad Sci USA 2004; 101 (36): 13291-13295. [ Links ]
39. Amoh Y, Li L, Campillo R, Kawahara K, Katsuoka K, Penman S, Hoffman RM. Implanted hair follicle stem cells form Schwann cells that support repair of severed peripheral nerves. Proc Natl Acad Sci USA 2005; 102 (49): 17734-17738. [ Links ]
40. Amoh Y, Li L, Katsuoka K, Hoffman RM. Multipotent hair follicle stem cells promote repair of spinal cord injury and recovery of walking function. Cell Cycle 2008; 7 (12): 1865-1869. [ Links ]
41. Amoh Y, Kanoh M, Niiyama S, Hamada Y, Kawahara K, Sato Y, Hoffman RM, Katsuoka K. Human hair follicle pluripotent stem (hfPS) cells promote regeneration of peripheral-nerve injury: an advantageous alternative to ES and iPS cells. J Cell Biochem 2009; 107 (5): 1016-1020. [ Links ]
42. Chunmeng S, Tianmin C. Skin: a promising reservoir for adult stem cell populations. Med Hypotheses 2004; 62 (5): 683-688. [ Links ]
43. Reynolds AJ, Lawrence C, Cserhalmi-Friedman PB, Christiano AM, Jahoda CA. Trans-gender induction of hair follicles. Nature 1999; 402 (6757): 33-34. [ Links ]














