Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.97 no.4 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULO DE REVISIÓN
Estomatitis por metotrexate. Breve revisión del tema
Methotrexate stomatitis. A brief review
AD Pérez- Elizondo * y RE Achenbach **
* Dermato-Oncólogo. Jefe de la Consulta Externa del Instituto Materno-Infantil del Estado de México. Profesor Titular de la Cátedra de Dermatología. Universidad Autónoma del Estado de México.
** Jefe de Unidad Dermatología. Hospital General de Agudos Dr. Ignacio Pirovano. Av. Monroe 3550 (1430). Ciudad Autónoma de Buenos Aires. Argentina.
E-mail: antoniodavid64@gmail.com
Los autores no poseen conflictos de interés alguno.
Recibido: 02.11.2016
Aceptado para su Publicación: 03.12.2016
RESUMEN
El empleo de metotrexate como inmunoimodulador y antimetabolito, ha ido en aumento debido a su efectividad terapéutica, bajo costo y su esquema sencillo de dosis única semanal. Sin embargo, recientemente se han reportado efectos adversos graves relacionados con su administración, entre ellos la estomatitis. Las úlceras bucales son el efecto adverso oral más frecuente y se relacionan con la falta de administración complementaria de ácido fólico, iatrogenias ocasionadas por errores en la ingestión o interacciones farmacológicas.
PALABRAS CLAVE: metotrexate, úlceras orales, mucoestomatitis inducida por fármacos.
SUMMARY
The use of methotrexate as immunomodulator and antimetabolite has been increasing because of its therapeutic effectiveness, low cost, and simple scheme single dose weekly. However, have recently been reported serious adverse effects related to administration, including stomatitis. Mouth ulcers are the most frequent oral adverse effect and relate to the lack of supplemental folic acid, iatrogenic errors caused by ingestion or drug interactions.
KEY WORDS: methotrexate, oral ulceration, mucositis, drug-induced stomatitis.
INTRODUCCIÓN
Las alteraciones orales, son una de las principales complicaciones de la variada terapia, de los pacientes con cáncer. Se calcula que del 30 al 50% de los casos sometidos a quimioterapia, desarrolla: estomatitis, infección local, sensación ardorosa y hemorragia. Más aún, aquellos bajo radiaciones ionizantes por procesos tumorales malignos en cabeza y cuello, experimentarán daño irreparable de las glándulas salivales, mucosa oral y las estructuras músculoesqueleticas, condicionando xerostomía, problemas odontológicos y osteoradionecrosis. La mucositis es una reacción inflamatoria que puede involucrar todo el tracto gastrointestinal, se describe una estomatitis eritematosa que aparece entre el tercero y sexto día de iniciada la quimioterapia; la otra más grave, ulcerosa, comienza después del séptimo día del manejo antineoplásico. Las manifestaciones clínicas van desde la sensación ardorosa u hormigueo con fisuraciones y descamación de los labios, sequedad de la boca, dificultad deglutoria, diarrea hasta infecciones herpéticas o candidósicas en pacientes neutropénicos, que ponen en riesgo su vida. Es más probable que los fármacos antineoplásicos como la actinomicina D, doxorrubicina, metotrexate, o el 5 fluorouracilo en infusión continua o en ciclos frecuentes, causen mucositis que cantidades similares de los mismos administrados, en bolos intravenosos. 1,2,3
METOTREXATE. EL FÁRMACO
Es un medicamento inmunomodulador y antimetabolito antagonista, competitivo del ácido fólico que reduce las concentraciones de tetrahidrofolato, su forma activa inhibe las enzimas dihidrofolato reductasa y timidilato sintetasa, responsables de la síntesis de ácidos nucleicos principalmente purinas, por lo que funciona como citostático que bloquea la fase S del ciclo celular y es precisamente, el mecanismo responsable de sus efectos adversos. Además, al parecer su capacidad competitiva con el ácido fólico, da lugar a la acumulación de poliglutamatos favoreciendo su acción terapéutica, así como sus efectos deletéreos en la mucosa digestiva y médula ósea, complejos tisulares de rápida reproducción celular. Los esquemas terapéuticos a dosis elevadas, resultan eficaces como quimioterápico en el manejo de algunos tumores sólidos, linfomas y leucemias. La dosificación semanal a dosis reducidas (7.5 a 25 mg) da lugar a una absorción intestinal del 70%, alcanzando el pico sérico en término de una hora. Su eliminación es vía renal, su interacción farmacológica con antinflamatorios no esteroideos y el ácido acetilsalicílico es relativamente segura, no así con las sulfonamidas de lenta eliminación, cuya combinación es desfavorable. Su acción inmunomoduladora resulta benéfica en el tratamiento de artritis reumatoide, psoriasis o enfermedad de Crohn; en trastornos autoinmunitarios, permite el ahorro de corticoides sistémicos con retraso de la administración de citostáticos y graves efectos secundarios. Al parecer su capacidad competitiva con ácido fólico, da lugar a la acumulación de poliglutamatos favoreciendo su acción terapéutica, así como sus efectos deletéreos en la mucosa digestiva y médula ósea, complejos tisulares de rápida reproducción celular. 4,5,6
Son factores de riesgo: los extremos de la vida, el género femenino, alteraciones orales previas (higiene bucal inadecuada, prótesis defectuosas, herpes simple o candidosis), medicamentos que condicionan xerostomía (antihistamínicos, antidepresivos, calcioantagonistas), neutropenia, la falta de suplementos de folatos e incluso la sobredosificación diaria.
Tal como se mencionó anteriormente, los efectos adversos acontecen en 30 a 80% de los casos lo que provoca abandono del tratamiento en 35%, tasa mayor que la causada por su falta de eficacia. El sistema digestivo es el más afectado presentándose como: estomatitis, disgeusia, náusea, vomito, malestar abdominal, dispepsia, diarrea y pérdida de peso. Sin duda, la presencia de estomatitis altera la calidad de vida de estos pacientes, por la presencia de úlceras orales dolorosas que dificultan la alimentación y pueden promover la progresión del padecimiento subyacente. 7
TRATAMIENTO
El consejo fundamental es la reducción paulatina de la dosificación, por la reagudización sintomática de algunas patologías, tales como artritis reumatoide o artropatía psoriática. En algunos casos el suministro de ácido folínico, a dosis de impregnación e infusión durante dos días, revierte la mucositis y la pancitopenia.
Las pautas terapéuticas recomendadas son:
a. Dieta, ingesta abundante de líquidos y proteínas en casos graves, nutrición parenteral por sonda nasogástrica.
b. Limpieza de cavidad oral: Enjuagues con solución fisiológica, bicarbonato de sodio.
c. Películas protectoras: gelclair, mejoría sintomática por tres horas.
d. Anestésicos locales: lidocaína viscosa al 2%.
e. Debridantes: solución bicarbonatada ± agua oxigenada.
f. Antisépticos: clorhexidina, yodopovidona.
g. Antibióticos: gentamicina, ácido fuscídico, mupirocina.
Hace poco se inició la administración de palifermin, factor de crecimiento de queratinocitos, con buen efecto costo-beneficio, pero con efectos secundarios de artralgias, que poco ayudan en estos pacientes con dolor articular crónico. Un metaanálisis reciente, realizado por la colaboración Cochrane, demostró que el factor estimulante de colonias de granulocitos en pacientes con mucositis por citostáticos y el alopurinol, son los únicos agentes sistémicos capaces de reducir el tiempo de recuperación de manifestaciones orales, en pacientes con esquemas quimioterapéuticos (3.5 días menos que con la administración de agentes tópicos); actualmente se evalúa su administración como agentes tópicos, para la prevención de mucositis. 8,9,10,11

Figs 1 y 2: escolar con leucemia linfocítica aguda tratado con metotrexate.

Figs 3 y 4: estomatitis úlceronecrotica resuelta, tras aplicación de solución de clorhexidina y pasta lassar, hacia las dos semanas.

Fig 5: estomatitis eritematosa, artritis reumatoide.

Fig 6: fisuraciones, vesicoampollas, costras, membrana blanquecina adherente en labio inferior, queilitis angular, afección de carrillos y lengua. Escolar tratado con metotrexate por artropatía psoriásica.
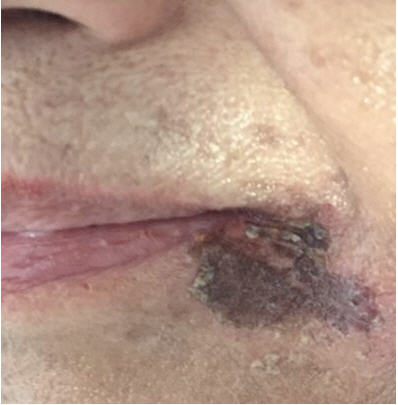
Fig 7: queilitis angular por metotrexate.
1. McKendry RJR. The remarkable spectrum of methotrexate toxicities. Rheum Dis Clin North Am 1997; 23: 939-954. [ Links ]
2. Del Pozo J, Martínez W, García-Silva J, Almagro M, Peña-Penabad C, Fonseca E. Cutaneous ulceration as a sign of methotrexate toxicity. Eur J Dermatol 2001; 11: 450-452. [ Links ]
3. Zachariae H. Methotrexate side-effects. Br J Dermatol 1990; 122: 127-133. [ Links ]
4. Callen J, Kulp-Shorten C. Methotrexate. In: Wolverton SE. Comprehensive dermatologic drug therapy. Indianapolis. Expert Consult 2012; 169-181. [ Links ]
5. Deeming GMJ, Colling Wood J, Pemberton MN. Methotrexate and oral ulceration. Br Dental J 2005; 198: 83-85. [ Links ]
6. López-Olivo MA, Siddhanamatha HR, Shea B, Tugwell P y col. Methotrexate for treatment in rheumatoid arthritis. Cochrane Database Syst Rev 2014; 10: CD000957. [ Links ]
7. Kalantzis A, Mashman Z, Falconer DT, Morgan PR, Odell EW. Oral effects of low-dose methotrexate treatment. Oral Surg Oral Med Oral Pathol Oral Radiol 2005; 100: 52-62. [ Links ]
8. Oli A, Bleyerx WA, Poplack DG. Methotrexate-induced oral mucositis and salivary methotrexate concentrations. Cancer Chemother Pharmacol 1979; 2: 225-226. [ Links ]
9. Al-Quteimat OM, Al-Badaineh MA. Methotrexate and trimethoprim-sulphamethoxazole: extremely serious and life-threatening combination. J Clin Pharm Ther 2013; 38: 203-205. [ Links ]
10. Heina M, Koestler WJ, Raderer M, Steger GG y col. Decrease of duration on and symptoms in chemotherapy-induced oral mucositis by topical GM-CSF: results of a prospective randomised trial. Eur J Cancer 2001; 37: 1994-2002. [ Links ]














