FASES DEL CICLO CAPILAR. ALOPECIA
El ciclo capilar implica una secuencia de etapas de crecimiento,por las que atraviesa cada folículo piloso, que incluyen la fase anágena (crecimiento activo), catágena (involución) y telógena (reposo)1. La fase anágena puede durar de 2 a 8 años, la catágenade 4 a 6 semanas y la telogéna de 2 a 3 meses; ésta se sigue de la fase exógena, en la que el cabello se desprende2. En el cuero cabelludo normal, el 90-95% de los folículos están en fase anágena y el resto en fase telógena. Diariamente se pierdenalrededor de 100-150 cabellos y en un ciclo capilar normal, cada unoqueda reemplazado en 3-5 años2.
La pérdida de cabello puede ser causada por diversos motivos. La alopecia androgenética (AGA) esel tipo más común de alopecia. Se caracteriza por una pérdida progresiva de cabello,debido a una miniaturización del folículo por causas androgénicas ysu incidencia aumenta con la edad3. Su herencia es poligénica y en términos generales, se produce por la acción de los andrógenos en individuos predispuestos genéticamente. La AGA es más frecuente en varones y en mujeres es más común tras la menopausia, al perderse el “efecto protector” de los estrógenos. Su fisiopatología se caracteriza por una mayor actividad de la 5-alfa-reductasa, enzima que reduce la testosterona a dihidrotestosterona, andrógeno activo en la unidad pilosebácea que acelera y acorta el ciclo capilar4.
Por otra parte, el efluvio telógeno (ET) es uno de los tipos más frecuentes de pérdida no cicatricial de cabello. Se trata de una alopecia difusa en la queel cabello se desprende prematuramente, con una disminución de la densidad capilar. Se ha sugerido que el factor desencadenante provoca una entrada precoz en la fase telógena, con lo que la asincronía habitual en la caída del cabello, se transforma en un período de pérdida sincrónica5. El ET puede ocurrir a cualquier edad, siendo los casos agudos más frecuentes en mujeres1. Por lo general,el trastorno escrónico aunque intermitente, con remisiones aparentes seguidas de recaídas3. La pérdida de cabello no suele parar hasta transcurridos 3-6 meses, después de los que puede notarse nuevo crecimiento. Sin embargo,pueden requerirse 12-18 meses para apreciar un crecimiento significativo,desde el punto de vista estético6.
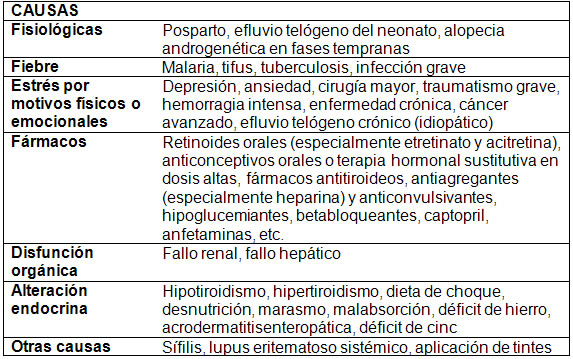
Entre los diversos factores desencadenantes del ET, se incluyen: la disfunción tiroidea, deficiencias nutricionales, pérdida rápida de peso, hemorragia significativa, parto, distintos medicamentos, así como el estrés de origen fisiológico o psicológico1,7(Tabla I).
ESTRÉS Y ALOPECIA
El estrés (del latín stringere o “apretar”) es una reacción fisiológica del organismo, en la que diversos mecanismos de defensa intervienen para afrontaruna situación, que se percibe como amenazante o excesivamente demandante. De incidencia creciente, el estrés continuado altera las funciones cognitivas y las actividades cotidianas8. Los pacientes describen síntomas como alteraciones del sueño, náuseas, palpitaciones o alopecia. Además, perciben angustia, agotamiento, dolor y falta de concentración8.
La capacidad de sobrellevar el estrés se denomina resiliencia y depende de varios factores, como: la personalidad, la salud y el entorno social. Cuanto menor es la resiliencia, más probable es que los síntomas del estrés persistan8. En el caso de la alopecia y dado que ésta suele afectar significativamente a la percepción de la propia imagen, puede generarse un círculo vicioso que dificulta la solución del problema9(Cuadro I).
La relación entre el estrés psicoemocional y la alopecia, fue establecida por primera vez por Selye en 195010. Con posterioridad, varios estudios en modelos murinos describieron un mecanismo neuro-inmunológico, para explicar la alopecia inducida por estrés11,12,13,14,15. En él, la sustancia P, un neuropéptido inmunomodulador presente en la piel y en la inflamación neurogénica, desempeña un papel esencial16,17.
EJE CEREBRO-FOLÍCULO PILOSO Y SUSTANCIA P
En un intento por describir en mayor detalle, la fisiopatología de la alopecia inducida por el estrés, Arcky col propusieron el eje “cerebro-folículo piloso" dependiente de la SP11,13,14 . Este mecanismo se basa en la activación, en respuesta al estrés, del eje hipotalámico-pituitario-adrenal (HPA) (Cuadro II).
Diversas hormonas que se liberan a lo largo del eje HPA, como la hormona liberadora de corticotropina, la adrenocorticotropina y los glucocorticoides, se han asociado a la pérdida de pelo en ratones18,20. Además, se cree que un aumento del tono del eje HPA, estimula la liberación de SP desde las fibras nerviosas cutáneas, que inervan densamente los folículos del cuero cabelludo19,21. La SP liberada localmente induce la apoptosis de los queratinocitos del folículo piloso, activando macrófagos y mastocitos22,23,24, de forma que se liberaninhibidores del crecimiento capilar como el factor de necrosis tumoral alfa25, la interleucina-126o distintas proteasas27.También se ha demostrado que el factor de crecimiento nervioso (NGF), promueve la proliferación de fibras nerviosas que liberan SP, así como la subsiguiente degranulación de los mastocitos28,29.
En resumen, según este modelo el estrés psicoemocional altera el ciclo del folículo piloso in vivo, terminando prematuramente el período normal del crecimiento capilar y activando la apoptosis y distintos eventos inflamatorios nocivos, alrededor del folículo30. Este mecanismo supuso la primera explicación fisiopatológica sólida sobre: cómo el estrés puede causar ET o incluso intervenir en otros tipos de alopecia.
TRATAMIENTO DE LA ALOPECIA INDUCIDA POR ESTRÉS. NUTRICOSMÉTICOS
Teóricamente, cualquier paso o molécula implicada en el eje “cerebro-folículo piloso" puede servir como objetivo terapéutico. La SP ejerce su efecto al unirse a una proteína, presente en la membrana de las células diana; este complejo se denomina receptor NK1 (de neuroquinina 1). En ratones knockout, se ha demostrado que el receptor de la neuroquinina-1 (NK-1R) y la SP, son resistentes a la inducción prematura de la fase catágena y a la apoptosis folicular, inducidos por estrés. Igualmente, la administración de anticuerpos neutralizantes de NGF tras un estímulo estresante, evita la aparición prematura de la fase catágenay reduce el número de mastocitos perifoliculares y la apoptosis de queratinocitos foliculares en ratones1.
Existen distintas opciones terapéuticas para tratar la alopecia inducida por estrés, desde sustancias naturales hasta medicamentos de prescripción. En el caso del ET, en función de la etiología pueden ser adecuados tratamientos que tengan como efecto32: 1) Inhibir la fase catágena, 2) Inducir la fase anágena en folículos telogénicos, 3) Inhibir la fase exógena, 4) Paliar los síntomas asociados al factor desencadentante. Así,en modelos murinos el tratamiento sistémico con antagonistas del NK-1R24, anticuerpos anti-TNF31 y minoxidil tópico33reduce la alopecia inducida por estrés. En cambio, lasbenzodiacepinas están contraindicadas para la terapia a largo plazo, por su alto potencial de adicción34.
En cualquier caso, se evitarán en la medida de lo posible fármacosque favorezcan la fase catágena (betabloqueantes, retinoides, antiagregantes o antitiroideos)y se tratarán los trastornos endocrinos que la promueven (disfunción tiroidea, hiperandrogenismo o hiperprolactinemia). Puede iniciarse también terapia sustitutiva de las deficiencias nutricionales,que favorecen la fase catágena (hierro, zinc, estradiol, proteínas, etc.)1. Como enfoque inicial, se recomienda una ingesta dietética adecuada y la administración oral de 300 mg de sulfato ferroso 3-4 veces al día, realizando la suplementación durante 3-6 meses hasta que se repongan los depósitos35.
Asimismo, pueden ser útiles en esta indicación los nutricosméticos. Se trata de complementos alimenticios, regulados por la Directiva 2002/46/CE36, que, administrados como complemento de una dieta saludable, favorecen la fisiología capilar y dermatológica en general. Los extractos de pasiflora (Passifloraincarnata L.) se encuentranautorizados por la European Medicines Agency (EMA), para el alivio temporal de los síntomas leves de estrés mental y de alteraciones del sueño (EMA/HMPC/669740/2013)37. El extracto de pasiflora forma parte de nutricosméticos orales como:Pilexilcápsulas®Strensia, que lo incorpora, en forma del flavonoide vitexina (apigenina-8-C-glucósido) en su fórmula (mínimo 2,2% PE partes aéreas de pasiflora, vitexina UV, 200 mg/cápsula) junto con hierro, vitaminas de la familia B, cinc y cistina de alta densidad, con la finalidad de paliar el estrés subyacente a la pérdida de cabello. Se encuentra en marcha un estudio piloto, tipo prueba de concepto, realizado en pacientes con efluvio telógeno, secundario a procesos de estrés.
EXTRACTO DE PASIFLORA: EFICACIA Y SEGURIDAD EN LA ALOPECIA INDUCIDA POR ESTRÉS
Passifloraincarnata L., conocida como "flor de la pasión", comprende unas 400 especies originarias de la franja tropical (Fig 1). Sus usos medicinales, que se remontan a los nativos americanos, incluyen el tratamiento de la ansiedad, la abstinencia de opiáceos, el insomnio, el trastorno por déficit de atención con hiperactividad y la epilepsia38,39,46. Su extracto contiene alcaloides, fenoles, flavonoides glicosílicos y compuestos cianogénicos42,47.
El extracto etanólico seco de la pasiflora tiene efectos calmantes bien documentados, así como una buena tolerabilidad8,44 . Sus efectos farmacológicos se han demostrado en dos ensayos clínicos aleatorizados, controlados con placebo48,49. En el primero, se observaron cambios significativos indicativos de actividad calmante,en el perfil electroencefalográficode voluntarios sanos, sin ningún efecto secundario atenuante de la cognición48. En el segundo, se confirmósu efecto en sujetos que padecían ansiedad49. Asimismo, Gibberty col investigaron los efectos de este extracto sobre la resiliencia y la calidad de vida, en 154 pacientes con estrés. Para ello, usaron comprimidos recubiertos que contenían 425 mg del extracto seco de pasiflora (proporción compuesto/extracto 5:1-7:1, solvente de extracción: etanol 50% V/V). El número de comprimidos por paciente fue decidido a criterio del investigador. Se usaron cuestionarios estandarizados para evaluar la resiliencia (RS-13), la calidad de vida (EQ-5D incluyendo EQ-VAS) y el potencial de adicción (BDEPQ). Tras 12 semanas de tratamiento, se observaron mejoras significativas en la resiliencia (RS-13: de 52,1 a 67,7 puntos) y en la calidad de vida (EQ-VAS: de 47,9 a 75,0 puntos) de los pacientes. Además, la puntuación media del cuestionario BDEPQ se redujo significativamente (de 23,0 a 19,3). Los valores medios de todos los síntomas concomitantes (inquietud, alteración del sueño, agotamiento, falta de concentración, transpiración excesiva, náuseas, temblores y palpitaciones) mejoraron significativamente8.
Respecto de la seguridad, no hay que olvidar que la dependencia farmacológica es común con los medicamentos sedantes como, por ejemplo las benzodiazepinas. En el estudio de Gibbert y col previamente citado8, durante el período de tratamiento de 12 semanascon extracto de pasiflora,los resultados del BDEPQ no superaron el valor umbral de la dependencia y se redujeron significativamente, al final del estudio. Además, los pacientes no aumentaron su dosis diaria durante el período de observación. Se detectó asimismo un buen cumplimiento y tolerabilidad del tratamiento, calificada por la mayoría de los pacientes como "muy buena" o "buena", con sólo 3 casos de eventos adversos leves (cansancio)8. Esto sugiere un bajo potencial adictivo y coincide con los datos, que muestran que el extracto de pasiflora es eficaz en el tratamiento de síntomas de abstinencia opioides, como los trastornos del sueño y la ansiedad38,39,40,41,43,50,51. También la EMA reseña que la toxicidad aguda y de dosis repetidas del extracto de pasiflora es baja37.
MECANISMO DE ACCIÓN DEL EXTRACTO DE PASIFLORA
Además de los efectos reconocidos del extracto de P. incarnataa través del eje HPA, se ha demostrado en estudios in vitro que sus propiedades farmacológicas,están mediadas por la modulación del sistema de neurotransmisión del ácido gamma-aminobutírico (GABA), que incluye afinidad por los receptores GABA-A (IC50 101 μg/ml) y GABA-B (IC50 120 μg /ml), así como efectos inhibidores de la captación de GABA(EC50 95,7 μg/ml)8,37,45,52,53.
Además de los efectos ansiolíticos de pasiflora mediados por el sistema GABAérgico, existe una creciente evidencia que las propiedades antioxidantes de sus flavonoides, también contribuyen a su mecanismo de acción. Dado que el estrés psicológico se asocia a una activación de los procesos prooxidantes y proinflamatorios54, estos efectos antirradicales son de gran relevancia8. Por otro lado, se ha demostrado que el sitosterol, uno de los componentes del extracto de pasiflora, actúa como un inhibidor de la actividad de la 5-alfa-reductasa, enzima clave en la AGA55,56. Un inhibidor de esta enzima podría alargar el ciclo capilar y mejorar la alopecia. Por tanto, se plantea como hipótesis un doble mecanismo de acción del extracto de pasiflora, que podría serútil en el tratamiento tanto de la AGA como del ET (Cuadro III), algo que requiere de estudios confirmatorios.
CONCLUSIÓN
El estrés es un factor desencadenante del ET y de otros tipos de alopeciaque dificulta su control. Los especialistas no deben subestimar el impacto emocional de la caída del cabello, que puede provocar un grado de angustia no proporcional a su gravedad objetiva. A medida que se sigue estudiandoel “eje cerebro-folículo piloso”, debeconsiderarse al folículo piloso como unadiana periférica de diversas moléculas bioactivas, involucradas en la cascada del estrés. Cualquier paso o molécula implicada en esta cascada podría servir como objetivo terapéutico, para lo que se necesita seguir investigando.Mientras tanto, los nutricosméticoscon extracto de P. incarnata, que han demostrado ser eficaces y seguros frente al estrés subyacente a la alopecia, representan una buena alternativa para romper este círculo vicioso y mejorar la calidad de vida del paciente.
AGRADECIMIENTO
Los autores agradecen a María de Miguel Gallo la asistencia editorial.
Cuadro I:círculo vicioso de las respuestas psico-emocionales inducidas por la alopecia. Adaptado de Hadshiev 20049
Cuadro II: cascada de eventos del eje “cerebro-folículo piloso"11.
Fig 1:imagen de Passifloraincarnata.
Cuadro III: hipótesis del doble mecanismo de acción del extracto de Passifloraincarnata frente a la alopecia inducida por estrés
Tabla I:causas del efluvio telógeno1