Metodología
Revisión narrativa de la literatura; se realizó la búsqueda bibliográfica en las bases de datos PubMed, Medline y Embase.
Objetivo
Presentar los aspectos más relevantes de la estructura y función de la IL-23 y su relación con la inmunopatogénesis de la psoriasis, para comprender el mecanismo de acción de los nuevos desarrollos de medicamentos biológicos dirigidos contra la IL-23.
Introducción
Las interleucinas (IL) son moléculas de naturaleza proteica producidas por las células del sistema inmunológico y cumplen una función de comunicación de señales a través de la unión a receptores específicos en la superficie celular; entre estas funciones se incluyen el control de la diferenciación, proliferación, migración, apoptosis, entre otros, de las células que sean blanco de su actividad biológica.1, 2La comprensión de la actividad de estas moléculas ha llevado al entendimiento de la fisiología del sistema inmunológico y de la patogénesis de diversas enfermedades que tienen en común la pérdida de la regulación de las vías que modulan este sistema.1
IL-23, citocina de la familia de la IL-12
La IL-23 es una molécula que pertenece a la familia de citocinas de la IL-12, a la cual pertenecen otras tres interleucinas heterodiméricas: IL-12, IL-27 e IL-35, que comparten características estructurales.3 El miembro fundador de esta familia, la IL-12, fue descrita por primera vez en 1990 por dos grupos de investigadores, Kobayashi et al. y Stern et al., quienes encontraron una proteína de 70 kDa que tenía un papel importante en la estimulación de los Linfocitos NK.4, 5 Posteriormente determinaron que estaba compuesta por dos subunidades, una de 35 kD y otra de 40 kD, unidas por puentes disulfuro.2, 6 En el año 2000, gracias al conocimiento de la superfamilia de citocinas de la IL-6, fue posible determinar que la subunidad p35 tenía homología estructural con la familia de la IL-6 pero que la IL-6 por sí misma no lograba desencadenar una actividad efectora si no estaba unida a la subunidad p40;7 sin embargo, la p40 poseía una estructura distinta, y la p40, de forma soluble podía funcionar como un antagonista competitivo del receptor de la IL-12.8 Esto generó la hipótesis de que la p40 podía estar unida a otras subunidades distintas y así, mediante una búsqueda de bases de datos computacionales de citocinas con plegamiento similar a la IL-6, se identificó una proteína helicoidal con capacidad de precipitación con p40, para la cual se logró la clonación de su cDNA, que fue nombrada p19.7 Esta nueva proteína heterodimérica fue nombrada IL-23.
La subunidad p40 es una proteína soluble, que posee una N-acetilglucosilación en la Asparagina 200, tiene un plegamiento en láminas β y se compone de tres dominios, nombrados D1, D2 y D3;2 los últimos dos son los sitios de unión a la subunidad p19. Esto se logra a través de una interacción entre las asas 1 y 3 del dominio D2 y las asas 5 y 6 del dominio D3 a las asas A y D de la p19 respectivamente, y adicionalmente éste se refuerza por puentes disulfuro entre la cisteína 54 en las asas A y B de la p19 a la cisteína 177 de la p40.9 El dominio D1 es el responsable de la unión de la p40 al receptor IL-12Rβ.10 Por su parte, la subunidad p19 es una proteína no glucosilada que está compuesta por cuatro hélices α largas (A, B, C y D) ubicadas en una topología estructural arriba-arriba-abajo-abajo;7 interactúa a través de las asas A y D con la p40, como se expuso previamente. Además, comparte homología con la IL-6 y con el factor estimulante de colonias de granulocitos/monocitos (GM-CSF).11
En 1998 se descubrió una segunda proteína con estructura en láminas β en células B infectadas con el Virus Epstein-Barr, que se denominó Ebi3.12 Con el descubrimiento posterior de la subunidad p35 (IL-12) y p19 (IL-23), ambas estructuras de α hélices, se determinó una tercera proteína similar, nombrada p28, la cual, apareada con la molécula Ebi3, forman la IL-27.13Finalmente, el último miembro de la familia, la IL-35, fue descrita al encontrarse unión entre la molécula Ebi3 (IL-27) y la p35 (IL-12), que forma una proteína dimérica con una función efectora por sí misma.14
En resumen, las citocinas de la familia IL-12 son cuatro (FIGURA 1) y se pueden clasificar de acuerdo con sus subunidades. Estas son cadenas α (p19, p28 y p35) y cadenas β (p40 y Ebi3), que dan lugar a la IL-12 (p35/p40), IL-23 (p19/p40), IL-27 (p28/Ebi3) e IL-35 (p35/Ebi3) respectivamente.3 Esta familia de moléculas no sólo comparte subunidades en su estructura biológica; además, sus receptores también tienen componentes similares; cada complejo receptor consta de un dímero proteico, que está constituido por las unidades IL-12Rβ1 e IL-12Rβ2 para la IL-12; IL-23R e IL-12Rβ1 para la IL-23; IL-27R y gp130 para la IL-27 y, finalmente, IL-12Rβ2 y gp130 para la IL-35.15, 16, 17
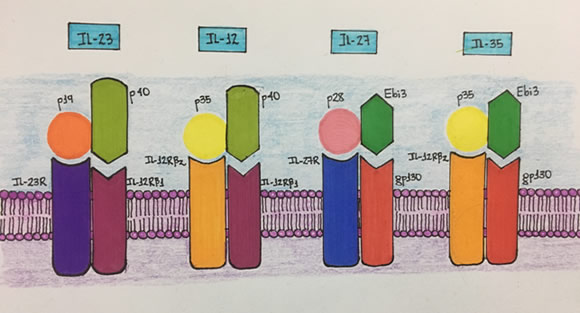
Figura 1: Citocinas de la familia de la IL-12. Se ilustran las cuatro interleucinas de la familia de la IL-12. Estas son IL-12, IL-23, IL-27 e IL-35. Comparten las subunidades y los receptores por medio de los cuales ejercen su acción biológica.
La subunidad IL-12Rβ1 forma parte de los receptores de IL-12 e IL-23. Es una proteína transmembrana glucosilada que posee cinco dominios extracelulares, uno transmembrana y otro citoplasmático. De sus dominios extracelulares, dos están destinados para la unión a citocinas, los denominados CBD (por su sigla en inglés Cytokine Binding Domains: D1 y D2); y los otros tres dominios son de tipo fibronectina.18, 15 El gen que codifica para esta molécula se expresa especialmente con la estimulación del Linfocito T a través de su complejo receptor TCR.19, 20 IL-23R es una molécula glucosilada que contiene tres dominios extracelulares, uno transmembrana y otro citoplasmático; tiene en su extremo N-terminal un dominio tipo inmunoglobulina (D1) que se continúa con dos dominios CBD (D2 y D3); los tres dominios son similares a los dominios correspondientes en el IL-12Rβ2; sin embargo, el IL-23R no contiene dominios transmembrana tipo fibronectina.16 En su dominio citoplasmático contiene adicionalmente siete residuos de tirosina, de los cuales uno, denominado Y399, es una secuencia de unión potencial a la proteína SHP2; otro, que se denomina Y611, es un sitio de unión a los factores de transcripción STAT1 y STAT3, y hay un tercero, Y484, que tiene un motivo de unión a STAT4.21
Unión al receptor: paradigma de los sitios canónicos
El ensamblaje de una citocina con su respectivo receptor, la interacción de estas moléculas y el desencadenamiento de la señalización intracelular han sido motivo de amplia investigación. Posteriormente al entendimiento del comportamiento molecular de la familia de la IL-6, se estableció un modelo de unión a través del cual una citocina interactúa con su receptor, que fue denominado paradigma de los sitios canónicos.22, 2 En este modelo se describen tres sitios (I, II y III) que se forman entre la citocina y su complejo receptor con el fin de inducir la activación de las señales intracelulares; según este modelo, el sitio I se ubica en la unión entre la cadena de cuatro hélices α y la cadena soluble β de la citocina; el sitio II es el sitio de interacción con el dominio tipo-Ig (inmunoglobulina) de la cadena β señalizadora del receptor y el sitio III comprende la unión con el CBD (Dominio de Unión a Citocina) de la cadena β del receptor.2 Este modelo ha sido útil para comprender la relación que se establece entre citocinas y sus respectivos receptores, y ha permitido comprender el comportamiento molecular de la IL-23 con su complejo receptor.
El sitio I de interacción para IL-23 se ubica entre ambas subunidades de la citocina (p19 y p40) a través de un residuo de Arginina que protruye de la D-α-hélice de p19 y se acomoda en una región de tipo cráter de la p40 cuyo fondo posee un ácido Aspártico; este sitio de la p40 es denominado bolsillo de la p40 (p40-Pocket) y es además el sitio de unión para la subunidad p35 de la IL-12. Adicionalmente a esta interacción, residuos aminoácidos hidrofóbicos periféricos al Ácido Aspártico de la p40 interactúan con residuos de alanina de la p19 para fortalecer la unión.23 La interacción que ocurre en el sitio I permite un cambio conformacional en ambas subunidades para que se permita la formación de los sitios II y III.10
Durante algún tiempo se postuló que el sitio II se formaba entre p19 y los dominios D1 y D2 del IL-12Rβ1; sin embargo, dado que la subunidad p40 se puede unir a esta subunidad del receptor en ausencia de p19, se pensó que tal vez el sitio se formaba con p40 en lugar de p19, por lo que a través de cultivos celulares COS fue posible determinar que p40 adopta un sitio de interacción funcional y por medio del dominio D1 interactúa con los CBD D1 y D2 del IL-12Rβ1; y que esto, a su vez, explica por qué p40 puede actuar como un antagonista de la señalización de IL-12 e IL-23 al unirse al receptor y bloquear la interacción de las interleucinas completas a su respectivo complejo. Para confirmar este hallazgo se diseñó una proteína de fusión conformada por p19 y los dominios D2 y D3 de p40 (p40-D2D3- p19Fp), la cual podía interactuar con el IL-23R pero no con el IL-12Rβ1 y, por tanto, no desencadenaba señalización.10
Finalmente, la interacción entre p19 y el dominio Inmunoglobulina del IL-23R conforma el sitio III; en éste, es imprescindible la intervención de un residuo de triptófano en la p19 pues se ha determinado que mutaciones que cambien el triptófano 157 por una alanina resultan en una pérdida de la unión de la citocina con el receptor y, por consiguiente, de la señalización.2, 10
Luego de la unión de la IL-23 con su complejo receptor y la formación de los tres sitios se desencadena el reclutamiento intracelular de la vía de cinasas Janus. La tirosina cinasa 2 (Tyk2) y la cinasa Janus 2 (Jak2), que se encuentran asociadas a IL-12Rβ1 e IL-23R respectivamente, son activadas y fosforilan principalmente a los factores de transcripción STAT3 y, en menor medida, a STAT1, 4 y 5.24 El dominio intracelular del IL-23R se compone de 252 aminoácidos para el humano (247 para el ratón) y se ha determinado que en él se exponen siete residuos de tirosina, como se presentó previamente (Y397, Y429, Y450, Y463, Y476, Y484 y Y611); el motivo más proximal (Y397) posee un sitio de unión para la cinasa de inositol 3 fosfato (PI3K) y de activación de la MAP cinasa (MAPK). EL motivo Y484 es el sitio de unión para el STAT4 y el motivo Y611 es el sitio de unión para STAT1 y STAT3.25, 2
A través de un estudio con ratones que genéticamente carecían del antagonista del receptor de la IL-1 (IL-1Ra -/-), se probó la importancia del factor STAT3 en la vía de señalización de la IL-23; estos ratones tenían mayor actividad de la IL-1β que potenciara la producción de IL-23 y, por consiguiente, presentaron mayor activación de linfocitos T CD4+ con diferenciación a la subclase Th17.24 STAT3 es un factor de transcripción que regula la transcripción del gen RORC para aumentar la expresión de otro factor de transcripción: RORγt, el cual, junto a STAT3, se une al promotor de la IL-17.26, 27 Adicionalmente, la unión de la IL-23 a su receptor provoca la degradación de la subunidad inhibidora del Factor Nuclear kappa B α (IκBα) para inducir la activación del Factor Nuclear asociado a las cadenas Kappa de células B activadas (NFκB).28
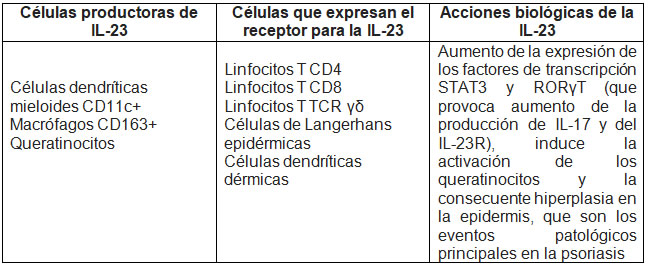
Células productoras de IL-23 y sus efectos biológicos
Comprendidas las características generales de la IL-23 y su vía de señalización, es necesario describir los procesos que inducen su producción (TABLA 1). Las células dendríticas y los macrófagos son los tipos celulares que producen en mayor proporción la IL-23 ante diversos estímulos y ésta posee diferentes efectos en inmunidad innata e inmunidad adaptativa.6 Se ha determinado que el contacto de estas células con bacterias como Escherichia coli, Bacteroides vulgatus y Veillonella parvula estimula la regulación al alta de p19, especialmente en las células dendríticas maduras, y que la producción es mucho mayor cuando se estimula el receptor TLR2 con peptidoglicano de bacterias gram positivas, mientras que la estimulación con lipopolisacárido a través del TLR4 no es una potente inductora de la expresión de mRNA de p19.6 Adicionalmente, se ha reportado que las células dendríticas derivadas de médula ósea, al ser estimuladas con Prostaglandina E2 (PGE2), inducen la producción de IL-17 por los linfocitos T en un proceso mediado por la IL-23: estas células, al ser cultivadas en presencia de PGE2, producen mRNA de p19 y p40, y además este proceso puede ser potenciado con la adición de factor estimulante de colonias de granulocitos-monocitos (GM-CSF).29
Los linfocitos T desencadenan respuestas a la IL-23 de acuerdo con su estadio de maduración y diferenciación; las células T vírgenes murinas tienen baja expresión del IL-23R y se desarrollan rápidamente ante la presencia de IL-12 y muy poco ante IL-23;16 sin embargo, las células T de memoria activadas expresan mayor concentración de IL-23R y responden rápidamente a la IL-23, iniciando su polarización a la subclase Th17 productoras de IL-17.7
La diferenciación de las células T en linfocitos productores de IL-17 requiere del factor de transcripción RORγT y para esto se requiere de IL-6 y TGF-B.30 Estas mismas citocinas estimulan la expresión de la subunidad IL-23R.19 En concordancia con lo anterior, aunque la IL-23 no es obligatoria para la polarización de la subclase Th17 de linfocitos, sí es necesaria para su mantenimiento y la expansión clonal.31, 32
IL-23 y psoriasis
La psoriasis es una enfermedad inflamatoria crónica cuya etiología incluye una compleja interacción de factores genéticos, epigenéticos, ambientales y del estilo de vida, y que puede ocurrir a cualquier edad y afecta a ambos sexos. Se caracteriza clínicamente por la aparición de placas eritematosas, que descaman y reflejan la hiperproliferación y diferenciación alterada de los queratinocitos en la epidermis.33 De acuerdo con el reporte global de psoriasis de la OMS para el año 2016 (Global Report on Psoriasis WHO), tiene una prevalencia mundial que varía entre 0.09% y 11.4% (promedio de 2-3%), y para países desarrollados se ubica entre 1.5-5%; adicionalmente, se encuentra en aumento.34 Dados la relevancia y el impacto que tiene esta enfermedad, se han desarrollado diversos estudios para comprender el mecanismo de su aparición, que encontraron múltiples asociaciones genéticas. A través de estudios pangenómicos de asociación (GWAS, por su sigla en inglés Genome-Wide Association Studies), se han identificado numerosos locus genéticos que tienen relación con psoriasis. La asociación más importante es con el alelo HLA-Cw*06:02, que se localiza en el denominado locus de susceptibilidad de psoriasis 1 (PSORS1), en el brazo corto del cromosoma 6. Otros polimorfismos han sido descritos, entre ellos los polimorfismos en el eje IL-23/Th17; estos polimorfismos ocurren en un único nucleótido (SNP’s, por su sigla en inglés Single-Nucleotide Polymorphisms) y se han encontrado en diferentes genes, entre los que se encuentran IL12Bp40, IL23Ap19, IL23R, JAK2 y TYK2.35
Diferentes células inflamatorias se han encontrado en las placas de pacientes con psoriasis, incluyendo células dendríticas, células T, neutrófilos y macrófagos. Las células dendríticas mieloides (con un marcador CD11c+) son las mayores productoras de IL-23 en la piel y se han encontrado aumentadas en pacientes con psoriasis; igualmente, un tipo especial de células dendríticas que expresan la enzima óxido nítrico sintasa inducible (iNOS), que son productoras de TNF36 y macrófagos activados CD163+ productores de IL-23p19 e IL-12/23p40, ha sido encontrado en muestras obtenidas de placas de pacientes con psoriasis. Igualmente, en estudios desarrollados por Lee et al. en 2004, se demostró la importancia de la IL-23 en esta enfermedad, dado que se encontró elevado mRNA que codificaba para la subunidad p40 y p19, pero no ocurrió lo mismo con p35, con lo que se descartaba la teoría de que IL-12 tenía mayor relevancia en psoriasis.37
En 2009 se desarrolló un estudio con ratones tratados con imiquimod tópico (Ligando TLR7/2), con el fin de inducir la aparición de lesiones parecidas a psoriasis y se determinó posteriormente la presencia de IL-23, IL-17A e IL-17F en las células de estas lesiones, por RT PCR (PCR en tiempo real). Se encontró que el imiquimod incrementó la proliferación epidérmica, la diferenciación celular anormal y la aparición de infiltrados de linfocitos CD4+, células dendríticas CD11c+ y células dendríticas plasmocitoides, hallazgos similares a los obtenidos en pacientes con psoriasis. Adicionalmente, se encontró aumento de la expresión de las citocinas mencionadas previamente. Experimentos con ratones deficientes para IL-23p19 e IL-17RA evidenciaron un bloqueo completo en la producción de IL-23, IL-17A e IL-17F y la presencia de lesiones muy leves, con lo que se concluyó que, aunque el eje IL-23/Th17 es central en psoriasis, no es el único.38
Estudios de PCR en piel afectada demostraron aumento de IL-23p19 e IL-12/23p40; de igual forma, por inmunohistoquímica se confirmó la presencia de IL-23 en piel comprometida, y son las células dendríticas en dermis superficial las de mayor producción de esta citocina. Posteriormente se evaluó la presencia del IL-23R por medio de citometría de flujo y se encontró elevada en células T CD3+ y CD8+ dérmicas; igualmente, se lo encontró aumentado en células dendríticas dérmicas y células de Langerhans, todas en piel comprometida. Asimismo, en este estudio se realizó un experimento con ratones inmunosuprimidos (deficientes para RAG 1/2, IFNRI e IFNRII), a los que se les realizó un trasplante de injerto de piel humana no lesionada de pacientes con psoriasis (xenotrasplante); estos injertos desarrollaron espontáneamente psoriasis, evidenciada por engrosamiento de la epidermis, elongación de las papilas dérmicas e incremento de las células T en epidermis; se determinó en estas muestras la presencia aumentada de IL-23 y la posterior expansión clonal de linfocitos CD3+. Este estudio concluyó que hay aumento de la expresión de la subunidad IL-23R del complejo receptor en células TCD3+, CD8+ y células dendríticas, todas en dermis, en pacientes con psoriasis.39
Otras células importantes en el eje TH17/IL-23 son los linfocitos T γδ producen grandes cantidades de IL-17 bajo estimulación con IL-2340 y los queratinocitos, que son productores de IL-23, en especial los de la piel afectada por psoriasis.41
Tratamiento: modificando la inmunología de la enfermedad
Conociendo la importancia de la IL-23 y su consecuente generación de las células Th17 por los procesos ya descritos, es posible comprender mejor la secuencia de pasos que lleva a la formación de la lesión en el paciente que desarrolla psoriasis. Está bien estudiada la acción que ejerce la IL-17 en los queratinocitos: aumenta su proliferación, disminuye su proceso de diferenciación y estimula el reclutamiento de neutrófilos a través de la liberación de quimiocinas CXCL1 y CXCL8.33 Este conocimiento ha permitido la generación de moléculas que modifican las rutas inmunológicas relacionadas con la fisiopatología de la enfermedad. A la fecha, se cuenta con un arsenal terapéutico para el tratamiento de la psoriasis. Al respecto, es necesario nombrar los medicamentos que actúan bloqueando directamente la acción de la IL-17: secukinumab, ixekizumab y brodalumab.42 Conocer el papel que cumple la IL-23 en este complejo proceso ha conllevado la generación de medicamentos que actúen directamente sobre ella (Tabla 2).
Se han diseñado dos medicamentos inhibidores de la subunidad p40 (por tanto, inhibidores de la IL-23 y la IL-12): ustekinumab y briakinumab. El primero comenzó a desarrollarse con posterioridad al descubrimiento de la estructura de la IL-12 y de su papel en el sistema inmune. Ratones transgénicos para inmunoglobulina humana fueron inmunizados con IL-12 recombinante y se generaron hibridomas de fusión con IgG (inmunoglobulina G) específica para la IL-12 humana; posteriormente, se determinó que la subunidad p40 era el sitio de unión del anticuerpo. A esta molécula se le dio la nomenclatura inicial de CNTO 1275 y luego recibió el nombre de ustekinumab. Luego del descubrimiento de la IL-23 y de que la p40 era compartida entre ésta y la IL-12, se pasó a determinar si el anticuerpo era capaz de unir a la IL-23 en análisis in vitro y se logró con éxito la inhibición de esta citocina. Después de demostrar su actividad in vitro se pasó a la realización de ensayos preclínicos y clínicos, y en 2009 fue aprobado por FDA para su uso en psoriasis moderada-grave.43, 44
El segundo de los anticuerpos diseñados contra la subunidad p40, el briakinumab (que inicialmente se conoció con el nombre de ABT-874), es un anticuerpo monoclonal humano para el cual comenzaron a desarrollarse ensayos desde 2008. Se encontró una mejoría de las lesiones en piel de los pacientes con psoriasis y con escasos efectos adversos a corto plazo; sin embargo, en 2011 el laboratorio encargado de su manufactura debió retirarlo debido al aumento en los reportes de efectos cardiovasculares mayores asociados al uso de este medicamento. Según el laboratorio, es posible que los eventos hayan ocurrido como parte de las manifestaciones clínicas de la psoriasis y que no sean realmente atribuibles al uso del anticuerpo, pues es bien reconocido el efecto cardiovascular que tiene esta enfermedad per se, siendo esta causa el principal motivo de mortalidad en estos pacientes.45, 46, 47
Con el advenimiento de la comprensión de la estructura molecular de la IL-23, especialmente de la relevancia de la subunidad p19, se disparó el diseño de anticuerpos contra esta molécula. El primero de ellos fue el MK-3222, que posteriormente fue nombrado tildrakizumab. Este es un anticuerpo monoclonal humanizado del tipo IgG1 de cadenas livianas k con alta afinidad por la subunidad p19. Demostró, en todas las fases de ensayos clínicos, la mejoría clínica de las lesiones cutáneas en pacientes con psoriasis, con pocos efectos secundarios; ha sido raprobado por la FDA (mayo de 2017) para el tratamiento de psoriasis moderada-grave.48, 49, 46, 50
En el año 2013 comenzaron a realizarse estudios con un nuevo anticuerpo contra la subunidad p19, el CNTO-1959, que fue llamado posteriormente guselkumab, un anticuerpo monoclonal humano tipo IgG. En 2014 se publicó un estudio que demostró la inhibición de la IL-23 y la mejoría de las lesiones en pacientes afectados, y desde entonces se han realizado múltiples ensayos clínicos que han demostrado la eficacia del medicamento comparándolo con placebo y con otros tratamientos empleados en psoriasis. Han sido pocos los efectos secundarios reportados con este medicamento e incluso tiene un perfil menor de asociación con infecciones secundarias. El guselkumab ha sido aprobado para uso en psoriasis moderada-grave por la FDA en julio de 2017.51, 49
En 2015 fue publicado un reporte sobre una nueva molécula llamada BI-655066, la cual era un novedoso anticuerpo monoclonal humanizado que también podía inhibir la subunidad p19; para éste comenzaron a desarrollarse varios ensayos clínicos, en los cuales se ha evidenciado mejoría de las lesiones dermatológicas. Al parecer, tiene como ventaja la necesidad de requerir menor cantidad de administraciones cutáneas y hasta ahora ha demostrado no ser inferior a ustekinumab; actualmente se encuentra en ensayos de fase III y se le ha dado el nombre de risankizumab.52, 49
El avance en el desarrollo de nuevos medicamentos permite que la acción biológica para modificar el curso de la enfermedad se realice de una forma más precisa, lo que permite un efecto que puede ser más duradero, con mejores resultados y con una menor tasa de eventos adversos o secundarios. Con el advenimiento de los inhibidores de la IL-23, especialmente de los que bloquean específicamente la subunidad p19, se ha abierto la posibilidad de tener muy buenos resultados clínicos, con la ventaja de la disminución de efectos desagradables y también de que puedan ser utilizados en pacientes que por sus condiciones clínicas de base no son ideales para otras terapias. Así, pacientes con psoriasis que tienen otras comorbilidades, por ejemplo la enfermedad inflamatoria intestinal, no son candidatos ideales para la terapia con inhibidores de la IL-17 pues este tipo de medicamento puede empeorar esta condición clínica; sin embargo, con los inhibidores de la IL-23 que bloqueen específicamente la subunidad p19 se evita este evento potencialmente adverso pues la IL-23 no interviene directamente en los mecanismos fisiopatológicos de la enfermedad inflamatoria intestinal. 46, 53, 54
Un reciente metaanálisis que compara la eficacia y seguridad de la terapia sistémica convencional y la terapia biológica en psoriasis moderada a grave incluye 109 estudios de 39.882 pacientes. En términos de obtener una mejoría PASI 90, todos los tratamientos biológicos anti-IL-17, anti-IL-12/IL-23 y anti-TNF alfa fueron significativamente más efectivos que la terapia sistémica convencional (metotrexate, ciclosporina, acitretin, ésteres del ácido fumárico). Todos los anti-IL-17 y guselkumab (antip19 de IL-23) fueron más efectivos que los anti-TNF alfa. No se encontraron diferencias significativas en los efectos adversos serios frente a los que se presentan en el grupo con placebo.55
CONCLUSIÓN
Con la comprensión de los mecanismos moleculares que intervienen en la respuesta inmune ha venido también el entendimiento de los mecanismos patológicos en diferentes enfermedades. La IL-23 ha sido descrita hace más de una década y desde entonces han sido múltiples los descubrimientos que su descripción inicial ha generado; rápidamente se volvió motivo de estudio pues su compleja interacción con diversos componentes inmunes está relacionada con procesos patológicos como la psoriasis. A través de esta revisión se presenta la estructura de esta molécula, cómo se encuentra relacionada dentro de una familia mayor de citocinas con las cuales comparte características estructurales y la capacidad de inducir un complejo receptor dimérico único, por medio del cual desencadena vías de señalización complejas que están relacionadas con la inducción de otras citocinas de la inmunidad adaptativa. El conocimiento de la IL-23 ha permitido la generación de moléculas que a través del bloqueo inmune directo de esta molécula (por medio de su interacción con alguna de sus dos subunidades), lo que permite modificar el curso de esta enfermedad y conlleva mejoría de las lesiones en piel. Nuevas investigaciones sobre los mecanismos que intervienen en el origen y mantenimiento de la psoriasis podrían llevar al diseño de más herramientas para tratar a los pacientes que padecen esta enfermedad.