Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista industrial y agrícola de Tucumán
versão On-line ISSN 1851-3018
Rev. ind. agríc. Tucumán v.85 n.1 Las Talitas jan./jun. 2008
ARTÍCULOS ORIGINALES
Acción inhibitoria de una cepa de Zymomonas mobilis mobilis aislada de caña de azúcar sobre Xanthomonas citri subsp. citri, agente causal de la cancrosis de los cítricos
María E. Romero*, C. Jacqueline Ramallo** y L. Daniel Ploper**
*Facultad de Bioquímica y Farmacia (UNT). meromero@eeaoc.org.ar.
**Sección Fitopatología, EEAOC.
Resumen
Zymomonas mobilis mobilis (Zm) produce factores antimicrobianos que actúan sobre un amplio espectro de microorganismos patógenos para el hombre, animales y plantas. Un problema importante a resolver en los tratamientos con antimicrobianos, es el desarrollo de resistencia a compuestos empleados actualmente, no siendo las bacterias fitopatógenas una excepción. En el presente trabajo se realizaron ensayos de antagonismo con células (pruebas de estrías cruzadas) y sobrenadantes concentrados (Sc) (por difusión en agar) preparados a partir de cultivos de Zm (aislada de jugo de caña de azúcar producido en Tucumán), frente a la bacteria causal de la cancrosis: Xanthomonas citri subsp. citri. Se evaluaron aislamientos de Xcc sensibles (Xc) y resistentes (Xcr) a compuestos a base de cobre. Los resultados obtenidos mostraron que la bacteria testigo fue inhibida totalmente por las células de Zm, ejerciendo un efecto bactericida. En los ensayos de difusión en el agar se observó que tanto Xc, como Xcr fueron sensibles al Sc de Zm. Se sabe, por estudios anteriores, que los metabolitos de Zymomonas tienen un efecto deletéreo en la membrana celular de E. coli AB1133, inhibiéndose la respiración de la bacteria inmediatamente de agregado Sc (60 UA). En el presente trabajo se observó el mismo efecto, inhibición total de la respiración en Xc, luego del agregado del Sc (60 UA). Por lo observado, se deduce que el blanco de acción de los metabolitos antimicrobianos de Sc en Xc, sería el mismo que el de E. coli AB1133. Con los resultados obtenidos se considera de interés encarar el estudio de los compuestos de Zm para ser empleados en el control de enfermedades que afectan los cultivos de valor económico de la región, como es el caso de la cancrosis, como así también profundizar acerca de la acción de dichos metabolitos en la membrana de Xanthomonas citri subsp. citri.
Palabras clave: Control biológico; Factores antimicrobianos; Bacterias fitopatógenas.
Abstract
Inhibition of Xanthomonas citri subsp. citri, causal agent of citrus canker, by a strain of Zymomonas mobilis mobilis isolated from sugarcane
Zymomonas mobilis mobilis (Zm) produces antimicrobial factors, which have an effect on a wide range of microorganisms pathogenic to man, animals, and plants. An important problem to solve with antimicrobial treatments is the development of resistance in these microorganisms, including phytopathogenic bacteria, to the currently used active ingredients. In this study, antagonism tests with cells (cross-streaking) and cell-free culture supernatants (CCS) (agar diffusion test) from Zm cultures, isolated from sugarcane juice in Tucumán, were carried out, measuring activity against Xanthomonas citri subsp. citri (Xcc), the causal agent of citrus canker. Xcc isolates sensitive (Xc) and resistant (Xcr) to copper pesticides were included in these tests. Results showed that indicator bacteria were completely inhibited by cells of Zm, which had a bactericide effect. Both Xc and Xcr were sensitive to the CCS in the agar diffusion method. Previous studies had revealed the deleterious effects of metabolites from Zm on cell membranes of E. coli AB1133, inhibiting the respiration of the bacteria inmediately after CCS addition. On the basis of these results, the effects of CCS on Xcc respiration were studied, verifyng a similar response. This would indicate that the site of action of these antimicrobial compounds is also located at the cell membrane of the bacteria under study. Based on these results, additional studies are suggested to evaluate Zm-derived products on the control of diseases that affect economically important crops, such as citrus canker.
Key words: Biological control; Antimicrobial factors; Phytopathogenic bacteria.
Introducción
En comunicaciones anteriores se observó que tanto los cultivos de una cepa de Zymomonas mobilis mobilis (Zm) aislada de jugo de caña de azúcar, como los sobrenadantes concentrados estériles (Sc) obtenidos de dichos cultivos, ejercían un notable efecto inhibitorio sobre un amplio espectro de microorganismos, entre ellos varios patógenos de vegetales de interés económico (Romero y Callieri, 2000; Romero, 2003; Romero et al., 2004, 2005 y 2006).
Uno de los problemas que se presenta en el tratamiento de enfermedades con antimicrobianos es la aparición de resistencia a los compuestos empleados, generalmente por selección de los componentes poblacionales no sensibles. Tal es el caso del uso de compuestos cúpricos para el tratamiento de la cancrosis de los cítricos (Xanthomonas citri subsp. citri) y de otras enfermedades (Adaskaveg y Hine, 1985; Bender et al., 1990; Cooksey et al., 1990; Jain, 1990; Rodrigues, 2000; Canteros, 2000).
Por lo tanto, resulta de interés la posibilidad de utilizar un nuevo agente para el manejo integrado de dichas enfermedades.
El objetivo del presente trabajo es: 1) analizar el efecto antagónico de Zymomonas y/ó sus metabolitos sobre el desarrollo de dos cepas de Xanthomonas citri subsp. citri: una sensible al oxicloruro de cobre (Xc) y la otra resistente (Xcr) y 2) determinar el blanco de acción de dichos metabolitos sobre el patógeno en estudio.
Cabe mencionar que Zymomonas está actualmente catalogada como GRAS ("Generally Regarded As Safe") (Varsaki et al., 1998). Además, la cepa que se utiliza en este trabajo fue aislada de jugo de caña de azúcar (Rodríguez y Callieri, 1986), de manera que forma parte de la microflora de cultivos. Estas circunstancias conllevan la posibilidad de su uso a campo, sin consecuencias adversas ni cuestionamientos fundamentados.
Materiales y métodos
1. Microorganismos
1.1. Zymomonas mobilis mobilis (Zm), aislada de jugo de caña de azúcar en Tucumán (Rodríguez y Callieri, 1986) conservada a 4ºC y mantenida por repiques sucesivos en MEGI.
1.2. Xanthomonas citri subsp. citri (Xc), provista por la Sección Fitopatología de la Estación Experimental Agroindustrial "Obispo Colombres" (EEAOC). Conservada a 4ºC y mantenida en "buffer" fosfato salino a temperatura ambiente.
1.3. Xanthomonas citri subsp. citri, resistente al oxicloruro de cobre (3 g/l) (Xcr). Conservada a 4ºC y mantenida en "buffer" fosfato salino a temperatura ambiente.
1.4. Escherichia coli AB1133, no patógena, resistente a la estreptomicina (75 mg/ml), provista por Escherichia coli Genetic Stock Center (USA). Conservada a 4ºC y mantenida por punción en medio LB (agar blando).
2. Medios de cultivo
2.1. Medio estándar líquido (MEGI). En g/l: glucosa, 50; extracto de levadura, 10; KH2PO4,1; (NH4)2SO4, 1; MgSO4 .7 H2O, 1.
2.2. "Buffer" fosfato salino. En g/l: K2HPO4, 1,07; KH2PO4, 0,44; ClNa, 8,18; pH 7.
2.3. Medio Luria Bertani (LB). En g/l: extracto de levadura, 5; peptona, 10; NaCl, 10. pH 7,4.
2.4. Agar nutritivo suplementado (ANS). En g/l: agar nutritivo de laboratorios Britania, 31; glucosa, 30; extracto de levadura, 10. pH 7,3.
2.5. Caldo nutritivo suplementado (CNS). En g/l: caldo nutritivo de laboratorios Britania, 8; glucosa, 10; cloruro de sodio 8. pH 6,9.
3. Determinación de la actividad antimicrobiana
Se utilizó la técnica de las estrías cruzadas. Para ello se prepararon placas de Petri con medio ANS. Se trazó una estría diametral de aproximadamente 5 mm de ancho, con un cultivo de Zm de 12 h en MEGI. Se incubó 24 h a 30ºC, para permitir la producción y difusión de los eventuales metabolitos antimicrobianos de Zm. Se procedió entonces a trazar estrías perpendiculares a la de Zm con cultivos frescos de Xc, Xcr y E. coli AB1133. Como controles se sembraron todas las cepas utilizadas, en placas con ANS. Los resultados se observaron a partir de las 18 h de incubación a 28-30ºC. Los ensayos se realizaron por triplicado, cuatro veces.
4. Sobrenadantes concentrados (Sc) a partir de cultivos de Zymomonas
Se preparó un inóculo de Zm en 1000 ml de MEGI a 30ºC, hasta fase de crecimiento exponencial (1-1,5 g/l peso seco). Las células se separaron por centrifugación a 13.000 g, resuspendidas en 100 ml de MEGI fresco y sembradas en 4000 ml de MEGI e incubadas 48 h a 30ºC. El sobrenadante obtenido por centrifugación fue reducido a un volumen de 20 ml por evaporación, tratado con metanol a 4ºC (1:3 v/v) y conservado a -20ºC durante 16 h. Luego de centrifugar a 23.500 g, 15 min, el metanol fue evaporado en un rotavap a 70ºC. La fracción acuosa obtenida fue liofilizada hasta sequedad y resuspendida en 20 ml de agua bidestilada.
5. Determinación del título de la actividad antimicrobiana de Sc
Método de las diluciones sucesivas
Se determinó el título de la actividad antimicrobiana de Sc por la técnica de difusión en agar (Toba et al., 1991; Jiménez Díaz et al., 1993), empleando E. coli AB1133 como cepa testigo. Para ello se prepararon placas de Petri con 16 ml de medio LB agarizado sobre el que se agregaron 3 ml de agar blando (0,6% p/v) inoculado con 30 ml de una suspensión de E. coli AB1133, en medio LB, de manera de obtener una concentración celular final de aproximadamente 1x106 UFC/ml. Se practicaron orificios de 5 mm de diámetro con un sacabocados estéril y en cada uno de ellos se colocaron 50 ml de las diluciones sucesivas de Sc. Las placas se dejaron a temperatura ambiente 30 minutos para permitir la difusión de los eventuales principios activos contenidos en el Sc y luego se incubaron 18 h a 37ºC. Se midieron los halos de inhibición y se tomó como valor la media resultante de medir los diámetros en cuatro direcciones distintas. Se define la unidad de actividad (UA) como la recíproca de la mayor dilución que produce un halo de inhibición bien definido. Para expresar el título se lleva este valor a UA/ml.
La esterilidad de Sc se comprobó sembrando 100 ml del mismo en MEGI e incubando 72 h a 28-30ºC.
6. Actividad del Sc sobre el desarrollo de Xc y Xcr
Se utilizó la técnica de difusión en agar, ya descripta para la determinación del título de la actividad antimicrobiana de Sc. En las cajas de Petri se colocó AN y el agar blando fue inoculado con suspensiones de Xc y Xcr en una concentración final de 1x106 UFC/ml. Se ensayaron: 1) Sc (120 y 60 UA/ml) y 2) soluciones de oxicloruro de cobre (2 y 3 g/l) y oxicloruro de cobre (3 g/l) combinado con mancozeb (2 g/l) (productos químicos que se utilizan para combatir la cancrosis en quintas de plantas cítricas). Como control negativo se usó agua. Se incubó de 24 a 48 h a 28ºC. Los ensayos se realizaron por triplicado, cuatro veces, realizándose una observación cualitativa de los resultados. Asimismo, se midieron los halos de inhibición y se tomó como valor la media resultante de medir los diámetros en cuatro direcciones distintas.
7. Medición del consumo de oxígeno
Se realizó de acuerdo a la técnica descripta por Rintoul et al. (2001). El agregado de un volumen de Sc, con una actividad de 60 UA, a un cultivo de E. coli AB1133 de 16 h en LB se hizo a los 5 minutos y las mediciones se llevaron a cabo durante 12 minutos. Al cultivo de Xc de 72 h en CNS se agregaron un volumen de Sc, con actividad de 20 UA a los 8 minutos y un volumen con 60 UA a los 21 minutos. Para realizar esta experiencia se utilizó un oxígrafo Wilson equipado con un electrodo tipo Clark, en un vaso cerrado de 2 ml, con agitación, a 30ºC para Xc y 37ºC para E. coli AB 1133. Se graficó el promedio de las mediciones del O2 residual en los cultivos de las bacterias testigo sin y con el agregado de Sc. Se determinó el porcentaje de inhibición del consumo de oxígeno en Xc para las actividades ensayadas (20 y 60 UA).
Resultados
La Figura 1 demuestra claramente que tanto las dos cepas de Xanthomonas en estudio como E. coli AB1133 se desarrollaron perfectamente en medio ANS. Por el contrario, en la placa de ensayo en la que se sembró previamente Zm, a las 18 h de incubación se observó una total inhibición de las cepas en estudio, inhibición que se mantuvo luego de 23 días de incubación a 28ºC.
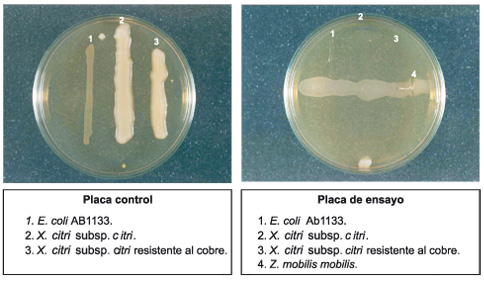
Figura 1. Actividad antimicrobiana de Zymomonas mobilis mobilis sobre microorganismos testigo por el método de las estrías cruzadas.
Para comprobar si es necesaria la presencia de células viables de Zm para que se ejerza inhibición, se realizaron ensayos con Sc estéril obtenido a partir de cultivos de la misma por medio de la técnica de difusión en agar.
El título del Sc fue 120 UA/ml, comprobándose su esterilidad luego de incubado 72 h a 28-30ºC, ya que no se observó el desarrollo de Zm cuando fue sembrado en MEGI.
En las Figuras 2 y 3 se exponen los resultados obtenidos, los que indican que en todos los casos se produjo inhibición, existiendo una relación directa entre esta y el grado de dilución del Sc (UA/ml). Cabe destacar el efecto ejercido sobre Xcr, resistente al oxicloruro de cobre.

Figura 2. Sensibilidad de Xanthomonas citri subsp. citri frente al Sc y oxicloruro de cobre.
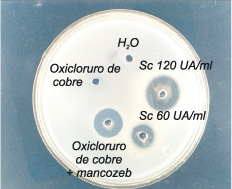
Figura 3. Sensibilidad de Xanthomonas citri subsp. citri (resistente al oxicloruro de cobre) frente al oxicloruro de cobre combinado con mancozeb.
El oxicloruro de cobre combinado con mancozeb constituye un fungicida que combina las propiedades de ambos compuestos para lograr la prevención y el control de un amplio espectro de enfermedades de frutales y hortalizas, mejorando la eficiencia que se obtiene cuando se utilizan solos ambos fungicidas (CASAFE, 2007). En la Figura 3 se observa que X. citri subsp. citri resistente al oxicloruro de cobre solo, es sensible al oxicloruro de cobre combinado con mancozeb.
En la lucha contra las enfermedades causadas por microorganismos, es de suma utilidad establecer cuál es el mecanismo de acción y el blanco de ataque de los productos utilizados. El ión cúprico, presente en el oxicloruro de cobre, reacciona con las enzimas del patógeno, provocando la desnaturalización de las proteínas. Se han sugerido varios mecanismos para explicar la resistencia de bacterias fitopatógenas al cobre, de los cuales uno de ellos sería el control de la entrada del compuesto químico al interior de la célula: el ión cúprico podría permanecer, en consecuencia, inactivo en el espacio periplásmico (Cooksey, 1993). Varios fungicidas y antibióticos han sido utilizados para el control de cepas resistentes. En particular, el fungicida mancozeb ha sido muy empleado en mezclas con compuestos cúpricos, para el control de Xanthomonas spp. en campo (Marco y Stall, 1983; Pereira et al., 1981).
En trabajos anteriores (Romero et al., 2004) se vio que los compuestos antimicrobianos presentes en el Sc de Zymomonas mobilis tienen, como blanco de acción, a la membrana celular de E. coli AB1133, ya que la inhibición de la bacteria (muerte celular) ocurría en todas las fases de su desarrollo, sin ocasionar la lisis de la misma. Asimismo se observó, mediante la determinación del consumo de oxígeno, que este era inhibido en un 100% inmediatamente luego de la adición de 60 UA de Sc. En el caso de X. citri subsp. citri se observó un efecto similar en cuanto a la inhibición de la respiración de la misma (Figura 4a y 4b), ya que los resultados obtenidos muestran una disminución de un 70% de la respiración con 20 UA de Sc y una inhibición total con 60 UA de Sc (Figura 5), por lo que se infiere que los metabolitos antimicrobianos de Zm tienen, como blanco de acción, a la membrana de la bacteria, efecto similar al observado en E. coli AB1133.
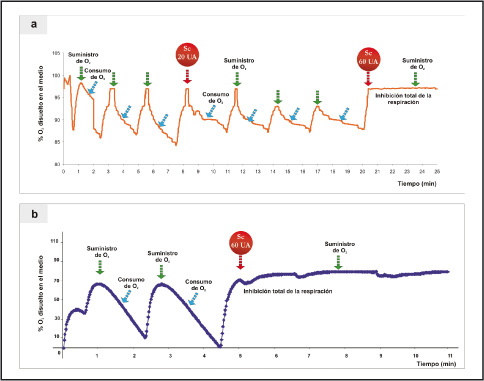
Figura 4. a) Consumo de oxígeno de un cultivo de Xanthomonas citri subsp. citri; b) consumo de oxígeno de un cultivo de E. coli AB1133, sin y con el agregado de Sc.

Figura 5. Efecto de Sc en el consumo de oxígeno en un cultivo de Xanthomonas citri subsp. citri.
Conclusiones
1.- En este trabajo se demostró el efecto antagónico de Zymomonas mobilis, aislada de jugo de caña de azúcar, tanto con cultivo de la bacteria, como en sobrenadantes concentrados libres de ella. De acuerdo a la bibliografía consultada, la actividad antimicrobiana de Zymomonas sólo se observaba cuando se utilizaban cultivos tempranos de la misma.
2.- Dos cepas de Xanthomonas citri subsp. citri, ambas causantes de cancrosis y una de ellas resistente al oxicloruro de cobre, se mostraron sensibles al efecto germicida tanto de cultivos de la cepa en estudio, como de sobrenadantes concentrados estériles obtenidos de los mismos.
3.- El probable blanco de ataque es la membrana celular, ya que se observó la inhibición total de la respiración en las bacterias ensayadas con el agregado de 60 UA en Sc.
4.- Zymomonas está clasificada como GRAS. Esta apatogenicidad y los resultados aquí expuestos abren la posibilidad de utilizar cultivos de la bacteria, como los sobrenadantes concentrados obtenidos de ellos, para ser empleados en el manejo integrado de la cancrosis de los cítricos, como así también de otros fitopatógenos.
Bibliografía citada
1.Adaskaveg, J. E. and R. B. Hine. 1985. Copper tolerance and zinc sensitivity of Mexican strains of Xanthomonas campestris pv. vesicatoria, causal agent of bacterial spot pepper. Plant Disease 69 (11): 993-996.
2.Bender, C. L.; D. K. Malvick; K. E. Conway; S. George and P. Pratt. 1990. Characterization of pXV10A, a copper resistance plasmid in Xanthomonas campestris pv. vesicatoria. Appl. and Environ. Microbiol. 56 (1): 170-175.
3.Cámara de Sanidad Agropecuaria y Fertilizantes (CASAFE). 2007. Guía de Productos Fitosanitarios para la República Argentina, vol. 2, 13. ed. Buenos Aires, Argentina.
4.Canteros, B. I. 2000. Citrus canker in Argentina: control, erradication, and current management. En: Abstracts of International Citrus Canker Research Workshop, Fort Pierce, Florida, USA, pp. 12-13.
5.Cooksey, D. A. 1993. Copper uptake and resistance in bacteria. Mol. Microbiol. 7 (1): 1-5.
6.Cooksey, D. A.; H. R. Azad; J. S. Cha and C. K. Lim. 1990. Copper resistance gene homologs in pathogenic and saprophytic species from tomato. Appl. and Environ. Microbiol. 56 (2): 431-435.
7.Jain, R. K. 1990. Copper-resistant microorganisms and their role in the environment. World J. of Microbiol. and Biotechnol. 6 (4): 356-365.
8.Jiménez Díaz, R.; R. M. Ríos Sánchez; M. Desmazeaud; J. L. Ruíz Barba and J. C. Piard. 1993. Plantaricin S and T, two new bacteriocins produced by Lactobacillus plantarum LPCO10 isolated from a green olive fermentation. Appl. and Environ. Microbiol. 59 (5): 1416-1424.
9.Marco, G. M. and R. E. Stall. 1983. Control of bacterial spot of pepper initiated by strains of Xanthomonas campestris pv. vesicatoria that differ in sensitivity to copper. Plant Disease. 67 (7): 779-781.
10.Pereira, A. L. G.; C. A. Campacci e D. A. Oliveira. 1981. Cancro cítrico: seleçao e eficiencia de defensivos agrícolas em ensaio preliminar de campo. O Biológico 47 (10): 265-287.
11.Rintoul, M. R.; B. F. Arcuri; R. A. Salomón; R. N. Farías and R. D. Morero. 2001. The antibacterial actino of microcin J25: evidence for disruption of cytoplasmic membrane energization in Salmonella newport. FEMS Microbiol. Lett. 204: 265-270.
12.Rodrigues, L. S. 2000. Estudo da sensibilidade ao cobre em Xanthomonas axonopodis pv. citri. Universidade Estadual de Londrina, Londrina, Brasil.
13.Rodríguez, E. and D. A. Callieri. 1986. High yield conversion of sucrose into ethanol by a flocculent Zymomonas sp. flocculent isolated from sugar cane juice. Biotechnol. Lett. 8 (10): 745-748.
14.Romero, M. E. 2003. Estudio de la actividad antimicrobiana de Zymomonas mobilis. Tesis doctoral inédita. Facultad de Bioquímica, Química y Farmacia, UNT.
15.Romero, M. E. y D. A. Callieri. 2000. Capacidad antimicrobiana de Zymomonas mobilis mobilis. En: Memorias del Simposium Internacional de Biotecnología UPIBI - IPN 2000, México D. F. , México, pp. 155.
16.Romero, M. E.; J. Ramallo; D. A. Callieri y L. D. Ploper. 2004. Estudio preliminar del modo de acción de compuestos antimicrobianos de Zymomonas mobilis: proyección. En: Libro de resúmenes CD . Congreso Latinoamericano de Microbiología, 17, Congreso Argentino de Microbiología, 10. Buenos Aires, Argentina.
17.Romero, M. E.; J. Ramallo; G. Fogliata y L. D. Ploper. 2006. Actividad antimicrobiana de Zymomonas mobilis frente a Penicillium digitatum, agente causal del moho verde de los cítricos. Biocell 31 (2): 292.
18.Romero, M. E.; J. Ramallo y L. D. Ploper. 2005. Sensibilidad de diferentes cepas de Xanthomonas axonopodis pv. citri frente a compuestos antimicrobianos producidos por Zymomonas. En: Libro de Resúmenes del Congreso Latinoamericano de Fitopatología, 13; Taller de la Asociación Argentina de Fitopatólogos, 3, Carlos Paz, Córdoba, Argentina, pp. 219.
19.Toba, T.; E. Yoshioka and T. Itoh. 1991. Lacticin, a bacteriocin produced by Lactobacillus delbrueckii subsp. lactis. Lett. in Appl. Microbiol. 12: 228-231.
20.Varsaki, A.; A. S. Afendra; G. Vartholomatos; G. Tegos and C. Drainas. 1998. Production of ice nuclei from two recombinant Zymomonas mobilis strains employing the ina Z gene of Pseudomonas syringae. Biotechnol. Lett. 20 (7): 647-651. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]














