Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista industrial y agrícola de Tucumán
versión On-line ISSN 1851-3018
Rev. ind. agric. Tucumán vol.92 no.2 Las Talitas dic. 2015
ARTÍCULOS ORIGINALES
Variación estacional de azúcares de reserva en yacón cultivado en el pedemonte de Tucumán*
Alejandra M. Kortsarz G. **, Martin L. Zannier***, Alfredo Grau**
*Trabajo subsidiado por Agencia Nacional de Promoción Científica y tecnológica
**Facultad de Ciencias Naturales e Instituto Miguel Lillo,alekort@gmail.com
***Becario PICT 2011-1781
Resumen
Se realizaron cosechas periódicas de plantas de Smallanthus sonchifolius (Poepp.) H. Robinson a lo largo del ciclo de cultivo. Se midió peso fresco y peso seco de órganos aéreos y mediante HPLC se determinaron la variación y rendimientos de azúcares de reserva en diferentes fechas de cosecha. El objetivo de este trabajo es estimar momentos adecuados de cosecha en cuanto a rendimiento y calidad de azúcares. El tiempo óptimo de cosecha fue entre junio y agosto, que en tiempo fenológico coincide con días después de terminada la floración hasta la finalización del proceso de senescencia de la parte aérea. El peso de azúcares totales fue máximo en la última cosecha a los 306 días. Las cosechas tempranas (mayo y junio) poseen el más alto contenido de FOS de grado de polimerización menor a 4, y mayor contenido de sacarosa y glucosa con respecto a fructosa. En cambio, en cosechas tardías (julio y agosto) la tendencia fue hacia la producción de raíces con FOS de grado de polimerización mayor a 5 y aumento de fructosa en relación a glucosa y sacarosa.
Palabras clave: fructo-oligosacáridos, pedemonte tucumano, azúcares totales.
Abstract
Seasonal variation of sugars of reserve in «yacón» cultivated in Tucuman piedmont
Periodic harvests of Smallanthus sonchifolius (Poepp.) H. Robinson plants were made throughout the crop cycle. Fresh weight and dry weight of aerial organs was measured. By HPLC was determined the variation and yields of storage sugars in different harvest dates. The aim of this paper is to estimate harvest appropriate times for performance and quality of sugar. The optimal harvest time was between June and August, which coincides with phenological time days after completion of flowering until the end of senescence of the aerial part. The weight of total sugars was highest in the last harvest to 306 days. Early harvests (May and June) have the highest content of FOS degree of polymerization less than 4, and higher content of sucrose and glucose compared to fructose. In contrast, in the late harvest (July and August) the trend was towards producing roots with FOS degree of polymerization greater than 5 and increased fructose in relation to glucose and sucrose.
Key words: oligofructans, Tucuman piedmont, total sugars.
Introducción
El "yacón" (Samallanthus sonchifolius) es un cultivo originario de los Andes que produce raíces tuberosas comestibles que almacenan fructooligosacáridos (FOS), (Seminario et al., 2003; Grau & Rea, 1997). Los fructoligosacáridos (FOS) se forman por la transferencia de una molécula de fructosa desde una molécula de sacarosa al carbono 1 de la fructosa de una segunda molécula de sacarosa, formando la 1-cestosa, reacción catalizada por la enzima sacarosa-sacarosa fructosiltransferasa (SST) (Vijn et al., 1997, 1999; Roitsch et al., 2000). Otra enzima, la fructano-fructano fructosil transferasa (FFT), cataliza la transferencia de fructosil entre las moléculas de fructano para alargar la cadena. En yacón, a diferencia de achicoria, los FOS poseen un grado de polimerización (GP) relativamente bajo, no mayor a 10-12, y representan aproximadamente el 67% de la materia seca total de las raíces (Grau y Rea, 1997; Grau y Kortsarz, 2001; Douglas et al., 2002). El interés sobre estos azúcares se ha incrementado en los últimos tiempos debido al bajo valor calórico y su importancia como prebióticos. Los prebióticos son compuestos fermentables por la microflora intestinal humana que promueven selectivamente el crecimiento y/o la actividad de bacterias intestinales que contribuyan con la salud del huésped (Robertfroid, 2007; Gibson et al., 1999). Se han demostrado efectos prebióticos en FOS de yacón (Genta et al., 2009). La mayor solubilidad de estos FOS en comparación con inulinas poliméricas (GP> 10) hace que estas moléculas estén más fácilmente disponibles y por lo tanto puedan ser más rapidamente fermentadas por la microbiota en el colon (Roberfroid et al., 1998). También debido a la mayor solubilidad, los FOS del yacón pueden ser utilizados principalmente en bebidas y en suplementos dietarios.
El objetivo de este trabajo es determinar un período de cosecha en el cual se logre optimizar el rendimiento y calidad de las sustancias de reserva en raíces de yacón, a fin de asegurar buenos volúmenes de cosecha y altas concentraciones de FOS en relación a sacarosa, glucosa y fructosa, con el fin de obtener un producto adecuado desde el punto de vista dietético, tanto para consumo fresco como para su posterior procesamiento industrial.
Materiales y métodos
Material Vegetal y Manejo de Cultivo
El trabajo experimental fue realizado en la localidad de Sauce huascho, 26° 59’ S y 65° 22’ W a 451 m.s.n.m. Departamento de Famaillá, Provincia de Tucumán, Argentina, durante el ciclo de cultivo 2002/2003, donde las precipitaciones marcaron un total de 1260 mm entre los meses de octubre de 2002 hasta julio de 2003 y una temperatura média de 21,3 °C.
La plantación se realizó el 4 de octubre de 2002 a partir de fragmentos de rizoma del clon LIEY 97-1 (material importado de Erquis, Departamento de Tarija, Bolivia), con un espaciamiento de 1 m entre plantas y 1,5 m entre surcos. El suelo fue preparado en bordos de 40 cm de altura y se aplicó fertilizante (P: 40 Kg/ ha y N: 60 Kg/ ha), que fue incorporado por medio de rastra antes de la plantación.
Fechas de cosecha
Las cosechas fueron efectuadas a los 128, 142, 156, 169, 188, 210, 233 y 272 y 306 días de realizada la plantación. En cada fecha se cosecharon 10 plantas al azar de líneas diferentes, evitando tomarlas de los bordes o en las líneas donde podían verse raíces desenterradas. Se separaron los órganos y se pesaron individualmente para el cálculo del peso fresco y seco de hojas, tallo, raíces y rizomas (n=10). De las diez plantas cosechadas se eligieron al azar tres plantas de las que se tomaron tres raíces por planta. De las nueve raíces se eligieron tres al azar para extracción de jugo y análisis de compuestos de reserva.
Peso fresco y seco
Se pesaron las plantas apenas cosechadas y se tomaron alícuotas de, al menos, un 10% de cada órgano; se secó el material en estufa a 80°C hasta obtener peso constante, y se estimó el peso seco total. La balanza utilizada fue una Mettler Toledo 8582 USA con 0,1 g de sensibilidad. A fin de comprobar si existían diferencias en el desarrollo entre los distintos órganos en cada período del año se realizaron análisis de la varianza con el test de student-Newman-Keuls.
Extracción de jugo de raíces y análisis de compuestos de reserva
Las tres raíces fueron peladas y pesadas. Se extrajo el jugo con una juguera centrífuga, obteniéndose una muestra mixta del jugo de las tres raíces. Se midieron los grados Brix (contenido de sólidos solubles totales) y se almacenó a 18°C hasta análisis en laboratorio.
Obtención de los extractos a partir de jugo
La metodología utilizada fue la descripta por Jefford and Edelman (1961) para tubérculos Helianthus tuberosus.
A 1 ml de jugo se le adicionaron 3 ml de EtOH 80%, 30 minutos a baño maría a 80 °C.
Se centrifugó 10 minutos a 3.500 rpm. Se separó el precipitado y se le cuantificaron los azúcares residuales, los que no fueron mayores al 0,5% del total, por lo cual fueron descartados.
El sobrenadante se evaporó a sequedad en vidrio de reloj, mediante un flujo de aire caliente. Se retomó en 1,5 ml de agua bidestilada.
Para la eliminación de sales, 0,25 ml del extracto acuoso obtenido se llevó a 1 ml con agua bidestilada. Se hidrató en tubos de hemólisis 1 gr de Amberlite MB3 (Sigma) con agua bidestilada, se centrifugó y retiró el exceso de líquido. Se sembró sobre la resina 1 ml del extracto acuoso, se agitó con varilla de vidrio y se procedió a centrifugar durante 10 minutos. Se separó el sobrenadante. Se lavó la resina dos veces con 1 ml de agua cada vez, juntando todos los sobrenadantes. El lavado se repitió otras dos veces con 0,5 ml de agua bidestilada. Se midieron los volúmenes de los sobrenadantes. Los extractos resultantes se almacenaron a -18º.
Identificación de las sustancias de reserva mediante cromatografía líquida de alta presión
Equipo utilizado: HPLC con horno (Gilson), Alícuotas: 20 μl de extracto. Columna: Rezex RSO oligosaccharide Ag++ (con precolumna). Fase móvil: agua a 70°C. Flujo: 0,3 ml/min. Tiempo de la corrida: 45'. Detector: Índice de Refracción. Patrones utilizados: glucosa, fructosa y sacarosa (Sigma) y nystosa (cedida por el Dr. Norio Shiomi). Debido a la falta de patrones comerciales de FOS de distinto grado de polimerización, los valores correspondientes a cada uno de ellos fueron calculados por comparación con las áreas determinadas por medio de HPLC.
Análisis estadístico
Para cada fecha se calculó un promedio del peso fresco y peso seco de cada órgano (n=10), se calcularon los desvíos (STD) y se hicieron los análisis de la varianza, para comparar si las diferencias de rendimientos de cada órgano eran significativas entre las fechas de cosecha.
Resultados
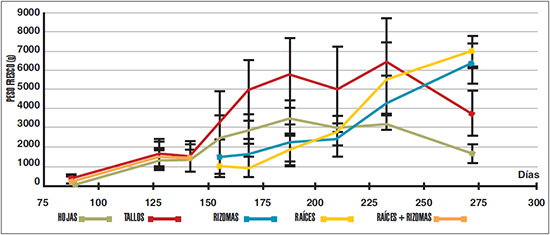
Los órganos subterráneos del yacón mostraron una tendencia al aumento lineal del peso fresco durante todo el ciclo de cultivo. Los órganos aéreos presentaron un comportamiento similar pero se produjo una disminución a partir de los 233 días, debido a que ya se encontraban claramente en etapa de senescencia. Hasta los 142 días se desarrollaron 4-6 pares de hojas de los 14-15 pares que se producen finalmente. A partir de los 142 días se observó un importante aumento en el peso fresco de la parte aérea (Figura 1). El aceleramiento en el crecimiento de las raíces almacenadoras se produjo a partir de los 169 días, manteniéndose hasta el fin del ciclo de cultivo (272 días), superando el peso determinado en la mitad del período (169 días) en siete ocasiones (Figuras 1, 2). En rizomas, tanto el peso fresco como seco tuvieron un incremento importante recién a partir de los 210 días (Figuras 1, 2). La floración fue generalizada en el cultivo y se produjo entre los 169 y 188 días del ciclo. A los 188 días se midió el mayor peso fresco del follaje. En los muestreos siguientes ya pudieron observarse signos del inicio de la senescencia de los órganos aéreos, particularmente de las hojas (Figuras 1, 3). Esta etapa coincide con la intensificación del aumento de peso fresco y seco de los órganos subterráneos, acelerándose particularmente el proceso de tuberización de las raíces almacenadoras (Figuras 1, 2, 3). El peso seco determinado varía entre el 10-15% del peso fresco del órgano correspondiente. En órganos subterráneos el mayor incremento del peso seco fue determinado a partir de los 210 días, una vez concluida la floración. En esta misma etapa y antes de la senescencia se cuantificó también un importante crecimiento de la parte aérea del cultivo.
Figure
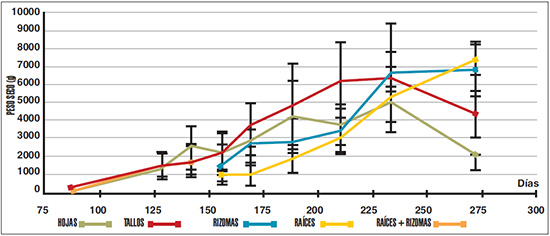
Figure 2. Variación del peso seco de los distintos órganos durante el ciclo de cultivo de yacón (n=10). Las barras verticales muestran la desviación estándar.
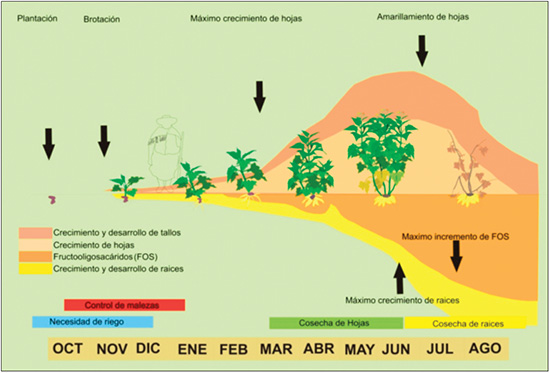
Figure 3. Esquema general del ciclo de cultivo de yacón.
Según los análisis estadísticos realizados con respecto tanto al peso fresco como al seco, se puede inferir que en la primera etapa del ciclo no hay diferencias significativas en el desarrollo de los distintos órganos. A partir del muestreo 4 (156 días), tallos y hojas adquieren un peso significativamente mayor al resto. A partir del muestreo 7 (210 días), raíces y rizomas ya son iguales a hojas (que está declinando), y recién en el muestreo 9 los órganos subterráneos resultaron significativamente mayores al resto.
Identificación de las sustancias de reserva mediante HPLC
La variación de las sustancias de reserva totales está determinada por cambios en las proporciones de los componentes, FOS, sacarosa y azucares reductores (fructosa y glucosa) (Tabla 1).
Tabla 1. Variación en mg/g de peso seco de compuestos de reserva en una muestra mixta de jugo de raíces de Smallanthus sonchifolius tomadas al azar. Se discriminan grados de polimerización (GP) entre 2 a 7.
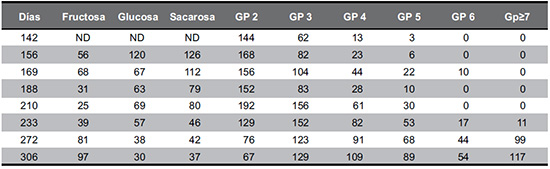
A partir de los 188 hasta los 210 días, fue el incremento más importante en el contenido de FOS. En esta etapa los valores ascendieron de 274 mg/g peso seco a 439 mg/g peso seco (Tabla 1). En los dos últimos meses la cantidad de fructosa se incrementó en relación a la cantidad de sacarosa y glucosa (Tabla 1). A los 272 días la relación fructosa / (sacarosa + fructosa) es igual a 0,5 y se hace mayor a 0,5 en el último muestreo a los 306 días.
Hasta los 233 días (casi ocho meses del cultivo), en todos los muestreos la 1-Kestosa (GP2), Nystosa (GP3) y Fructofuranosil Nystosa (GP4) resultaron ser los FOS mayoritarios. En los dos últimos meses esta relación se modificó cualitativamente: se redujeron los FOS de menor GP y aparecieron concentraciones importantes de FOS de mayor GP (Tabla 1).
Discusión
El aumento de FOS asociado a la senescencia de los órganos aéreos coincide con los estudios de Itaya et al. (2003) y Fukai et al. (1995, 1997) en trabajos realizados en Brasil y Japón, respectivamente.
La reducción durante la floración y un nuevo aumento una vez finalizada esta también se observó en otros estudios, como los de Isejima et al. (1993); Fukai et al. (1995); Van den Ende et al. (1996) y Vilhena et al. (2003).
La marcada disminución inicial de sacarosa entre el primer y segundo muestreo (Tabla 1) se debe la unión de dos moléculas de sacarosa para producir 1-kestosa, que es el fructooligosacárido más sencillo y que sirve como intermediario en la síntesis de FOS de mayor grado de polimerización (Vijn et al., 1997, 1999; Roitsch et al., 2000). La síntesis de este primer FOS implica la liberación de una molécula de glucosa, esto explica también el aumento de la misma en el segundo muestreo (Tabla 1).
El aumento de fructosa y reducción de sacarosa es adjudicada a la despolimerización de fructosa terminal, de la cadena de FOS, en azúcares más simples (Vilhena et al., 2003).
Respecto de los FOS, los resultados son coincidentes con Vilhena et al. (2003), ya que se produjo aumento en el GP, particularmente en los dos últimos muestreos (Tabla 1) por degradación de FOS de GP menor (Marx et al., 1997; Itaya et al., 2002).
Si bien se ha citado en estudios realizados en raíces de yacón la disminución hacia el final del ciclo de FOS totales, coincidiendo con el reinicio de la brotación de los rizomas (Fukai et al., 1997; Vilhena et al., 2003; Sumiyanto et al., 2012), en este trabajo se determinó que el incremento de FOS, así como el de los azúcares reductores, se mantiene hasta el final del ciclo de 10 meses, momento en el que no se había iniciado aún el rebrote de rizomas.
Conclusiones
Es posible cultivar yacón para ser utilizado como una importante fuente de FOS de buena calidad en el pedemonte de Tucumán, Argentina.
Las raíces cosechadas a partir de los 233 días de cultivo poseen las mejores condiciones para ser consumidas como alimentos hipocalóricos, aptos para diabéticos: por un lado, la fructosa (apta para diabéticos cuando se ingiere en forma natural, American Diabetes Asociation, 2002) es mayoritaria en esta etapa del ciclo, seguida en cantidad por la glucosa y sacarosa respectivamente; además, en este período se registró la mayor concentración de FOS GP ≤ 5).
Debido al incremento de peso seco y peso fresco, de raíces tuberosas y de FOS y fructosa, es conveniente prolongar el ciclo por lo menos hasta los 270 días para realizar la cosecha final, con el fin de obtener mayores rendimientos.
Agradecimientos
- Los autores agradecen al Dr. Ricardo Fitszimons y a la Dra. Soledad Cuello por los análisis de HPLC.
- Al Dr. Norio Shiomi de la Universidad Rakuno Gakuen (Japón), quien gentilmente cedió patrones de FOS.
- A Acheral SA, que cedió generosamente el sitio, recursos y personal para la realización del ensayo en Sauce Huascho (Famaillá, Tucumán, Argentina).
Bibliografía citada
1. Douglas, J. A.; J. J. C. Scheffer; I. M. Sims and C. M. Triggs. 2002. Maximising fructo-oligosaccharide production in yacon. In : Proceedings of the Agronomy Society of New Zealand 32, pp. 49-55. [ Links ]
2. Fukai, K.; S. Ohno; K. Goto and Y. Hara. 1995. Seasonal growthand fluctuations of sugar content in yacon (Polymnia sonchifolia) during growth and dormancy. Jpn. J. Soil Sci. Plant Nutr. 66: 236-237. [ Links ]
3. Fukai, K.; S. Ohno; K. Goto; F. Nanjo and Y. Hara. 1997. Seasonal fluctuations in Fructan content and related enzyme activities in yacón (Polymnia sonchifolia). Soil Science and Pl. Nutr. 43: 171-177. [ Links ]
4. Genta, S.; W. Cabrera; N. Habib; J. Pons; I. M. Carillo; A. Grau and S. Sánchez. 2009. Yacon syrup: beneficial effects on obesity and insulin resistance in humans. Clinical Nutrition 28 (2): 182-187. [ Links ]
5. Gibson, G. R. 1999. Dietary modulation of the human gut microflora using the prebiotics oligofructose and inulin. The Journal of nutrition 129 (7): 1438S-1441s. [ Links ]
6. Grau, A. and J. Rea. 1997. Yacon. Smallanthus sonchifolius (Poepp. & Endl.) H. Robinson. In: Hermann, M. and J. Heller (eds.), Andean roots and tubers: Ahipa, arracacha, maca and yacon. Promoting the conservation and use of underutilized and neglected crops 21, pp. 199-242. [ Links ]
7. Grau, A.; A. M. Kortsarz; M. J. Aybar; A. N. Sánchez Riera y S. S. Sánchez. 2001. El retorno del yacón. Ciencia Hoy 11 (63): 24-32. [ Links ]
8. Isejima, E. M. and R. C. L. Figueiredo-Ribeiro. 1993. Fructan variation in tuberous root of Viguiera discolors Baker (Asteraceae): the influence of phenology. Plant and Cell Phys. 34: 723-727. [ Links ]
9. Itaya, N. M. 2002. Purificaçao e caracterizaçao comparadadas enzimas de sintese e degradaçao de fructanos en Viguiera discolor Baker e Polymnia sonchifolia Poepp. y Endl. (Asteraceae). Tese Doutorado. UESP. Sao Paulo, Brasil. [ Links ]
10. Jefford, T. G. and J. Edelman. 1961. Changes in content and composition of the fructose polymers in tubers of Helianthus tuberosus L. during growth of daughter plants. Journal of Experimental Botany 35: 177-187. [ Links ]
11. Marx, S.; J. Nösberger and M. Frehner. 1997. Seasonal variation of fructan-fructosidase (FEH) activity and characterization of a - (2-1) linkage specific FEH from tubers of Jerusalem artichoke (Helianthus tuberosus). New Phytol. 135: 267-277. [ Links ]
12. Roberfroid, M. B.; J. A. Van Loo and G. R. Gibson. 1998. The bifidogenic nature of chicory inulin and its hydrolysis products. The Journal of nutrition 128 (1): 11-19. [ Links ]
13. Roberfroid, M. B. 2007. Inulin-type fructans: functional food ingredients. The Journal of nutrition 137 (11): 2493S-2502S. [ Links ]
14. Roitsch, T.; R. Ehneß; M. Goetz; B. Hause; M. Hofmann and A. K. Sinha. 2000. Regulation and function of extracellular invertase from higher plants in relation to assimilate partitioning, stress responses and sugar signalling. Functional Plant Biology 27 (9): 815-825. [ Links ]
15. Seminario, J.; M. Valderrama and I. Manrique. 2003. El yacón: fundamentos para el aprovechamiento de un recurso promisorio.Centro Internacional de la Papa (CIP), Universidad Nacional de Cajamarca, Agencia Suiza para el Desarrollo y la Cooperación (COSUDE), Lima, Perú [ Links ].
16. Sumiyanto, J.; F. E. Dayan; A. L. Cerdeira; Y. H. Wang; I. A. Khan and R. M. Moraes. 2012. Oligofructans content and yield of yacon (Smallanthus sonchifolius) cultivated in Mississippi. Scientia horticulturae 148: 83-88. [ Links ]
17. Van den Ende, W.; J. De Roover and A. Van Laere. 1996. In vitro synthesis of fructofuranosyl-only oligosaccharides from inulin and fructose by purified chicory root fructan: fructanfructosyltransferase. Physiol. Plant. 97: 346-352. [ Links ]
18. Vijn, I.; A. V. Dijken; N. Sprenger; K. V. Dun; P. Weisbeek; A. Wiemken and S. Smeekens. 1997. Fructan of the inulin neoseries is synthesized in transgenic chicory plants (Cichorium intybus L.) harbouring onion (Allium cepa L.) fructan: fructan 6G‐fructosyltransferase. The Plant Journal 11 (3): 387-398. [ Links ]
19. Vijin, I. and S. Smeekens. 1999. Fructan: More Than a Reserve Carbohydrate? Plant Physiol. 120: 351-359. [ Links ]
20. Vilehna, S. M. C.; F. L. Camara; I. M. Piza y G. P. Lima. 2003. Contenido de Fructanos en Raíces Tuberosas de Yacón (Polymnia sonchifolia). Ciencia y Tecnología Alimentaria 4: 35-40. [ Links ]














