Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista industrial y agrícola de Tucumán
On-line version ISSN 1851-3018
Rev. ind. agric. Tucumán vol.93 no.1 Las Talitas June 2016
ARTÍCULOS ORIGINALES
ANÁLISIS COMPARATIVO DE COLORANTES VITALES EN EL ESTUDIO DE LA VIABILIDAD DE LEVADURAS
Juan Luis Aráoz Martínez*, Gerónimo Cárdenas**, Marcelo Ruiz* y Carlos Gusils*,***
* Sección Química, EEAOC;
** Sección Ingeniería y Proyectos, EEAOC
*** ITANOA-CONICET. Email: cgusils@eeaoc.org.ar.
Resumen
La fermentación alcohólica es un proceso que implica el uso de levaduras para obtener alcohol a partir de azúcar. La viabilidad de las levaduras y su control son muy importantes para que este proceso tenga éxito. Eritrosina es un colorante que puede ser utilizado en el recuento en cámara en lugar de azul de metileno, que se utiliza convencionalmente. Se planteó como objetivo de este trabajo comparar la utilización de eritrosina y azul de metileno en la determinación de la viabilidad celular. Ambos colorantes se usaron en paralelo para analizar 101 muestras de diferentes etapas del proceso de fermentación. Los resultados fueron analizados por regresión y se observó que no hubo diferencias significativas entre el uso de cualquiera de los colorantes. La eritrosina, además, presenta ventajas adicionales tales como que su preparación es más fácil y rápida, no mancha materiales ni microscopio y permite observar mejores contrastes entre células vivas y muertas.
Palabras clave: Saccharomyces cerevisiae, eritrosina, viabilidad, bioetanol.
Abstract
COMPARATIVE ANALYSIS OF VITAL DYES IN THE STUDY OF THE VIABILITY OF YEAST
Alcoholic fermentation is a process that involves the use of yeasts to obtain alcohol from sugar. yeast viability and its control are highly important for this process to succeed. Erythrosine is a dye that can be used in the counting chamber, instead of methylene blue, which is conventionally utilized. The present work aimed to compare the use of erythrosine and methylene blue in determining cell viability. Both dyes were used in parallel to analyze 101 samples from different fermentation process stages. Results were analyzed by regression and it was observed that they differed slightly, so there were no significant differences between using either dye. Furthermore, erythrosine presents additional advantages, such as the fact that its preparation is easier and faster, it does not stain microscopy equipment and it reveals better contrasts between live and dead cells.
Key words: Saccharomyces cerevisiae, erythrosine, viability, bioethanol.
Introducción
El cultivo de la caña de azúcar y su industrialización son las principales actividades agroindustriales en Tucumán, y tiene como finalidad la producción de azúcar, bioetanol y más recientemente energía eléctrica para venta.
El proceso de fermentación industrial para producir biocombustibles consiste en la transformación bioquímica de los azúcares de diversas materias primas en alcohol y CO2, buscando los máximos rendimientos y el menor grado de pérdidas posibles.
Saccharomyces cerevisiae es la especie de levadura empleada por excelencia en la obtención de etanol por su capacidad fermentativa (rendimiento y velocidad), tolerancia osmótica al etanol, resistencia a medios ácidos y a temperaturas, alta viabilidad celular para reciclajes y estabilidad genética (Ceccato-Antonini, 2010).
Sus células elípticas miden alrededor de 6-8 μm de longitud por 5 μm de ancho y su reproducción asexuada se realiza por brotación (Payne et al., 2011).
En la búsqueda de optimizar el estudio del comportamiento de las levaduras en los procesos de fermentación es importante emplear técnicas confiables y de mejor resolución.
La viabilidad celular es, sin duda, un aspecto importante en el control de la fermentación alcohólica.
Cuanto mayor es el número de células vivas, mejor será el rendimiento neto del proceso. La presencia de alcoholes superiores (n-butanol, alcohol isoamílico), ácidos grasos yésteres, incluso a bajas concentraciones, hace que estos actúen de una manera sinérgica como compuestos tóxicos de las células de levadura, dando lugar a la muerte y, en consecuencia, a una disminución de la viabilidad celular (Ceccato-Antonini, 2010).
Existen numerosas pruebas para determinar la viabilidad celular, entre las que se pueden mencionar la coloración de células por microscopía directa y el cultivo en medios agarizados. Se planteó como objetivo del presente trabajo estudiar el uso del colorante eritrosina para determinar la viabilidad de células de levadura, como una alternativa al azul de metileno, que se emplea convencionalmente.
Materiales y métodos
Se analizaron un total de 101 muestras de diferentes etapas del proceso de fermentación de un ingenio para evaluar la eficacia del empleo del colorante eritrosina como alternativa para visualizar el estado de las levaduras y poder informar la viabilidad de estas.
Para estudiar la viabilidad se realizó el conteo de células con cámara de Neubaüer (Copersucar, 1987) en crema de levadura, pre-fermentador, mostos en las diferentes etapas de fermentación y vino.
Soluciones para recuentos de células
Eritrosina
Se disolvió 1g de eritrosina en 100 ml de agua destilada; luego se agregó 1 ml de esta solución en 50 ml de solución tampón, partes iguales de Na2HPO4 0,2 M y NaH2PO4 0,2 M, y se obtuvo una solución del colorante de 1:5000 (Oliveira et al., 1996).
Azul de metileno
Se pesaron 0,025g de azul de metileno; 0,9g de NaCl; 0,042g de KCl; 0,048g de CaCl2.6H2O; 0,02g de NaHCO3 y 1g de glucosa. Se disolvieron en 100 ml de agua destilada con agitación constante durante seis horas.
Posteriormente, la solución se filtró empleando papel de filtro tipo Whatman Nº 1, y se almacenó en un recipiente oscuro para preservarla de la luz.
Recuento en cámara de Neubaüer
Se mezclaron 100 μl de cada uno de los colorantes con igual volumen de diluciones de las muestras, y se colocó posteriormente un volumen de las mezclas en la cámara de recuento. Se observó al microscopio empleando un aumento de 400x.
Análisis de datos
Se realizó Prueba T apareada para el análisis de los datos empleando el programa InfoStat (Di Rienzo et al., 2010) para Windows.
Resultados y discusión
Del análisis estadístico de datos pareados se determinó que no existe diferencia significativa al emplear eritrosina en lugar de azul de metileno. Esto se observa también en la gráfica de correlación (Figura 1), en la cual se comparan gráficamente ambas técnicas, y se constata que no hubo dispersión de los puntos en las determinaciones efectuadas (índice de correlación de 94,5%).

Además se observó que el empleo del colorante eritrosina para el recuento de levaduras presenta las siguientes ventajas sobre la utilización del azul de metileno (Tabla 1):

1) La preparación es más sencilla, como se indica.
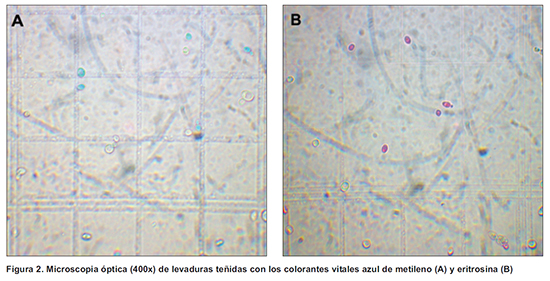
2) El colorante presenta mejor resolución ya que acentúa las diferencias entre las células viables e inviables, permitiendo un mejor contraste en la
visualización microscópica (Figura 2).
3) En muestras de mostos con alta concentración de melaza utilizando azul de metileno, las levaduras vivas se tornan de un color verdoso que dificulta la visualización de las levaduras muertas. En cambio con eritrosina se observó claramente la diferencia entre células vivas y muertas.
4) Es una metodología más económica no sólo por el costo de la droga sino por material que se debe reponer por la tinción de los elementos de laboratorio al emplear azul de metileno, por ejemplo la cámara de Neubauer.
Los colorantes vitales, entre ellos el azul de metileno y, recientemente, la eritrosina, son ampliamente empleados para estudiar la viabilidad celular por la facilidad y rapidez del análisis. Esto se hace en control de células en los procesos de producción de levaduras (levadura prensada) y fermentación alcohólica (Ceccato-Antonini, 2010).
Algunos autores emplean eritrosina para evaluar viabilidad celular, tanto incorporándola en medios agarizados (Mendes et al., 2013), como recuento por microscopía (Alcarde, 2000; Alcarde et al., 2003; Nobre et al., 2007).
Conclusiones
Es importante controlar la viabilidad celular, ya que existen diferentes factores que pueden causar estrés y muerte en las células de levadura durante el proceso de fermentación industrial.
Del presente trabajo se puede concluir que el análisis de regresión realizado no presenta variabilidad en el empleo de la eritrosina como colorante, respecto de la metodología convencional que utiliza azul de metileno para el recuento de células en cámara de Neubaüer.
Las ventajas del uso de eritrosina en recuento de células por microscopía van desde una preparación rápida y sencilla de sus soluciones hasta una mejor definición y contraste, incluso en muestras con altas concentraciones de melaza. Asimismo, la solución de eritrosina puede almacenarse por largos períodos en heladera, presenta mayor estabilidad y no mancha los elementos de microscopía.
Bibliografía citada
1. Alcarde, A. R. 2000. Efeito da radiação gama em alguns parâmetros microbiológicos e bioquímicos da fermentação alcoólica. Piracicaba. Tese (Doutor em Ciências), Centro de Energia Nuclear na Agricultura, Universidade de São Paulo (USP). [ Links ]
2. Alcarde, A. R.; J. M. Melges Walder and J. Horii. 2003. Fermentation of irradiated sugarcane must. Scientia Agricola 60 (4): 677-681. [ Links ]
3. Ceccato-Antonini, S. R. 2010. Microbiologia da fermentaçâo alcoólica. A importância do monitoramento microbiológico em destilarias. EduFSCar, Sâo Carlos, Brasil. [ Links ]
4. Cooperativa de Produtores de Cana, Açúcar e Álcool do Estado de São Paulo ltda.(Copersucar). 1987. Metodologia da análise microscópica (Viabilidade). Copersucar, São Paulo, Brasil. [ Links ]
5. Di Rienzo, J. A.; F. Casanoves; M. G. Balzarini; L. González; M. Tablada y C. W. Robledo. 2010. InfoStat versión 2010. Grupo Infostat, FCA, Universidad Nacional de Córdoba, R. Argentina. [ Links ]
6. Mendes, T. A.; L. M. Pinto; D. de Sena Oliveira Mendes; H. L. Malta and E. de Souza Oliveira. 2013. Increase in yeast biomass production in batch ande mi-continuous aerated propagators in the production of sugarcane spirit. Braz. J. Food Technol. 16 (2): 81-89. [ Links ]
7. Nobre, T. P.; J. Horii and A. R. Alcarde 2007. Cellular viability of Saccharomyces cerevisiae cultivated in association with contaminant bacteria of alcoholic fermentation. Ciênc. Tecnol. Aliment., Campinas 27 (1): 20-25. [ Links ]
8. Oliveira, A. J.; C. R. Gallo; V. E. Alcarde; A. Godoy e H. V. Amorim 1996. Métodos para o controle microbiológico na produção de álcool e açúcar. Fermentec; Fealq; ESALQ-USP. Piracicaba, Brasil, pp. 89. [ Links ]
9. Payne, R.W.; C. P. Kurtzman; J. W. Fell and T. Boekhout. 2011. Key to Species. In The Yeasts (Fifth Edition), Kurtzman, C. P.; J. W. Fell; T. Boekhout (eds.), pp. 175-221. [ Links ]














