Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista industrial y agrícola de Tucumán
versión On-line ISSN 1851-3018
Rev. ind. agric. Tucumán vol.94 no.1 Las Talitas jun. 2017
Incompatibilidad pre y postcigótica entre dos poblaciones de Diatraea saccharalis Fabricius, 1794 (Lepidóptera: Crambidae) de Argentina
Sofia V. Fogliata*, María I. Herrero*, Alejandro M. Vera**, Lucas A. Fadda**, María I. Cuenya*, Atilio P. Castagnaro*, Gerardo Gastaminza** y María G. Murúa**
*Instituto de Tecnología Agroindustrial del Noroeste Argentino (ITANOA)-
Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)-
**Estación Experimental Agroindustrial Obispo Colombres (EEAOC). sofiavfogliata@gmail.com
RESUMEN
Diatraea saccharalis (Fabricius) (Lepidóptera: Crambidae), es una de las plagas de mayor importancia en el Norte Argentino en caña de azúcar y en la región pampeana es la más importante en maíz y sorgo. Es una especie polífaga, con características bioecológicas que podrían generar un limitado flujo génico entre las poblaciones del país, favoreciendo la aparición de biotipos. Por ello, el objetivo del trabajo fue caracterizar la biología y la compatibilidad reproductiva de dos poblaciones recolectadas en Buenos Aires (maíz) y Tucumán (caña de azúcar) en Argentina. Las larvas recolectadas fueron mantenidas en laboratorio bajo condiciones controladas (25 ± 2 ºC, 75% HR, 14:10 L/O). Los parámetros evaluados fueron: duración del huevo, larva y pupa, peso de las pupas, longevidad de los adultos y proporción de sexos, número de espermatóforos, duración de los periodos de preoviposición, oviposición y postoviposición, fertilidad y fecundidad. No se encontraron diferencias significativas en los parámetros biológicos, pero se detectó incompatibilidad precigótica y postcigótica entre las poblaciones. Este resultado demuestra una interrupción del flujo génico, lo que sugiere que las poblaciones de Tucumán y Buenos Aires son, posiblemente, biotipos diferentes. Este estudio constituye el primer registro de aislamiento reproductivo entre poblaciones de D. saccharalis de Argentina utilizando parámetros biológicos y de compatibilidad reproductiva, siendo de utilidad para definir estrategias de manejo y control de las poblaciones de D. saccharalis en Argentina.
Palabras clave: barrenador del tallo, biotipos, ciclo de vida, flujo génico.
ABSTRACT
Pre- and post-zygotic incompatibility between two populations of Diatraea saccharalis Fabricius, 1794 (Lepidoptera: Crambidae) from Argentina
Preliminary studies of cane sugar refining in the off season
Diatraea saccharalis (Fabricius) (Lepidoptera: Crambidae) is one of the most important pests in the North of Argentina in sugar cane and in the Pampas region is the most important pest in maize and sorghum. It is a polyphagous species, with bioecological characteristics that could generate a limited gene flow among the populations of the country, favoring the appearance of biotypes. Therefore, the objective of the study was to characterize the biology and reproductive compatibility of two populations collected in Buenos Aires (maize) and Tucumán (sugarcane) in Argentina. The collected larvae were kept in the laboratory under controlled conditions (25 ± 2 ºC, 75% RH, 14:10 L / O). The parameters evaluated were: egg duration, larvae and pupa, pupae weight, adult longevity and sex ratio, number of spermatophores, duration of periods of preoviposition, oviposition and postoviposition, fecundity and fertility. No significant differences were found in biological parameters, but prezygotic and postzygotic incompatibility was detected among populations. This result shows an interruption of the gene flow, suggesting that the populations of Tucumán and Buenos Aires are, possibly, different biotypes. This study constitutes the first record of reproductive isolation among populations of D. saccharalis from Argentina using biological parameters and reproductive compatibility, being useful to define strategies of management and control of populations of D. saccharalis in Argentina.
Key words: Stem borer, biotypes, life cycle, gene flow.
INTRODUCCIÓN
Dentro del orden Lepidóptera, la tercera superfamilia más grande, Pyraloidea, está compuesta por dos familias; Pyralidae y Crambidae (Solis, 2007). Esta última contiene a la subfamilia Crambinae, que incluye al género Diatraea Guilding, uno de los grupos de polillas de mayor importancia económica en el hemisferio occidental, entre ellas el barrenador del tallo, Diatraea saccharalis (Fabricius) (Lepidóptera: Crambidae). Esta especie es la más ampliamente distribuida dentro del género Diatraea. Se la encuentra desde el sur de EE.UU., Las Antillas, el Caribe, Centroamérica y hasta América del Sur (Dyar and Heinrich, 1927; Box, 1931, 1951, 1956). Las larvas son barrenadores del tallo y de hábito polífago, alimentándose de numerosas especies silvestres y de poáceas (Solis and Metz, 2016), que incluyen pastos acuáticos y semiacuáticos como Paspalum spp., Echinocloa spp, Leptochloa spp. e Hymenachne spp (Box, 1931, 1935; Myers, 1932). Actualmente ha sido citada aproximadamente en 65 especies de plantas, 30 de las cuales son cultivos de importancia económica, como caña de azúcar (Saccharum officinarum L.), maíz (Zea mays), sorgo (Sorghum bicolor L.), trigo (Tríticum vulgare L.) y arroz (Oryza sativa L.) (Ingram and Bynum, 1941; Box, 1951; Randolph et al.,1967; Dinther and Goossens, 1970; Dinther, 1971). Esto motivó el aumento del interés por el grupo desde la domesticación de estos cultivos de importancia para el hombre, que no solo amplió el rango de plantas hospederas para este género, sino que produjo un cambio de preferencia hacia plantas más suculentas.
En la Argentina, los principales cultivos hospederos de esta especie varían según cada región; en el Noroeste Argentino (NOA) ocasiona importantes pérdidas en caña de azúcar (Willink, 1982; Salvatore et al., 2010) y en la zona pampeana, el principal hospedero es el maíz, seguido por el sorgo y el trigo (Aragón, 2002; Iannone, 2002; Serra and Trumper, 2006). En algunos casos, existen especies de insectos fitófagos que, aun siendo polífagos, muestran preferencia o adaptaciones a un hospedero en particular. Esta especialización adaptativa es considerada como una vía para la generación de nuevos biotipos mediante procesos de especiación ya sea simpátrica, alopátrica o parapátrica. El resultado de dichos procesos es el surgimiento de razas hospederas o biotipos o incluso de nuevas especies entre las que el flujo génico será mínimo o nulo (Drès and Mallet, 2002; Rull et a., 2012). La identificación de biotipos se basa por lo general en la preferencia diferencial de las plantas hospederas, en el comportamiento, en la composición y variación genética, en las respuestas fisiológicas a los cambios físicos y las presiones en el medio ambiente (luz, temperatura, humedad relativa, insecticidas y las plantas hospederas), en el análisis reproductivo (fecundidad y fertilidad), en los patrones de actividad diurna o estacional, migración y tendencias de dispersión, en las diferencias de feromonas, e incluso en algunos casos en las diferencias morfométricas (Eastop, 1973; Russel, 1978; Gonzalez et al., 1979; Saxena and Rueda, 1982; Saxena and Barrion, 1985; Fargo et al.,1986). Además, actualmente se considera también fundamental el estudio del flujo de genes y las barreras reproductivas, ya sean físicas, conductuales o citológicas, existentes entre los biotipos. Estas barreras reproductivas se pueden clasificar en precigóticas y postcigóticas, dependiendo del momento en que actúan. Las barreras precigóticas actúan antes de la formación del zigoto, e involucran todas aquellas situaciones o mecanismos que impiden la cópula, incluyendo los aislamientos temporales, por diferenciación de hábitat o recurso y el aislamiento etológico (por diferencias en el comportamiento sexual). Mientras que las barreras postcigóticas son todas aquellas situaciones o mecanismos en las que los cigotos y los individuos adultos, si es que llegan a completar su desarrollo, tienen prácticamente anulada su eficacia biológica (Dobzhansky, 1970; Perfectti, 2002). El estudio de biotipos de los insectos plaga es particularmente relevante para los programas de manejo relacionados con las preferencias de uso de hospederos, el uso de insecticidas, la resistencia (tanto a insecticidas como a proteínas Bt) y el control biológico (Gonzalez et a., 1979; Saxena y Barrion, 1987).En el caso de lepidópteros plaga, la eficacia de los programas de control radica en usar estrategias que minimicen el riesgo de aparición de genotipos resistentes ya sea por un mal uso de insecticidas o de cultivos genéticamente modificados. En ambos casos, lo que se busca es aumentar la frecuencia de individuos susceptibles y reducir la frecuencia de individuos resistentes. Para ello, se debe favorecer la cruza entre ambos tipos de individuos. Es así como resulta necesario entonces conocer la variabilidad genética existente entre las poblaciones y la forma en la que esta varía a lo largo del tiempo, como así también estimar el grado de intercambio de genes entre poblaciones (Saxena y Barrion, 1987). En el caso particular de D. saccharalis, la ocurrencia de estructuración genética ya fue detectada en poblaciones del norte y del sur del continente americano. La mayoría de estos estudios utilizaron herramientas moleculares (Lange et al., 2004; Cadena Goyes, 2008; Cortés et al., 2010; Joyce et al., 2014; Pavinato, 2014; Joyce et al., 2016). Solo Box (1951, 1956) y Pashley et al. (1990) reportaron diferencias morfológicas, fisiológicas y de comportamiento entre poblaciones del barrenador. Si bien existen antecedentes que prueban la existencia de cambios en la estructura genética de las poblaciones, es poco lo que se conoce con respecto a la compatibilidad reproductiva y el éxito de cópula entre poblaciones de D. saccharalis provenientes de diferentes hospederos y/o regiones. En base a lo expuesto, el objetivo de este estudio fue caracterizar los parámetros biológicos y reproductivos de dos poblaciones de D. saccharalis: una proveniente de la provincia de Tucumán del cultivo de caña de azúcar, y otra de la provincia de Buenos Aires del cultivo de maíz, bajo condiciones controladas.
MATERIALES Y MÉTODOS
Recolección de los insectos: las larvas fueron recolectadas en el año 2014 en campos comerciales en dos regiones geográficas de Argentina. En el NOA, la recolección se realizó en la localidad de La Cocha, (Tucumán) (S: 27° 50' 4,6'', O: 65° 30' 58,7'') en caña de azúcar (población A) y en la región pampeana, en la localidad de Pergamino (Buenos Aires) (S: 33° 51' 51,6'', O: 60° 39' 32,3'') en maíz convencional (no Bt) (población B). En cada sitio de muestreo se recolectó al azar un mínimo de 200 larvas (estadios larvales 3-6). Estas fueron colocadas individualmente en tubos de vidrio (12 cm de alto y 1,5 cm de diámetro) con trozos de tallos de los correspondientes cultivos. Las larvas recolectadas fueron llevadas al laboratorio y se colocaron en una cámara de cría bajo condiciones controladas (25 ± 2 ºC, 70 a 75% de HR, 14L:10O) hasta la emergencia de los adultos. Una vez emergidos, fueron examinados utilizando claves taxonómicas para confirmar la identidad de la especie. Los insectos identificados de cada una de estas poblaciones fueron guardados como especímenes "vouchers". Cría de los insectos: a partir de las larvas recolectadas en los cultivos de caña de azúcar y maíz se estableció una colonia experimental para cada población con un total de aproximadamente 350 adultos (175 hembras y 175 machos). Estos adultos se distribuyeron en 10 jaulas cilíndricas de oviposición con aproximadamente 20 hembras y 20 machos por jaula para cada población. Estas jaulas se mantuvieron bajo iguales condiciones ambientales de 25 ± 2 ºC, 70-75% de humedad relativa y un fotoperíodo de 14L:10O en la misma cámara de cría. Las jaulas cilíndricas de oviposición (200 cm de alto x 150 cm de diámetro) fueron fabricadas con una malla de alambre y luego forradas con bolsas transparentes de polietileno como sustrato de oviposición. Para favorecer la aireación, ambos extremos de la jaula se cubrieron con tela de nylon sujeta con bandas elásticas. Las jaulas se colocaron en bandejas de plástico con base de espuma de poliuretano humedecida para mantener la humedad. Los adultos fueron alimentados con una solución de miel y agua (1: 1 vol:vol), proporcionada embebiendo un trozo de algodón, el cual era colgado en la pared de la jaula. El alimento fue renovado todos los días y las jaulas fueron revisadas diariamente para registrar la oviposición y mortalidad de adultos. Los huevos fueron recolectados diariamente con un pincel de cerdas finas y depositados en cajas de Petri forradas con papel de filtro humedecido para evitar la desecación. Una vez eclosionadas, las larvas neonatas fueron colocadas individualmente en tubos de ensayo de vidrio (12 cm de alto y 1,5 cm de diámetro) con dieta artificial (Murúa et al., 2003). La dieta fue renovada cada dos o tres días. Una vez obtenidas las pupas, estas fueron sexadas y colocadas en contenedores plásticos hasta la emergencia de los adultos. Los adultos obtenidos fueron utilizados para iniciar una nueva generación. Después de establecida la colonia para cada población, se utilizaron individuos de la segunda a la quinta generación para los estudios de "aptitud biológica" y de compatibilidad reproductiva entre las poblaciones. Aptitud biológica de las poblaciones del barrenador: de las colonias experimentales de cada población, descriptas anteriormente, una vez eclosionadas las larvas de la primera generación de laboratorio fueron elegidas al azar un total de 80 larvas neonatas por cada población. Las larvas fueron individualizadas en tubos de ensayo de vidrio con dieta artificial. Diariamente fueron revisadas para registrar los siguientes parámetros: duración de estadios larvales y de pupa, masa pupal (obtenida 24 h después de la formación de la pupa) y la proporción de sexo de los adultos. De los adultos obtenidos, se eligió al azar un conjunto de aproximadamente 15 hembras y 30 machos de cada población. Para promover el apareamiento de las hembras, se colocaron en jaulas cilíndricas de oviposición (30 cm de alto x 15 cm de diámetro), similares a las descriptas anteriormente, una hembra virgen y dos machos vírgenes de 24 h de edad, que pertenecían a una misma población. Esto se efectuó para ambas poblaciones. Estas jaulas de cruzas fueron denominadas como "jaulas triples" (población de Tucumán, N = 12; población de Buenos Aires N = 15). Este tipo de cruza se consideró una cruza parental y se utilizó para los estudios de compatibilidad reproductiva como testigo y para determinar los siguientes parámetros: longevidad de los adultos (hembras y machos), duración de los períodos de preoviposición, oviposición y postoviposición (días que la hembra sobrevive después de colocar la última postura), número de espermatóforos por hembra. Los parámetros de mortalidad diaria y oviposición (para hembras) se registraron hasta la muerte del último de los tres individuos. Las hembras muertas fueron disectadas para obtener el número de espermatóforos presentes en su tracto reproductivo, lo que permitió determinar si se produjo o no la cópula. Compatibilidad reproductiva: para determinar la compatibilidad reproductiva entre las poblaciones de Tucumán (región noroeste) y Buenos Aires (región pampeana), se realizó un experimento de cruzas según las metodologías descritas por Pashley and Martin (1987), Pashley et al. (1990), López-Edwards et al. (1999) y Murúa et al. (2008). Se utilizó el método de jaula triple descrito anteriormente. Las diferentes cruzas realizadas se agruparon en cuatro tipos: i) cruzas parentales: utilizando los padres de la misma población, ii) cruza de híbridos: usando uno de los padres de cada población, iii) retrocruzas: utilizando el progenitor femenino como el padre recurrente y retrocruzas con el progenitor masculino como el padre recurrente y iv) cruza entre híbridos: F1 de diferentes poblaciones. Un subconjunto de la progenie larval (F1) de las jaulas triples fue monitoreado para evaluar la supervivencia hasta el estado de pupa y adulto. Los parámetros medidos para determinar la compatibilidad fueron: número de espermatóforos por hembra, duración de los períodos de preoviposición, oviposición y postoviposición, fecundidad total y fertilidad total. Análisis de los datos: la normalidad de los datos fue analizada mediante la prueba de Shapiro and Wilk (1965). Los datos de espermatóforos por hembra, duración de los períodos de preoviposición, oviposición y postoviposición, la fecundidad total y la longevidad de los adultos que no mostraron homogeneidad en la varianza normal fueron transformados con _(x + 0.5). Los datos de fertilidad total, expresados en porcentaje, se transformaron con arcsen (x/100) 0.5. Para los estudios de aptitud biológica, los datos fueron analizados utilizando una prueba t (p <0,05) para detectar diferencias entre las poblaciones del barrenador de la caña. Para los estudios de compatibilidad reproductiva, debido al número elevado de combinaciones, se utilizaron los valores de las cruzas parentales como testigos para ser contrastados con los resultados de los otros tipos de cruzas (cruzas de híbridos, retrocruzas y cruzas entre híbridos) utilizando análisis de la varianza (ANOVA). Las comparaciones múltiples entre las medias de los distintos tipos de cruzas se realizaron con el test de Tukey. Para análisis estadísticos de aptitud biológica y compatibilidad reproductiva, la duración de los períodos de preoviposición, oviposición y postoviposición se compararon utilizando los datos de aquellas hembras que pusieron huevos. En el análisis de la fecundidad total se compararon los datos de todas las hembras, incluyendo aquellas hembras que no colocaron huevos. Todos los datos fueron analizados utilizando Infostat (2006).
RESULTADOS Y DISCUSIÓN
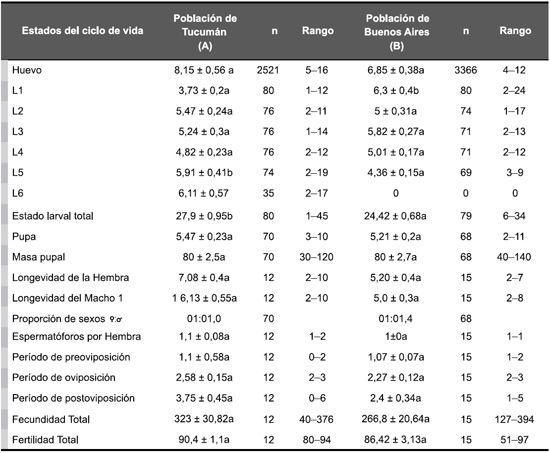
Se realizaron un total de 12 y 15 cruzamientos parentales para determinar los parámetros biológicos y reproductivos de las poblaciones de Tucumán y Buenos Aires, respectivamente (Tabla 1). Los resultados encontrados mostraron que las poblaciones de D. saccharalis de las provincias de Tucumán y Buenos Aires tienen un ciclo de vida (de huevo a adulto) de 47 y 41 días, respectivamente, bajo condiciones de laboratorio. La duración del huevo para ambas poblaciones no fue diferente a la reportada en otros trabajos publicados por Wongsiri and Randolph (1962); Greco (1995); King et al. (1975); Navarro et al. (2009) bajo condiciones similares. Fueron registrados seis y cinco estadios larvales para Tucumán y Buenos Aires, respectivamente. Wongsiri y Randolph (1962), King et al. (1975), Melo (1984), Machado Botelho (1985), Greco (1995) y Navarro et al. (2009) registraron en general un mínimo de cinco estadios larvales y algunos de ellos mencionaron seis o siete. Los resultados encontrados en este estudio con respecto a la duración del estado larval fueron similares a los reportados por Wongsiri and Randolph (1962) y Greco (1995), o bien de menor duración que otros (King et al.,1975; Navarro et al., 2009). La duración del estado de pupa fue también más corta que la obtenida por Wongsiri and Randolph (1962), King et al. (1975), Greco (1995) y Navarro et al. (2009). Los valores de masa pupal obtenidos para ambas poblaciones fueron menores que los reportados por King et al. (1975). Esta diferencia podría deberse a que estos autores utilizaron una dieta artificial diferente a la utilizada en este trabajo. Los adultos de la población de caña de azúcar mostraron una longevidad similar a la reportada por Wongsiri and Randolph (1962), King et al. (1975), y Navarro et al. (2009). La proporción de sexos para la población de D. saccharalis de Tucumán fue similar a la reportada por Bessin and Reagan (1990) (1F: 1M), mientras que la proporción de sexos de la población de Buenos Aires dio valores sesgados ligeramente hacia los machos (1F: 1.44M). El número de espermatóforos encontrado en las hembras fue generalmente de uno para ambas poblaciones. Esta observación ya había sido reportada por Peairs and Saunders (1980). Los períodos de preoviposición, oviposición y postoviposición y los valores de fertilidad fueron similares a los obtenidos por Wongsiri y Randolph (1962), King et al. (1975) y Greco (1995). Mientras que la fecundidad registrada en este estudio fue menor que la reportada por King et al. (1975) y Bessin and Reagan (1990) y similar a la mencionada por Wongsiri y Randolph (1962) y Greco (1995). Variaciones en las condiciones de laboratorio (temperatura o humedad) y/o la dieta utilizada (dieta artificial o con tejido vegetal de diferentes plantas hospederas), utilizadas por estos autores, podrían explicar las diferencias entre los resultados obtenidos. Estos resultados muestran que los parámetros reproductivos mencionados anteriormente no mostraron diferencias significativas entre las poblaciones.
Tabla 1. Parámetros biológicos y reproductivos de poblaciones de Diatraea saccharalis recolectadas en las provincias de Tucumán y Buenos Aires (Argentina) y criadas a 25 ± 2°C, 70-75% HR y 14L: 10O.
Duración en días (media ± E.E.) de huevos, larvas (L1-L6) y pupas, masa pupal (mg), longevidad de hembras y machos (días), proporción de sexos (F:M), número de espermatóforos por hembra, duración de los períodos de preoviposición, oviposición y postoviposición (días), fecundidad y fertilidad total (%). Valores seguidos por la misma letra dentro de una fila no presentan diferencias significativas de acuerdo a la prueba t de Student (P> 0,05).
1 La longevidad de los machos fue estimada del promedio de los dos machos
Con respecto a las cruzas intra e inter poblacionales de D. saccharalis, un total de 405 cruzamientos se llevaron a cabo entre las poblaciones de Tucumán y Buenos Aires, los cuales fueron agrupados en 27 cruzas parentales, 85 cruzas híbridas, 202 retrocruzas y 91 cruzas entre híbridos. Se encontraron diferencias significativas para todos los parámetros evaluados (Tabla 2). En general, las cruzas híbridas, las retrocruzas y las cruzas entre híbridos mostraron valores más bajos que los cruzamientos parentales para todos los parámetros evaluados. Considerando los resultados de los análisis comparativos realizados entre los tres tipos de cruzas con las cruzas parentales, se detectó incompatibilidad, tanto precigótica como postcigótica, entre los individuos de las diferentes poblaciones. Estas incompatibilidades generaron una aptitud nula o baja en los híbridos, reduciendo su eficacia biológica cuando se compararon con las cruzas parentales (Perfectti, 2002). Este resultado probablemente es el producto de una interrupción en el flujo de genes producido por aislamiento geográfico o por una asociación de preferencia a una planta hospedera en particular (host races) (Pashley et al., 1992; Bickford et al., 2007). Esto sugiere que las poblaciones de Tucumán y Buenos Aires de D. saccharalis presentan posiblemente un genotipo distinto, por lo cual podrían, a futuro, constituir especies incipientes.
Tabla 2. Número (media ± EE) de espermatóforos por hembra, duración de los períodos de preoviposición, oviposición y postoviposición, fecundidad total (número de huevos por hembra), fertilidad total (porcentaje de huevos eclosionados) de cruzas parentales, cruzas híbridas, retrocruzas y cruzas entre híbridos, usando poblaciones de Diatraea saccharalis recolectadas en las provincias de Tucumán y Buenos Aires (Argentina) y criadas a 25 ± 2°C, 70-75% HR Y 14L:10O.
Valores seguidos por la misma letra dentro de una fila no presentan diferencias significativas de acuerdo a la prueba de ANOVA y al test de Tuckey (P> 0,05).
1 Cruzas parentales incluyen los datos de ambas poblaciones (A × A y B × B).
CONCLUSIONES
Esta investigación constituye el primer registro de aislamiento reproductivo entre poblaciones de D.saccharalis de Argentina utilizando parámetros biológicos, reproductivos y de compatibilidad reproductiva. Mediante la caracterización de los parámetros biológicos analizados de las poblaciones de Tucumán (caña de azúcar) y Buenos Aires (maíz) de D. saccharalis no fue factible encontrar diferencias significativas que permitan o ayuden a la diferenciación de las poblaciones. Sin embargo, el estudio de compatibilidad reproductiva del barrenador demostró que no existiría flujo génico continuo entre las poblaciones de D. saccharalis, constituyendo probablemente dos biotipos o especies incipientes morfológicamente indistinguibles.
AGRADECIMIENTOS
Agradecemos a Carmen Urueña, Sofía Torres y David González (EEAOC) por el apoyo técnico y asistencia en la recolección de material. Agradecemos al Lic. Dr. Eduardo Willink por sus comentarios y aportes durante el proceso de escritura del manuscrito.
BIBLIOGRAFÍA CITADA
1.Aragón, J. 2002. Plagas del maíz y su control integrado. En: Satorre, E. (ed.), Guía Dekalb del cultivo de maíz, pp. 118-132.
2.Bessin, R. T. and T. E. Reagan. 1990. Fecundity of sugarcane borer (Lepidoptera: Pyralidae), as affected by larval development on gramineous host plants. Environ. Entomol.19: 635-639. [ Links ]
3.Bickford, D.; D. J. Lohman; N. Sodhi; P. K. L. Ng; R. Meier; K. Winker; K. K. Ingram and I. Das. 2007. Cryptic species as a window on diversity and conservation. TRENDS in Ecol. Evol. 22: 148-155. [ Links ]
4.Box, H. E. 1931. The crambine genera Diatraea and Xanthopherne (Lep. Pyralidae). BER 22: 1-50. [ Links ]
5.Box, H. E. 1935. New records and three new species of American Diatraea (Lep., Pyral.). BER 26: 323-333. [ Links ]
6.Box, H. E. 1951. New species and records of Diatraea Guild from northern Venezuela (Lepid: Pyral.). BER 42: 379-398. [ Links ]
7.Box, H. E. 1956. New species and records of Diatraea Guilding and Zeadiatraea Box from México, Central and South America. BER 47: 755-776. [ Links ]
8.Cadena Goyes, P. 2008. Caracterización morfológica y molecular de especies de Diatraea spp. (Lepidóptera Crambidae) Available: http://www.cenicana.org/pdf/ no_clasificacion/6194.pdf. Consultado el 17 de junio de 2017. [ Links ]
9.Cortés, A.M.; P. H. G. Zarbin; D. M. Takiya; J. M. S. Bento; A. S. Guidolin and F. L. Consoli. 2010. Geographic variation of sex pheromone and mitochondrial DNA in Diatraea saccharalis (Fab. 1794) (Lepidoptera: Crambidae). J. Insect Physiol. 56: 1624- 1630. [ Links ]
10.Dinther, J. B. M. 1971. A method of assessing rice yield losses caused by the stem borer Rupela albinella and Diatraea saccharalis in Surinam and the aspect of economic thresholds. Entomophaga 16: 185-191.
11.Dinther, J. B. M. and P. A. Goossens. 1970. Rearing of Diatraea saccharalis on diets in Surinam. Entomol. Exp. Appl. 13: 320-326. [ Links ]
12.Dobzhansky, T. 1970. Genetics of the evolutionary process. Columbia University Press, NY, EE.UU. [ Links ]
13.Drès, M. and J. Mallet. 2002. Host races in plant-feeding insects and their importance in sympatric speciation. Philos Trans R Soc Lond B Biol Sci. 357 (1420): 471-92. [ Links ]
14.Dyar, H. G. and C. Heinrich. 1927. The American moths of the genus Diatraea and allies. Proc. U.S.A. National Museum 71: 1-48. [ Links ]
15.Eastop, V. F. 1973. Biotypes of aphids. Bull. Entomol. Soc. New Zealand, 2: 40-57. [ Links ]
16.Fargo, W. S.; C. Inayatullah; J. A. Webster and D. Holbert. 1986. Morphometric variation within apterous females of Schizaphis graminum biotypes. Res. Popul. Ecol., 28: 163-172. [ Links ]
17.Gonzalez, D.; G. Gordh; S. N. Thompson and J. Adler. 1979. Biotype discrimination and its importance to biological control. In: Hoy, M.A. and J. J. McKelvey Jr. (Eds.). Genetics in Relation to Insect Management, Rockefeller Foundation. New York. [ Links ]
18.Greco, N. 1995. Tablas de vida de Diatraea saccharalis (Lepidoptera: Pyralidae) en laboratorio. Revista de la Facultad de Agronomía (La Plata) 71: 157-164. [ Links ]
19.Iannone, N. 2002. Servicio técnico Diatraea en maíz. INTA Pergamino. [ Links ]
20.Ingram, K. M. and E. K. Bynum. 1941. The sugarcane borer. USDA Farmer´s Bulletin, 1884, 1-17. [ Links ]
21.Joyce, A. L.; M. Sermeno Chicas; L. Serrano Cervantes; M. Paniagua; S. J. Scheffer and M. Solis. 2016. Host-plant associated genetic divergence of two Diatraea spp. (Lepidoptera: Crambidae) stemborers on novel crop plants. Ecol. Evol. 6, (23): 8632-8644. [ Links ]
22.Joyce, A. L.; W. H. White; G. S. Nuessly; M. A. Solis; S. J. Scheffer; M. L. Lewis and R. F. Medina. 2014. Geographic population structure of the sugarcane borer, Diatraea saccharalis (F.) (Lepidoptera: Crambidae), in the southern United States. PloS ONE, 9: (10). [ Links ]
23.King, E. G.; F. D. Brewer and D. F. Martin. 1975. Development of Diatraea saccharalis at constant temperatures. Entomophaga 20: 301-307. [ Links ]
24.Lange, C. L.; K. D. Scott; G. C. Graham; M. N. Sallam and P. G. Allsopp. 2004. Sugarcane moth borers (Lepidoptera: Noctuidae and Pyraloidea): phylogenetics constructed using COII and 16S mitochondrial partial gene sequences. BER ,94: 457- 64. [ Links ]
25.López Edwards, M.; J. L. Hernández Mendoza; A. Pescador Rubio; J. Molina Ochoa; R. Lezama Gutiérrez; J. J. Hamm and B. R. Wiseman. 1999. Biological differences between five populations of fall armyworm (Lepidoptera: Noctuidae) collected from corn in Mexico. Florida Entomologist 82 (2): 254-262. [ Links ]
26.Machado Botelho, P. S. 1985. Tabela de vida ecológica e simulação da fase larval da Diatraea saccharalis (Fabricius, 1794) (Lepidoptera, Pyralidae). Tesis de doctorado presentada en la Escuela Superior de Agricultura "Luiz de Queiroz" de la Universidad de San Pablo. [ Links ]
27.Melo, A. B. P. 1984. Biologia de Diatraea saccharalis (Fabricius, 1794) (Lepidoptera, Pyralidae) em diferentes temperaturas para determinação das exigências térmicas. Dissertação de mestrado. ESALQ. Piracicaba
28.Murúa, M. G.; M. T. Vera; S. Abraham; M. L. Juaréz; S. Prieto; G. P. Head and E. Willink. 2008. Fitness and mating compatibility of Spodoptera frugiperda (Lepidoptera: Noctuidae) populations from different host plant species and regions in Argentina. Ann. Entomol. Soc. Am. 101: 639- 649. [ Links ]
29.Murúa, M. G.; E. Virla y V. Defagó. 2003. Evaluación de cuatro dietas artificiales para la cría de Spodoptera frugiperda (Lep.: Noctuidae) destinada a mantener poblaciones experimentales de himenópteros parasitoides. Boletín de Sanidad Vegetal Plagas 29: 43-51. [ Links ]
30.Myers, J. G. 1932. The original hábitat and hosts of three major sugarcane pests of Tropical America (Diatraea, Castnia, and Tomaspis). BER 23: 257-272. [ Links ]
31.Navarro, F. R.; E. D. Saini y P. D. Leiva. 2009. Clave pictórica de polillas de interés agrícola. Pergamino (BA) - Argentina: INTA, EEA Pergamino, p 82. [ Links ]
32.Pashley, D. P.; A. M. Hammond and T. N. Hardy. 1992. Reproductive Isolating Mechanisms in Fall Armyworm Host Strains (Lepidoptera: Noctuidae). Ann. Entomol. Soc. Am., 85: 4, 400-405. [ Links ]
33.Pashley, D. P.; T. N. Hardy; A. M. Hammond and J. A. Mihm. 1990. Genetic evidence for sibling species within the sugarcane borer (Lepidoptera: Pyralidae). Ann. Entomol. Soc. Am. 83: 1048-1053. [ Links ]
34.Pashley, D. P. and J. A. Martin. 1987. Reproductive incompatibility between host strains of the fall armyworm (Lepidoptera: Noctuidae). Ann. Entomol. Soc. Am. 80: 731-733. [ Links ]
35.Pavinato, V. A. C. 2014. Variabilidade genética, estruturação populacional e busca de variação alélica em locos associados à adaptação inseto-planta em Diatraea saccharalis (Fabr. 1794) (Lepidoptera: Crambidae). Tesis de Doctorado del Instituto de Biología de la Universidad Estadual de Campinas en el área de genética animal y evolución. Campinas. San Pablo. [ Links ]
36.Peairs, F. B. and J. L. Saunders. 1980. Diatraea lineolata y D. saccharalis: una revisión en relación con el maíz. Agronomía Costarricense 4: 123-135. [ Links ]
37.Perfectti, F. 2002. Especiación: Modos y Mecanismos. Evolución. La Base de la Biología pp. 307-321. Proyecto Sur España, Granada, España. M. Soler (Ed.). España. [ Links ]
38.Randolph, N. M.; G. L. Teetes and B. E. Jeter Jr. 1967. Insecticide sprays and granules for control of the sugarcane borer on grain sorghum. J. Econ. Entomol. 60: 762-765. [ Links ]
39.Rull, J.; S. Abraham; A. Kovaleski; D. F. Segura; A. Islam; V. Wornoayporn; T. Dammalage; U. Santo Tomas and M. T. Vera. 2012. Random mating and reproductive compatibility among Argentinean and southern Brazilian populations of Anastrepha fraterculus (Diptera: Tephritidae). BER, 102: 435-443. [ Links ]
40.Russell, G. E. 1978. Plant Breeding for Pest and Disease Resistance. Butterworths-Heinemann. [ Links ]
41.Salvatore, A. R.; M. B. García; E. Romero and E. Willink. 2010. Sugar losses caused by the sugarcane borer (Diatraea saccharalis) in Tucumán, Argentina. Proceedings of International Society of Sugar Cane Technologists, Veracruz, Mexico, 27. [ Links ]
42.Saxena, R. C. and A. A. Barrion. 1985. Biotypes of the brown planthopper Nilaparvata lugens (Stal) and strategies in deployment of host plant resistance. Insect Science and its Application, 6: 271-289. [ Links ]
43.Saxena, R. C. and A. A. Barrion. 1987. Biotypes of insect pests of agricultural crops. Insect Science and its Application, 8: 453-458. [ Links ]
44.Saxena, R. C. and L. M. Rueda. 1982. Morphological variation among three biotypes of the brown planthopper, Nilaparvata lugens, in the Philippines. Insect Science and its Application, 3: 193-210. [ Links ]
45.Serra, G. and E. Trumper. 2006. Estimating the incidence of corn stem damage produced by Diatraea saccharalis (Lepidoptera: Crambidae) larva through assessment of external infestation signs. Agriscientia XXIII 1: 1-7. [ Links ]
46.Shapiro, S. S. and M. B. Wilk. 1965. An analysis of variance test for normality: complete samples. Biometrika, 52: 591-611. [ Links ]
47.Solis, M. A. 2007. Phylogenetic studies and modern classification of the Pyraloidea (Lepidoptera). Revista Colombiana de Entomología, 33, (1): 1-9. [ Links ]
48.Solis, M. A. and M. A. Metz. 2016. An illustrated guide to the identification of the known species of Diatraea Guilding (Lepidoptera: Crambidae: Crambinae) based on genitalia. ZooKeys, 565: 73-121. [ Links ]
49.Willink, E. 1982. Especies de Diatraea en cañaverales del Noroeste Argentino. Estación Experimental Agro- Industrial "Obispo Colombres", 140: 1-38. [ Links ]
50.Wongsiri, T. and N. Randolph. 1962. A comparison of the biology of sugarcane borer on artificial and natural diets. J. Econ. Entomol. 55: 471-473. [ Links ]