Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de endocrinología y metabolismo
On-line version ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.44 no.4 Ciudad Autónoma de Buenos Aires Oct./Dec. 2007
Perfil androgénico en mujeres hirsutas. Modificaciones de sus niveles en la fase lútea.
Androgenic profile in hirsute women. Modifications of the levels in lutheal phase.
Scaglia, H.E.1; Viola, A.M.2; Guevel, L.2; Guerra, L.N.2; Mohr, A.L.2; Jozami, L.S.2; Aquilano, D.R.3; Scaglia, J.1
1 Laboratorio de Determinaciones Hormonales. Hospital Italiano de La Plata
2 Alumnos de Curso Superior de Bioquímica Endocrinológica 2001-2002. Universidad Rene Favaloro y Colegio de Bioquímicos de la Provincia de Buenos Aires
3 Instituto Análisis Bioquímicos Endocrinológicos. La Plata.
Dirección Postal: Hugo E Scaglia. Calle 59 # 969, (1900) La Plata. Tel & Fax: 54-221-452-9577.
E-mail: info@iabe.com / iabe@speedy.com.ar
Resumen
Introducción: El objetivo de este estudio fue evaluar Los niveles de Testosterona (T), T libre TL, DHEAs y Androstanodiol glucuronidato (A2G) mujeres hirsutas con ciclos menstruales (CM) regulares en la fase folicular (FF) y en una muestra tomada entre -5 a -10 días premenstrual (FL) a los efectos de 1) poder definir bioquímicamente el tipo de hirsutismo y 2) determinar si el aumento de Progesterona modifica los niveles de los andrógenos.
Materiales y Métodos: En 65 mujeres hirsutas con CM regulares se determinó en FF los niveles de T, A2G, y DHEAs por RIE y TL calculada por la ecuación de la ley de acción de masas, y en la FL los niveles de P4. En 28 de las 65 pacientes, en la FL se repitió el perfil androgénico
Resultados: Los niveles de T correlacionaron, en todos los casos, con los de TL. En 51 de las pacientes los niveles de P4 fueron ovulatorios, 25 de las cuales tuvieron normales los andrógenos evaluados (Hirsutismo Idiopático) De las 26 pacientes restantes, en 2 tenían T aumentada, en 4 la DHEAS. Se obtuvieron 2 parámetros aumentados en los siguientes casos; en 2 la DHEAs y el A2G, en 1 la T y la DHEAs y en1 la T y el A2G. En 4 pacientes se obtuvieron incremento de los 3 parámetros. Estas pacientes corresponden a Hiperandrogénicas ovulatorias. Las 12 restantes de estas 26 hirsutas tenían solamente el A2G aumentados. Dado que éste constituye la expresión periférica de la 5a reductasa, las mismas podrían incluirse en el grupo de hiperandrogénicas ovulatorias por aumento local de DHT. En 14 de las 65 pacientes los niveles de P4 fueron compatibles con ciclos anovulatorios correspondiendo a pacientes con Síndrome de Ovario Poliquístico (SOP). En 6 de ellas se constató aumento de 1, 2 o los 3 parámetros evaluados (SOP hiperandrogénicos), en las restantes 6 pacientes los niveles androgénicos fueron normales (SOP con hirsutismo clínico). El A2G aumentó significativamente en FL en las mujeres con ciclos ovulatorios (4.89±2.19 vs 3.36±2.38 ng/ml en FL y FF, respectivamente). En las anovulatorias las diferencias no fueron significativas (4.32±3.16 vs 4.69±4.54 ng/ml en FL y FF, respectivamente. Estos resultados indican que la P4 podría inducir un incremento del A2G. Dado que la T no se modificó en la FL respecto a FF (0.28±0.22 vs 0.30±0.25ng/ml en hirsutas ovulatorias y 0.47±0.32 vs 0.42±0.23 en hirsutas anovulatorias) es posible que la P4 aumente el A2G por un camino distinto a la de la T y DHT
Conclusiones: En base a estos resultados podemos concluir que la determinación de A2G podría ser empleada como parámetro complementario en el estudio del hiperandrogenismo debiendo realizarse en FF dado que en FL podría ser el resultado del metabolismo de hormonas no androgénicas.
Palabras clave: Glucuronidato de Androstanodiol; Hirsutismo idiopático; Marcador hiperandrogenismo.
Abstract
Introduction: The aim of the present study was to evaluate the circulating levels of Testosterone (T), free T (TL), DHEAs and Androstanediol glucuronide (A2G) in hirsute women with regular menstrual cycles (CM) in follicular phase (FF), and in a samples obtained 5 to 10 days before the next menstrual bleeding (FL), in order to 1) biochemically define type of hirsutism and 2) determine whether the increase in progesterone (P4) induces changes in androgen levels.
Materials and Methods: Sixty five hirsute women with regular CM were studied. FF levels of T, A2G and DHEAs were determined by RIA, and TL by mass law calculation. FL levels of P4 were measured by RIA. In 28 of the 65 patients the androgen profile was also evaluated in FL.
Results: The levels of T correlated in every case with those of TL. In 51 patients P4 levels were ovulatory. Twenty five of them showed normal androgen levels (Idiopathic hirsutism). From the remaining 26 patients, 2 had increased T, and 4 had increased DHEAs. Two parameters were found increased in the following cases: DHEAs and A2G in 2, T and DHEAs in 1, and T and A2G in 1. All the 3 parameters were found increased in 4 cases. These patients were ovulatory hiperandrogenic women. The remaining 12 of these 26 hirsute women had only A2G increased. Since this steroid is the peripheral expression of the 5a reductase activity, these women could be included in the ovulatory hiperandrogenic group because of a local increase in DHT. In 14 of the 65 patients the levels of P4 correlated with anovulatory cycles corresponding to Polycystic Ovarian Syndrome (SOP). In 6 of them an increase of 1, 2 or the 3 parameters were observed (Hiperandrogenic SOP); in the remaining 6 patients androgen levels were normal (SOP with clinical hirsutism). FL A2G significantly increased in women with ovulatory cycles (4.89±2.19 vs 3.36±2.38 ng/ml in FL and FF, respectively. Differences were no significant in the anovulatory patients (4.32±3.16 vs 4.69±4.54 ng/ml in FL and FF, respectively. These results indicate that P4 could induce an increase in A2G. Since T did not change in FL respect to FF (0.28±0.22 vs 0.30±0.25ng/ml in ovulatory hirsute and 0.47±0.32 vs 0.42±0.23 in anovulatory hirsute) it is possible that P4 increases A2G through a pathway different than that of T and DHT.
Conclusions: Based on these results we conclude that A2G could be used as a complementary parameter in the study of hiperandrogenism, only in FF since in FL, it could be the result of the metabolism of non-androgenic hormones.
Key words: Androstandiol glucuronidate; Idiopatic hirsutism; Hyperandrogenism marker.
Introducción
La unidad pilosebácea consiste en un folículo piloso, la glándula sebácea y el ducto sebáceo. El folículo piloso, dependiendo del estímulo androgénico puede originar un pelo terminal cuyas características son largo, grueso y pigmentado o vello,que es fino, pequeño y ligeramente pigmentado. El ciclo de los folículos se realiza en forma asincrónica, una fase de crecimiento, anagen; de transición, catagen y de reposo; telogen. El crecimiento de algunos folículos son andrógenos dependientes y se encuentran localizados en las siguientes áreas: axila, región púbica, pecho, espalda, abdomen, barba, orificios nasales, línea media y el cuero cabelludo (1). Los andrógenos en presencia de un receptor de andrógenos activo transforman el vello a pelo terminal (2).
La acción biológica de los andrógenos se debe en parte a la Testosterona (T) pero fundamentalmente a la DHT. La T circulante no unida a la SHBG difunde a través de la membrana plasmática y en el citoplasma se une a receptor de andrógenos (RA), se transloca al núcleo y el complejo actúa sobre el elemento de respuesta a los andrógenos regulando la trascripción de genes que resulta en la producción de ARNm y eventualmente proteínas (3,4). La T expresa el gen de la 5a reductasa que la convierte en DHT. Ambos andrógenos se unen al mismo RA y a nivel del sistema pilo sebáceo inducen la producción de sebo y la expresión de proteínas vinculadas al desarrollo piloso, por ej. keratina (3,4). Existen 2 tipos de 5a reductasa la tipo I y II, ambas de 25 aminoácidos. El gen de la tipo I se encuentra en el cromosoma 5p1, se expresa en el hígado, glándulas sebáceas, en el cuero cabelludo y escasamente en la próstata. En gen de la tipo II, en el cromosoma 2p1, se expresa en la próstata y genitales externos e internos en el hombre, en la piel genital y en la vaina interna del folículo piloso (5,6).
La T además de su origen glandular se produce in situ por la conversión de precursores como la DHEA(s), de origen fundamentalmente adrenal y de la Androstenediona (A4) y DHEA libre, ambas de origen ovárico y adrenal (7).
La DHT y la T se unen al mismo receptor, pero con diferentes constantes de afinidad, así como diferente eficacia para estabilizar al receptor y producir distintas acciones fisiológicas (8). En efecto la DHT unida al receptor se une al Elemento de Respuesta del Receptor de Andrógenos y actúa como un factor de trascripción. La DHT es capaz de activar genes que el complejo T - Receptor no lo hacen (9). La DHT es metabolizada in situ a Glucuronidato de 3 a androstanodiol 17 glucurónido y 3 a androstanodiol 3 glucurónido (A2G) por lo cual estos metabolitos han sido considerados marcadores periféricos de la actividad 5 a Reductasa (10-13). La A4 también se metaboliza a estos a estos compuestos pero como producto intermedio se convierte a DHT, por lo cual podrían ser considerados, particularmente el 3 a androstanodiol 17 glucurónido como un producto de la acción androgénica local de la DHT (14). La Figura 1 muestra la secuencia de esta conversión. Sin embargo, la utilidad de esta determinación no ha sido completamente aceptada por todos. Esta controversia responde a diferentes fundamentos en uno u otro sentido.

Fig. 1: Conversión de la Testosterona, Androstenediona en Dihidrotestosterona y metabolismo a 3 a androstanediol-17 glucurónido y 3 a androstanediol 3-glucurónido.
La expresión clínica del hiperandrogenismo en la mujer resulta desde el hirsutismo, la alopecia y el acné, hasta la virilización. El hirsutismo, patología que afecta entre el 5 al 10 % de las mujeres, es la presencia de pelo terminal con una distribución semejante a la de los hombres (15-17). El grado de hirsutismo puede ser evaluado por el método de Ferriman y Gallwey (4) evaluando 9 áreas del cuerpo sensibles a los andrógenos, asignándole a cada una un score de "0" (sin pelo) a "4" (francamente virilizada). Un score total mayor de 8 se considera anormal.
En la mayoría de las pacientes el hirsutismo se considera un signo de diversas patologías, entre otras, el síndrome de ovario poliquístico (SOP), la forma no clásica de la hiperplasia adrenal, los tumores secretantes de andrógenos, etc. La excepción son posiblemente aquellas pacientes con Hirsutismo Idiopático (HI), definidas como un hirsutismo con un score mayor de 9, con ciclos ovulatorios, verificados por los niveles de Progesterona (P4) en la fase lútea o por temperatura basal y con niveles androgénicos normales, al menos de Testosterona libre (TL) y sulfato de DHEA (DHEAs). Para definir pacientes con HI deben excluirse patologías relacionadas que presenten estas mismas características, por ej. algunas pacientes con expresión mínima de la forma no clásica de hiperplasia adrenal, alteraciones tiroideas, ingestión de andrógenos, etc. (18-23).
Sin embargo, es posible que algunas mujeres con niveles normales de TL y DHEAs puedan presentar una hiperactividad de 5 a Reductasa generando un hiperandrogenismo in situ por aumento de DHT, por lo cual podrían ser consideradas como HI pacientes hiperandrogénicas.
Los objetivos de este trabajo en mujeres hirsutas con ciclos menstruales regulares, ovulatorias y anovulatorias fueron evaluar:
1) El significado del A2G como expresión de Hiperandrogenismo local en mujeres hirsutas con el perfil androgénico normal
2) Establecer si los niveles de P4 en días premenstruales de hirsutas ovulatorias modifican los valores de A2G respecto a los obtenidos en fase folicular, comparativamente
a los obtenidos en mujeres anovulatorias.
Materiales y métodos
En 65 mujeres hirsutas entre 17 y 43 años de edad con CM regulares se determinó en FF los niveles de T, SHBG, 17 hidroxiprogesterona (17OHP4), A2G, y DHEAs por RIE y TL calculada. En días premenstruales (FL) los niveles de P4. En 28 de las 65 pacientes, en días premenstruales se repitió el perfil androgénico.
En todos los casos los valores de Prolactina y 17OHP4 fueron normales y la evaluación de otros ejes endocrinos como tiroides y adrenal fue normal. Al examen clínico no presentaron ningún otro tipo de patología. El índice de masa corporal (IMC) fue normal y nunca estuvieron bajo métodos anticonceptivos hormonales. Al momento de ser incluídas en el estudio no presentaron ningún tipo de patología evidente. Fueron excluídas aquellas pacientes que ingirieron fármacos dentro de los últimos 6 meses que pudieran afectar el transporte de los andrógenos modificando la concentración de SHBG.
Determinaciones hormonales
Los diferentes métodos de evaluación hormonal fueron descriptos previamente (24). En síntesis la T se realizó por un método previamente publicado por nuestro laboratorio (25). El anticuerpo anti Testosterona se obtuvo por inoculación a conejos del complejo 6-oxima Testosterona unida a la albúmina del suero de bovino. La reacción antígeno anticuerpo se realizó en el extracto etéreo obtenido del suero a evaluar suspendido en buffer fosfato 0.05 M en solución fisiológica de cloruro de sodio. Se utilizó como trazador Testosterona tritiada (3 H) de 127 Ci / mmol de actividad específica. La separación de la Testosterona 3 H unida al anticuerpo de la libre se realizó por el agregado de Carbón - Dextrán (1.2 gr y 120 mg %, respectivamente). La determinación de la radioactividad del sobrenadante se determinó en un contador de centelleo líquido. Las características del anticuerpo (especificidad, dilución apropiada de trabajo, etc.) así como los controles de calidad del método (sensibilidad, error intra e interensayo, etc.) han sido previamente publicados (26). Los valores obtenidos en el grupo control fueron (media ± DS) 0,4 ± 0.2 ng/ml.
La determinación de la SHBG, expresada como la capacidad máxima de unión de la SHBG a la DHT, se realizó por un método desarrollado en nuestro laboratorio utilizando un ensayo con una sola dosis de saturación de la unión a la proteína (27).
La TL se calculó por un programa de computación (TRANSP) de Dunn y col. (28) basado en la ley de Masas, donde como variables se utiliza la concentración de T total, SHBG y Albúmina. Dicho programa nos fue generosamente cedido por los autores para fines de investigación clínica y adaptado a nuestro sistema por el Dr. J. C. Calvo. Los valores obtenidos en el grupo control fueron 6.0 ± 4.0 pg/ ml, respectivamente.
La DHEAs, 17OHP4 y P4 se determinaron por kits comerciales distribuidos por el Laboratorio DPC. El A2G se determinó por kits distribuido por los Laboratorios DSL. El anti A2G empleado en este kit es específico para 5 a androstan 3 a,17 bdiol 17-glucurónido, no presentando reacción cruzada para 5a androstan 3 a,17 bdiol 3-glucurónido, según el inserto del mismo, por lo cual cuando nos referimos a A2G significa 5 a androstan 3 a,17 bdiol 17-glucurónido. Los controles de calidad de estos son los especificados en los insertos correspondientes y corroborados en nuestro Laboratorio. Los valores obtenidos en el grupo control para DHEAs fueron 1850 ± 1150 ng / ml; para 17OHP4 1.2 ± 0.8 ng/ ml y para A2G 3.0 ± 1.0 ng / ml.
El estudio estadístico se realizó por el test "t" de Student.
Resultados
Se obtuvo una correlación entre los niveles circulantes de TT y TL. La Figura 2 muestra los resultados obtenidos en las pacientes hirsutas estudiadas. Como puede observarse, cuando los niveles de TT fueron normales o aumentados, en todos los casos la TL fue normal o aumentada, respectivamente. Estos resultados podrían resultar de que fueron excluídas aquellas pacientes que presentaran patología o ingesta de fármacos que pudieran afectar el transporte del andrógeno. Por esta razón se analizarán los resultados en base a la TT y las conclusiones son las mismas que para la TL.
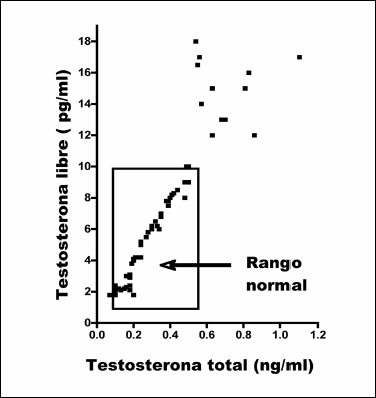
Fig. 2: Relación entre los valores de testosterona libre y testosterona total en mujeres hirsutas.
En base a los resultados de P4 obtenidos en días premenstruales, las pacientes fueron clasificadas en ovulatorias, P4 mayor de 5.0 ng/ml y anovulatorias menores de 3.0 ng/ml. Cincuenta y una de las 65 pacientes hirsutas tuvieron niveles de P4 compatibles con ciclos ovulatorios.
La Figura 3 (panel izquierdo) muestra los resultados individuales de P4 en 28 de las 65 mujeres hirsutas cuyos niveles de A2G y TT se evaluaron en FF y FL. En 20 de estas pacientes se obtuvieron ciclos ovulatorios y en las restantes 8 anovulatorios. Los niveles de A2G en FL respecto a FF en las pacientes con ciclos anovulatorios, no se modificaron en 3 casos, disminuyó en 4 y aumentó en el caso restante (Figura 3 panel central). De las 20 pacientes con ciclos ovulatorios, en 18 casos el A2G aumentó en FL y disminuyó en los 2 restantes (Figura 3 panel derecho).
Fig. 3:
(izquierda) Niveles de Progesterona en mujeres hirsutas con ciclos regulares ovulatorios y anovulatorios. Valores de 3a androstanediol-17 glucurónido (A2G) en fase folicular (FF) y lútea (FF) en ciclos anovulatorios (centro) y ovulatorios (derecha).
La Figura 4 muestra los niveles de A2G en FF y FL. Se obtuvo una diferencia estadísticamente significativa (p< 0.01) en los valores en FL respecto a FF en las hirsutas ovulatorias. En las pacientes anovulatorias no se obtuvieron diferencias estadísticamente significativas de A2G en las dos fases del ciclo evaluadas (p> 0.5). La T no se modificó en la FL respecto a FF (0.28±0.22 vs 0.30±0.25ng/ml en hirsutas ovulatorias y 0.47±0.32 vs 0.42±0.23 en hirsutas anovulatorias). Los valores de T en ambas fases del ciclo fueron mayores en las pacientes con ciclos anovulatorios (p< 0.02). El incremento de P4 sin que la T se modifique indicaría que dicho esteroide podría metabolizarse a A2G, independientemente de convertirse a T. Por esta razón en la evaluación del hiperandrogenismo en pacientes hirsutas consideraremos los valores obtenidos en FF temprana.

Fig. 4: Media ± DS de los niveles de 3 a androstanediol-17 glucurónido en fase folicular temprana (FF) y días premenstruales (FL) en mujeres hirsutas con ciclos anovulatorios y ovulatorios.
En 51 de las pacientes los niveles de P4 fueron ovulatorios, 25 de las cuales tuvieron normales los andrógenos evaluados, TT, DHEAs y A2G (Figura 5 panel izquierdo). De las 26 pacientes restantes, dos tenían T aumentada y cuatro la DHEAS. Se obtuvieron dos parámetros aumentados en los siguientes casos; en dos la DHEAs y el A2G, en una la T y la DHEAs y en una la T y el A2G. En 4 pacientes se obtuvieron incremento de los 3 parámetros. Las 12 restantes de estas 26 hirsutas tenían solamente el A2G aumentados (Figura 5 panel central). En el panel derecho de la Figura 5 se muestran los resultados de los andrógenos evaluados en las 14 de las 65 pacientes cuyos niveles de P4 fueron compatibles con ciclos anovulatorios. En 6 de ellas se constató aumento de 1, 2 o los 3 parámetros evaluados, en las restantes 6 pacientes los niveles androgénicos fueron normales.
Fig. 5:
Valores individuales de parámetros androgénicos evaluados en mujeres hirsutas con ciclos menstruales regulares, ovulatorios (panel Izquierdo y central) y anovulatorios (panel derecha). El panel izquierdo representa mujeres hirsutas ovulatorias normoandrogénicas y el central ovulatorias hiperandrogénicas. Las pacientes identificadas con triángulos negros presentan los 3 parámetros; DHEAs, TT y A2G aumentados. Los triángulos claros 2 de los 3 parámetros aumentados y los cuadrados negros y círculos negros sólo aumento de DHEAs y TT, respectivamente. Los cuadrados blancos incremento sólo de A2G. El panel de la derecha representa los valores individuales de hirsutas con ciclos regulares anovulatorias. Los círculos blancos representan pacientes con los 3 parámetros normales. Las pacientes con hiperandrogenismo se identifican con triángulos negros, blancos, cuadrados negros y círculos negros con el mismo significado que en el panel central.
Discusión
Nuestros resultados demuestran el incremento en los niveles de A2G durante la FL normal y no en ciclos anovulatorios. El A2G es el glucuronidato del 3 a androstanediol, principal metabolito de la DHT, con una potencia significativamente menor (29). Dado que en la FL de mujeres con ciclos ovulatorios o anovulatorios no se obtuvo incremento de T el aumento de los niveles de A2G sugirieren que la P4 podría estar involucrada en el mismo. Resultados similares han sido descriptos previamente, sin embargo, no se evaluaron comparativamente los niveles de A2G en la misma mujer en ambas fases del ciclo menstrual ni tampoco en mujeres con ciclos anovulatorios (30).
Cianciosi y col. (24) comunican el posible papel de la determinación de A2G en el diagnóstico del hirsutismo idiopático. Este estudio confirma y amplía esos resultados evaluando el perfil androgénico en hirsutas con ciclos regulares, normales y anovulatorios.
La P4 por acción de la 5 a reductasa se transforma en 5 a pregnane 3,20 diona. Ambos esteroides por efecto secuencial del citocromo P450-17 y de la 17b HSD se transforman en T y DHT, respectivamente. La T en DHT por la 5 a reductasa. La DHT se metaboliza a 3 a androstanediol y a A2G. Por esta razón este compuesto ha sido considerado el producto de reducción intracelular de la DHT, aunque no está claramente definido su sitio de producción, postulándose la piel y el hígado (31). Similarmente el A2G puede ser sintetizado directamente de precursores glucurónidos como la androsterona (32). La Figura 6 muestra los caminos metabólicos descriptos. Como puede verse, además 5 a pregnane 3,20 diona por cambios inducidos por la 3 a reductasa, citocromo P450 17 y 17b HSD, respectivamente, puede transformarse en A2G sin pasar por DHT, con lo cual el valor de A2G en FL de ciclos con altos niveles de P4 pudieran representar en parte el metabolismo final de esteroides no androgénicos (33). Por estas circunstancias se sugiere que la determinación de A2G debe realizarse en días de la FF temprana.
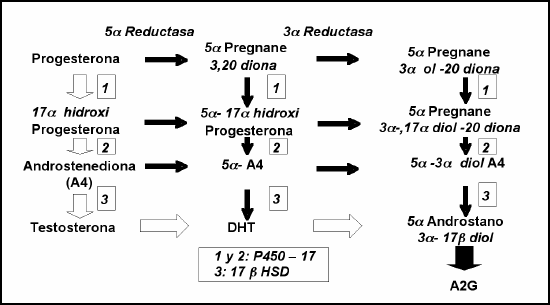
Fig. 6: Metabolismo de la Progesterona a 3 a androstanediol-17 glucurónido (A2G) por conversión intermedia a Dihidrotestosterona (DHT) camino indicado por flechas blancas y negras y por un camino independiente del andrógeno (flecha punteada).
De las 65 pacientes hirsutas estudiadas en el 78 % se obtuvieron ciclos ovulatorios. Azziz y col. (34) comunican que el 48 % de 132 mujeres hirsutas presentaron ciclos regulares y de éstas el 61 % ciclos ovulatorios. El exceso de andrógenos induce el desarrollo en la mujer de alopecia, acné, hirsutas, disfunción ovulatoria y en caso extremos virilización (35).
El hirsutismo idiopático es diagnosticado sobre la base de hiperandrogenismo clínico con ciclos ovulatorios y niveles normales de andrógenos (34). Por otro lado, se considera como diagnóstico de síndrome de ovarios poliquísticos (SOP) con dos de los siguientes criterios: oligo o anovulación, clínica y/o bioquímica de hiperandrogenismo y ovarios poliquísticos, con exclusión de hiperplasia adrenal congénita, tumores secretores de andrógenos y síndrome de Cushing (36).
En 51 de las pacientes los niveles de P4 fueron ovulatorios, 25 de las cuales tuvieron normales los andrógenos evaluados (Hirsutismo Idiopático). De las 26 pacientes restantes, 14 presentaron incremento de 1, 2 o los 3 parámetros evaluados. Estas pacientes corresponden a Hiperandrogénicas ovulatorias, aunque no podemos descartar que sean SOP ovulatorias dado que no se realizaron ecografías ginecológicas. Las 12 restantes de estas 26 hirsutas tenían solamente el A2G aumentados, el cual constituye la expresión periférica de la 5 a reductasa. Clásicamente, dado que son ovulatorias con DHEAs, TT y TL normales estas pacientes podrían ser incluidas como hirsutas idiopáticas. Sin embargo, debido al posible aumento local de la DHT, las mismas podrían incluirse en el grupo de hiperandrogénicas ovulatorias. Deberán realizarse nuevos estudios para poder definir con mayor precisión si el A2G constituye un parámetro de hiperandrogenismo así como la posible implicancia terapéutica que pudiera tener esta reclasificación de las pacientes.
En 14 de las 65 pacientes los niveles de P4 fueron compatibles con ciclos anovulatorios correspondiendo a pacientes con SOP. En 6 de ellas se constató aumento de 1, 2 o los 3 parámetros evaluados (SOP hiperandrogénicos), en las restantes 6 pacientes los niveles androgénicos fueron normales (SOP con hirsutismo clínico).
La determinación de la TT constituye un problema de gran significación clínico y bioquímico. En estudios multicéntricos evaluando alícuotas de un mismo suero por los métodos que normalmente se emplean con mayor frecuencia, métodos directos por RIA, ELISA, quimioluminiscencia, o fluorescencia comparados con técnicas consideradas de referencia como cromatografía gaseosa en tandem con espectrometría de masa (GCMS) fue claramente demostrado que un grupo de ellos, sobrevaloran las concentraciones de TT y aumentan el número de pacientes hiperandrogénicas y el otro grupo disminuye el número de las mismas (37).
Dado el número de comunicaciones en este mismo sentido la Sociedad de Endocrinología de EE.UU. en base a los resultados de 3 mezclas de sueros de hombres normales, de mujeres normales y de hombres con hipogonadismo y mujeres androgenizadas evaluadas por más de 1000 laboratorios establecieron una posición donde recomiendan: utilizar tecnología convalidada por métodos de referencia debido a que la mayoría de los laboratorios utilizan ensayos para TT y TL; los cuales resultan decididamente no satisfactorios. Mientras tanto, los ensayos directos deberán evitarse sobre todo a concentraciones menores a 3.0 ng/ml, Probablemente, los métodos extractivos y con cromatografía seguida de inmunoensayos o espectrometría de masas, resultarán más confiables (38).
Dado que la TT y la TL constituyen la base sobre la clasificación fisiopatológica de mujeres hirsutas con las consecuencias terapéuticas que esto implica, la evaluación androgénica con métodos apropiados podría cambiar significativamente esta situación. El método desarrollado por nosotros no está convalidado con GCMS, pero al ser extractivo nos libera por un lado de las proteínas transportadoras y por otro nos permite aumentar el volumen de muestra con el consiguiente incremento de la sensibilidad analítica.
En nuevos estudios con extractos etéreos cromatografiados en columna de celita, previo al RIA y convalidado con GCMS, reevaluaremos las pacientes con hirsutas para una mejor identificación de la fisiopatología de las mismas.
1. Thiboutot, D.M. Normal physiology of the pilosebaceous unit. En androgen excess disorders in women. Azziz, R.; Nestler, J.E.; Dewailly, D. Lippincott-Raven Publishers, Philadelphia-New Cork, pag.103, 1997. [ Links ]
2. Hamada, K.; Thornton, M.; Laing, I. y col. The metabolism of testosterona by termal papilla cells culture from human pubis and axillary hair follicles concurs with hair growth in 5 a-reductase seficiency. J Invet Dermatol 106: 1017-1022, 1996. [ Links ]
3. Kovacs, W.J. The androgen receptor in androgen excess disorders in women. Azziz, R.; Nestler, J.E.; Dewailly, D. Lippincott-Raven Publishers, Philadelphia-New Cork, pag. 53, 1997. [ Links ]
4. Aquilano, D.R. Estrógenos. Unidad: Bioquímica y farmacología de los esteroides sexuales. En Climaterio. Coordinador A. Eduardo Depiano. Ed Ascune hermanos. Buenos Aires, 2006, pág. 569, 2006. [ Links ]
5. Thigpen, A.E.; Silver, R.I.; Guileyardo, J.M. y col. Tissue distribution and ontogeny of steroid 5 a- reductasa isozyme expression. J Clin Invest 92: 903-910, 1993. [ Links ]
6. Eicheler, W.; Tuohimaa, P.; Vilja, P. y col. Immunoicytochemical localization of human 5 a-reductase 2 with polyclonal antibodies in androgen target and non-target human tissues. J Histochem Cytochem 42: 667-675, 1994. [ Links ]
7. Simpson, J.L. Fert Steril 77 Supll 4, S6, 2002. [ Links ]
8. Zhou, Z-X; Lane, M.V.; Kemppainen, J.A. y col. Specificity of ligand-dependent androgen receptors stabilization: receptor domain interactions influences ligand dissociation and receptor stability. Mol Endocrinol 9:208-218, 1995. [ Links ]
9. Wilson, J.D.; Griffin, J.E.; Russell, D.W. Steroid 5a reductase 2 deficiency. Endocr Rev 14:577-593, 1993. [ Links ]
10. Zawadzki, J.K.; Dunaif, A. Diagnostic criteria for polycystic ovary syndrome: towards a rational approach. In: Dunaif A, Givens JR, Haseltine F, Merriam GR (eds) Polycystic Ovary Syndrome. Blackwell Scientific Publications, Boston, MA p 377-384, 1990. [ Links ]
11. Horton, R.; Hawks, D.; Lobo, R. 3a 17b-Androstanediol glucuronide in plasma. J Clin Invest 69: 1203-1206, 1982. [ Links ]
12. Gompel, A.; Wright, F.; Kuttenn, F. y col. Contribution of plasma androstenedione to 5a-androstanediol glucuronide in women with idiopathic hirsutism. J Clin Endocrinol Metab 62: 441-444, 1986. [ Links ]
13. Paulson, R.J.; Serafini, P.C.; Catalino, J.A. y col. Measurement of 3a 17b-androstanediol glucuronide in serum and urine and the correlation with skin 5 a reductase activity. Fertil Steril 46: 227-231, 1996. [ Links ]
14. Rittmaster, R.S. Androgens in adrenarche and pubarche. En Azziz, R.; Nestler, J.E.; Dewailly, D. Lippincott-Raven Publishers, Philadelphia-New Cork, pag. 73, 1997. [ Links ]
15. Ferriman, D.; Gallwey, J.D. Clinical assessment of body hair growth in women. J Clin Endocrinol Metab 21: 1440-1447, 1961. [ Links ]
16. MacKnight, E. The prevalence of "hirsutism"in young women. Lancet 1: 410-413, 1964. [ Links ]
17. Barth, J.H.; Catalan, J.; Cherry, C.A. y col. Psychological morbidity in women referred for treatment of hirsutism. J Psychosom Res 37: 615-619, 1993. [ Links ]
18. Bardin, W.C.; Lipsett, M.B. Testosterone and androstenedione blood production rates in normal women and women with idiopathic hirsutism or polycystic ovaries. J Clin Invest 46:891-897, 1967. [ Links ]
19. Casey, J.H.; Nabarro, J.D.N. Plasma testosterone in idiopathic hirsutism, and the changes produced by adrenal and ovarian stimulation and supression. J Clin Endocrinol Metab 27:1431-1435, 1967. [ Links ]
20. Thomas, J.P.; Oake, R.J. Androgen metabolism in the skin of hirsute women. J Clin Endocrinol Metab 38:19-22, 1967. [ Links ]
21. Kirschner, M.; Zucker, R.; Jespersen, D. Idiopathic hirsutism - an ovarian abnormality. N Engl J Med 294: 637-641, 1976. [ Links ]
22. Pugeat, M.; Forest, M.G.; Nisula, B.C. y col. Evidence of excessive androgen secretion by both the ovary and the adrenal in patients with idiopathic hirsutism. Obstet Gynecol 59: 46-51, 1982. [ Links ]
23. Kirschner, M.A.; Samojlik, E.; Szmal, E. Clinical usefulness of plasma androstanediol glucuronide measurement in women with idiopathic hirsutism. J Clin Endocrinol Metab 65: 597-601, 1987. [ Links ]
24. Cianciosi, MC.; Mansur, JL.; Riesco, O. y col. El glucuronidato de androstanodiol como marcador de hiperandrogenismo en pacientes con diagnóstico previo de hirsutismo idiopático. Posible implicancia de otros factores locales en el hirsutismo. Rev Argent Endocrinol Metab. 39: No 2, 83-97, 2002. [ Links ]
25. Scaglia, H.E.; Carrere, C.; Mariani, V. y col. Altered testicular hormone production in infertile patients with idiopathic oligo-asthenospermia. J Androl 12: 273-277, 1991. [ Links ]
26. Levalle, O.; Zylbersztein, C.C.; Aszpiz, S. y col. Recombinat human FSH administration increases testosterone production in men, possibly by a Sertoli cell- secreted non steroid factor. J Clin Endocrinol Metab 83: 3973-3976, 1998. [ Links ]
27. Riesco, O.; Aquilano, D.; Scaglia, H. Descripción de un método simple para la determinación de Testosterona biodisponible. Evaluación crítica y aplicaciones en la clínica endocrinológica. Acta Bioquímica Clínica Latinoamericana vol. XXXVI, No 1, 5-26, 2002. [ Links ]
28. Dunn, J.F.; Nisula, B.C.; Rodbard, D. Transport of steroids hormones: Binding of 21 endogens steroids to both testosterone - binding globulin and corticosteroid - binding globulin in human plasma. J Clin Endocrinol Metab 53: 58-68, 1981. [ Links ]
29. Dorfman, R.I.; Shipley, R.A. Andogens. John Wiley and Sons, Inc. New York, 1956,pp 116-128. [ Links ]
30. Narangg, R.; Rao, J.; Savjani, G. y col. radioimmunoassay kit for the quantitative measurement of androstanediol glucuronide in unextracted serum (Abstract) Clin Chem 37: 1049, 1991. [ Links ]
31. Horton, R.; Lobo, R.A. Peripheral androgens and the role of androstanediol glucurónido. J Clin Endocrinol Metab 15: 293-306, 1986. [ Links ]
32. Rittmaster, R.S. Androgens conjugates: physiology and clinical significance. Endocrine Rev 14: 121-132, 1993. [ Links ]
33. Viola, A.M.; Guevel, I.; Guerra, L.N. y col. Aumento de los niveles circulantes del glucuronidato de androstanodiol (A2G) en la fase lútea del ciclo menstrual XIII Congreso de la Sociedad Argentina de Endocrinología y Metabolismo, Buenos Aires, Argentina 6-8 de noviembre de 2003. Resumen 11. [ Links ]
34. Azziz, R.; Carmina, E.; Sawaya, ME. Idiopathic hirsutism, Endocr Rev 21: 347-362, 2000. [ Links ]
35. Azziz, R.; Sánchez, A.; Knochenhauer, E. y col. Androgen excess in women: Experience with over 1000 consecutive patients. J Clin Endocrinol Metab 89: 453-462, 2004. [ Links ]
36. Consensus statement. Revised 2003 consensus on diagnostic criteria and long - term health risks related to polycystic ovary syndrome. The Rotterdam ESHRE/ASRM - Sponsored PCOS consensus workshop group. Fert Steril 81: 19-25, 2004. [ Links ]
37. Taieb,J.; Mathian, B.; Millot, F. y col. Testosterone measured by 10 immunoassay and by isotope-dilution gas chromatography-mass spectrometry in sera from 116 men, women and children. Clin Chem 49: 1381-1395, 2003. [ Links ]
38. Rosner, W.; Auchus, R.J.; Azziz, R. y col. Position statement: limitations and pitfalls in measuring testosterone: an endocrine society position statement. J Clin Endocrinol Metab 92: 405-413, 2007. [ Links ]
Recibido: 10-10-07
Aprobado: 22-11-07.














