Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de endocrinología y metabolismo
On-line version ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.46 no.4 Ciudad Autónoma de Buenos Aires Oct./Dec. 2009
DISFUNCIÓN TIROIDEA SUBCLÍNICA
DISFUNCIÓN TIROIDEA Y AMIODARONA
Mesa 1: Hipotiroidismo Subclínico*
Graciela Alcaraz, Carmen Cabezón, Ricardo Parma, Eduardo Pusiol (en representación del Panel de Expertos)
*Tercer Consenso Argentino sobre Patologías Endocrinológicas Federación Argentina de Sociedades de Endocrinología
Buenos Aires, 28 al 30 de agosto de 2009
Diabetes
Coordinadores Generales: Oscar A. Levalle - Eduardo Pusiol
Coordinador: Isaac Sinay
Panel de Expertos:
Graciela Alcaraz (Buenos Aires)
Liliana Bergoglio (Córdoba)
Gabriela Brenta (Buenos Aires)
Carmen Cabezón (Buenos Aires)
Ana Fadel (Buenos Aires)
Alicia Gauna (Buenos Aires)
Paula Mereshian (Córdoba)
Ana María Orlandi (Buenos Aires)
Ricardo Parma (Rosario)
Eduardo Pusiol (Mendoza)
Jorge Rezzónico (Mendoza)
María del C. Silva Croome (Buenos Aires)
Conflicto de interés: Los autores declaran no poseer conflictos de interés.
A) Definición. Diagnóstico. Síntomas y signos clínicos. Valores de corte de TSH basal. ¿Cuántas determinaciones y qué periodicidad para confirmarlo? Importancia de la determinación de TPOAb. Rol de la ecografía tiroidea. Test de TRH: ¿si/no, cuándo? Diagnóstico diferencial con otras causas de TSH elevado.
El Hipotiroidismo Subclínico (Hipo SC) se define por concentraciones séricas de TSH por encima del límite superior del rango de referencia con valores normales de hormonas tiroideas (HT), habiéndose descartado otras causas de TSH elevada.(1)
Su prevalencia oscila en distintas series entre el 4,3 y 9,5%, (2,3) siendo más frecuente en mujeres mayores de 65 años (hasta 20%)(3). Este rango de presentación podría deberse al nivel de corte utilizado para definir el Hipo SC y diferencias en edad, sexo e ingesta de yodo de las poblaciones estudiadas.
En general, la etiología es la misma que para el hipotiroidismo clínico. Se reconocen las siguientes causas:
· Tiroiditis autoinmune bociosa y atrófica (la más frecuente).
· Tiroiditis subaguda en todas sus etiologías (viral, indolora esporádica o posparto).
· Injuria tiroidea: tiroidectomía parcial, radioyodo, radioterapia externa.
· Drogas: yoduros (especialmente amiodarona), antitiroideos, litio, Interferón α, aminoglutetimida, etionamida, sulfonamidas, sulfonilureas.
· Hipotiroidismo clínico insuficientemente sustituido (situación observada en aproximadamente el 20% de los casos) (2).
· Enfermedades infiltrativas con compromiso tiroideo: amiloidosis, sarcoidosis, hemocromatosis, cistinosis, tiroiditis de Riedel, SIDA, linfoma primario de tiroides.
· Sustancias tóxicas, ambientales e industriales.
· Mutaciones en el gen del receptor de TSH o de la proteína G α.
Diagnóstico
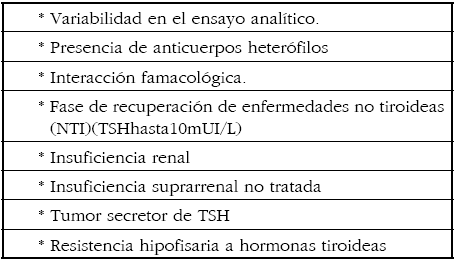
Es por su naturaleza un diagnóstico bioquímico, por lo que se imponen controles de calidad del método utilizado para la determinación de TSH que aseguren resultados confiables y reproducibles. Deben descartarse otras causas de TSH elevada (Tabla 1).
Tabla 1. Causas de TSH elevada que no corresponden a Hipotiroidismo
Valores de corte de TSH basal
Dado que el diagnóstico está basado en parámetros bioquímicos, debe definirse el límite superior normal de TSH en individuos libres de enfermedad. Diversos estudios poblacionales se refieren al nivel de corte de TSH. En uno de ellos(2), se observó que la población más cuidadosamente seleccionada (excluidos fundamentalmente quienes tenían antecedentes personales o familiares de enfermedad tiroidea, presencia de autoinmunidad e ingesta de medicamentos que pudieran alterar la función tiroidea) presentaba una media de TSH de 1.39 mUI/L y los percentilos 2.5 y 97.5 correspondían a una media de TSH de 0.45 y 4.12 mUI/L respectivamente. En base a estos resultados algunos autores(4,5) proponen bajar el límite superior a valores cercanos a 3 mUI/L. En opinión de otros autores(6,7) este descenso implicaría un enorme incremento en el diagnóstico de una dudosa hipofunción tiroidea SC sin que existan actualmente evidencias de beneficios clínicos y terapéuticos.
Este panel recomienda mantener el valor tradicionalmente utilizado y acepta un nivel de corte superior de TSH de 4.5 mUI/L medida por métodos de 3ra generación. De to-dos modos valores de TSH entre 3 y 4.5 mUI/L deben interpretarse según el contexto individual (edad, presencia de autoinmunidad o de dislipemia, deseo de embarazo, etc.) y en función del mismo se condicionará el seguimiento y eventual tratamiento.
¿Cuántas determinaciones y con qué periodicidad son necesarias para confirmarlo?
Dos determinaciones de TSH separadas por un intervalo de 4 a 12 semanas acompañadas de hormonas tiroideas (T4/T4L) normales realizadas en una de las dos determinaciones efectuadas.
Importancia en la determinación de los TPOAb
La positividad de los TPOAb no sólo confirma la etiología autoinmune si no que también predice un mayor riesgo de progresión al hipotiroidismo franco. Por lo tanto el panel considera recomendable la determinación de los TPOAb en alguna de las evaluaciones confirmatorias.
Rol de la ecografía tiroidea
Si bien el patrón ecográfico de hipoecogenicidad y heterogeneidad del parénquima tiroideo es característico de la tiroiditis autoinmune y puede según algunos autores predecir la positividad de los TPOAb, el panel no considera indicado el pedido rutinario de la ecografía, reservando su solicitud a aquellos casos que la semiología tiroidea lo amerite.
Test de TRH
Su empleo ha decrecido ampliamente en el mundo y des-de hace varios años prácticamente ya no se realiza en los Estados Unidos y en numerosos países de Europa en virtud de considerar que la respuesta de TSH post TRH habitual-mente correlaciona de manera positiva con los niveles de TSH basal. En una recopilación de 334 pruebas de TRH realizadas por el Departamento de Bioquímica de SAEM se observó en pacientes con anticuerpos negativos que ninguna hiperrespuesta presentó basales de TSH menores de 2.8 y 3 mUI/L cuando la TSH fue medida por quimioluminiscencia por Immulite Siemens y fluorescencia por Axsym respectivamente. Con esta última metodología un 14% de pruebas con respuesta normal de TSH al TRH tenían basales de TSH menores de 4 mUI/L. Se consideró un límite de corte de TSH post TRH < 27 mUI/L para Immulite y <25 para Axsym. En nuestro medio hay servicios que ya no la utilizan y otros que aún la solicitan aunque con menor frecuencia o en situaciones particulares (niños, infértiles, entre otras).
En la experiencia de años previos en el hospital Durand, 280 pruebas de TRH correspondientes a mujeres con niveles de TSH basal entre 2.5 y 8 mUI/L tenían determinaciones de TPOAb. Con basales de TSH entre 2.5 y 4 mUI/L, del 60 al 72% mostraron respuesta normal de TSH al TRH. Del mismo modo entre el 31 y el 54% presentaron normorrespuesta cuando los basales de TSH oscilaban entre 4.1 y 6 mUI/L. Recién con basales de TSH mayores de 6 mUI/L del 90 al 100% presentaron hiperrespuesta (TSH>26.8 mUI/L, 25 minutos post TRH). Los grupos que presentaban mayor porcentaje de hiperrespuesta eran los que tenían autoinmunidad tiroidea positiva. Por otra parte, en una población de mujeres infértiles con TSH menores de 4.22 mUI/L pudo diagnosticarse un 12.7% de Hipo SC grado1.
En resumen, el panel no recomienda la utilización de rutina de la prueba de TRH, aún con basales entre 3 y 4.5 mUI/ L. En casos particulares y según criterio médico puede tener indicación.
Diagnóstico diferencial con otras causas de TSH elevada.
Ciertas condiciones que no implican hipofunción tiroidea pueden cursar con niveles de TSH elevada. La Tabla 1 nos indica las principales:
B) Riesgo cardiovascular en el hipotiroidismo subclínico. Factores protectores y deletéreos. (Estudios poblacionales y riesgo en el paciente individual). Utilidad de efectores periféricos. Función cognitiva.
El sistema cardiovascular es el mayor blanco de acción de las hormonas tiroideas y obviamente los cambios hemodinámicos dependen de la severidad de la deficiencia de ellas.
Los cambios más frecuentes que ocurren en pacientes hipotiroideos son: aumento de la resistencia vascular sistémica, disfunción diastólica, reducida función sistólica y disminución de la pre-carga cardíaca. Además, factores proaterogénicos como la dislipemia, la hipertensión arterial y la disfunción endotelial, también se han vinculado con el hipotiroidismo subclínico.
Tres factores principales pueden contribuir en la fisiopatología de la hipertensión sistémica en los pacientes con hipotiroidismo subclínico. El primero y más ampliamente reconocido es el incremento de la resistencia vascular sistémica; el segundo es el aumento de la rigidez arterial que resulta de la infiltración mixedematosa; y el tercero es la disfunción endotelial.(8)
El hipotiroidismo, clínico y subclínico, ha sido asociado con un estado reversible de disfunción endotelial, que puede ser responsable de la hipertensión arterial y del riesgo incrementado de ateroesclerosis. A medida que la TSH se incrementa, los valores de vasodilatación mediada por flujo disminuyen, señalando la presencia de disfunción endotelial. Entre las posibles causas de la misma se encontrarían la dislipidemia y la presencia de sustancias inflamatorias que actuarían en forma indirecta. Las hormonas tiroideas también tendrían un efecto directo sobre el vaso. La alteración cardiovascular más constantemente encontrada en el hipotiroidismo subclínico es la disfunción diastólica del ventrículo izquierdo, caracterizada por una relajación miocárdica lenta y un retardo en el llenado ventricular.
Los resultados concernientes a la disfunción sistólica en reposo no son firmes, aún estudiada con nuevos métodos más sensibles, como la resonancia magnética y el ecodoppler. Todas las alteraciones cardiovasculares demostradas en pacientes con hipotiroidismo subclínico son similares a aquellas observadas en el hipotiroidismo manifiesto. Esto sugiere que existe una continuidad en los cambios cardíacos que ocurren entre el hipotiroidismo leve, subclínico y clínico.
En los últimos 30 años se realizaron diferentes estudios observacionales en relación a enfermedad coronaria y disfunción tiroidea. Varios de ellos concluyeron que los sujetos con hipotiroidismo subclínico tenían una alta prevalencia de enfermedad coronaria en comparación con sujetos eutiroideos. A pesar de ello, al día de hoy no se ha podido realizar ningún estudio controlado a gran escala que arroje evidencia sólida en cuanto a la asociación entre hipotiroidismo subclínico y enfermedad cardiovascular y que permita aseverar que el tratamiento disminuye la morbimortalidad asociada con el riesgo cardiovascular.(8)
Factores protectores y deletéreos
En dos estudios realizados en sujetos mayores de 85 años se encontró un rol protector del Hipo SC en relación a la tasa de mortalidad en general y de morbimortalidad cardiovascular en particular. Dichos pacientes tenían una media de TSH de 4,8 mUI/L. 9,10.
Por el contrario, el mayor riesgo de enfermedad coronaria ha sido observado en pacientes con Hipo SC menores de 60 años con TSH entre 4 y 10 mUI/L. (Figura 1)
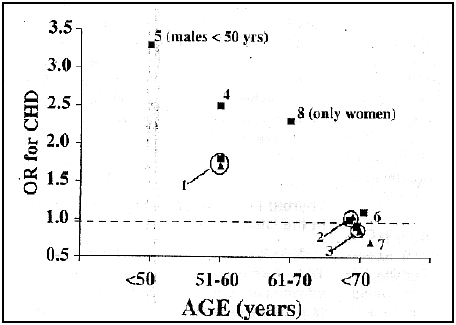
FIG 1. Relación de Odds para enfermedad coronaria en sujetos con Hipo SC de acuerdo a la media de edad de la población estudiada. Adaptado de Mariotti S.(11)
Lípidos: en el hipotiroidismo manifiesto, el incremento del colesterol total se encuentra por encima del 50% de los valores hallados en sujetos eutiroideos; esto puede atribuirse, en primer lugar, al aumento de LDL-C y secundariamente al incremento de las fracciones LDL y VLDL-C. La principal causa de hipercolesterolemia en estos pacientes, es la disminución del aclaramiento de LDL por su receptor, basado en la disminución de la expresión génica de los receptores LDL en fibroblastos, hígado y otros tejidos.
1. Walsh 2005 (TSH>10)
2. Cappola 2006 (n=496 73a seguimiento 13a)
3. Rodondi 2005 (n=2730 70-79a TSH>7)
4. Imaizumi 2004 (n=2856 58.5a TSH 5-10)
5. Kventy 2004 (n=1374 sólo en <50a)
6. Lindeman 2003 (n=755 >65a significativo con TSH>10)
7. Parle 2001 (n=1191 >60a no > mortalidad )
8. Hak 2000 (n=149 sólo mujeres >55a TSH> de 4)
Respecto del hipotiroidismo subclínico, existen datos menos claros acerca de la repercusión de dicho estado sobre el metabolismo lipídico.(12)
Se postula que las alteraciones pueden ser cuali y cuantitativas.
Los datos epidemiológicos que relacionan Hipo SC y dislipemia son conflictivos. Existe evidencia que muestra una asociación débil entre ambos a partir de niveles de TSH de 5 mUI/L y que adquieren mayor significancia a partir de TSH mayores de 10 mUI/L. Un grupo(13) estimó un aumento significativo de 3.5 mg% de colesterol en hombres y 6.2 mg% en mujeres por cada mUI/L de elevación de TSH por encima del rango.
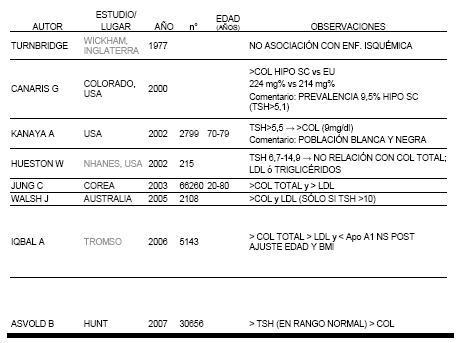
Varios estudios clínicos relacionaron el Hipo SC con aumento de colesterol, mientras que otros no encontraron asociaciones. Entre los estudios poblacionales que observaron correlación positiva entre Hipo SC y concentraciones séricas de colesterol total y/o LDL se encuentran el de Colorado(3), Kanayu(14), Jung(15) y Walsh(16). El estudio clínico Rotterdam(17) demostró mayor aterosclerosis e infarto de miocardio en mujeres añosas aunque los niveles de colesterol total no fueron más elevados en aquellas con diagnóstico de Hipo SC a diferencia de lo observado en hipotiroidismo clínico. LDL no fue medido en este estudio.
Por otra parte, los estudios poblacionales WHICKHAM (con 20 años de seguimiento), NANHES III(2) y TROMSO(18) no encontraron asociación significativa entre aumento de colesterol total y LDL en HIPO SC. En relación a la presentación de angina de pecho, IAM o ACV, Ladenson tampoco observó diferencias significativas. Tabla 2 El mayor impacto de Hipo SC sobre los niveles de colesterol total y LDL se observó en pacientes con TSH mayor de 10 mUI/L y en aquellos con valores séricos de colesterol mayor de 240 mg%.
Tabla 2 Estudios poblacionales que evalúan la asociación entre dislipemia e Hipo SC
Utilidad de los efectores periféricos de hormonas tiroideas
A los efectores tradicionales de hormonas tiroideas como SHBG y los ya mencionados colesterol total y LDL , se han propuesto más recientemente otros como homocisteína, PCR ultrasensible, fracciones lipoproteicas, PAI -1, etc. Su compromiso es multifactorial y actualmente no existen evidencias sólidas de que el Hipo SC los altere.(12)
El panel recomienda incluir las determinaciones de colesterol total y LDL previo a la evaluación de la decisión terapéutica, a diferencia del resto de los parámetros que no resultan de utilidad por el momento.
Función cognitiva
Los resultados son conflictivos pero se acepta que en general no hay demasiadas diferencias en función neuropsicológica, síntomas depresivos, humor y memoria (excepto, tal vez, una ligera afectación de la memoria laboral pero no otras funciones de la memoria), comprobadas en estudios con RMN(19)entre pacientes con Hipo SC y eutiroideos.
C) Tratamiento del hipotiroidismo subclínico. ¿Cuándo tratar y cuándo no tratar? ¿Cuándo suspende y reevalúa? Dosis de LT4.
Aunque existen controversias, la mayoría de los autores concuerdan en tratar rutinariamente a los portadores de Hipo SC con TSH mayor de 10 mUI/L y considerar cada caso en forma individual en pacientes con valores de TSH entre 4,5 a 10 mUI/L.
Otros autores sostienen que todos los pacientes deberían ser tratados, aún con pequeñas elevaciones de la TSH, siempre que tengan factores de riesgo. (5, 7, 20) El panel consensúa lo siguiente:
1.-Tratamiento de rutina con TSH mayor de 10 mUI/L.
2.- Considerar tratamiento con valores de TSH entre 4,5 y 10 mUI/L, en las siguientes situaciones:
· Disfunción ovulatoria / Infertilidad (siempre)
· Embarazo e intención de embarazo (siempre)
· Síntomas/signos compatibles con Hipo SC
· Bocio nodular o difuso
· Hipotiroidismo autoinmune (Tiroiditis de Hashimoto)
· Hipotiroidismo posquirúrgico o post 131I (siempre en pacientes con oftalmopatía).
· Autoinmunidad extratiroidea.
· Factores de riesgo cardiovascular, parti cularmente en individuos menores de 60 años.
¿Cuándo suspende y reevalúa?
1.- Para confirmar diagnóstico cuando los elementos que lo avalan son insuficientes.
2.- Para confirmar persistencia o transitoriedad por ejemplo en Hipo SC diagnosticado durante la adolescencia o en el posparto. También en aquellos casos que suprimen TSH aún con dosis menores a las calculadas según peso corporal. La recuperación espontánea de la función tiroidea se ha descripto entre el 5 y el 61,5% de los casos. Los mayores porcentajes corresponden a pacientes con TPOAb negativos. (21, 22)
Dosis de LT4.
El tratamiento de reemplazo siempre debe realizase con L-T4. Se recomienda utilizar dosis de 1.1-1.2 µg/Kg/día, dosis menores a las requeridas en el hipotiroidismo franco. Nivel deseable de TSH bajo tratamiento con L-T4 El panel recomienda lograr niveles de TSH entre 1 y 2,5 mUI/L. Casos particulares corresponden a:
· 1.- Mujeres con infertilidad, intención de embarazo y embarazo, para las cuales el nivel óptimo de TSH recomendable es alrededor de 1mUI/L con el objetivo de minimizar los incrementos posteriores que habitualmente se requieren en estas situaciones.
· 2.- Cardiópatas/Añosos mayores de 70 años. El nivel deseado de TSH suele ser mayor, oscilando alrededor del límite superior del valor normal de referencia.
D) Evaluación del beneficio del tratamiento: ¿Cómo? ¿A qué tiempo? Efectos deletéreos y Riesgos de sobre tratamiento y como prevenirlo.
El objetivo del tratamiento del Hipo SC procura:
1.- Evitar la progresión al hipotiroidismo clínico.
La progresión está directamente relacionada con los mayores niveles de TSH y la positividad de los TPOAb. Según el estudio WHICKHAM la progresión anual se estimó en 4% en pacientes con TSH elevada y TPOAb positivos, 3% en los que tienen TSH elevada y 2% en los que sólo presentan TPOAb positivos. Según otros autores, luego de un seguimiento de 3 a 10 años, la progresión al hipotiroidismo clínico osciló entre 5,5 y 43%.(21, 22, 23)
2.- Corregir síntomas y signos, especialmente los relacionados con la función cognitiva. Si bien, puede no haber demasiadas diferencias entre Hipo SC y eutiroideos, es razonable tener en cuenta esta sintomatología en el momento de la decisión terapéutica.
3.- Normalizar la dislipemia. Estudios poblacionales demostraron que el tratamiento con L-T4 produce un leve descenso de los valores de colesterol total (aproximadamente de 15 mg%) y de LDL, que se acentúa con niveles de TSH basales más elevados y colesterol pre tratamiento mayor a 240 mg%. Si bien el nivel de reducción logrado es escaso (6% del colesterol total), podría contribuir al descenso de la enfermedad cardíaca isquémica.
4.- Disminuir la mortalidad cardiovascular. La mayoría de los estudios poblacionales no encuentra influencia del Hipo SC sobre la mortalidad a largo plazo. Sola-mente en una población japonesa de varones se detectó un riesgo aumentado. (24)
Monitoreo del tratamiento: ¿Cómo? ¿A qué tiempo?
Puede administrarse la dosis plena calculada de L-T4 en pacientes jóvenes exentos de riesgo.
El panel aconseja la evaluación de signos, síntomas y monitoreo de los valores de TSH en no menos de 90 días de estar recibiendo la dosis indicada. Las mujeres que se embaracen o planeen hacerlo deben estar advertidas de concurrir al médico inmediatamente para evaluar el reajuste de dosis. Confirmado el embarazo, recomendamos efectuar controles según evaluación de cada caso en particular siendo mensuales en la mayoría de los mismos. (Recordamos que el tópico Hipo SC y embarazo no se desarrolla en profundidad dado que fue tratado en un consenso previo de FASEN). Efectos deletéreos . Riesgos de sobretratamiento y cómo prevenirlo.
El riesgo asociado con la terapia de reemplazo con L-T4 en pacientes con Hipo SC podría ocurrir en pacientes:
1) que tengan una enfermedad coronaria clínicamente establecida
2) con enfermedad coronaria subyacente, especialmente añosos El tratamiento en estos casos debe iniciarse con dosis mínimas y aumentos paulatinos con estricta vigilancia clínica y bioquímica.
3) con hipertiroidismo subclínico iatrogénico debido a sobredosis hormonal. Esta situación se observa en aproximadamente el 20% de los pacientes sustituidos con hormona tiroidea. En lo que respecta a cómo prevenir el riesgo de sobretratamiento es imprescindible el monitoreo bioquímico periódico. El panel recomienda hacerlo cada 6 a 12 meses, a menos que algún factor de los evaluados se modifique.
Conclusiones
El hipo SC tiene alta prevalencia, no obstante su pesquisa no se recomienda en la población general sino en grupos de riesgo. Su manejo difiere dependiendo de los niveles de TSH, considerando el tratamiento si la misma es mayor de 10 mUI/L. En el 75-80% de los casos(25), los pacientes se presentan con valores de TSH entre 5 y 10 mUI/L. Por el momento, el tratamiento en este subgrupo debe ser individualizado teniendo en cuenta la edad, presencia de síntomas y condiciones médicas asociadas.
La evidencia actual muestra que la población de edad media se beneficia más del tratamiento que los añosos.
La presencia de un Hipo SC durante el embarazo impone obligatoriedad de tratamiento dado que disminuye la morbimortalidad materno-fetal.
1. Cooper DS. Subclinical hypothyroidism. N Engl J Med 345:260-265, 2001 [ Links ]
2. Hallowell J, Staehling W, Flanders D, Hannon W, Gunter E, Spencer C, Braverman L. Serum TSH, T4 and Thyroid Antibodies in the United Status Population (1988 to 1994): Nacional Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metabol 87: 489-499, 2002 [ Links ]
3. Canaris G, Manowitz N, Mayor G, Ridgway E. The Colorado Thyroid disease Prevalence Study Arch Intern Med 160: 526-534, 2000 [ Links ]
4. Spencer C. Thyroid testing for the new millennium. Thyroid 13: 2-34, 2003 [ Links ]
5. Wartofsky L, Dickey R. Controversy in Clinical Endocrinology. The evidence for a narrower thyrotropin reference range is compelling J Clin Endocrinol Me-tab 90: 5483-5488, 2005 [ Links ]
6. Surks M, Hollowell J. Age-Specific distribution of serum thyrotropin and antithyroid anti-obodies in US population: Implications for the prevalence of subclinical hypothyroidism. J Clin Endocrinol Metab 92: 4575-5482, 2007 [ Links ]
7. Surks M, Ortiz E, Daniels G, Sawin C, Col N, Cobin R, Franklyn J, Hershman J, Burman K, Denke M, Gorman C, Cooper R, Weissman N. Subclinical thyroid disease. Scientific review and guidelines for diagnosis and management. JAMA 291, Nº 2: 228-238, 2004 [ Links ]
8. Biondi B and Cooper D. The clinical significance of subclinical thyroid dysfunction Endocrine Reviews 29: 76-131, 2008 [ Links ]
9. Gussekloo J, van Exel E, de Craen A, Meinders A.Frolich M, Westendorp R. Thyroid status, disability and cognitive function, and survival in old age. JAMA 292:25912599, 2004 [ Links ]
10. Singer R. Mortality in a complete 4-year follow up of 85-year-old residents of Leiden, classified by serum level of thyrotropin and thyroxine. J Insur Med 38:1419, 2006 [ Links ]
11. Mariotti S, Cambuli V. Cardiovascul-ar risk in elderly hypothyroid patients. Thyroid 17:1067-1073, 2007 [ Links ]
12. Duntas L, Wartofsky L Cardiovascular risk and subclinical hypothyroidism: focus on lipids and new emerging risk factors. What is the evidence ?.Thyroid 17:1075-1084, 2007 [ Links ]
13. McDermott M and Ridgway E. Clinical Perspective: Subclinical hypothyroidism is mild thyroid failure and should be treated. J Clin Endocrinol Metab 86: 4585-4590, 2001 [ Links ]
14. Kanaya A, Harris F, Volpato S, Perez-Stabile E, Harris T, Bauer D. Association between thyroid dysfunction and total cholesterol level in and older biracial population: the health, aging and body composition study. Arch Intern Med 162:773-779, 2002 [ Links ]
15. Jung C, Sung K, Shin H, Rhee E, Lee W, Kim B, Kang J, Kim H, Kim S, Lee M, Park JR, Kim S. Thyroid disfunction and their relation to cardiovascular risk factors such as lipid profile, hsCRP, and waist hip ratio Korea. Korean J Intern Med 18:146-153, 2003 [ Links ]
16. Walsh J, Bremmer A, Bulsara M, O'Leary P, Leedman P, Feddema P, Michelangeli V. Subclinical thyroid dysfunction as a risk factor for cardiovascular disease Arch Intern Med 165: 2467-2472, 2005 [ Links ]
17. Hak E, Pols H, Visser T, Drexhage H, Hofman A, Witteman J. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infraction in elderly women: The Rotterdam Study. Ann Intern Med 132: 270-278, 2000 [ Links ]
18. Iqbal A, Schirmer H, Lunde P, Figenschau Y, Rasmussen K, Jorde R. Thyroid stimulating hormone and left ventricular function J Clin Endocrinol Metab 92: 35043510, 2007 [ Links ]
19. Samuels M, Schuff K, Carlson N, Carello P, Janowsky J. Health Status, mood and cognition in experimentally induced subclinical hypothyroidism. J Clin Endocrinology Metab 92:2545-2551, 2007 [ Links ]
20. Gharib H, Tuttle R, Baskin J, Fish L, Singer P, McDermott. Consensus statement: Subclinical thyroid dysfunction: A joint statement on management from the American Association of Clinical Endocrinologists, the American Thyroid Association and the Endocrine Society. J Clin Endocrinol Metabol 90: 581-585, 2005 [ Links ]
21. Diez J, Iglesias P. Spontaneous subclinical hypothyroidism in patients older than 55 years: an analysis of natural course and risk factors for the development of overt thyroid failure. J Clin Endocrinology Metab 89:4890-4897, 2004 [ Links ]
22. Rosario P, Bessa B, Valadao M, Purisch S. Natural history of mild subclinical hypothyroism: prognostic value of ultrasound. Thyroid 19:9-12, 2009 [ Links ]
23. Huber G, Staub J, Meier CH, Mitrache C, Guglielmetti M, Huber P, Braverman L. Prospective study of the spontaneous course of subclinical hypothyroidism: prognostic value of thyrotropin, thyroid reserve, and thyroid antibodies. J Clin Endocrinology Metab 87: 3221-3226, 2002 [ Links ]
24. Imaizumi M, Akahoshi M, Ichimaru S, Nakashima E, Hida A, Soda M, Usa T, Ashizawa K, Yokoyama N, Maeda R, Nagataki S, Eguchi K. Risk for ischemic heart disease and all-cause mortality in subclinical hypothyroidism J Clin Endocrinol Metab 89: 3365-3370, 2004 [ Links ]
25. Fatourechi V. Subclinical hypothyroidsm: an update for primary care physicians Factors Mayo Clin Proc 84: 65-71, 2009 [ Links ]














