Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de endocrinología y metabolismo
On-line version ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.46 no.4 Ciudad Autónoma de Buenos Aires Oct./Dec. 2009
DISFUNCIÓN TIROIDEA SUBCLÍNICA
DISFUNCIÓN TIROIDEA Y AMIODARONA
Mesa 3: Disfunción Tiroidea y Amiodarona*
Ana Fadel, Alicia Gauna, Jorge Rezzónico, M. del C. Silva Croome (en representación del Panel de Expertos)
*Tercer Consenso Argentino sobre Patologías Endocrinológicas Federación Argentina de Sociedades de Endocrinología
Buenos Aires, 28 al 30 de agosto de 2009
Diabetes
Coordinadores Generales: Oscar A. Levalle - Eduardo Pusiol
Coordinador: Isaac Sinay
Panel de Expertos:
Graciela Alcaraz (Buenos Aires)
Liliana Bergoglio (Córdoba)
Gabriela Brenta (Buenos Aires)
Carmen Cabezón (Buenos Aires)
Ana Fadel (Buenos Aires)
Alicia Gauna (Buenos Aires)
Paula Mereshian (Córdoba)
Ana María Orlandi (Buenos Aires)
Ricardo Parma (Rosario)
Eduardo Pusiol (Mendoza)
Jorge Rezzónico (Mendoza)
María del C. Silva Croome (Buenos Aires)
Conflicto de interés: Los autores declaran no poseer conflictos de interés.
Introducción:
La amiodarona, droga de amplio uso en cardiología, es un potente antiarrítmico que contiene 37,2% de yodo en su molécula. Se deposita en tejido adiposo y se metaboliza lentamente, por lo cual sus efectos pueden verse hasta varios meses después de su suspensión. Inhibe la 5'desyodasa tipo 1 y altera el metabolismo de las hormonas tiroideas (HT). También inhibe la 5'desyodasa tipo 2 (aunque este efecto sólo se ve en humanos los primeros 3 meses) y puede inducir citotoxicidad. Por efecto de su contenido en I disminuye el transporte de yoduro, la síntesis y la liberación de HT.
Se concentra en la tiroides y puede inducir hipotiroidismo o hipertiroidismo (1).
El hipertiroidismo en un cardiópata es una situación severa con riesgo de vida para el paciente. La amiodarona puede estar asociada a un hipertiroidismo previo no diagnosticado o inducir hipertiroidismo ya sea sobre una tiroides con patología autónoma o Enfermedad de Graves subyacente, o inducir tirotoxicosis por citotoxicidad. Además, la amiodarona altera los parámetros de laboratorio, atenúa la respuesta a antitiroideos y dificulta el uso de 131I.
El objetivo de esta mesa es tratar algunos aspectos controvertidos sobre los efectos colaterales de la amiodarona sobre la función tiroidea.
A) Hipotiroidismo y amiodarona: Pacientes en riesgo: a-¿hay parámetros para predecir quién va a desarrollar hipotiroidismo amiodarona inducido? En caso afirmativo: ¿qué solicitaría? b- En un paciente con hipotiroidismo tratado con LT4 ¿la contraindica relativamente o considera que no representa situación de riesgo? c-En un paciente bajo amiodarona que desarrolla hipotiroidismo: ¿sugiere suspensión de la misma o agregar LT4?¿cómo lo monitorea y qué niveles de TSH y HT busca lograr?
a- No hay parámetros absolutos para predecir quién va a desarrollar hipotiroidismo amiodarona inducido (AIH) Es más frecuente en áreas yodo suficientes. En contraste con el hipertiroidismo es ligeramente más frecuente en mujeres, con un índice mujer/ hombre de 1,5:1. Lo desarrollan pacientes de mayor edad que los que presentan hipertiroidismo ya sea en pacientes con tiroides aparentemente normales como en pacientes con tiroideopatía previa. Dentro de estas anormalidades la presencia de anticuerpos antitiroideos circulantes tiene especial peso, ya que fueron encontrados en el 53% de los pacientes que desarrollaron hipotiroidismo. El sexo femenino representa un riesgo relativo de 7,9 y la presencia de anticuerpos antiperoxidasa (TPOAb) de 7,3. La combinación de ambos aumenta el riesgo a 13,5. La Tiroiditis crónica de Hashimoto es un factor de riesgo para el desarrollo de hipotiroidismo en los pacientes que reciben amiodarona como así también la presencia de bocio o antecedentes de patología tiroidea personal o familiar y niveles de TSH relativamente elevados previos al tratamiento (1,2).
El hipotiroidismo inducido por amiodarona suele aparecer generalmente durante los primeros meses de tratamiento y no depende de la dosis diaria ni acumulativa de amiodarona. El mecanismo se debe a la acción antitiroidea persistente del yodo (falla del escape al efecto Wolff-Chaikoff) y a su discutida acción antagonista sobre los receptores de T3 (3,4).
Si bien, no hay parámetros absolutos para predecir el desarrollo de AIH, en base a la presencia de los factores de riesgo mencionados, este panel considera de buena práctica la evaluación clínica y dosaje de TPOAb y TSH a todos los pacientes previo a iniciar tratamiento con amiodarona.
b- Un paciente hipotiroideo en tratamiento con LT4 no tie-ne contraindicación para recibir amiodarona.
Debe monitorearse por la posibilidad de cambios en los requerimientos de LT4. Distintos autores refieren que se ha observado una elevación de TSH en pacientes hipotiroideos tratados con LT4 que reciben amiodarona. Es fundamental tener en cuenta para el seguimiento de estos pacientes los valores normales de hormonas tiroideas bajo tratamiento crónico y agudo con amiodarona, dado que varían en estas situaciones. Es aceptado que a los primeros 3 meses de iniciar amiodarona, aumenta la T4 total y libre, disminuye la T3, y aumenta la rT3 y la TSH. En tratamiento crónico, se mantienen elevadas T4 y rT3, baja la T3 y se normaliza la TSH (5). En pacientes eutiroideos crónicamente tratados con amiodarona, en relación a sus valores basales, un aumento de T4 o T4 L del 42%, un aumento de rT3 del 172% y una disminución de T3 del 20-25%, seguida de un 16% aunque los valores pueden ser menores, se consideran valores normales (6). Esto puede ser válido si se conocen los valores pretratamiento. En la experiencia del Htal. Ramos Mejía los pacientes crónicamente tratados con amiodarona, eutiroideos, con TPOAb negativos presentaron (por quimioluminiscencia): T3 (X ± SD) de 108 ± 27.3 ng/dL, T4 10,3 ± 2,07 μg/dL. La mediana de T3 fue de 106 ng/dL, con un rango de 40 a 150 ng/dL, y la de T4 de 10,2 ug/dL, con un rango de 6 a 14,1 μg/dL .
Este panel considera que no está contraindicado el tratamiento con amiodarona en pacientes hipotiroideos tratados con LT4. Deben monitorearse a los 3 meses de iniciada la amiodarona con dosajes de TSH y T4 o T4 libre y ajustar la dosis buscando niveles de TSH y HT considerados como normales en pacientes eutiroideos tratados con amiodarona y de acuerdo a la tolerancia clínica.
c- En un paciente bajo amiodarona que desarrolla hipotiroidismo la conducta a tomar dependerá de la necesidad de continuar con amiodarona la conducta a tomar, dado que tanto la suspensión de la droga como el agregar LT4 son opciones válidas.
Se continúa con amiodarona si hay riesgo cardiovascular al suspenderla o durante su suspensión. Si es factible, se la suspende, observándose un elevado porcentaje de curación en pacientes con TPOAb negativos. Está referida la administración de perclorato de potasio luego de la discontinuación de amiodarona con el objeto de acelerar el restablecimiento del eutiroidismo(7).
Se considera que continuar con la amiodarona agregando dosis de LT4 con control mensual hasta que el nivel de TSH alcance niveles normales altos es el tratamiento más confiable y seguro.
Se recomienda:
1) la suspensión de amiodarona, si cardiológicamente es factible en los pacientes que desarrollan HAI sin tiroideopatía previa conocida, ni factores de riesgo, sin tratar con LT4. De lo contrario, iniciar LT4 y continuar con amiodarona. 2) En presencia de hipotiroidismo severo es conveniente indicar tratamiento con LT4 aunque se suspenda la amiodarona y bajos estrictos controles periódicos a fin de ajustar las dosis de LT4. 3) El panel no utiliza perclorato en el hipotiroidismo amiodarona inducido. 4) En el paciente que se suspende amiodarona , sugerimos el control clínico mensual y dosaje de TSH y T4 o T4 libre cada 45 días los primeros 6 meses; si se indica LT4, control clínico mensual a dosis progresivas y monitoreado con TSH y T4 o T4 L cada 45 días hasta lograr la dosis óptima para cada paciente con el objetivo de mantener una TSH lo más normal posible de acuerdo a su cardiopatía.
B) Hipertiroidismo y amiodarona. Clínica. Definición de hipertiroidismo tipo 1 y tipo 2, formas mixtas. Hipertiroidismo amiodarona asociado (hipertiroidismo no diagnosticado tratado con amiodarona). Diagnóstico de hipertiroidismo: Valores de TSH, T4 y T3. ¿Cuándo lo confirma? ¿Cuando lo excluye? ¿Cuándo solicita yoduria? Utilidad de la tiroglobulina (Tg) en el diagnóstico de hipertiroidismo.
El Hipertiroidismo amiodarona inducido (HAI) se desarrolla en individuos más jóvenes que el AIH y con mayor prevalencia en varones. Tiene una alta tasa de morbimortalidad a corto y largo plazo La clínica del síndrome hipertiroideo no suele ser tan florida como en el hipertiroidismo sin amiodarona, probablemente porque la amiodarona puede enmascarar los síntomas adrenérgicos, y también, porque en sujetos añosos, en quienes la indicación de amiodarona es frecuente, el hipertiroidismo puede ser apático. La pérdida de peso sin ingesta disminuida fue el signo más constante que observamos en los pacientes, seguidos de menor respuesta al antiarrítmico y temblor fino distal (7,8). Dependiendo de la etiología, si presentan enfermedad de Graves, la presencia de oftalmopatía y bocio difuso pueden agregarse al cuadro. Los pacientes con bocios nodulares tóxicos, obviamente presentan nódulos tiroideos, y en las tiroiditis destructivas, no hay bocio o sólo un discreto aumento del tamaño tiroideo.
Los pacientes con Hipertiroidismo amiodarona inducido (HAI) tienen diferentes mecanismos patogénicos. Se describieron 2 tipos de HAI: Tipo I (TI) con autonomía tiroidea subyacente y Tipo II (TII) por tiroiditis destructiva. Como el tratamiento difiere, el diagnóstico diferencial entre ambas es fundamental. El hallazgo de situaciones que no presentan los criterios descriptos para diferenciar una de otra entidad, llevó a hablar de formas mixtas. A partir de entonces el diagnóstico etiológico se tornó más complejo. Una forma mixta verdadera es aquella donde coexisten autonomía tiroidea y tiroiditis destructiva, y no las situaciones que no presenten parámetros de diagnóstico claros.
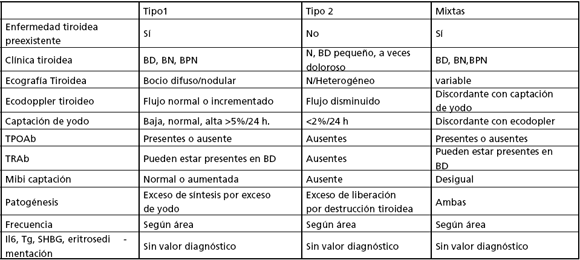
Diagnóstico de Hipertiroidismo:
Ante la sospecha de hipertiroidismo en un paciente tratado con amiodarona, la determinación de TSH es mandatoria. No hay consenso sobre la medición sistemática de HT totales o libres. En las encuestas de la ETA y de LATS no todos los autores solicitan T3(9).
Si presentan T4, T3 totales o libre elevadas y TSH inhibida, confirman obviamente el hipertiroidismo. Sin embargo, dado que la amiodarona inhibe la conversión de T4 a T3, puede ocurrir que la T3 esté en rango normal en pacientes con hipertiroidismo amiodarona inducido (HAI). En la experiencia del Htal. Ramos Mejía se establecieron rangos de referencia para HT en 209 sujetos eutiroideos crónicamente tratados con amiodarona (sin bocio, con TPOAb negativos y TSH normal). El límite superior de T3 fue de 150 ng/dL y para el de T4 de 14,1 μg/dL. Entre los pacientes eutiroideos e hipertiroideos con amiodarona, se observó superposición en los niveles de T3 y con me-nor frecuencia de T4 (8). Por lo tanto, consideraron que una TSH menor de 0,1 mU/L, indica hipertiroidismo, aún con HT normales (hipertiroidismo subclínico). A los fines diagnósticos la TSH inhibida se consideró suficiente y el dosaje de T4 y T3 necesarios para monitorear la evolución y respuesta al tratamiento. Una TSH normal excluyó el hipertiroidismo.
En caso de TSH entre 0,1 y el límite inferior del nuevo rango de referencia empírico de TSH (0,3 mU/L) propuesto por la AACE (American Association of Clinical Endocrinologists), con T4 y T3 en rango normal para pacientes con amiodarona, ante sospecha clínica, consideramos, dado el riesgo aumentado de los pacientes cardiópatas, que la confirmación de TSH no debe posponerse 6 a 8 semanas como en otros casos de hipertiroidismo subclínico, y aún ante la duda, considerarlos como que presentan hipertiroidismo subclínico. La tiroglobulina Tg no es un marcador útil para diagnóstico de síndrome hipertiroideo bajo amiodarona.
No solicitamos yoduria en pacientes que están bajo amiodarona o con suspensión reciente de la misma, ya que en nuestra experiencia está indefectiblemente elevada y no modifica la conducta. Sólo la solicitamos en los casos en que el hipertiroidismo se presenta alejado de la suspensión de la amiodarona, para corroborar el exceso de yodo, o durante la evolución, para determinar cuando desapareció la sobrecarga de yodo y definir el tratamiento.
Este panel considera que el HAI debe ser una patología a tener en cuenta en pacientes tratados con amiodarona, dado que la clínica puede ser poco florida. Es relevante para la sospecha clínica la reagudización de la patología cardiológica bajo el tratamiento como la disminución del peso corporal del paciente. El diagnóstico de hipertiroidismo se confirma con una TSH menor de 0,1mUI/L y se excluye con TSH normal. Los valores de HT totales o libres son variables dado los efectos de la amiodarona y la enfermedad no tiroidea (ENT) que puede presentar el paciente, pero es importante su dosaje para el seguimiento.
En relación a la determinación de yoduria, sólo la solicitamos cuando el hipertiroidismo se presenta alejado de la suspensión de la amiodarona, (para corroborar el exceso de yodo), o durante la evolución (para determinar si desapareció la sobrecarga de yodo y adecuar terapéutica).
C) Diagnóstico entre tipo 1 y 2. Rol de la captación y de la presencia de bocio. Utilidad del ecodoppler tiroideo, e IL6. ¿Efectúa PAAF en los pacientes con bocio nodular? ¿Es útil en el diagnóstico diferencial entre tipo 1 y 2? Formas mixtas: ¿cuándo hay verdadera coexistencia de tipo 1 y 2, y cuándo se trata sólo de una limitación en establecer el diagnostico diferencial?
Los pacientes con HAI Tipo I presentan: a-) Enfermedad de Graves con o sin oftalmopatía, bocio difuso y TRAb/ TPOAb positivos o b-) bocios nodulares o polinodulares autónomos con TRAb/TPOAb negativos. Algunos reportes de Europa sugieren que los pacientes con HAI tipo I tienen las captaciones de radioyodo altas o normales comparadas con las del tipo II que son bajas o indetectables (10). Sin embargo las publicaciones de EE.UU. y del Reino Unido son diferentes. En estas regiones las captaciones son bajas independientemente del tipo de HAI, probablemente relacionadas con los altos niveles de yodo circulantes que bloquean la captación de radiotrazador (7). En el Hospital Ramos Mejía, se observó que algunos pacientes con clínica clara de HAI Tipo I, presentaban captación de 131I indetectable y en un estudio retrospectivo se comparó la utilidad de 2 parámetros diagnósticos, captación y bocio, en el diagnóstico de tipo de HAI, en relación a la evolución como "gold- Standard". La captación detectable diagnosticó HAI Tipo I con una agudeza de predicción positiva del 100%, aunque la captación bloqueada no la excluyó. La presencia de bocio fue importante en el diagnóstico de HAI Tipo I, con un valor predictivo positivo del 86,9% y descartó Tipo II en el 95,2% de los casos (8).
El ecodoppler color de la tiroides puede estimar cuantitativamente el flujo sanguíneo tiroideo y se lo reportó como una herramienta eficaz para el diagnóstico diferencial entre HAI tipo I y Tipo II en el 80% de los casos. Mientras que en el HAI tipo I la vascularización tiroidea está normal o aumentada, en la HAI tipo II la vascularización es nula o mínima. En este último aspecto es similar a la observada en pacientes eutiroideos en tratamiento con amiodarona (4).
Se reportó que la citoquina interleuquina 6 (IL6) se eleva en diferentes inflamaciones tiroideas. Aunque el ran-go se superpone entre ambas HAI, es muy utilizada en algunos países de Latinoamérica (1). La Tg puede también estar elevada en ambos HAI y tiene escaso valor en el diagnóstico diferencial.
En cuanto a otros estudios complementarios, pedimos sistemáticamente TPOAb y TRAb. Fue referida la utilidad del centellograma con Tc 99 MIBI en el diagnóstico diferencial del HAI Tipo I (retención difusa sugestiva de tejido hiperfuncionante) y HAI Tipo II (captación no significativa sugestiva de proceso destructivo).
La punción-aspiración con aguja fina (PAAF) tiroidea tiene un escaso papel en el diagnóstico del HAI. Aunque la PAAF puede descubrir un daño folicular en HAI Tipo II, los hallazgos, son a menudo, desiguales por lo que la mayoría de los autores no recomienda su uso sistemático. Sin embargo, su uso podría estar indicado en caso de nodularidad tiroidea para excluir malignidad.
El hallazgo de situaciones que no presentan los criterios descriptos para diferenciar una de otra entidad, llevó a hablar de formas mixtas. A partir de entonces el diagnóstico etiológico se tornó más complejo. Resultan llamativas las diferencias entre las encuestas de la ETA y LATS en cuanto a prevalencia de formas mixtas.
Una forma mixta verdadera es aquella donde coexisten autonomía tiroidea y tiroiditis destructiva, y no las situaciones que no presenten parámetros de diagnóstico claros. La evolución puede aclarar el diagnóstico, pero es un dato tardío en el momento de tomar decisiones terapéuticas.
Este panel considera útil para el diagnóstico diferencial entre HAI Tipo I y Tipo II: los antecedentes del paciente, el dosaje de anticuerpos antitiroideos (TPOAb y TRAb), la captación de 131I y la presencia de bocio. La existencia de una captación no bloqueada (mayor a 5%) descarta un HAI Tipo II, mientras que la captación bloqueada puede estar presente en ambos Tipos. La ausencia de bocio avala la Tipo II.
Si bien el ecodoppler tiroideo está referido como un excelente parámetro para distinguir entre HAI TI y TII, remarcamos la importancia de conocer los errores del método en cada centro en particular para validar los hallazgos. No consideramos los dosajes IL6 y Tg, ni la PAAF de utilidad en el diagnóstico diferencial entre los dos Tipos de HAI.
D) Tratamiento del hipertiroidismo por amiodarona: ¿sugiere suspensión de amiodarona? (siempre, sólo en tipo1?) MMI: ¿cuando? ¿en qué dosis? Complicaciones. Perclorato: ¿cuándo, en qué dosis y por cuánto tiempo? Dosis de 131I: ¿cuándo? ¿cómo calcula la dosis? Complicaciones. Cirugía: ¿cuándo? Ventajas y desventajas de la misma. Otros tratamientos (Corticoides, Litio, Colestiramina, etc.)
La identificación de los diferentes subtipos de AIT permite elegir el tratamiento racionalmente más apropiado.
TIPO I: El tratamiento inicial es la suspensión de la amiodarona si es factible y su reemplazo por otro antiarrítmico, y la indicación del tratamiento antitiroideo.
Muchas veces es imposible suspender la droga por la resistencia que presentan ciertos pacientes a otras drogas antiarrítmicas. Además suspendiendo la amiodarona no se previene la continuación de su efecto. También debe considerarse el efecto "hipotiroideo símil" que tienen sus metabolitos sobre el corazón que paradójicamente protegen al corazón del exceso de HT (11). Por otro lado, ciertos trabajos informan sobre la posibilidad de empeoramiento de los síntomas con la suspensión (12), pero pocos demuestran mejoría sólo con la suspensión (13).
Dado que el alto contenido de yodo de la glándula la hace más resistente a las tionamidas deben utilizarse dosis más altas: Metimazol 40 a 60 mg y de Propiltiuracilo 600 a 800mg.
El agregado de perclorato de potasio 0.5-1 g /día disminuye la entrada de yodo a la glándula, deplecionando así los depósitos. Utilizando este esquema se acorta el lapso para lograr el eutiroidismo.
La utilización de este esquema puede producir una elevación transitoria de las hormonas tiroideas (HT) y de la yoduria (14). El uso del Perclorato de Potasio está limitado por su toxicidad: anemia aplástica, agranulocitosis y complicaciones renales. Trotter comparó la toxicidad de las tionamidas y el perclorato publicando que la incidencia de complicaciones por el perclorato fue del 2 al 3%. Se presentó agranulocitosis en el 0,3 % de los casos comparados con el 0.94% de los tratados con tionamidas La frecuencia de aparición de estas complicaciones aumenta al 16-18% cuando se utilizan dosis mayores de 1 g/día. Se suspende el Perclorato en cuanto se logra el eutiroidismo (alrededor de las 4-6 semanas).
Se ha publicado el agregado de Carbonato de Litio de 900 a 1350 mg/día por 4 a 6 semanas (15). En el Hospital Ramos Mejía se utilizó Li (900 mg/día) como adyuvante de los antitiroideos en el tratamiento del AIT TI y fue efectivo en disminuir los valores de T3 a corto plazo de iniciado el mismo. Los valores de HT tanto T4 como T3, a igual tiempo de tratamiento, fueron significativamente menores en los pacientes con litio y MMI vs. los pacientes con tratamiento con MMI. El tratamiento con Litio requiere control de función renal y litemia, y presenta fenómeno de escape por lo que no lo utilizamos de rutina, sino sólo en casos severos o contraindicación a MMI (8).
El tratamiento radical de elección del AIT Tipo I en Europa y EE.UU. es la tiroidectomía, ya que resuelve rápidamente el hipertiroidismo y permite reanudar el antiarrítmico (16). En algunos centros efectúan la tiroidectomía con anestesia local.
Dosis de 131I: Este tratamiento puede considerarse en caso de contarse con captaciones adecuadas. Primeramente debe obtenerse la determinación de yoduria en 24 h, de no ser ésta elevada se efectuará la captación de 131I. Algunos autores a captaciones mayores del 10% las consideran como posibles, administrando dosis de 200 μCi/g de tejido. La utilización de TSH recombinante fue referida para aumentar las captaciones, teniendo en cuenta que se puede exacerbar el hipertiroidismo (17). El tratamiento con radioyodo puede considerarse preventivamente en caso de necesidad de reanudar el tratamiento con amiodarona. En estos casos debe calcularse una dosis de tipo ablativa (asegurar a la glándula una dosis absorbida de 300 rads).
Otros tratamientos propuestos son la plasmaféresis e inyección intranodular de etanol.
Está descripto el uso de la colestiramina en la AIT Tipo I con la doble acción de disminuir el circuito enterohepático de las HT y acelerar la eliminación de la amiodarona.
Tipo II: Como resultado de su etiopatogenia la forma pura, no responde a las tionamidas. En este tipo no es fundamental la suspensión de la amiodarona. El tratamiento de elección son los corticoides. Las dosis recomendadas son generalmente de 40 a 80 mg de prednisona/día con mejoría de los síntomas dentro de la semana. El tiempo medio para la restauración del eutiroidismo es de 30 días. Este tiempo puede ser más prolongado en los casos con T4L más altas y con mayor volumen glandular (18). Otros autores no encuentran una diferencia significativa en la evolución de los pacientes tratados con corticoides y los que no reciben tratamiento específico (19).
La utilización de agentes colecistográficos: ácido iopanoico, se basa en que son potentes inhibidores de la 5' desyodasa que cataliza la activación de la prohormona T4 a la forma más potente T3. Se ha demostrado también que reducen la captación periférica de HT en los tejidos y que son inhibidores de la síntesis nuclear de T3. Se utilizan en dosis de 500 mg, dos veces al día. Estos autores encontraron un alto índice de hipotiroidismo postutilización de este esquema. Bogazzi y col. demostraron que si bien los corticoides y el ácido iopanoico son efectivos en controlar el AIT II, los corticoides logran el eutiroidismo más rápidamente (20).
Este panel considera que en la AIT Tipo I debe indicarse la suspensión de la amiodarona, pero la decisión la toma el cardiólogo tratante, ya que no siempre es factible. Independientemente de la suspensión o no de la amiodarona debe iniciarse el tratamiento con MMI a altas dosis asociado al perclorato.
En los pacientes en los cuales se pudo suspender la amiodarona y se alcanzó una captación de 131I mayor del 10% consideramos la administración de una dosis de 131I..
El tratamiento radical quirúrgico puede ser de alto riesgo, pero es una opción terapéutica a considerar. En caso de optar por la cirugía, es fundamental que la realicen cirujanos de cabeza y cuello y anestesiólogos entrenados y bajo estricto monitoreo cardiológico.
En los pacientes con bocio poli o uninodular puede considerarse la alcoholización de los mismos, si bien los integrantes del panel no tienen experiencia propia.
Se considera en AIT Tipo II la sugerencia de suspensión de amiodarona, aunque esto es menos relevante. Puede utilizarse o no la corticoterapia.
En las formas mixtas el tratamiento combinado con MMI, perclorato y corticoides.
Es opinión del panel la administración preventiva de dosis ablativas de 131I en los pacientes con pasado de AIT Tipo 1 que deben reanudar el tratamiento con amiodarona.
1. Harjai K, Licata A. Effects of Amiodarone on Thyroid Function. Ann Intern Med 126:63-73, 1997 [ Links ]
2. Trip M, Wiersinga W, Plomp T. Incidence, predictability and pathogenesis of amiodarone-induced thyrotoxicosis and hypothyroidism. Am J Med 91 507-11, 1991 [ Links ]
3. Bogazzi F, Bartalena L, Gasperi M, Braverman LE, Martino E. The various effects of amiodarone on thyroid function. Thyroid; 11: 511-9, 2001 [ Links ]
4. Martino E, Bartalena L, Bogazzi F, Braverman L. The effects of amiodarone on the thyroid. Endocr Rev 22: 240-54, 2001 [ Links ]
5. Newman C, Price A, Davies D, Gray T, Weetman A. Amiodarone and the thyroid: a practical guide to the management of thyroid dysfunction induced by amiodarone therapy. Heart 79: 121-7, 1998 [ Links ]
6. Daniels G. Amiodarone- induced thyrotoxic-osis. J Clin Endocrinol Metab 86:3-8, 2001 [ Links ]
7. Basaria S, Cooper D. Amiodarone and the thyroid. Am J Med 118: 706-14, 2005 [ Links ]
8. Silva Croome M, Messutti H. Hipertiroidismo y Corazón. En: Hipertiroidismo. Gauna A, Novelli JL, Sánchez A; Capítulo 26: 275-291, Ed. UNR, 2008 [ Links ]
9. Diehl L, Romaldini J, Graf H, Bartalena L, Martino E, Albino C, Wiersinga W. Management of amiodarone-induced thyrotoxicosis in Latin America: an electronic survey. Clin Endocrinol (Oxf) 65:433-438, 2006 [ Links ]
10. Martino E, Mariotti S, Aghini-Lombardi F, Ceccarelli C, Lippi F, Piga M. Loviselli A, Braverman L, Safran M, Pinchera A. Radioactive iodine thyroid uptake in patients with amiodarone-induced thyroid dysfunction. Acta Endocrinologica (Copenh)119:167173, 1988 [ Links ]
11. Wiersinga W. Pharmacotherapeutics of the Thyroid Gland. Springer Verlag, Berlin, pp 225-287, 1997 [ Links ]
12. Harjai K. Amiodarone induced hyperthyroidism: a case series and brief review of literat-ure. Amiodarone induced hyperthyroidism: a case series and brief review of literature. Pacing Clin Electrophysiol 19:1548-1554,1996 [ Links ]
13. Trip M, Düren D, Wiersinga W. Two cases of amiodarone-induced thyrotoxicos-is successfully treated with a short course of antithyroid drugs while amiodarone was continued. BrHeartJ 72:266-268, 1994 [ Links ]
14. Martino E, Aghini-Lombardi F, Mariotti S y col. Treatment of Amiodarone associated thyrotoxicosis by simultaneous administration of potassium perchlorate and methimazole. J Endocrimol Invest 9: 201-207, 1986 [ Links ]
15. Dikstein G, Shechner C, Adawi F, Kaplan J, Baron E, Ish-Shalom S. Litium tratment in Amiodarone -induced Thyrotoxicosis. Am J Med 102:454-458, 1997 [ Links ]
16. Meurisse M, Hamoir E, D`Silva M, Joris J, Hennen G. Amiodarone induced Thyrotoxicosis: Is there a place for Surgery?. World J. Surg 17: 622-627, 1993 [ Links ]
17. Ryan L, Braverman L, Cooper D, Ladenson P, Kloos R. Can amiodarone be restarted after amiodarone induced thyrotoxicosis? Thyroid 14: 149-153, 2004 [ Links ]
18. Bogazzi F, Bartalena L, Tomisti L, Rossi G, Tanda M, Dell'Unto E, Aghini-Lombardi F, Martino E. Glucocorticoid Response in Amiodarone-Induced Thyrotoxicosis Resulting from Destructive Thyroiditis Is Predicted by Thyroid Volume and Serum Free Thyroid Hormone Concentrations. J Clin Endocrinol Metab 92:556-562, 2007 [ Links ]
19. Conen D, Melly L, Kaufmann C, Bilz S, Ammann P, Schaer B, Sticherling C, Muller B, Osswald S. Amiodarone-induced thyrotoxicosis: clinical course and predictors of outcome. J Am Coll Cardiol 49:2350-5, 2007 [ Links ]
20. Bogazzi F, Bartalena L, Cosci C, Broggnoni S, DellÙnto C, Graso L, Aghini-Lombardo F, Rossi G, Pinchera A, Braver-man LE, Martino E. Treatment of type II amiodaroneinduced thyrotoxicosis by either iopanoic acido or glucocorticoids: a prospective, randomized study. J Clin Endocrinol Metab 88:1999-2002, 2003 [ Links ]














