Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. v.46 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2009
PATOLOGÍA SUPRARRENAL
Mesa 1 Incidentaloma Suprarrenal*
Raúl Chervin, Jorge Herrera, Ariel Juri, Esther Pardes, María E. Surraco (en representación del Panel de Expertos)
*Tercer Consenso Argentino sobre Patologías Endocrinológicas Federación Argentina de Sociedades de Endocrinología
Buenos Aires, 28 al 30 de agosto de 2009
Diabetes
Coordinadores Generales: Oscar A. Levalle - Eduardo Pusiol
Coordinador: Isaac Sinay
Panel de Expertos:
Liliana Alba (Buenos Aires)
Gabriel Isaac (Mar del Plata)
Susana Belli (Buenos Aires)
Ariel Juri (Mendoza)
Raúl Chervin (Buenos Aires)
Susana Leiderman (Buenos Aires)
Lía Colombi (Mendoza)
Esther Pardes (Buenos Aires)
Graciela A. de Cross (Buenos Aires)
Titania Pasqualini (Buenos Aires)
Javier Herrera (Mendoza)
Carlos Sanz (Mendoza)
Jorge Herrera (San Juan)
María E. Surraco (Córdoba)
Conflicto de interés: Los autores declaran no poseer conflictos de interés.
1.- Definición
Se define como incidentaloma adrenal (IA) a una masa suprarrenal descubierta de manera casual, durante una evaluación por imágenes realizada por una indicación no vinculada con la evaluación de patología de dicha glándula.
De acuerdo con la definición adoptada se excluyen de la condición de IA a todos aquellos pacientes que presenten:
· Manifestaciones clínicas ostensibles y específicas de disfunción suprarrenal
· Pacientes asintomáticos con predisposición genética para tumores suprarrenales
· Pacientes con cáncer extraadrenal en proceso de estadificación
Las masas adrenales incidentales son halladas en 2 a 4% de las TC de abdomen y su frecuencia se incrementa correlativamente con la edad, calculándose 0.2% en la 3ra década y hasta 7% en los mayores de 70 años. Representa un subproducto de la tecnología moderna, ya que la utilización rutinaria de técnicas radiológicas sofisticadas ha puesto de manifiesto un problema que no es nuevo, pero que cada vez es más reconocido en la práctica médica.
El desafío consiste en reconocer y tratar el pequeño porcentaje de IA que implique riesgo significativo, ya sea por su actividad hormonal como por su histología maligna.
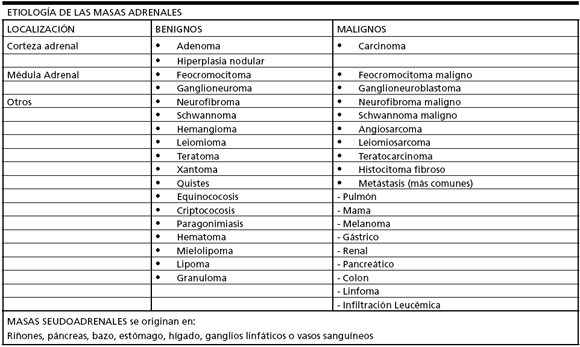
La etiología de los IA incluye los tumores benignos y malignos de todas las zonas de la corteza y de la médula suprarrenal, las metástasis a las glándulas suprarrenales, así como enfermedades infiltrativas. Ocasionalmente la investigación de estas lesiones puede llevar a un diagnóstico de "pseudoadrenal" correspondientes a tumores o masas artificiales derivados de estructuras adyacentes (riñones, páncreas, bazo, ganglios linfáticos o estructuras vasculares) (Tabla 1).
Tabla 1
2.- Criterios de Sospecha de Cáncer Adrenal: Tamaño. Imagen.
La gran mayoría de los IA son benignos, siendo el carcinoma córticoadrenal primitivo (CCA) una entidad poco frecuente. Sobre 2005 pacientes con un IA, el CCA fue encontrado en el 4,7%. El diagnóstico diferencial entre un tumor adrenal benigno o maligno constituye sin duda un desafío, y las características de las imágenes serán de mucha utilidad por su valor orientativo sobre la naturaleza de la lesión, permitiendo diagramar la conducta a seguir en la mayoría de los casos.
I) Tamaño
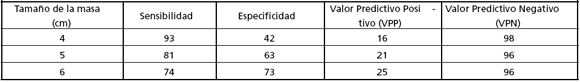
El diámetro máximo de una masa adrenal puede sugerir un CCA. En un estudio multicéntrico de Italia, sobre 1004 pacientes con IA, el 93% de los CCA tuvieron un tamaño al inicio mayor de 4 cm. Sin embargo, la especificidad de esta línea de corte fue limitada ya que la mayoría de las masas mayores de 4 cm fueron benignas. Los mismos autores analizaron el poder diagnóstico de las diferentes líneas de corte del diámetro para la diferenciación de un CAA de una lesión benigna (ver tabla 2) El CCA fue observado en el 2% de los tumores iguales o menores a 4 cm, en el 6% de los que tienen entre 4,1 y 6 cm y en el 25% de los que son mayores de 6 cm. En relación con el tamaño debemos destacar que: 1) si un tumor no crece es muy probable-mente benigno, aunque entre el 5 y 25% de estos tumores pueden crecer hasta 1 cm, y 2) el pronóstico de un CCA es mejor cuanto más pequeño es el tamaño al momento de su extirpación.
Tabla 2: Análisis del poder diagnóstico de diferentes valores de corte del tamaño de la masa para la diferenciación de un cáncer adrenocortical primario de una lesión benigna
No obstante, el tamaño no puede ser tomado en cuenta aisladamente y otras características de la lesión, además del diámetro, deben ser escrupulosamente consideradas.
II) Análisis de otras características por imágenes además del diámetro
El poder y la viabilidad de un estudio por imágenes diseñado para diferenciar estas lesiones dependerán en última instancia de su sensibilidad y especificidad. Primero, debe ser lo suficientemente sensible para detectar lesiones focales de las suprarrenales cuando estén presentes. Sin embargo, mientras que una alta sensibilidad es útil, una alta especificidad de los estudios por imágenes de suprarrenales es crucial, y es preciso que dichos estudios estén diseñados de modo de brindar una especificidad lo más próxima al 100%, de modo de evitar un falso diagnóstico de benignidad. Afortunadamente, disponemos de procedimientos que reúnen los requisitos anteriores sacando provecho de 3 aspectos fisiopatológicos: 1) contenido intracitoplasmático de lípido, 2) diferencias de perfusión entre masas benignas y malignas y 3) diferente actividad metabólica (esta última aplicada al PET).
La medición del contenido intracitoplasmático de lípido por TC y/o RM ha permitido reconocer las lesiones benignas (adenomas) con mucha mayor especificidad que solamente el análisis morfológico, ya que éstas en hasta un 70% tienen un alto contenido de lípido que típicamente está ausente en las lesiones malignas. Por otro lado, los estudios de perfusión son complementarios ya que permiten caracterizar con precisión las lesiones que quedan indefinidas por otros métodos.
a.-Tomografía Computada (TC)
En las recomendaciones del panel de consenso del National Institutes of Health, en el año 2003, se sugiere que una masa de forma oval o redondeada de bordes netos, homogénea y sin calcificaciones es compatible con benignidad aunque ninguno de estos aspectos individualmente puede descartar malignidad en forma confiable.
En un estudio retrospectivo en pacientes adrenalectomizados utilizando la histopatología como "gold standard" diagnóstico, la TC sin contraste, tomando el valor de corte de 10 Unidades Hounsfield (UH), mostró una sensibilidad de 40,5% y una especificidad de 100% para diferenciar adenomas de lesiones no adenomatosas. Esto implica que las lesiones que tienen menos de 10 UH son casi seguramente benignas. Los mielolipomas son fácilmente distinguibles ya que la densidad es generalmente menor de - 40 UH, típicamente entre - 30 y - 120 UH.
La TC también puede ser útil para reconocer el 30% de adenomas pobres en lípido (> de 10 UH) mediante el cálculo del porcentaje de lavado del contraste con la aplicación de fórmulas apropiadas para tal fin. El procedimiento, a cargo de un radiólogo familiarizado con el mismo, consiste en la realización de una TC con cortes cada 3 mm midiendo la atenuación (en UH) sin contraste y a los 60 segundos y 15 minutos postcontraste. Un lavado de contraste mayor al 50% sugiere fuertemente que la lesión es un adenoma ya que, con esta metodología la sensibilidad y especificidad son cercanas al 100%.
b.-Resonancia Magnética
La imagen producida por la RM refleja la densidad de pro-tones y la composición química del medio objeto de la evaluación. Debido a su mayor contenido de agua y a una mayor irrigación, las masas malignas presentan una alta intensidad de señal en T2 (se ven brillantes) y refuerzan más con el contraste. Sin embargo, existe superposición significativa, y una imagen hiperintensa en T2, pueden corresponder tanto a una lesión maligna como a un feocromocitoma, quiste o hematoma. En T1 las lesiones malignas suelen ser hipointensas comparadas con el hígado y las benignas isointensas con el parénquima hepático; no obstante existe también marcada superposición. Vale decir que la intensidad de señal por RM mediante técnica estándar no tiene más que un valor orientativo sobre la naturaleza de la masa en estudio y no ofrece ventajas sustanciales sobre la TC.
Basados en el principio de una diferente tasa de resonancia de los protones en la grasa y en el agua, se ha desarrollado una técnica que permite reconocer tejidos ricos en lípido. Esta técnica, llamada "desplazamiento químico", mide la intensidad de la señal en dos secuencias en T1: "en fase" y "fuera de fase" y los cambios observados en dicha intensidad de señal son empleados para el diagnóstico diferencial de las patologías adrenales benignas y malignas.
Es así, que las lesiones ricas en lípido (benignas), pierden intensidad de señal (se oscurecen), cuando son puestas "fuera de fase", mientras que aquellas lesiones con escaso contenido lipídico (probablemente malignas), no muestran cambios significativos.
Otra aplicación importante de la RM reside en que, al permitir cortes multiplanares, puede ser más útil que la TC para valorar la extensión de la lesión y la posible invasión de estructuras vecinas. Dado que en la secuencia de T1 es posible reconocer muy claramente la imagen de los vasos, es útil para diferenciar seudotumores producidos por aneurismas. Por último, la RM puede ser útil en el diagnóstico de un feocromocitoma dado que, característicamente, suelen producir una imagen muy brillante en T2.
c.- Otros Métodos:
-Ecografía: Es operador dependiente y la presencia de obesidad y gas son obstáculos para una adecuada visualización de las adrenales. No suele detectar tumores menores de 2 cm y su definición de imagen es muy inferior a la de TC y RM, razones por las que habitualmente no se recurre a la ecografía para la evaluación de los IA. Podría tener utilidad para diferenciar un quiste de un adenoma con bajo índice de atenuación por TAC y aunque es capaz de detectar cambios en el tamaño de tumores suprarrenales, no se la emplea habitualmente para estos fines.
-Tomografía por emisión de positrones (PET): Las células constitutivas de la mayor parte de los tumores malignos tiene un elevado consumo de glucosa, cosa que se puede poner de manifiesto utilizando PET con (18) F-2-fluoro-Ddesoxiglucosa (FDG). Varios estudios coinciden en que un nivel de captación de FDG por la lesión superior a la del parénquima hepático es compatible con el diagnóstico de malignidad; Los procesos inflamatorios y algunos adenomas pueden ser causa de falsos positivos, por lo que es conveniente cuantificar la captación ("standard uptake value"; SUV) expresándola ya sea como captación máxima por el tumor o en relación con la captación hepática. Recientemente, en 77 pacientes no oncológicos operados por presentar masas adrenales indeterminadas, el FDG-PET fue capaz de detectar carcinomas adrenales con una sensibilidad del 100% y una especificidad del 88%. Estos datos son de indudable interés y posiblemente anticipatorios de la aplicación futura de FDG-PET para la evaluación de pacientes seleccionados con IA de naturaleza indeterminada por otros procedimientos. Por el momento, por razones de costo, disponibilidad y, en especial, por la relativa carencia de datos, no recomendamos la inclusión del PET en el estudio habitual del IA.
3.- ¿Es una metástasis? ¿Búsqueda de primario? ¿Cómo? ¿Con que extensión?
Las glándulas suprarrenales son un sitio usual de metástasis de casi todas las neoplasias conocidas. Los cánceres que con más frecuencia dan metástasis a las adrenales son los de pulmón, riñón, mama, colon, melanoma y linfoma. Cuando nos hallamos frente a un IA (por definición en un paciente no oncológico) la posibilidad de una metástasis es remota, no justificándose habitualmente la realización de estudios dirigidos a evaluar un cáncer primitivo oculto. En estos casos trataremos de excluir en primer lugar la posibilidad de un CCA. En cambio, cuando un nódulo adrenal es descubierto en un paciente en proceso de estadificación de un cáncer extraadrenal primitivo, o con historia de cáncer, en el 50% de los casos será una metástasis imponiéndose su diferenciación de un adenoma para definir la conducta oncológica, siempre que no exista ya evidencia de enfermedad metastásica múltiple.
Las metástasis se caracterizan por ser bilaterales en el 65% de los casos y por tener un amplio rango de tamaño que oscila entre 1.4 y 12 cm; si bien suelen incrementar su diámetro con el tiempo, puede ocurrir que se reduzcan. Aunque suelen mostrar la irregularidad de la forma y la inhomogeneidad propia de los procesos malignos pueden ocasionalmente confundirse con adenomas e incluso pueden ser microscópicas sin deformar la imagen adrenal. Las imágenes de las lesiones benignas y malignas por RM en T2 muestran una superposición de 20% al 30%. Por consiguiente, utilizadas aplicando técnica estándar, tanto la TC como la RM carecen de especificidad suficiente para tomar decisiones y no permiten prescindir de la biopsia. En cambio, el empleo de técnicas sensibles para lípido (TC con medición de atenuación en UH o RM con desplazamiento químico) o la valoración del lavado de contraste por TC (ver tomografía computada), permiten identificar confiablemente a los adenomas o sugerir la posibilidad de una metástasis. El empleo de FDG-PET puede ser de utilidad cuando los resultados de los procedimientos anteriores no son concluyentes en un paciente con cáncer. Se ha comunicado una sensibilidad de 93 a 100% y una especificidad de 93 a 96% para diferenciar adenomas de metástasis. Una captación de FDG negativa tiene un alto valor predictivo negativo (VPN) (> 95%) para el diagnóstico de metástasis. En resumen, desde el punto de vista de las imágenes, podemos decir que: Las características de los "adenomas corticales" son:
· Generalmente menores de 4 cm.
· Tamaño estable en el tiempo
· Redondeados, de densidad homogénea, de bordes netos y ausencia de calcificaciones.
· Densidad tomográfica < 10 UH
· Lavado > 50% luego de 15 minutos de la inyección de contraste
· En RM con desplazamiento químico pérdida de intensidad "fuera de fase" Los características típicas de los "carcinomas adrenales" son:
· Mayores de 4 cm y unilaterales
· Crecimiento en el tiempo
· Forma irregular, no homogéneos con áreas de necrosis y calcificación
· Densidad > 20 UH en la TC no contrastada
· Lavado < 50% a los 15 minutos
· RM: hipointensos en T1 e hiperintensos en T2 sin caída de señal fuera de fase por desplazamiento químico
· Evidencia de invasión local y/o metástasis
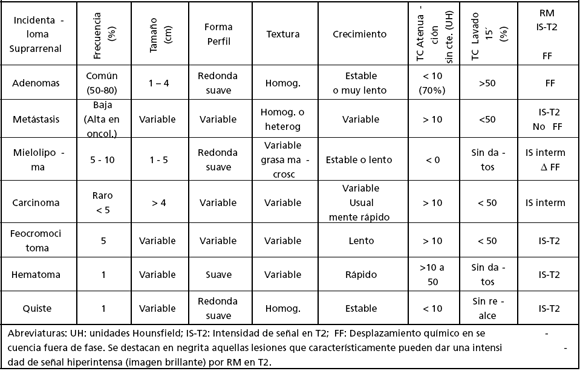
En la siguiente tabla se resume las características morfológicas y por imágenes de los IA según su etiología:
4.- ¿Qué lugar ocupa la biopsia?
En los pacientes con cáncer extraadrenal conocido, determinar si una lesión adrenal detectada por TC se trata o no de una metástasis puede ser crucial para definir la conducta oncológica. Mediante las nuevas técnicas por TC o RM, de alta especificidad, podemos definir la naturaleza benigna los nódulos adrenales en casi todos los casos, por lo que la biopsia guiada por TC o ecografía queda reservada para las situaciones en las que queden dudas.
La citología obtenida por aspiración con aguja fina, se considera que no distingue masas adrenales benignas de un carcinoma adrenal, pero lo que sí puede hacer es diferenciar un tumor de origen adrenal de una metástasis. No obstante su utilidad sigue siendo controvertida y existen estudios que muestran una muy buena sensibilidad y especificidad. Recientemente, Mazzaglia y col. analizaron 163 biopsias realizadas en pacientes con y sin un cáncer extra-adrenal previamente diagnosticado referidos para estudio de una masa adrenal. La sensibilidad para diagnóstico de CCA fue solamente de 50%, indicando un valor predictivo negativo de malignidad inaceptablemente bajo. En contraste, en 70% de los pacientes con cáncer extraadrenal diagnosticado o sospechado, la citología permitió detectar una metástasis. Los autores concluyen que la biopsia es de utilidad sólo en aquellos pacientes con un nódulo adrenal en los que se sospecha metástasis y que no es confiable para excluir malignidad en pacientes con IA.
Tabla 3: Características morfológicas y por imágenes de los IA
Las complicaciones ocurren con una frecuencia es de 2,8 al 4% e incluyen: hematoma adrenal, hematuria, neumotórax, absceso adrenal y pancreatitis.
Es importante descartar por laboratorio, la presencia de un feocromocitoma antes de realizar la punción biopsia para evitar la probabilidad del desarrollo de una crisis hipertensiva.
· Por lo tanto consideramos que la citología por punción con aguja fina está indicada solamente en:
· Pacientes portadores de cáncer extraadrenal, con imágenes sospechosas de malignidad en el contexto de una estadificación para determinar cam-bios en la conducta terapéutica.
· Pacientes con sospecha de cáncer primario desconocido e imagen adrenal sospechosa.
· Pacientes con IA bilateral, no funcionante, con fenotipo de imagen no adenoma.
5.- Evaluación funcional
· a.- ¿Es diferente en los hipertensos?
· b.- Cushing Subclínico: Criterios
El 10-15% de los IA son funcionantes. De estos, entre 6 y 9% hipersecretan cortisol, 3 a 5% catecolaminas y 1% aldosterona. En muy raras ocasiones puede haber también hipersecreción de esteroides sexuales. En la evaluación inicial de un IA, se deben tener en cuenta los datos de la anamnesis y del examen físico que puedan sugerir hipersecreción hormonal: síndrome de Cushing, feocromocitoma, hiperaldosteronismo primario (HAP) o hipersecreción de andrógenos o estrógenos. No obstante, la ausencia de estigmas clínicos reduce pero no descarta la posibilidad de un tumor funcionante. En efecto, fue observado en distintas series que en el 50% de los casos los pacientes con un feocromocitoma de hallazgo incidental eran normotensos, que un 40 a 70% de pacientes con HAP eran normokalémicos y que en la gran mayoría de los pacientes con hipersecreción de cortisol faltaban los signos típicos de hipercortisolismo, condición que se conoce como síndrome de Cushing subclínico (SCS). Por lo tanto, debido a su alta frecuencia, se recomienda que en todos los pacientes con IA sea realizada la evaluación funcional con el objeto de descartar SCS y feocromocitoma, y de investigar un HAP en los pacientes hipertensos. Los IA secretores de esteroides sexuales son raros y frecuentemente se presentan con las manifestaciones clínicas típicas (virilización en la mujer y feminización en el varón), por lo que su estudio estaría indicado sólo en presencia de sintomatología sugestiva.
La hiperplasia adrenal congénita no-clásica es otra causa infrecuente de IA, por lo que su estudio queda reservado sólo para pacientes con cuadro clínico sospechoso (ej: hiperandrogenismo) y especialmente cuando las masas son bilaterales. Un patrón mixto de secreción hormonal (por ej.: cortisol y andrógenos) es sugestiva de CCA.
Síndrome de Cushing subclínico:
Se define por la ausencia de signos clínicos de exceso de cortisol y al menos dos tests anormales durante la evaluación del eje hipotálamo-hipófiso-adrenal. No obstante faltar las manifestaciones clínicas típicas es posible observar otras consecuencias del exceso de la producción de cortisol como ser una mayor prevalencia de la intolerancia a la glucosa o diabetes mellitus, HTA, obesidad, dislipidemia y osteoporosis, con el consiguiente aumento del riesgo cardiovascular y de fracturas patológicas, aunque esto último no ha podido ser demostrado en todos los estudios. Para la evaluación del SCS no existe un único test que pueda identificar a todos los pacientes con anormalidades en la secreción de cortisol ("gold standard"), cosa que obedece fundamentalmente a la falta de sensibilidad y especificidad de las distintas pruebas de diagnóstico utilizadas. En un trabajo multicéntrico de Italia, donde se obtuvieron datos de 1004 pacientes con IA, se halló una prevalencia de SCS del 9.2%, ostentando el siguiente perfil hormonal:
- ACTH baja 79%
- Cortisol libre urinario (CLU) de 24 h elevado 75%
- Test de supresión con Dxm 1mg >5 mcg/dl 73%
- Falta de respuesta de ACTH a CRH 55%
- Alteración del ritmo circadiano 43%
En la conferencia de consenso del NIH realizada en 2002 el comité de expertos propuso para la detección de SCS en pacientes con IA el test de supresión con 1 mg de dexametasona (Dxm) a las 23 h con medición de cortisol en suero o plasma a las 8:00 h del día siguiente (test de Nu-gent). Empleando esta prueba establecieron que valores > 5 mcg/dl (E 90% - S 73%) definían a la hipersecreción autónoma de cortisol como clínicamente significativa, postura a la cual adhieren varios autores incluyendo a la Endocrine Society. Alternativamente, otros proponen valores de corte mas bajos: > 3 mcg/dl y > 1.8 mcg/dl. Al bajarse el valor de corte, aunque se aumenta la sensibilidad se reduce la especificidad, vale decir que se incrementa la tasa de falsos positivos. Para evitar estos resultados falsos positivos, algunos autores proponen usar para el test de supresión una dosis de Dxm mayor, de 2 a 3 mg.
Toda vez que se obtenga un resultado de la prueba de supresión sugestivo de hipercortisolismo, corresponderá confirmar el diagnóstico con otro estudio, aunque no ha sido claramente estipulado cuál sería la prueba más apropiada. Algunos de los tests propuestos son la medición de ACTH sérica, CLU de 24 hs, CLU de 24 h postsupresión durante 48 horas con Dxm 2 mg c/6 horas (Liddle clásico) - éste último se considera anormal si el CLU supera el límite inferior del rango normal de referencia -, evaluación del ritmo circadiano y/o test de supresión con 8 mg Dxm a las 23 h. El diagnóstico queda confirmado si 2 o más pruebas complementarias arrojan resultado positivo para hipercortisolismo.
Consideramos razonable que en aquellos pacientes con valores de cortisol postsupresión con Dxm entre 1.8 y 5.0 mcg/dl que tengan asociados trastornos potencialmente atribuibles a la secreción autónoma de glucocorticoides (HTA, intolerancia a la glucosa o DM, obesidad u osteoporosis), sea repetido el test de supresión con Dxm, ya sea con 1 mg o con dosis mayores (3 mg a las 23 h o 0.5 mg cada 6 h por 48 h); de este modo un valor no suprimido de cortisol indicaría de manera más confiable que se trata de un tumor hiperfuncionante.
En caso de que la secreción de cortisol sea normal diferentes autores sugieren, basándose en dos estudios que mostraban la posible progresión de IA inicialmente no funcionante a funcionante, repetir la evaluación hormonal una vez por año, durante 4 años. De todos modos, la propuesta sobre el seguimiento óptimo de los IA no es una cuestión cerrada y algunos autores advierten sobre los costos y riesgos de los estudios propuestos para el seguimiento de pacientes con un IA considerado inicialmente benigno y no funcionante.
Feocromocitoma
Un feocromocitoma puede ser encontrado en el 3-5% de los IA; dado que aproximadamente 50% de los mismos son clínicamente silentes, dada la trascendencia de su detección, debe investigarse de manera sistemática la posible presencia de un feocromocitoma en todos los pacientes con un IA, sean o no hipertensos.
Se recomienda la medición de catecolaminas y de ácido vainillin mandélico (AVM) en orina de 24 h y, si fuera factible, el dosaje de metanefrinas en orina de 24 h (S 95% - E 95%). Debido a la mayor posibilidad de resultados falsos positivos no se considera recomendable como estudio inicial la medición de metanefrinas libres en plasma (S 98% - E 89%) la que se reserva para pacientes con alta sospecha de feocromocitoma en quienes los otros tests han sido normales. La centellleografía con metayodo-bencilguanidina (MIBG), de alta especificad para un feocoromocitoma, está recomendado sólo cuando los valores de catecolaminas o metanefrinas sean extremadamente elevados, sugestivos de un feocromocitoma maligno y/o múltiple, o antes de la resección quirúrgica de una masa que no pudo ser correctamente caracterizada por la TC y/o con niveles de catecolaminas o metanefrinas "borderline" o variables en estudios repetidos.
Hiperaldosteronismo primario
El HAP ha sido encontrado en 0.0-1.8% de los IA según las distintas series, y hasta en un 4% de los pacientes con IA e HTA. En el estudio comunitario italiano su prevalencia fue de 1.6%, con el 100% de pacientes con algún grado de HTA y niveles de potasio sérico > 3,5 meq/l, por lo que resulta razonable su evaluación en todos los pacientes hipertensos independientemente de la kalemia. El estudio consiste en el dosaje simultáneo de aldosterona y actividad de renina plasmática (ARP) a las 10 h con 2 h de ambulación. Una relación aldosterona/ARP elevada (RAA) con una aldosterona mayor de 15 ng/dl es altamente sugestiva de HAP, debiendo ser confirmado el diagnóstico mediante un test de supresión (infusión salina o test de fludrocortisona). En el estudio multicéntrico reciente llevado a cabo por el Departamento de Suprarrenal de SAEM establecimos un valor de corte de la RAA ≥ 36.
Tumor productor de andrógenos y estrógenos
Son tumores muy raros, que habitualmente se manifiestan clínicamente por el desarrollo de virilización en la mujer (hirsutismo severo, calvicie con patrón masculino, clitorimegalia, atrofia mamaria, cambios en la voz y amenorrea) o feminización en el varón (ginecomastia, disfunción eréctil, hipotrofia testicular). No obstante podrían pasar inicialmente desapercibidos en los casos de tumores productores de testosterona en el varón. Su investigación debe quedar entonces restringida sólo a casos con sospecha clínica.
Hiperplasia Suprarrenal Congénita
La HAC no clásica es otra causa poco frecuente de IA, uni o bilateral, por lo que su estudio está recomendado en casos de sospecha clínica o de masas adrenales bilaterales y consiste en la demostración de niveles elevados de 17OH progesterona basales o tras el estímulo con 250 μg de ACTH. (Ver consenso sobre hiperplasia adrenal congénita)
Incidentaloma adrenal bilateral
Las lesiones bilaterales han sido observadas en alrededor del 10% de los IA. Éstas pueden corresponder a enfermedad metastásica, HAC, adenomas, linfomas, infecciones (tuberculosa o fúngica), hemorragia, síndrome de Cushing ACTH dependiente, feocromocitoma, enfermedades infiltrativas, amiloidosis e hiperplasia macronodular bilateral ACTH-independiente. En la evaluación funcional debemos considerar las mismas premisas que para lesiones unilaterales, agregando la evaluación para HAC. Se debe tener en cuenta la posibilidad de insuficiencia adrenal por destrucción glandular bilateral, por lo que sería prudente su evaluación. Dada la multiplicidad de las posibles etiologías de las masas adrenales bilaterales sin un franco predomino de los adenomas está justificada la indicación de punciónbiopsia para esclarecer la naturaleza de lesiones sin un fenotipo radiológico de adenoma.
6.- Conducta terapéutica: depende de:
a.- Tamaño 4, 5 ó 6 cm. VPP y VPN
b.- Funcionalidad
c.- Características de la imagen
d.- Todas ellas
La conducta terapéutica dependerá de la respuesta que se haya obtenido para los interrogantes siguientes: 1.- ¿estamos frente a un tumor funcionante o no funcionante? 2.¿Nos orientamos a pensar que se trata de una lesión benigna o maligna?
En relación con la primera cuestión, la funcionalidad se considera que constituye por sí misma una indicación de cirugía en el caso de un IA unilateral independientemente de su tamaño, y de otras características de la imagen adrenal; este criterio se aplica, sobre todo, en aquellos pacientes con signos clínicos, muchas veces sutiles, de exceso de glucocorticoides, mineralocorticoides, andrógenos, estrógenos o catecolaminas; sin embargo, en ausencia de manifestaciones clínicas y con la sola evidencia de hiperfunción bioquímica, la decisión no es tan lineal. Una situación particular plantean los feocromocitomas, tumores para los cuales debe siempre indicarse la cirugía incluso para aquellos clínicamente silentes, por el riesgo de crisis hipertensivas y complicaciones potencialmente letales.
En los pacientes con HAP atribuible a un adenoma unilateral, también se recomienda la extirpación quirúrgica, dado que, incluso en la minoría de casos en los que la hipertensión arterial pudiera no resolverse, existiría el beneficio de la reducción del impacto cardiovascular propio de los elevados niveles circulantes de aldosterona. En aquellos casos en los que la cirugía estuviera contraindicada o no fuera aceptada por el paciente, se puede recurrir al tratamiento médico con antagonistas de aldosterona (espironolactona, eplerenona), eventualmente con reposición de potasio.
En lo referente al SCS, se describe un espectro continuo del exceso de cortisol desde la normalidad hasta la autonomía completa, desconociéndose cuál es el grado de autonomía secretoria de cortisol de un adenoma suprarrenal a partir del cual cabe esperar morbilidad clínica. El SCS ha sido asociado con un incrementado riesgo cardiovascular y de fracturas osteoporóticas; sin embargo hasta el momento, no existe la certeza de una mayor morbimortalidad de pacientes con SCS como para establecer en todos los casos la superioridad de la conducta quirúrgica sobre la no quirúrgica. Además, si bien puede observarse mejoría de los parámetros clínicos en el período inmediato postadrenalectomía, no está establecido que dicha mejoría se mantenga a largo plazo. Una estrategia razonable sería considerar la cirugía en pacientes < 40 años con trastornos tales como un empeoramiento o aparición reciente de hipertensión arterial, diabetes, obesidad u osteoporosis que pudieran atribuirse a la presencia del SCS. Todos los pacientes que no fueran candidatos a la cirugía, deberían ser seguidos en forma estrecha y permanente.
Con respecto al segundo interrogante, el tamaño de la lesión ha sido tradicionalmente considerado como el mayor predictor de malignidad, según ya fue considerado. Se ha descripto que los incidentalomas < 4cm son adenomas en un 60% y carcinomas sólo un 2% mientras que las lesiones > 6 cm corresponden a carcinomas en un 25% y a adenomas en un 15%. Por lo tanto, las lesiones > 6 cm, con un 25% de probabilidad de ser un CCA, son extirpadas, en tanto que las < 4 cm con fenotipo de adenoma, son observadas. En pacientes con lesiones entre 4 y 6 cm, la decisión quirúrgica dependerá de la existencia o no de características de la imagen que orienten hacia posible malignidad ya descriptas (ver riesgo de carcinoma).
En el estudio multicéntrico llevado a cabo por el Departamento de Suprarrenal de SAEM sobre 77 pacientes con incidentaloma suprarrenal, establecimos un valor de corte de 5 cm que correspondió al de menor tamaño de los 4 carcinomas adrenocorticales, siendo el mayor de 20 cm. Debemos mencionar, además, que hallamos 9 feocromocitomas, de los cuales 4 eran silentes (catecolaminas y AVM urinarios normales); en estos últimos se indicó la cirugía a causa de una imagen por TAC sugestiva de malignidad. El CCA, representó el 5% de nuestra población de incidentalomas, siendo todos de mayor tamaño y 3/4 hiperfuncionantes (dos con patrón mixto de hipersecreción de cortisol y andrógenos y uno solamente con hipercortisolismo). Anteriormente, Herrera y col. habían establecido un límite de corte de 4 cm, con lo cual, para ellos, la relación benigno/maligno había sido de 8:1, lo que implica que la cirugía había sido innecesaria en una alta proporción de pacientes. Analizando el comportamiento estadístico en términos de S, E, VPP y VPN, de diferentes líneas de corte del diámetro correspondientes a una extensa serie de IA, (ver tabla 2) advertimos que el valor de 5 cm es el que con mayor exactitud permitió evaluar el potencial maligno al tiempo que evitar intervenciones innecesarias. Por lo tanto, resolvimos adoptar la línea de corte de 5 cm, recomendando que todos aquellos tumores de entre 3 y 5 cm con fenotipo benigno sean observados estrechamente. Como ya fuera señalado, recomendamos el criterio de tamaño no debe constituir el único elemento para decidir la conducta, habiendo de considerarse otras características de la lesión, particularmente para aquellos IA con 3 a 5 cm de diámetro (ver sección de imágenes). La decisión debe tomarse en cada caso en particular.
Teniendo en cuenta que el pronóstico de los CCA está estrechamente ligado al tamaño de la lesión al momento de su resección, a los fines del diagnóstico precoz y de no dejar evolucionar un posible CCA, debe considerarse la posibilidad quirúrgica incluso en los casos de lesiones pequeñas pero con características de malignidad (bordes irregulares, contenido heterogéneo, necrosis, etc.). En to-dos estos pacientes siempre debe excluirse un primero un feocromocitoma, el que puede compartir el fenotipo radiológico con los CCA.
En caso de indicarse la conducta quirúrgica, se plantea además cuál es la vía más apropiada. No hay estudios randomizados que demuestren la superioridad de los distintos abordajes. En general se recomienda la vía laparoscópica para los tumores menores de 10 cm, cuya imagen no sugiera un carcinoma. La preferencia por este abordaje se basa en su menor tiempo de hospitalización, menor sangrado y menor tasa de complicaciones que la cirugía por laparotomía, siempre que sea realizada por cirujanos entrenados; de lo contrario, se puede utilizar la lumbotomía. En caso de tumores mayores de 10 cm y/o con sospecha de CA está recomendada la cirugía abierta por vía anterior.
7.- Método de seguimiento:
a.- ¿Imágenes? ¿Cada cuánto? ¿Hasta cuándo?
b.- Funcionalidad
En el manejo de los pacientes con incidentaloma que no han sido sometidos a cirugía, es fundamental establecer los intervalos de control por imágenes y de estudios funcionales de modo de detectar cambios en las características del tumor o en el desarrollo de sobreproducción hormonal. La óptima frecuencia y duración del seguimiento son inciertos y los datos prospectivos, insuficientes. Las imágenes deben repetirse a los 6, 12 y 24 meses. Es aconsejable que ante un tumor con fenotipo radiológico sospechoso, el primer control radiológico sea realizado a los tres meses del estudio inicial.
Toda vez que se produzca crecimiento del tumor de más de un centímetro debería indicarse la cirugía. En series de incidentalomas adrenales seguido por un período de 4 años, 5 a 20% incrementaron su tamaño y 1,3 a 5,2% lo disminuyeron. Entre 20 pacientes de estas series, opera-dos a causa del aumento de tamaño tumoral, en uno fue diagnosticado un CCA. Un estudio longitudinal de más de 10 años reportó que el riesgo de desarrollar un CCA es extremadamente bajo.
El desarrollo de hipersecreción autónoma hormonal, puede ocurrir en hasta un 20% de pacientes durante el seguimiento, aunque es improbable en los casos de lesiones menores a 3 cm. La hipersecreción de cortisol es el trastorno más frecuente, en tanto que es raro de observar el desarrollo de sobreproducción de aldosterona y catecolaminas. Para los fines del seguimiento funcional recomendamos la realización anual, durante al menos 4 años, del test de supresión con Dxm 1 mg y la medición de catecolaminas y AVM urinarios ya que tras ese lapso es muy poco probable que se desarrolle hiperproducción hormonal.
Por todo lo expuesto nosotros recomendamos control radiológico y funcional anualmente durante 4 años, espaciándolo luego.
Consideraciones finales:
Frente a un IA sugerimos una evaluación clínica y estudios complementarios de imágenes y de laboratorio:
• Una imagen de tamaño y características estables es sugerente de benignidad.
• Si la lesión tiene menos de 4 cm, con fenotipo benigno (<10 UH en la TC precontraste y/o un lavado > de 50% postcontraste) es compatible con adenoma.
• Si la lesión es mayor de 4 cm con fenotipo indeterminado (con una densidad > de 10 UH en la TC precontraste y/o un lavado < 50% postcontraste) es compatible con malignidad.
• La evaluación funcional se realiza con: catecolaminas urinarias, AVM y/o metanefrinas urinarias y prueba de Nugent
• Si la prueba de Nugent es positiva realizar CLU, ACTH, ritmo circadiano, prueba de inhibición con Dxm 8 mg.
• En pacientes con HTA y/o hipokalemia solicitar aldosterona y ARP.
• En pacientes con un IA bilateral se debe descartar HAC y una posible insuficiencia suprarrenal mediante prueba de estímulo con ACTH.
• Si la lesión es funcionante se adopta conducta quirúrgica.
• En el SCC no está establecido el riesgo/beneficio de la cirugía
• En pacientes con tumores no funcionantes ≥ 5 cm se deberá indicar la cirugía.
• En pacientes con tumores no funcionantes < 5 cm con fenotipo de adenoma, se realiza seguimiento funcional y por imágenes a los 6 y 12 meses y luego anualmente hasta los 4 años, espaciándolo luego.
• Si la lesión es no funcionante entre 3 y 5 cm con fenotipo no compatible con adenoma, solicitar el primer control por imágenes a los 3 meses. Si la misma se mantiene estable, realizar un seguimiento estrecho.
• Los distintos criterios de tamaño son arbitrarios y no deben constituirse en el único elemento para decidir la conducta.
• El crecimiento o cambio de aspecto de cualquier lesión es indicativo de conducta quirúrgica.
• La biopsia queda reservada para aquellos pacientes:
a) portadores de cáncer extraadrenal, con imágenes sospechosas de malignidad o indeterminadas en el contexto de una estadificación
b) en pacientes con sospecha de cáncer primario desconocido e imagen adrenal sospechosa c) en lesiones bilaterales sin fenotipo de adenoma, en las que se haya descartado feocromocitoma, SCS o HAC.
1. Boland G, Blake M, y col. Incidental Adrenal Lesions: principles techniques an algorithm for imagin caracterisation. Radiology 249:756-775, 2008 [ Links ]
2 Cawood T, Hunt P, y col. Recommended evaluation of adrenal incidentalomas is costly, has high false positive rates and confers a risk of fatal cancer that is similar to the risk of the adrenal lesion becoming malignant; time for a re-think?. Eur J Endocrinol Accepted Preprint as Manuscript EJE-09-0234.13 May 2009 [ Links ]
3 Groussin L, Bonardel G, y col. 18 F-Fluorodesoxyglucose Positron Emission Tomography for the diagnosis of Adrenocortical Tumors: A Prospective Study in 77 Operated Patients. J Clin Endocrinol Metab 94:1713-1722, 2009 [ Links ]
4 Grumbach M, Biller B, y col. Management of the Clinically Inapparent Adrenal Mass ("Incidentaloma"). NIH Conference. Ann Int Med 138:424-429, 2003 [ Links ]
5 Herrera M, Grant C, y col. Incidentally discovered adrenal tumors : an institutional perspective. Surgery 110:1014-21, 1991 [ Links ]
6 Mansmann G, Lau J, y col. The Clinically Inapparent Adrenal Mass:Update in Diagnosis and Management. End Rev 25:309-340, 2004 [ Links ]
7 Mantero F. Subclinical Hormone Excess and Adrenal Incidentaloma. Meet The Professor. The Endocrine Society 91th Annual Meeting 43-49 , 2009 [ Links ]
8 Mantero F, Terzolo M, y col. A survey on Adrenal Incidentaloma in Italy. J Clin Endocrinol Metabol 85:2:637-44, 2000 [ Links ]
9 Mazzaglia P, Monchik J. Limited value of adrenal biopsy in the evaluation of adrenal neoplasm: a decade of experience. Arch Surg 144:465-470, 2009 [ Links ]
10 Tabarin A, Bardet S, y col. Exploration and management of adrenal incidentalomas. French Society of Endocrinology Consensus. Ann d`Endocrinol 69:487500, 2008 [ Links ]
11 Terzolo M, Bovio S, y col. Subclinical Cushing's Syndrome in Adrenal Incidentalomas. Endocrinol Metab Clin N Am, 34: 423-439, 2005 [ Links ]
12 Yampey J, Pardes, E, y col. Incidentaloma suprarrenal: estúdio multicéntrico de 77 casos. Rev Arg Endocrinol Metab 2:98-111, 2001 [ Links ]
13 Young WF, Jr. The incidentally Discovered Adrenal Mass N Eng J Med,356:610.2007 [ Links ]














