Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.47 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2010
TRABAJOS ORIGINALES
Medición de 25-hidroxivitamina D sérica: comparación de dos inmunoensayos
Measurement of 25-hydroxyvitamin D in serum: comparison of two immunoassays
Fuentes A.M., Fierro M.F., Medici M., Perharic C., Drnovsek M., Ercolano M., Glikman P.
División Endocrinología, Hospital J.M. Ramos Mejía, Gral. Urquiza 609, 1221 - CABA - Argentina
Correspondencia: Patricia Glikman. labendoramos@fibertel.com.ar. Unidad Determinaciones Hormonales. División Endocrinología. Hospital "J.M. Ramos Mejía". General Urquiza 609. 1221 CABA Argentina. +54-11-4932 1448.
Resumen
La concentración sérica de 25-hidroxivitamina D (25-OHD) es utilizada como indicador del estado nutricional de Vitamina D (VD). El método más utilizado para medirla es el RIA. El desarrollo reciente de métodos automatizados no radiactivos facilitaría la práctica diaria de laboratorio y el diagnóstico de necesidad de suplementación.
Objetivos: Comparar los datos de 25-OHD obtenidos usando un RIA y un método de quimioluminiscencia (QLIA) automatizado disponible en nuestro medio.
Materiales y métodos: Concentraciones de 25-OHD se midieron en suero de 45 pacientes: 8 hombres y 37 mujeres; 18 no suplementados y 27 suplementados con VD (n=5 con VD2 y n=22 con VD3). Las mediciones de 25-OHD se realizaron con un RIA y un QLIA automatizado (LIAISON), ambos DiaSorin. Se calcularon los coeficientes de variación intraensayo (CV intra) e interensayo (CV inter) para ambos métodos. Análisis estadístico: la comparación entre métodos se realizó con los programas Analyse-it y Med Calc Se consideró significativa una p<0.05.
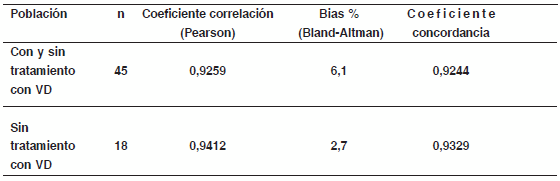
Resultados: Los CV% intra e inter fueron: para RIA menores de 10,6 y 19,9 vs QLIA menores de 8,0 y 13.2, respectivamente. En la población total y en el subgrupo no suplementado con VD los datos de RIA vs QLIA fueron: coeficiente de correlación de Pearson (0,9259 vs 0,9412), Bias%: (6.1 vs 2.7), coeficiente de concordancia (0,9244 vs 0,9329).
Conclusiones: 1) Ambas metodologías son adecuadas para mediciones de 25OHD, especialmente en casos no medicados con VD, 2) La tendencia hacia un mayor bias% observado en pacientes suplementados con VD no parecería ser atribuible a variabilidad metodológica, y sugeriría que la VD exógena o alguno de sus metabolitos interactuaría en forma diferente en la medición de 25-OHD por cada una de las metodologías utilizadas. Mayor número de casos es necesario a fin de confirmar esta hipótesis.
Los autores declaran no poseer conflictos de interés.
Palabras clave: Vitamina D; 25-hidroxivitamina D; Inmunoensayos
Abstract
Serum concentration of 25-hydroxyvitamin D (25OHD) is used as an indicator of nutritional status of Vitamin D (VD). The methodolgy more frequently used for its measurement is RIA. The recent development of automated non-radioactive methodologies would help the laboratory daily practice to diagnose the need for supplementation.
Objectives: To compare the data of 25-OHD obtained using a RIA and an automated chemiluminescence method (CLIA) automated available in our country.
Materials and methods: Concentrations of 25-OHD were measured in serum of 45 patients: 8 men and 37 women, 18 unsupplemented and 27 supplemented with VD (n=5 with VD2 and n=22 with VD3). For 25-OHD measurements we used a RIA and a QLIA under an automated platform (LIAISON), both DiaSorin. We calculated intra-assay (intra) and interassay (inter) coefficients of variation (CV%) for both methods. Statistical analysis: comparison between methods was conducted with Analyse-it and Med Calc softwares; p <0.05 was considered significant.
Results: The intra and inter CV% were below 19.9 and 10.6 for RIA vs 8.0 and 13.2 for CLIA, respectively. In the overall population and in the subgroup never supplemented with VD, data for RIA vs CLIA were: Pearson correlation coefficient (0.9259 vs 0.9412), Bias% (6.1 vs. 2.7), concordance coefficient (0.9244 vs 0.9329).
Conclusions: 1) Both methods are suitable for measurements of 25OHD, particularly in cases not medicated with VD, 2) The trend toward greater bias% observed in patients supplemented with VD does not appear to be attributable to methodological variability, and suggests that exogenous VD or its metabolites interact differently in the measurement of 25-OHD by each of the methodologies used. A higher number of cases is needed to confirm this hypothesis.
No financial conflicts of interest exist.
Key words: Vitamin D; 25-hydroxyvitamin D; Immunoassays
La hipovitaminosis D es frecuente debido a la baja ingesta de vitamina D asociada a una escasa exposición al sol(1-3) y es actualmente reconocida como una causa frecuente de hiperparatiroidismo secundario, con la consiguiente pérdida de masa ósea(4,5). La insuficiencia de vitamina D también ha sido vinculada a un riesgo incrementado y progresión de algunas enfermedades, como cáncer(6,7) hipertensión y diabetes, entre otras(8,9). La suplementación con Vitamina D (VD) sola(10) o asociada a calcio(11,12) lleva a la normalización de su status con una mejora en la calidad ósea y reducción en el riesgo de fractura. Muchos autores se han focalizado en definir el nivel sérico óptimo de 25-hidroxivitamina D (25OHD). Algunos de ellos consideran que 80 nmol/litro (32 ng/ml) sería un valor adecuado(13-15). Existen diferentes métodos para la medición sérica de 25OHD que incluyen radioinmunoensayos (RIA), cromatografía líquida de alta performance (HPLC), cromatografía líquida-espectrometría de masa (LC-MS) y más recientemente, los inmunoensayos automatizados. Si bien la LC-MS ha sido propuesta como el método "gold standard"'(16), es oneroso, laborioso y requiere personal especializado ampliamente experimentado, por lo cual no es accesible para la práctica diaria de los laboratorios clínicos(17). Existe una variabilidad importante en las mediciones de 25OHD realizadas por diferentes metodologías y por distintos laboratorios, lo que demuestra la necesidad imperiosa de contar con preparaciones de referencia adecuadas que permitan una apropiada estandarización de los ensayos(18). El ensayo más frecuentemente utilizado es el RIA. Algunos autores han propuesto que el RIA de 25OHD (DiaSorin) sea incorporado como un método de referencia secundaria(18,19). Sin embargo, dada la incrementada demanda de su determinación y la reciente disponibilidad de inmunoensayos automatizados, nuestro objetivo fue comparar los datos de 25OHD obtenidos mediante dos de los métodos actualmente disponibles en nuestro mercado: uno manual (RIA) y otro de quimioluminiscencia (QLIA) en plataforma automatizada.
MATERIALES Y MÉTODOS
Se emplearon muestras de suero de 45 pacientes (8 hombres y 37 mujeres, de los cuales 18 no habían recibido nunca suplemento con VD, 5 suplementados con ergocalciferol (VD2) y 22 con colecalciferol (VD3) y que cubrían un amplio rango de concentraciones de 25OHD. Las muestras fueron alicuotadas y guardadas en freezer a -20°C. Dentro de los 30 días de extraídas, fueron descongeladas y se midió 25-OHD por 2 métodos diferentes del mismo fabricante (DiaSorin): un RIA y un QLIA que se realiza en una plataforma automatizada (LIAISON). Según indica el fabricante, ambos métodos utilizan el mismo anticuerpo, que reconoce tanto 25OHD2 como 25OHD3(20). Las concentraciones de 25OHD se expresaron en ng/mL (factor de conversión a nmol/L= 2.496).
Principios de los ensayos empleados
Para el RIA se realiza un procedimiento de dos pasos. El primero consiste en extraer rápidamente, mediante acetonitrilo, la 25OHD y otros metabolitos hidroxilados presentes en el suero. Luego de esta etapa, la muestra se somete a un RIA de equilibrio, incubándola con el anticuerpo y el trazador 90 minutos a temperatura ambiente. La separación de las fases libre y unida al anticuerpo, se realiza por medio de una incubación con un segundo anticuerpo durante 20 minutos a temperatura ambiente.
Luego del agregado de un buffer para reducir las uniones no específicas, se procede a centrifugar las muestras y a medir la radioactividad en el precipitado mediante un contador gamma, para lo cual hemos utilizado un contador ANSR (Abbott Laboratories).
El QLIA LIAISON es un inmunoensayo competitivo directo quimioluminiscente. Durante la primera incubación la 25OHD es disociada de su proteína de unión por la acción de un buffer que contiene 10% de etanol y posteriormente es captada por el anticuerpo específico ubicado en la fase sólida (partículas magnéticas). Luego de 10 minutos es incorporado el trazador, que consiste en 25OHD conjugada con un derivado de isoluminol. Luego de una segunda incubación de 10 minutos, la fracción libre es eliminada mediante un ciclo de lavado después del cual se agregan los reactivos iniciadores, que dan lugar a una reacción quimioluminiscente rápida. La señal luminosa se mide en unidades lumínicas relativas con un fotomultiplicador y es inversamente proporcional a la concentración de 25OHD.
Análisis estadístico
Los datos fueron analizados usando el Programa estadístico Analyse-it y el software Med-Calc. Se consideró significativa una p<0.05.
RESULTADOS
Para el monitoreo de la precisión, se determinaron los coeficientes de variación % (CV) para dos niveles de concentración de 25OHD empleando los controles provistos por el fabricante. Los CV intraensayo (CV intra) se calcularon en base a 34 repeticiones para RIA y 10 para QLIA, mientras que los CV interensayo (CV inter) se calcularon promediando los datos de 40 ensayos sucesivos para RIA y 12 para QLIA. Los datos están expresados en la Tabla I. Como era esperable para un método automatizado, los CV intra e inter para QLIA fueron menores que los correspondientes a RIA. Adicionalmente, se emplearon como controles para ambas metodologías, los tres niveles del Liquichek Specialty Immunoassay Control (Bio-Rad Laboratories, USA), obteniéndose valores dentro de los reportados en el inserto para la metodología correspondiente. Los datos obtenidos para n=45 muestras medidas por RIA y QLIA pueden observarse en la Fig.1, habiéndose hallado una alta correlación entre ambos metodologías: R2= 0,8573, p<0.0001 (Fig. 2).
TABLA I. Coeficientes de variación de 25OHD medidos por RIA y QLIA.
Se emplearon para el cálculo los controles comerciales provistos por el fabricante

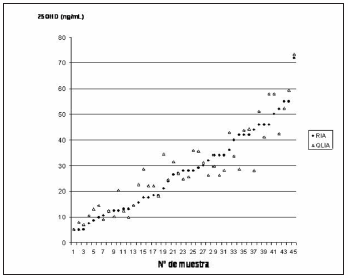
Figura 1. Datos de 25OHD obtenidos por RIA y QLIA (n=45).

Figura 2. Correlación entre los resultados de 25OHD medidos por RIA y QLIA. Los datos están expresados en ng/mL. La ecuación de la recta es y= 0,9129x + 3,3154, R2=0,8573, n=45 (p<0.0001)
Cuando se compararon ambos inmunoensayos (Fig. 3, Tabla II) pudo observarse una muy buena concordancia para la población total no diferenciada en base a tratamiento con VD (bias=6.1%, coeficiente de concordancia= 0.9244, n=45). Sin embargo, en aquellos casos de pacientes que nunca habían sido medicados con VD (Fig. 4, n=18), a pesar de haber una muy buena concordancia entre ambas metodologías (coeficiente de concordancia=0.9329, se verificó una tendencia hacia un menor bias (2.7%), aunque no significativamente diferente del correspondiente a la población total.

Figura 3. Gráfico de Bland -Altman para la comparación de los niveles de 25OHD medidos por RIA y QLIA en el grupo total de pacientes (n=45)

Figura 4. Gráfico de Bland -Altman para la comparación de los niveles de 25OHD medidos por RIA y QLIA en pacientes sin suplementar con VD. (n=18)
TABLA II. Comparación de ensayos de 25OHD medidos por RIA vs QLIA.
Datos comparando resultados del grupo total analizado (con y sin tratamiento con VD) y del subgrupo de pacientes sin tratamiento con VD
DISCUSIÓN
La determinación de 25OHD en el laboratorio ha aumentado significativamente durante la última década a causa de una creciente toma de conciencia de que la deficiencia de 25OHD es muy común y puede aumentar el riesgo de fractura y, posiblemente, el riesgo de cáncer(8,14,21-24).
El indicador más utilizado para la evaluación del status de la VD es la medición de 25OHD sérica, que puede derivar de la hidroxilación de la VD2 o la VD3. Por este motivo, la medición de la 25OHD total (25OHD2 y 25OHD3) es el test preferido para evaluar el status de la VD. Además, dado que tiene una vida media larga en suero, se considera que su concentración está en equilibrio con la VD almacenada en el cuerpo(25,29).
Existen diferencias importantes entre los resultados obtenidos con diferentes ensayos de 25OHD(25,30) dado que es un analito difícil de cuantificar debido a su hidrofobicidad y sus con-centraciones séricas relativamente bajas(25,29). Los métodos requieren de la extracción y concentración de la muestra antes de su análisis, aumentando la variabilidad del ensayo. Por otra parte, la detección por igual de la 25OHD2 y de la 25OHD3 representa un desafío, en particular para los ensayos basados en la unión a la proteína ligadora de la vitamina D, debido a que las proteínas de unión de diferentes especies muestran mayor afinidad por 25OHD3 que por 25OHD2(31).
En 2001, Nichols presentó un método de medición por quimioluminiscencia automatizado: el Advantage 25OHD(32), que no requiere una extracción previa del suero o plasma, ya que el mismo se añade directamente a una mezcla que contiene DBP humana, pero posteriormente se demostró que sobreestimaba la 25OHD total y no detectaba la 25OHD2 en varios de los pacientes tratados con VD2(33). Esto motivó una nota interna de Nichols a sus clientes alertando sobre esta situación y finalmente, en febrero de 2006 Nichols retiró este método del mercado. Ya en el año 2004, la Corporación DiaSorin había presentado un ensayo totalmente automatizado por quimioluminiscencia: el método 25OHD LIAISON(34). Este ensayo es muy similar al ensayo Advantage, con una diferencia importante: el ensayo Liaison utiliza un anticuerpo como agente de unión, a diferencia del sistema Advantage que recurre a la proteína ligadora de VD humana. El ensayo LIAISON de 25OHD es específico para 25OHD2 y 25OHD3, por lo que reporta la concentración de 25OHD total. Más recientemente ha sido introducido otro método automatizado para la determinación de 25OHD: el ensayo de Roche Diagnostics. Sin embargo, este análisis puede detectar sólo 25OHD3, por lo que será un producto viable sólo en los países en los que se utiliza como suplemento únicamente la VD3.
Ya sea que se trate de métodos manuales o automatizados, la falta de una adecuada estandarización para este ensayo es un factor importante que contribuye a las diferencias halladas. Como consecuencia de todos estos factores, sólo el 50-60% de los 100 laboratorios que participan en el sistema internacional de evaluación de la calidad para los metabolitos de la vitamina D (DEQAS), reúnen los criterios de funcionamiento adecuados, y los resultados obtenidos para la misma muestra pueden variar de 2-4 veces, incluso para el mismo ensayo, cuando se realiza en diferentes laboratorios(30).
En nuestro estudio hemos evaluado dos métodos del mismo fabricante (DiaSorin): un RIA y otro QLIA automatizado (LIAISON). Ambos mostraron una alta correlación y CV% semejantes a los publicados en la bibliografía(35, 36). La diferencia en el número de muestras y ensayos que hemos utilizado para determinar los CV inter e intraensayo para una y otra metodología se debió a que el RIA fue el método en uso en nuestro laboratorio durante varios años, mientras que el QLIA es de reciente incorporación en nuestro mercado.
En nuestra población total de pacientes encontramos un bias=6.1%, (2,2 nmol/L) con un coeficiente de concordancia= 0.9244, siendo estos datos semejantes a los referidos por Wagner y col. en una población de 390 pacientes(36).
Hemos hallado una correlación lineal altamente significativa entre ambas metodologías tanto en pacientes no suplementados como suplementados con VD (coeficientes de correlación de Pearson: 0,9412 vs. 0,9259 respectivamente). Sin embargo, nuestro hallazgo de una tendencia hacia un menor bias% en los casos de pacientes que nunca habían sido medicados con VD en relación a la población suplementada (2.7% vs. 6.1%, respectivamente), sugeriría que la VD exógena o alguno de sus metabolitos interactuaría en forma diferente con los reactivos utilizados por cada una de las metodologías de medición de la 25OHD. Esto fue sugerido también por otros autores que señalan como una posible causa de estas discrepancias la capacidad de los ensayos "para responder por igual a 25OHD2 y 25OHD3", además de la preparación de calibradores y la recuperación de la 25OHD de muestras enriquecidas, lo cual también puede ocasionar interferencias(37).
Otros autores han comparado las concentraciones de 25OHD obtenidas por los métodos RIA y LIAISON DiaSorin, hallando resultados controvertidos, ya que algunos encontraron lecturas en LIAISON inferiores a las del RIA en concentraciones bajas, pero mayores en altas concentraciones(38) mientras que otros(39) sugirieron que los resultados del método LIAISON DiaSorin tendían a arrojar datos superiores al RIA tanto en concentraciones altas como en bajas. Nuestros datos no muestran una tendencia definida de valores diferentes entre una y otra metodología en función de la concentración de 25OHD.
En conclusión: 1) Ambas metodologías son adecuadas para las mediciones de 25OHD, especialmente en casos no medicados con VD, 2) La tendencia hacia un mayor bias% observado en pacientes suplementados con VD no parecería ser atribuible a variabilidad metodológica, y sugeriría que la VD exógena o alguno de sus metabolitos interactuaría en forma diferente en la medición de 25-OHD por cada una de las metodologías utilizadas. Mayor número de casos es necesario para confirmar esta hipótesis.
Agradecimientos
Los autores agradecen a la Técnica de Laboratorio Mirna López por su colaboración en la separación y clasificación de las muestras.
1. Kudlacek S, Schneider B, Peterlik M, Leb G, Klaushofer K, Weber K, Woloszczuk W, Willvonseder R. Austrian Study Group on Normative Values of Bone Metabolism. Assessment of vitamin D and calcium status in healthy adult Austrians. Eur J Clin Invest 33: 323-31, 2003. [ Links ]
2. Gomez-Alonso C, Naves-Diaz ML, Fernandez-Martin JL, Diaz-Lopez JB, Fernandez-Coto MT, Cannata-Andia JB. Vitamin D status and secondary hyperparathyroidism: the importance of 25-hydroxyvitamin D cut-off levels. Kidney Int 63(Suppl 85): S44-S48, 2003. [ Links ]
3. McKenna MJ, Freaney R. Secondary hyperparathyroidism in the elderly: means to defining hypovitaminosis D. Osteoporos Int 8(Suppl 2): S3-S6, 1998 [ Links ]
4. LeBoff MS, Kohlmeier L, Hurwitz S, Franklin J, Wright J, Glowacki J. Occult vitamin D deficiency in postmenopausal US women with acute hip fracture. JAMA 281: 1505-11, 1999. [ Links ]
5. Parfitt AM. Osteomalacia and related disorders. En: Avioli LV, Krane SM, eds. Metabolic bone disease and clinically related disorders. 2nd ed. Philadelphia: W. B. Saunders Co.; 329-96, 1990. [ Links ]
6. Garland CF, Comstock GW; Garland FC, Helsing KJ, Shaw EK, Gorham ED. Seum25-hydroxyvitamin D and colon cancer: eight -year prospective study. Lancet 2: 1176-78, 1989. [ Links ]
7. Tretli S, Hernes E, Berg JP, Hestvik UE, Robsahm TE. Association between serum 25(OH)D and death from prostate cancer. Br. J. Cancer 100: 450-54, 2009. [ Links ]
8. Zittermann A. Vitamin D in preventive medicine: are we ignoring the evidence? Br J Nutr 89: 552-72, 2003. [ Links ]
9. Holick MF. Vitamin D: a millennium perspective. J Cell Biochem 88: 296-07, 2003. [ Links ]
10. Trivedi DP, Doll R, Khaw KT 2003. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ 326: 469-74, 2003. [ Links ]
11. Chapuy MC, Pamphile R, Paris E, Kempf C, Schlichting M, Arnaud S, Garnero P, Meunier PJ. Combined calcium and vitamin D3 supplementation in elderly women: confirmation of reversal of secondary hyperparathyroidism and hip fracture risk: the Decalyos II Study. Osteoporos Int 13: 257-64, 2002. [ Links ]
12. Chapuy MC, Arlot ME, Duboeuf F, Brun J, Crouzet B, Arnaud S, Delmas PD, Meunier PJ. Vitamin D3 and calcium to prevent hip fractures in elderly women. N Engl J Med 327: 1637-42, 1992. [ Links ]
13. Heaney RP. Vitamin D: how much do we need, and how much is too much Osteoporos Int 11: 553-55, 2000. [ Links ]
14. Chapuy MC, Preziosi P, Maamer M, Arnaud S, Galan P, Hercberg S, Meunier PJ. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int 7: 439-43, 1997. [ Links ]
15. Holick MF, Siris ES, Binkley N, Beard MK, Khan A, Katzer JT, Petruschke RA, Chen E, de Papp AE. Prevalence of Vitamin D inadequacy among postmenopausal North American women receiving osteoporosis therapy. J Clin Endocrinol Metab. 90 (6): 3215-24, 2005. [ Links ]
16. Hollis BW. Measuring 25-hydroxyvitamin D in a clinical environment: challenges and needs. Am J Clin Nutr 88: 507S-510S, 2008. [ Links ]
17. Turpeinen U, Hohenthal U, Stenman UH. Determination of 25-hydroxyvitamin D in serum by HPLC and immunoassay. Clin Chem 49: 1521-24, 2003. [ Links ]
18. Binkley N, Krueger D, Cowgill CS, Plum L, Lake E, Hansen KE, De Luca HF, Drezner MK. Assay variation confounds the diagnosis of hipovitaminosis D: A call for standardization. J. Clin. Endocrinol Metab 89: 3152-57, 2004. [ Links ]
19. Carter GD, Carter R, Jones J, Berry J. How Accurate Are Assays for 25-Hydroxyvitamin D? Data from the International Vitamin D External Quality Assessment Scheme. Clin Chem 50: 2195-97, 2004. [ Links ]
20. Banci M, Splendore R. Il dosaggio della Vitamina D con un método completamente automático, validazione analitica e clínica. Ligand Assay 12 (1): 49-54, 2007. [ Links ]
21. Vieth R Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr 69: 842-856, 1999. [ Links ]
22. Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 22: 477-501, 2001. [ Links ]
23. Fairfield KM, Fletcher RH Vitamins for chronic disease prevention in adults: scientific review. JAMA 287: 3116-26, 2002. [ Links ]
24. Hansen CM, Binderup L, Hamberg KJ, Carlberg C. Vitamin D and cancer: effects of 1,25(OH)2D3 and its analogs on growth control and tumorigenesis. Front Biosci 6: D820-848, 2001. [ Links ]
25. Hollis B. The determination of circulating 25-hydroxyvitamin D: no easy task. J Clin Endocrinol Metab 89: 3149-51, 2004. [ Links ]
26. Barragry JM, France MW, Corless D, Gupta SP, Switala S, Boucher BJ, Cohen RD. Intestinal cholecalciferol absorption in the elderly and in younger adults. Clin Sci Mol Med 55: 213-20, 1978. [ Links ]
27. Barragry JM, France MW, Boucher BJ, Cohen RD. Metabolism of intravenously administered cholecalciferol in man. Clin Endocrinol (Oxf) 11: 491-95, 1979. [ Links ]
28. Clemens TL, Zhou XY, Myles M, Endres D, Lindsay R. Serum vitamin D2 and vitamin D3 metabolite concentrations and absorption of vitamin D2 in elderly subjects. J Clin Endocrinol Metab 63: 656-60, 1986. [ Links ]
29. Zerwekh JE. The measurement of vitamin D: analytical aspects. Ann Clin Biochem 41: 272-81, 2004. [ Links ]
30. Carter GD, Carter CR, Gunter E, Jones J, Jones G, Makin HL, Sufi S Measurement of vitamin D metabolites: an international perspective on methodology and clinical interpretation. J Steroid Biochem Mol Biol 89-90: 467-71, 2004. [ Links ]
31. Horst RL, Reinhardt TA, Beitz DC, Littledike ET 1981 A sensitive competitive protein binding assay for vitamin D in plasma. Steroids 37:581-91, 1981 [ Links ]
32. Roth HJ, Zahn I, Alkier R, Schmidt H. Validation of the first automated chemiluminescence protein-binding assay for the detection of 25-hydroxycalciferol. Clin Lab. 47(7-8):357-65, 2001. [ Links ]
33. Leventis P, Garrison L, Sibley M, Peterson P, Egerton M, Levin G, Kiely P Underestimation of serum 25-hydroxyvitamin D by the Nichols Advantage Assay in patients receiving vitamin D replacement therapy. Clin Chem 50 (11):2195-7, 2004. [ Links ]
34. Ersfeld DL, Rao DS, Body JJ, y col. Analytical and clinical validation of the 25 OH vitamin D assay for the LIAISON automated analyzer. Clin Biochem 37: 867-74, 2004. [ Links ]
35. Carter GD 25-Hydroxivitamin D Assays: The Quest for Accuracy. Clinical Chemistry 55:7, 1300-02, 2009 [ Links ]
36. Wagner D, Hanwell HE, Vieth R. An evaluation of automated methods for measurement of serum 25-hydroxyvitamin D. Clin Biochem. 42(15):1549-56, 2009 [ Links ]
37. Lensmeyer G, Wiebe D, Binkley N, Drezner M. HPLC method for 25-hydroxyvitamin D measurement: comparison with contemporary assays. Clin Chem 52: 1120-26, 2006. [ Links ]
38. Souberbielle JC, Fayol V, Sault C, Lawson-Body E, Kahan A, Cormier C. Assay-Specific Decision Limits for Two New Automated Parathyroid Hormone and 25-Hydroxyvitamin D Assays. Clin Chem 51:395-00, 2005. [ Links ]
39. Fidaa I, Parmentier C, Boudou P. Divergence in Classification of 25-Hydroxyvitamin D Status with Respect to Immunoassays. Clin Chem 53: 363-64, 2007. [ Links ]














