Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista argentina de endocrinología y metabolismo
On-line version ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.50 no.2 Ciudad Autónoma de Buenos Aires Apr./July 2013
TRABAJOS ORIGINALES
Medición de la concentración plasmática de renina inmunoreactiva por un método automatizado y su correlación con la actividad de renina plasmática
Measurement of Immunoreactive Plasma Renin Concentration by an Automated Method and its Correlation with Plasma Renin Activity
Fierro MF 1, Lupi S1, Ilera V 1, Damilano S 2, Glikman P 1, Fenili C 2
1División Endocrinología Hospital J. M. Ramos Mejía. 2Laboratorio Bioanalítica
Contacto: Patricia Glikman. Unidad Laboratorio Endocrinológico, División Endocrinología Hospital J. M. Ramos Mejía. General Urquiza 609. 1221. Buenos Aires, Argentina.
labendoramos@fibertel.com.ar. Teléfono 011-4932-1448
cecifenili@hotmail.com. Teléfono: 011-1558834070.
Recibido: 17-07-2012
Aceptado: 05-11-2012
RESUMEN
Está en discusión si la concentración de renina inmunoreactiva (CR) aporta la misma información que la actividad de renina plasmática (ARP), pero sí está demostrado que el índice aldosteronemia / ARP (ARR) presenta un mayor valor predictivo positivo que las determinaciones aisladas de ARP y de aldosterona (A) para el tamizaje del hiperaldosteronismo primario (HAP). En un estudio experimental prospectivo de 227 muestras consecutivas correspondientes a individuos ambulatorios, ninguno de ellos con diagnóstico definitivo de HAP, nos propusimos evaluar 1) la correlación de los resultados de un método automatizado para medir CR (LIAISON, DiaSorin) respecto de los de ARP (RIA, DiaSorin). 2) La Concordancia Diagnóstica Presuntiva (CDP) entre los resultados bioquímicos de CR y ARP. 3) La correlación entre los resultados de los cocientes A/CR (ACR) y ARR. Resultados: Hemos observado una correlación altamente significativa (p < 0,0001) entre los resultados de ARP y CR, con una CDP del 83 % para concentraciones medias y altas de ARP. Sin embargo, la CDP es menor y no aceptable para concentraciones bajas de ARP (< 1,3 ng/mL/hora). La correlación entre los resultados de ACR y ARR fue altamente significativa (p < 0,0001). Conclusiones: El método de CR sería de utilidad para un estudio inicial del paciente con el fin de descartar HAP. Para CR bajas, debería recurrirse a la medición de ARP que presenta mayor sensibilidad para valores bajos de Renina (R). Estudios poblacionales con mayor número de individuos son necesarios para confirmar estos resultados preliminares.
Los autores no poseen conflictos de interés.
Palabras clave: Renina; Aldosterona; Índice aldosterona/renina; Métodos; Hiperaldosteronismo primario.
ABSTRACT
It is under discussion whether the results of immunoreactive renin concentration (RC) provide the same information as plasma renin activity (PRA). Additionally, it has been suggested that the determination of the aldosteronemia / PRA ratio (ARR) has a higher positive predictive value than isolated determinations of PRA and aldosterone (A) for screening of primary hyperaldosteronism (PHA). We designed an experimental and prospective study of 227 consecutive samples from ambulatory individuals, none of them with a definitive diagnosis of PHA. Our objective was to evaluate: 1) the correlation of results from an automated method to measure RC (LIAISON, DiaSorin) with respect to the PRA. (RIA, DiaSorin). 2) the presumptive diagnosis concordance (PDC) between the results of RC and PRA. 3) the correlation between the results of of the A/CR ratio (ACR) and ARR. Results: There is a high significant correlation (p < 0.0001) between results of PRA and RC, with a PDC = 83 % for regular and high PRA. However, PDC is low and not acceptable for low levels of PRA (< 1.3 ng/mL/hr). The correlation between the results of A/RC ratio (ACR) and ARR is highly significant (p < 0.0001). Conclusions: RC methodology would be useful for an initial study of a patient, in order to rule out PHA. For low levels of RC, would be necessary to additionally measure PRA, since it has higher sensitivity for low Renin (R) concentrations. Additional population studies with higher number of individuals will be necessary to confirm this preliminary data.
No financial conflicts of interest exists.
Key words: Renin; Aldosterone; Aldosterone/renin index; Methods; Primary hyperaldosteronism.
INTRODUCCIÓN
El sistema Renina(R)-Angiotensina(AT)-Aldosterona (A) es una cascada proteolítica asociada a un sistema de transducción de señales, que interviene en la regulación del balance de la presión arterial y el equilibrio hidrosalino.
La R circula en plasma en dos formas moleculares, una activa, la R propiamente dicha y otra inactiva, de mayor peso molecular, la prorenina (proR), cuyas proporciones relativas varían considerablemente de acuerdo con diferentes circunstancias fisiopatológicas(1). Es una proteasa que cataliza la escisión del dominio N-terminal del angiotensinógeno (proteína hepática), dando origen al decapéptido angiotensina I (AT I) y ésta por acción de la enzima convertidora de angiotensina (ECA), secretada fundamentalmente por las células endoteliales pulmonares y también renales, se convierte en angiotensina II (ATII), que presenta propiedades vasomotoras, antidiuréticas y de estímulo de la secreción de A.
La A se sintetiza en la zona glomerular de la corteza suprarrenal. Regula el metabolismo hidroelectrolítico, favoreciendo la reabsorción de sodio en el túbulo distal y colector renal y aumentando simultáneamente la absorción osmótica de agua, que aumenta el espacio extravascular, la presión arterial sistodiastólica y la secreción de potasio e hidrogeniones(2).
El hiperaldosteronismo primario (HAP) se ha definido como un síndrome constituido por un grupo de desórdenes que presentan una producción de A inapropiadamente alta, relativamente autónoma del sistema R-AT y no suprimible por una sobrecarga de sodio. Esta enfermedad está fuertemente asociada a hipertensión arterial (HTA), siendo considerada como uno de los problemas más importantes de salud pública en los países desarrollados y afectando a cerca de mil millones de personas a nivel mundial.
En las últimas décadas, se ha observado un marcado incremento en la prevalencia del HAP, alcanzando actualmente un 10 % y siendo de un 20 % cuando se trata de HTA resistente(3). En la actualidad se considera que es la causa más frecuente de HTA endocrinológica. Se ha demostrado que muchos pacientes a los que se les diagnostica HAP son normokalémicos. Por lo tanto, es imprescindible una adecuada pesquisa de esta patología. Su detección se incrementó mediante la implementación de una herramienta de laboratorio sensible y útil como es la relación Aldosterona / Actividad de Renina plasmática (ARR), descripta en 1981 por Hiramatsu y col.(4). Se ha demostrado que la determinación de este índice presenta un mayor valor predictivo positivo que las determinaciones aisladas de A y Actividad de Renina plasmática (ARP)(5,6). Dado que este índice es altamente dependiente del denominador, los ensayos de R deben ser lo suficientemente sensibles como para detectar valores bajos de actividad.
La determinación de la ARP por Radioinmunoensayo (RIA) es el método que más se ha empleado con propósitos diagnósticos y de seguimiento. Ante la falta de un método patrón ("gold standard") para la determinación de R, la medición de ARP, por su gran utilidad clínica, es usada como método de referencia. Este método es laborioso, complejo, consume mucho tiempo y por ser operador-dependiente, es difícil la comparación de resultados entre laboratorios.
Si bien la relación ARR ha sido utilizada exitosamente por muchos investigadores, no existe hasta la fecha un valor de corte consensuado, dada su variabilidad en los diferentes estudios. Cada grupo de trabajo debe definirlo en su población de acuerdo a la técnica de laboratorio utilizada. En un estudio efectuado en nuestro país, se ha fijado un valor de corte de normalidad para la ARR de 36, utilizando el método RIA (Diasorin) para medir ARP y RIA, DPC para medir A(7).
Actualmente contamos con un método automatizado quimioluminiscente que cuantifica la concentración de R inmunoreactiva (CR). Este inmunoensayo es más fácil de implementar en el laboratorio clínico, presenta mejor reproducibilidad y lleva menor tiempo de procesamiento que el que determina ARP. Mientras que ARP mide una actividad enzimática, el método CR determina la masa de R presente en la muestra. Dado que estos inmunoensayos no miden la misma variable, solo es posible evaluar la Concordancia Diagnóstica Presuntiva (CDP) de sus resultados. Dicho de otra manera, determinar si por ambas metodologías se llega al mismo diagnóstico bioquímico presuntivo.
En los últimos años diferentes grupos están realizando estudios de comparación entre CR y ARP. Algunos autores han comenzado a estudiar la eficiencia diagnóstica de la relación A/CR (ACR) para el HAP y a determinar el valor de corte.
En una población de individuos provenientes de la Ciudad Autónoma de Buenos Aires y de la provincia de Buenos Aires que concurre al Hospital Ramos Mejía, nos propusimos:
OBJETIVOS
1. Evaluar la correlación de los resultados de un método automatizado para medir CR respecto de los de ARP. 2. Determinar la CDP entre los resultados de CR y ARP. 3. Determinar la correlación entre los resultados de ACR y ARR.
MATERIALES Y MÉTODOS
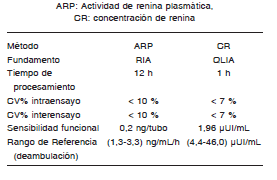
Se realizó un estudio experimental, prospectivo en 227 muestras consecutivas correspondientes a individuos ambulatorios que concurrieron a nuestro laboratorio entre el 12/5/11 y el 30/5/12 y que cubrían un amplio rango de valores de ARP. En ellas se midieron CR, ARP y A en paralelo. La toma de muestra se hizo por la mañana, entre las 8 y las 9 h(8), en condiciones de posdeambulación. La muestra se obtuvo en tubo con EDTA-K3 al 6 %, que inhibe la conversión de ATI en ATII, quelando cofactores necesarios para la actividad de la ECA(9). La centrifugación se realizó dentro de los 10 min luego de su obtención para asegurar la calidad de la determinación(10,11). Las muestras de plasma fueron alicuotadas y almacenadas inmediatamente a -20 °C hasta su procesamiento. Cada alícuota fue descongelada una única vez. Se midió A plasmática mediante un RIA competitivo en fase sólida (RIAzenco, Zentech), La determinación de ARP se realizó usando un RIA en fase sólida (DiaSorin) y la de CR mediante un método quimioluminiscente que utiliza una plataforma automatizada LIAISON, DiaSorin. Las características de cada ensayo, de acuerdo a las especificaciones de los respectivos fabricantes, están detalladas en la Tabla I. En nuestro laboratorio, los CV% interesensayo fueron < 7,8 % para CR y < 17,4 % para ARP. Los CV% intraensayo fueron < 6,2 % para CR y < del 7,0 % para ARP.
TABLA I. Características de los ensayos de acuerdo a las especificaciones de los fabricantes.
El método para determinar ARP consta de dos pasos: en el primero se realiza la generación de AT I "in vitro" por la acción enzimática de la R presente en la muestra del paciente. En un segundo paso, mediante un método RIA en fase sólida, se mide la AT I generada.
En primera instancia se realiza una mezcla de la muestra de plasma con buffer maleato (pH 6,0)-que optimiza la reacción enzimática- y luego se agrega fluoruro de fenilmetilsulfonilo-PMSF- con el fin de bloquear la conversión de AT I a AT II y evitar la degradación proteolítica durante la generación de AT I. Posteriormente la muestra se subdivide en 2 alícuotas: una se incuba para generar AT I durante 90 minutos a 37 °C y la otra permanece durante ese mismo tiempo en baño de hielo. Luego se cuantifica AT I en ambas alícuotas mediante un RIA que incluye una incubación a temperatura ambiente durante 3 h. La ARP de cada muestra se calcula en base a la diferencia entre los valores de AT I generada a 37 °C y el basal correspondiente (AT I a 4 °C).
La determinación cuantitativa de CR se realizó mediante un inmunoensayo de tipo sándwich con señal quimioluminiscente. Este método usa un anticuerpo monoclonal unido a partículas magnéticas (fase sólida) que reconoce tanto la R como la proR y otro anticuerpo monoclonal específico anti-R enlazado a un derivado del isoluminol que genera la señal de lectura. Según especificación del fabricante, este método está calibrado de modo que ARP=1 mg/mL/h corresponde a 8 µUI/mL de CR.
Se calcularon las relaciones A/ARP (ARR) y A/CR (ACR).
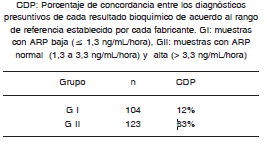
En base al límite inferior del rango de referencia del fabricante de ARP, la población estudiada (n = 227) se dividió en 2 subgrupos según los niveles de ARP observados: GI (n = 104): muestras con ARP baja (=1,3 ng/mL/hora) y GII (n = 123): muestras con ARP > 1,3 ng/mL/hora, es decir normales y altas.
Ninguno de los pacientes cuyas muestras fueron comparadas en este trabajo tiene aun diagnóstico confirmatorio de HAP. Los métodos CR y ARP miden parámetros diferentes pero sus resultados, sin embargo, evaluarían el mismo diagnóstico clínico presuntivo. Por este motivo, para poder compararlos, decidimos utilizar como parámetro la concordancia diagnóstica presuntiva (CDP), definida como la concordancia entre los diagnósticos presuntivos de cada resultado bioquímico de acuerdo al rango de referencia establecido por cada fabricante. Lo calculamos como el porcentaje de muestras que, en función de su dato de laboratorio, son igualmente clasificadas como dentro, debajo o por encima del rango de referencia establecido por cada fabricante de los dos métodos en evaluación. Hemos empleado para ello estos rangos de referencia debido a que no poseemos aún rangos propios de nuestro laboratorio para las metodologías en evaluación.
ESTADÍSTICA
Los datos apareados fueron analizados usando el método de correlación de Spearman (Programa estadístico MedCalc, versión 9.3)
RESULTADOS
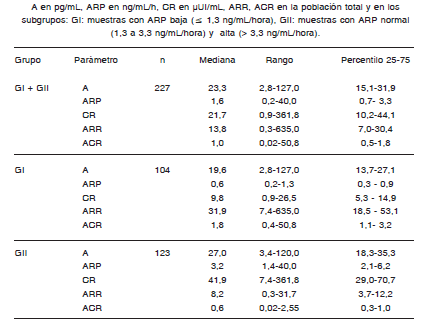
En la Tabla II se muestran los resultados de A, ARP, CR, ARR y ACR de la población total y de cada uno de los grupos estudiados.
TABLA II. Niveles circulantes de Aldosterona (A), Actividad de renina plasmática (ARP), concentración de renina (CR), relación A/ARP (ARR), relación A/CR (ACR).
En la Fig. 1a,b,c puede observarse una muy buena correlación entre los resultados de CR vs ARP, tanto en la población total (n = 227, Spearman r = 0,936, p < 0,0001) como en el GI (n = 104, Spearman r = 0,791, p < 0,0001) y en el GII (n = 123, Spearman r = 0,829, p < 0,0001). De igual manera, se observó una correlación altamente significativa entre ACR y ARR (n = 227, r Spearman = 0,9000, p < 0,0001) (Fig 2).
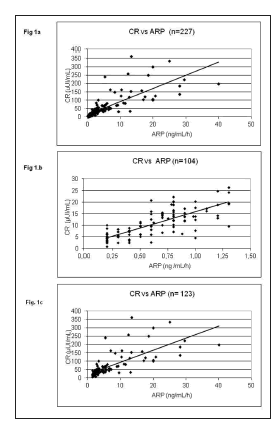
Fig. 1. Correlación entre Concentración de Renina (CR) y Actividad de Renina plasmática (ARP). Test de correlación de Spearman.
Fig 1a. CR (µUI/mL) vs. ARP (ng/mL/h) con datos correspondientes a la población total. (n = 227), r = 0,936, p < 0,0001.
Fig 1b. CR (µUI/mL) vs. ARP (ng/mL/h) con datos correspondientes al Grupo I: muestras con ARP baja (= 1,3 ng/mL/hora), n = 104, r = 0,791; p < 0,0001
Fig 1c. CR (µUI/mL) vs. ARP (ng/mL/h) con datos correspondientes al Grupo II: muestras con ARP normal (1,3 a 3,3 ng/mL/hora) y alta (> 3,3 ng/mL/hora), n = 123, r = 0,8929, p < 0,0001.
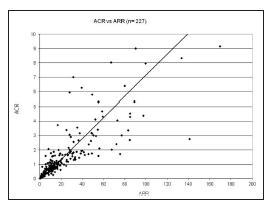
Figura 2. Relación aldosterona / concentración de renina (ACR) vs. aldosterona/ actividad de renina plasmática (ARR) en la población total. (n = 227), r = 0,900, p < 0,0001. Test de correlación de Spearman.
Los resultados obtenidos (Tabla III), indican una CDP del 83 % en el GII, pero fue del 12 % en el G I, grupo correspondiente a muestras con ARP = 1,3 ng/mL/h.
TABLA III. Concordancia Diagnóstica Presuntiva (CDP) entre los resultados bioquímicos de Actividad de Renina Plasmática (ARP) y Concentración de Renina (CR) según los valores de referencia de cada fabricante.
DISCUSIÓN
En este trabajo evaluamos la correlación y la CDP entre dos inmunoensayos: uno automatizado para medir CR y otro manual que mide ARP, en un grupo de muestras que abarcan un amplio rango de niveles de ARP.
Encontramos una correlación altamente significativa y una buena CDP (83 %) entre los resultados obtenidos con ARP y CR en muestras con ARP > 1,3 ng/mL/h (G II). Por lo tanto, ambos métodos serían igualmente útiles en este rango de ARP. Sin embargo, al analizar las muestras con baja ARP (GI), que son las concentraciones habitualmente halladas en el HAP, hemos encontrado una baja CDP (12 %) a pesar de la correlación altamente significativa.
Otros autores han realizado comparaciones de ARP y CR (IRMA), demostrando buena correlación(12,13), aunque también fue concentración-dependiente, con dificultades en la concordancia analítica en concentraciones bajas(14). Nuestros resultados concuerdan con éstos y confirman la limitación del método que mide CR para ser utilizado en el diagnóstico del HAP.
Ante la falta de un método patrón ("gold standard") para la determinación de R, la medición de ARP, por su gran utilidad clínica, ha sido ampliamente utilizada como método de referencia. Como ventaja de este método podemos resaltar la capacidad de ampliar el rango útil de trabajo, modificando los tiempos de generación de AT I para interpolar en la curva de calibración del RIA en mejores zonas de linealidad de acuerdo a la mayor o menor ARP que tenga la muestra.
Sin embargo, varias desventajas de este ensayo (muy laborioso, con incubaciones prolongadas, operador-dependiente, de difícil comparación interlaboratorios y dependiente de la concentración de angiotensinógeno) han planteado la necesidad del diseño de otra metodología como la medición de renina masa.
Existen marcadas diferencias en cuanto a los métodos para determinar CR y ARP. La ARP mide la actividad enzimática de la R, mientras que el inmunoensayo CR mide la concentración de R o R masa, por lo que detecta la inmunoreactividad de la R. La expresión de los resultados de ambos métodos se realiza en diferentes unidades, la ARP se expresa como ng de AT I generada "in vitro" por mililitro y por hora, expresando la actividad enzimática de la renina, mientras que la CR se expresa con unidades de masa por volumen (microU/mL). Por lo tanto, los resultados de estas dos metodologías solo se pueden comparar en cuanto a su CDP.
La medición de CR es automatizable, presenta mayor reproducibilidad intra e interlaboratorios y es aplicable al laboratorio de rutina clínica. Los resultados de CR están estandarizados frente al estándar Internacional de la OMS 68/356 (NIBSC), lo que garantiza la trazabilidad de los mismos, permitiendo la comparación de resultados entre distintos laboratorios, mientras que los de ARP no son trazables a ningún estándar(12).
Ambos inmunoensayos son susceptibles de sobreestimación de R debido a la crioactivación de proR, por lo que se requiere una cuidadosa manipulación en la etapa preanalítica.
En 2010 se publicó una Guía para la medición del índice A/R y el manejo del paciente con HAP, donde se incluyen las condiciones preanalíticas y analíticas para su determinación(15).
Para demostrar la complejidad de la situación actual, vale la pena mencionar que un importante grupo de trabajo(16), ha incorporado desde el año 2002, la determinación de CR (Liason; DiaSorín) como rutina para el estudio de HAP. Estos mismos autores han publicado recientemente(17) que han encontrado valores falsos positivos del índice A/R en mujeres normales estudiadas durante la fase luteal cuando utilizan CR y eso podría explicar la mayor incidencia de relaciones de A/R alteradas en mujeres hipertensas vs. hombres, lo cual obligaría a realizar innecesarios test de confirmación. Por ello, los autores sugieren que la ARP es preferible a la CR en la determinación del cociente, al menos al estudiar a las mujeres.
En resumen, en la población estudiada: 1. Se observa una correlación altamente significativa de los resultados de ARP y CR. 2. Si bien los resultados de ARP y CR tienen una elevada CDP, ésta es menor y no es aceptable en concentraciones bajas de R. 3. Se observa correlación altamente significativa entre los resultados de ACR y ARR.
CONCLUSIONES
La medición de CR sería útil para un estudio inicial del paciente con el fin de descartar HAP. En caso de que la CR sea baja, se debería recurrir adicionalmente a la medición de ARP ya que presenta mayor sensibilidad para valores bajos de R. Es necesario realizar estudios poblacionales con mayor número de individuos, incluyendo pacientes con diagnóstico clínico de HAP, para confirmar nuestros resultados preliminares.
Consideraciones éticas: se han tenido en cuenta los criterios aprobados por la comisión de ética del hospital Ramos Mejía GCBA, ajustándose a las normas éticas sobre experimentación humana de la Declaración de Helsinki de 1975 y revisado en 2000. Los pacientes han firmado consentimiento informado.
1. Sealey JE, Blumenfeld J, Laragh JH. Prorenin cryoactivation as a possible cause of normal renin levels in patients with primary aldosteronism. J Hypertens. 23:459-460, 2005 [ Links ]
2. Adrogué H. y Madias E. Sodium and Potassium in the Pathogenesis of Hypertension. N Engl J Med. 356(19):1966-1978, 2007 [ Links ]
3. Stowasser M. Update in Primary Aldosteronism. JCEM. 94(10):3623-3630, 2009 [ Links ]
4. Hiramatsu K, Yamada T, Yukimura Y; Komiya I, Ichikawa K, Ishihara M, Nagata H, Izumiyama T. A Screening Test to Identify Aldosterone-Producing Adenoma by Measuring Plasma Renin Activity: Results in Hypertensive Patients. Arch Intern Med. 141(12):1589-1593, 1981 [ Links ]
5. Sau-Cheung Tiu. The Use of Aldosterone-Renin Ratio as a Diagnostic Test for Primary Hyperaldosteronism and Its Test Characteristics under Different Conditions of Blood Sampling. JCEM.. 90(1):72-78, 2005 [ Links ]
6. Perschel F H, Schemer R, Seiler L; Reincke M, Deinum J, Maser-Gluth C, Mechelhoff D, Tauber R, Diederich S. Rapid Screening Test for Primary Hyperaldosteronism: Ratio of Plasma Aldosterone to Renin Concentration Determined by Fully Automated Chemiluminescence Immunoassays. Clin Chem. 50(9):1650-1655, 2004 [ Links ]
7. Pardes E, Belli S, Cornaló D, Contreras L, Costa L, Chervin R, Damilano S, Fenili C, Gómez RM, Leal Reyna M, Lupi S, Martínez M, Nofal MT, Ruibal G. Determinación del valor de corte de la relación aldosterona/actividad de renina plasmática para la detección de hiperaldosteronismo primario en hipertensión arterial esencial: estudio multicéntrico. Rev Argent Endocrinol Metab. 47(2):27-39, 2010 [ Links ]
8. Hurwitz S, Cohen RJ, Williams GH. Diurnal variation of aldosterone and plasma renin activity: timing relation to melatonin and cortisol and consistency after prolonged bed rest. J Appl Physiol. 96:1406-1414, 2004 [ Links ]
9. Eley J D, J H Kelly. Importance of incubation conditions in measuring renin activity. Clin Chem. 23(10):1944-1945. 1977 [ Links ]
10. Fyhrqulst F, Puutula L. Effect of Temperature on Plasma Renin Samples Clin Chem. 24(7):1202-1204, 1978 [ Links ]
11. Rodica L. E, Gordon H. W. Should Blood Samples for Assay of Plasma Renin Activity Be Chilled? Clin Chem. 24 (11): 2042-2043, 1978 [ Links ]
12. de Bruin RA, Bouhuizen A, Diederich S, Perschel FH, Boomsma F, Deinum J. Clin Chem. 50:2111-2116, 2004 [ Links ]
13. Deinum J, Derkx FH, Schalekamp MA. Improved immunoradiometric assay for plasma renin. Clin Chem. 45:847-854, 1999 [ Links ]
14. Hartman D, Sagnella G, Chesters C, MacGregor G. Direct Renin Assay and Plasma Renin Activity Assay Compared. Clin Chem. 50(11):2159-2161, 2004 [ Links ]
15. Arlt W. A detour guide to the Endocrine Society Clinical Practice Guideline on case detection, diagnosis and treatment of patients with primary aldosteronism Eur J Endocrinol. 162:435-438, 2010. [ Links ]
16. Pimenta E, Gordon RD, Ahmed AH, Cowley D, Robson D, Kogovsek C, Stowasser M. Unilateral adrenalectomy improves urinary protein excretion but does not abolish its relationship to sodium excretion in patients with aldosterone-producing Adenoma. J Hum Hypertension.25:592-599, 2011 [ Links ]
17. Ashraf H. Ahmed, Richard D. Gordon, Paul J. Taylor, Gregory Ward, Eduardo Pimenta, and Michael Stowasser. Are Women More at Risk of False-Positive Primary Aldosteronism Screening and Unnecessary Suppression Testing than Men. J Clin Endocrinol Metab. 96: E340-E346, 2011 [ Links ]














