Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.50 no.2 Ciudad Autónoma de Buenos Aires abr./jul. 2013
CABE-FASEN
Diagnóstico, prevención y tratamiento de la hipovitaminosis D
Coordinador:
Ariel Sánchez
Expertos:
Ariel Sánchez1, Beatriz Oliveri 2, José Luis Mansur 3, Erich Fradinger 4
Colaboradora:
Silvina Mastaglia5
1Centro de Endocrinología, Rosario. Expresidente de la Asociación Argentina de Osteología y Metabolismo Mineral
2Investigadora del Consejo Nacional de Ciencia y Técnica (CONICET); Laboratorio de Enfermedades Metabólicas Óseas, Instituto de Inmunología, Genética y Metabolismo (INIGEM), CONICET-UBA; a cargo de la Sección Osteopatías Médicas, Hospital de Clínicas, Universidad de Buenos Aires, 3Centro de Endocrinología y Osteoporosis, La Plata
4Laboratorio del Instituto de Investigaciones Metabólicas, Buenos Aires, 5Investigadora Asistente del CONICET, Laboratorio de Enfermedades Metabólicas Óseas, Instituto de Inmunología, Genética y Metabolismo (INIGEM), CONICET-UBA; y Médica de Planta Honoraria de la Sección Osteopatías Médicas, Hospital de Clínicas, Universidad de Buenos Aires.
ÍNDICE
Efectos de la vitamina D sobre el intestino
Efectos óseos de la vitamina D
Efectos renales de la vitamina D
EPIDEMIOLOGÍA Y PATOLOGÍA DE LA CARENCIA DE VITAMINA D
Estado nutricional de vitamina D en las diferentes etapas de la vida
Hipovitaminosis en embarazadas, neonatos, lactantes, niños y adolescentes
Efecto del déficit de vitamina D sobre la masa ósea pico
Hipovitaminosis en adultos jóvenes, mujeres posmenopáusicas y adultos mayores
GRUPOS DE RIESGO DE DÉFICIT VITAMÍNICO
Osteoporosis
Síndromes de malabsorción: enfermedad celíaca, enfermedad inflamatoria intestinal, enfermedad de Crohn, cirugía bariátrica, enteritis posradiación
Enfermedad renal crónica
Insuficiencia hepática
Hiperparatiroidismo
Fármacos: anticonvulsivantes, glucocorticoides, ketoconazol, colestiramina, algunos tratamientos del SIDA
Adultos mayores con historia personal de caídas o de fracturas no traumáticas
Obesidad
Enfermedades granulomatosas: sarcoidosis, tuberculosis, histoplasmosis, coccidiomicosis, beriliosis
Enfermedades neurológicas crónicas: parkinsonismos, esclerosis múltiple, etc.
Cáncer
Trasplantados
METODOLOGÍA DE DOSAJE DE 25HIDROXIVITAMINA D
ESQUEMAS DE ADMINISTRACIÓN DE VITAMINA D
Las recomendaciones hechas en la presente Guía se basan en el sistema GRADE usado por la Sociedad de Endocrinología de los Estados Unidos para sus consensos y guías de práctica clínica (Swiglo y col., J Clin Endocrinol Metab 2008; doi: 10.1210/jc.2007-1907).
La calidad de la evidencia se clasifica en cuatro niveles: ⊕ (muy baja), ⊕⊕(baja), ⊕⊕⊕ (moderada) y ⊕⊕⊕⊕ (alta).
Las recomendaciones que hace el panel de expertos redactores de esta Guía se dividen en "fuertes" y "débiles". Una recomendación fuerte (simbolizada con 1) significa que hay evidencia de alta calidad que la respalda y que la mayor parte de los pacientes implicados se beneficiarán con la indicación sugerida, con mínimos efectos indeseables. Una recomendación débil o sugerencia (simbolizada con 2) denota que no hay evidencia de alta calidad que la respalde, que la posibilidad de obtener un beneficio de la indicación es variable en los sujetos que la siguen, y que esta indicación deberá discutirse entre el médico y el paciente, evaluando los riesgos y beneficios.
La vitamina D tiene un amplio papel en la salud, y no solo en lo relacionado con el metabolismo óseo, sino también en lo referente al sistema cardiovascular, el desarrollo neurológico, la inmunomodulación, y la regulación del crecimiento celular. Hay más de 900 genes (aproximadamente 10 % del genoma) que responden a la vitamina D; 80 % de esos genes son estimulados por ella; los demás son inhibidos(1) .
La vitamina D3 o colecalciferol se genera en la piel de animales superiores por efecto de los rayos ultravioletas de la luz solar, a partir del 7-deshidrocolesterol. Un proceso parecido ocurre en los vegetales, generándose vitamina D2 o ergocalciferol. Hay pocos alimentos ricos en vitamina D (huevos, algunos pescados marinos como la sardina, el atún y la caballa, leche, manteca, hongos). Sea cual sea el origen de la vitamina D circulante (alimentario, cutáneo o farmacológico), durante su paso por hígado es hidroxilada en posición 25. La 25-hidroxivitamina D, 25OHD o calcidiol es el sustrato de la 1-alfa hidroxilasa, enzima normalmente operante en el parénquima renal, que lo convierte en 1-alfa,25-dihidroxivitamina D, o calcitriol, que es el metabolito activo. Esta reacción resulta estimulada por la hormona paratiroidea (PTH), los estrógenos y la hipofosfatemia, entre otros factores, y resulta inhibida por su propio producto-el calcitriol-, la calcitonina, el fósforo y el factor de crecimiento fibroblástico 23 (FGF-23).
El calcidiol se encuentra en suero en concentraciones del orden de ng/ml, mientras que el calcitriol está en cantidades de pg/ml. La proteína específicamente encargada del transporte plasmático de la vitamina D y sus metabolitos es la DBP (D Binding Protein), de la familia de la albúmina.Tiene alta capacidad (está saturada en menos del 5 % en humanos) y alta afinidad por la vitamina, particularmente por los metabolitos 25-hidroxilados(2). El metabolito que se usa para evaluar el estatus de vitamina D corporal es el calcidiol, sobre todo porque aun en situaciones de hipovitaminosis severa, el nivel de calcitriol se mantiene dentro del rango normal, a expensas de un hiperparatiroidismo secundario. La vitamina D se almacena en los tejidos, sobre todo en hígado, músculos y grasa. Las personas que se exponen poco al sol, las de piel oscura, las que habitan en latitudes elevadas y los obesos tienen mayor probabilidad de sufrir hipovitaminosis D.
El receptor de vitamina D (VDR) y la 1-alfa hidroxilasa están expresados en casi todos los tejidos humanos, lo que plantea la probabilidad de efectos autocrinos y paracrinos de la hormona D.
Nuevas técnicas de investigación de la transcripción amplían nuestro conocimiento sobre las acciones moleculares de la vitamina D. El VDR, activado por el ligando, forma en el núcleo celular un heterodímero con el receptor de retinoides (RXR) y se une directamente a regiones regulatorias del locus del gene blanco. El propio VDR y varias hidroxilasas (CYP24A1, CYP27B1) sontambién blancos directos del calcitriol. Después se sintetiza ARNm y siguen luego las cascadas metabólicas para dar la respuesta biológica específica que lleva a la regulación del metabolismo fosfocálcico, entre muchos otros efectos. Ciertos cambios en la expresión de algunos genes blanco pueden resultar en modificaciones biológicas del mensaje hormonal(1,2).
Efectos de la vitamina D sobre el intestino
El sistema endocrino de la vitamina D tiene como actor principal-como se dijo más arriba- a una hormona esteroide, el calcitriol. Éste actúa sobre el intestino por vía genómica y no genómica. La vía genómica sigue un mecanismo muy bien caracterizado, semejante al de otros esteroides. La hormona se liga a un receptor: una proteína intracelular de alta afinidad presente en el núcleo, que se activa por este fenómeno. El complejo hormona-receptor se liga a secuencias reguladoras del ADN nuclear y controla la transcripción de ARN mensajeros específicos que a su vez controlan la síntesis de proteínas específicas (osteocalcina, fosfatasa alcalina, colágeno, calbindina-D, etc.). La calbindina-D promueve la absorción de calcio por difusión facilitada: ligamiento del calcio en el borde en cepillo o superficie luminal (que se incorpora por canales de calcio o por transportadores) y traslado del complejo calbindina-Ca a la membrana basal donde transfiere el ión a una bomba Ca-ATPasa que lo vuelca a la circulación.
Mediante la modulación de la concentración citosólica de calcio y la síntesis de protooncogenes regula, además, la proliferación y diferenciación celular. Los efectos sobre la proliferación y diferenciación celular son evidentes 1-2 horas después de la unión de la hormona al receptor. El proceso de proliferación y diferenciación celular se manifiesta en el aumento del número y en el perfeccionamiento de las funciones de las células de las microvellosidades.
La vía no genómica modula un transporte rápido de calcio llamado "transcaltaquia", que involucra la apertura de canales de calcio operados por el voltaje a través de la membrana, transporte vesicular de calcio asociado a la polimerización de microtúbulos que marcan el camino tráfico entre membranas.
El receptor de membrana de la vía no genómica es peculiar porque es afín con el del citosol (ligan el mismo esteroide: 1,25-dihidroxivitamina D), pero con diferente dominio proteico para la unión.
Los procesos que participan en la absorción intestinal de calcio representan el primer paso para el ingreso del calcio de la dieta en los procesos fisiológicos que contribuyen tanto al crecimiento del esqueleto como a la homeostasis cálcica (intra y extracelular).
Existe una gran variación en la ingesta cálcica del hombre (300-1.500 mg/día) y en las necesidades fisiológicas a través de la vida (crecimiento, pubertad, gestación, lactancia, menopausia y envejecimiento). Para asegurar la recuperación del calcio de la dieta diaria, es necesario que el intestino se adapte simultáneamente a las modificaciones fisiológicas y a la dieta. Estos procesos son perfeccionados por el sistema endocrino del colecalciferol(1).
Efectos óseos de la vitamina D
El calcitriol posee una acción similar a la parathormona al estimular la resorción ósea rápidamente ante una disminución de la calcemia iónica, para favorecer su normalización.
La vitamina D favorece la cantidad y calidad ósea, por los siguientes mecanismos: disminuye la reabsorción ósea inducida por PTH y citokinas, aumenta la formación de hueso cortical, disminuye la porosidad cortical, aumenta el número y la función de osteoblastos a través de la inducción de factores de crecimiento óseo y de la síntesis de proteínas de la matriz ósea. Además, aumenta la resistencia ósea y promueve la reparación de microfracturas, ya que sostiene la vitalidad y la función de los osteocitos.
Los osteoblastos expresan 1-alfa hidroxilasa y también 24-hidroxilasa; en cultivos de osteoblastos, la 25OHD permite la síntesis de osteocalcina, y sus niveles se correlacionan con los de calcitriol en el medio. La carencia de vitamina D disminuye la función de los osteoblastos, induce osteoclastogénesis mediada por el RANKL generando pérdida ósea. La deficiencia de vitamina D también se asocia con un mayor cociente RANKL/osteoprotegerina, el mecanismo humoral responsable de la mayor actividad resortiva.
El calcitriol es un inductor del VDR y de la fosfolipasa C (PLC) en células óseas en cultivo. Muy recientemente se ha demostrado en cultivos de osteoclastos que la 25OHD induce la expresión de 1-alfa hidroxilasa, sustentando la hipótesis de que la vitamina D tiene un efecto modulador sobre estas células.
Otras células que reciben el mensaje de la vitamina D son los condrocitos, y es posible que entre las funciones de éstos esté controlar la actividad de los osteoclastos: los condrocitos estimulados por el calcitriol sintetizan el ligando del RANK (RANKL), y éste estimula la osteoclastogénesis. La inactivación del VDR en condrocitos reduce la expresión del FGF-23, hormona expresada habitualmente por los osteoblastos (son conocidos la acción fosfatúrica del FGF-23, capaz de inhibir un transportador tubular renal de fósforo, y su efecto reductor de la síntesis de calcitriol). Se puede concluir que la señalización a través del VDR en condrocitos es importante para la función de los osteoclastos y para una correcta homeostasis del fósforo.
Clásicamente se acepta que la hipovitaminosis D impide la normal mineralización del osteoide y lleva a una severa enfermedad ósea, la osteomalacia o el raquitismo (éste es la expresión clínica en niños del mismo proceso histopatológico conocido como osteomalacia)(2).
La administración oral de vitamina D2, D3, o calcidiol cura la osteomalacia en humanos y animales. La administración de calcitriol aumenta la absorción intestinal de calcio, pero no es suficiente para normalizar los defectos de mineralización.
Por otra parte, a mayor nivel de 25OHD en el suero de ratas raquíticas, menor la demora en la mineralización: la administración de pequeñas dosis de vitamina D resuelve la osteomalacia; se requieren niveles séricos > 10 ng/ml para su curación, pero los animales persisten con osteopenia. Se requieren niveles séricos altos (> 32 ng/ml) para mejorar la masa ósea. Hay buena correlación entre la concentración sérica de 25OHD y la masa ósea. Esto es consistente con las actuales recomendaciones de niveles de 25OHD sérico en seres humanos para prevenir fracturas. En ratones knock out para el VDR se produce osteomalacia. Si a estos ratones se les restaura el VDR humano en el duodeno por técnicas transgénicas, una dieta "de rescate" rica en Ca, P y vitamina D cura la osteomalacia. Por otro lado, la sobreexpresión del VDR en ratones transgénicos incrementa la masa ósea. En un modelo de rata castrada, el calcitriol acelera la reparación de la fractura femoral experimental y la remodelación ósea.
En animales se ha visto que a niveles muy altos (160 ng/ml) la 25OHD puede activar directamente el VDR, lo que permite explicar los cuadros de intoxicación por vitamina D que pueden verse en la clínica1.
Efectos renales de la vitamina D
El calcitriol potencia el efecto de la PTH para facilitar la reabsorción del calcio en el túbulo contorneado distal, aumentando el número de receptores a PTH y su afinidad por la hormona. Además la vitamina D aumenta la síntesis de calbindinas y del canal epitelial de calcio (TRPV5) en túbulos distales. Otro efecto renal importante del calcitriol es la inhibición de la 1 alfa-hidroxilasa y la inducción de la 24-hidroxilasa. Además, el calcitriol, estimulando el FGF-23, participa en la regulación del metabolismo del fósforo(3).
EPIDEMIOLOGÍA Y PATOLOGÍA DE LA CARENCIA DE VITAMINA D
La hipovitaminosis D, definida por los bajos niveles circulantes de 25OHD, está ampliamente distribuida mundialmente en los 6 continentes y representa un problema de Salud Pública(4). Las clasificaciones del estado nutricional de vitamina D han variado en los últimos años; la más aceptada en la actualidad es la que considera como niveles de deficiencia de vitamina D a aquellos de 25OHD <20 ng/ml(5), aclarando que muchos expertos opinan que los niveles óptimos de 25OHD son de =30 ng/ml, tanto por su acción sobre las acciones clásicas sobre el metabolismo mineral como sobre las no clásicas para la salud general(6).
Si bien los estudios no son siempre comparables, ya que han utilizado diferentes técnicas de medición de 25OHD, y éste es un metabolito cuya cuantificación puede presentar variaciones según el método utilizado (ver más adelante en esta Guía), se analizará la prevalencia del déficit de vitamina D en los diferentes grupos de edad, tanto a nivel mundial como nacional, basados en la clasificación mencionada.
1.0 Estado nutricional de vitamina D en las diferentes etapas de la vida
1.1 Hipovitaminosis en embarazadas y neonatos
- Evidencia
Se ha reportado que las embarazadas con un nivel menor de 15 ng/ml antes de la semana 22 tienen un riesgo de preeclampsia 5 veces mayor. A su vez, los neonatos de las mujeres con preeclampsia tuvieron un riesgo de tener niveles de 25OHD < 15 dos veces mayor. Así, el déficit de vitamina D materno puede ser un factor de riesgo independiente para preeclampsia(7). La suplementación con vitamina D en el embarazo temprano debe evaluarse para prevenirla(8).
Los niveles de 25OHD del feto durante todo el embarazo dependen de los niveles maternos de 25OHD, que pasan a través de la placenta a la circulación fetal. Se estima que 60-80 % del nivel circulante de 25OHD en el recién nacido es de origen materno. Al nacer el bebé, sus niveles circulantes son 60-80 % de los maternos. Considerando que la vida media de la 25OHD es aproximadamente de tres semanas, los niveles de 25OHD comienzan a disminuir en el primer mes de vida si los bebés no reciben suplementación con vitamina D o comienzan a sintetizar vitamina D por exposición a la radiación solar. En los últimos años se ha recomendado limitar en los menores de 6 meses la exposición solar por el posible daño cutáneo, con lo cual hay mayor riesgo de estado nutricional inadecuado en infantes. Los niños alimentados a pecho exclusivamente son un grupo de riesgo, ya que los niveles promedio en la leche materna son bajos: ~22 UI/l (rango 15-50 UI/l) incluso en madres que reciben dosis habituales de vitamina D(9).
A nivel mundial (Europa, Estados Unidos, Asia, Medio Oriente, Oceanía) se han publicado en neonatos altas prevalencias de deficiencia de vitamina D, incluso utilizando niveles de corte de 25OHD muy bajos, entre 10 y 15 ng/ml. Dichos porcentajes varían entre 10 y 96 %. Los mayores porcentajes se observaron en niños de piel oscura, especialmente de raza negra, en altas latitudes, nacidos en invierno o al final de primavera, hijos de madres con muy escasa exposición solar por razones religioso-culturales, con lactancia materna exclusiva y sin suplementación de vitamina D(10-16 ).
Estudios efectuados en la Argentina en sangre de cordón de neonatos de Ushuaia (55° S), Río Gallegos (52° S) y Buenos Aires (34° S) al final del invierno mostraron niveles promedio de 25OHD de 4,0 ± 2,7, 8,9 ± 5,7 y 11,3 ± 6,0 ng/ml, respectivamente. Niveles de 25OHD = 10 ng/ml se observaron en el 100 % de los neonatos de Ushuaia, 78 % de los de Río Gallegos y 28 % de los de Buenos Aires. Y niveles < 20 ng/ml en todos los de Ushuaia, 96 % de Río Gallegos y 90 % de los de Buenos Aires. En esos mismos grupos los niveles maternos oscilaron entre 6,3 ± 4,8, 15,1 ± 8,1 y 14,4 ± 8,7 ng/ml, con porcentajes de deficiencia severa (inferior a 10 ng/ml) en 81 % de las madres de Ushuaia, 30 % de las de Río Gallegos y el 43 % de las de Buenos Aires. La prevalencia de niveles de 25OHD < 20 ng/ml fue del 100 % en las madres de Ushuaia, 96 % en las de Río Gallegos y 81 % de las Buenos Aires(17,18). Un estudio posterior realizado en embarazadas de hospitales de la ciudad de Buenos Aires en primavera y verano mostró que el 88 % presentaban niveles de 25OHD < 30 ng/ml, siendo menores en aquellas mujeres de nivel socioeconómico bajo(19).
- Comentarios
Una reciente revisión Cochrane determina que no hay evidencia de ventajas para la mujer embarazada con la suplementación de vitamina D, salvo para la prevención de la preeclampsia en mujeres de riesgo (hipertensas, o que ya han tenido preeclampsia en embarazos previos)(20).
En los neonatos e infantes la deficiencia de vitamina D se asocia a menor crecimiento posnatal, mayor riesgo de hipocalcemia-que si es severa puede causar incluso síndrome convulsivo y cardiomiopatía-, y se ha asociado a mayor incidencia de otras patologías como diabetes tipo 1(21).
- Recomendaciones
Idealmente, habría que determinar el nivel sérico de 25OHD en mujeres embarazadas. De no ser posible, nosotros recomendamos suplementar con una dosis de 800-1.200 UI diarias. (1/⊕⊕⊕).
Actualmente se carece de evidencia que muestre la inocuidad de dosis altas intermitentes (100.000 UI o más) en mujeres embarazadas.
En neonatos e infantes de hasta 1 año de edad, la suplementación recomendada es de 400 UI diarias (1/⊕⊕⊕⊕).
1.2 Hipovitaminosis en niños y adolescentes
- Evidencia
Estudios en niños y adolescentes de EUA muestran también alta prevalencia de niveles inadecuados de vitamina D. En una población entre 6 y 21 años, el 68 % presentaba niveles inferiores a 30 ng/ml; la tasa ascendía al 94 % en la población de raza negra versus el 51 % en los de raza blanca. En otras ciudades norteamericanas más del 50 % de los adolescentes hispánicos y de raza negra y el 48 % de preadolescentes presentaban niveles inferiores a 20 ng/ml(22,23 ).
En países del Medio Oriente las adolescentes presentan déficit severo (25OHD menos de 10 ng/ml) con tasas del 70 % en Irán, 80 % en Arabia Saudita, y 32 % en el Líbano. Ésto se atribuye principalmente a los hábitos culturales, de casi nula exposición solar de la piel, a pesar de poseer excelente heliofanía(24).
En Asia, el 89 % de mujeres adolescentes de Pekín (China) presentaban niveles de 25OHD inferiores a 20 ng/ml, y en la India 73 % de las adolescentes tenían niveles inferiores a 12 ng/ml(25). En un reciente estudio que incluyó adolescentes de nueve países de Europa, 39 % presentaban niveles de 25OHD entre 30 y 20 ng/ml, 27 % entre 19 y 11 ng/ml y 15 % inferiores a 11 ng/ml(26).
En la Argentina se han estudiado principalmente los niños de ciudades del sur del país: Ushuaia, Río Gallegos y Comodoro Rivadavia (55° a 42° S), y se han comparado con zonas centrales como Buenos Aires y Tucumán. En niños sin suplementación con vitamina D en las ciudades nombradas, con edades entre 9 meses y 13 años, los niveles de 25OHD promedio al final del invierno oscilaron entre 9,3 y 14,1 ng/ml. En Buenos Aires (34° S) en niños de 4 a 16 años los niveles fueron 20,2 ng/ml y en Tucumán (26° S), en niños de 5 a 9 años, 19,6 ng/ml(17,27).
En los neonatos e infantes la deficiencia de vitamina D se asocia a menor crecimiento posnatal, mayor riesgo de hipocalcemia-que si es severa puede causar incluso síndrome convulsivo y cardiomiopatía-, y se ha asociado a mayor incidencia de otras patologías como diabetes tipo 1. En la niñez y adolescencia, hasta completar el crecimiento longitudinal y el cierre de los cartílagos de crecimiento, la deficiencia severa de vitamina D aumenta el riesgo de raquitismo carencial con las consecuentes deformidades óseas(2).
Las presentes recomendaciones de suplementación en niños y adolescentes coinciden con las de la Academia Americana de Pediatría(21).
- Recomendaciones
En niños mayores de 1 año y hasta la aparición de la pubertad, la dosis recomendada es de 600 UI diarias (1/⊕⊕⊕⊕).
Desde la pubertad y hasta los 18 años de edad, la dosis recomendada es de 800-1.000 UI diarias (1/⊕⊕⊕⊕).
El raquitismo carencial fue descripto por primera vez en el siglo XVII, observándose una alta incidencia con la revolución industrial, que disminuyó posteriormente mediante la suplementación con aceite de hígado de bacalao y el uso de alimentos suplementados. Sin embargo, en las últimas décadas han reaparecido casos de raquitismo tanto en Europa como en EUA, principalmente en grupos minoritarios de inmigrantes de piel oscura (de la India y del África) o en aquellas comunidades con dietas especiales (como las macrobióticas) o con hábitos de poca exposición al aire libre. En algunos países de Asia (Mongolia, Tibet), Medio Oriente, y en ciertas regiones de África (Etiopía, Yemen) se ha observado una elevada prevalencia (entre 27 y 70 %) de raquitismo carencial(24,28,29).
El cuadro clínico del raquitismo se caracteriza por retardo del crecimiento, ensanchamiento de las extremidades en zonas epifisiarias, con tumefacción dolorosa. A veces se observa aumento de tamaño de los cartílagos costales ("rosario raquítico"). Cuando inician la deambulación, los niños comienzan a deformar sus piernas. El laboratorio muestra típicamente calcemia y fosfatemia bajas y aumento de la tasa sérica de fosfatasa alcalina. La PTH sérica está elevada, y al dosar la 25OHD se comprueba la deficiencia de mayor o menor severidad. La excreción urinaria de calcio disminuye, y la reabsorción tubular de fósforo es baja. Estos cambios reflejan la baja absorción intestinal de calcio y fósforo, y el aumento de la reabsorción tubular de calcio por el hiperparatiroidismo secundario. Los signos radiológicos son deficiente mineralización epifisiaria, márgenes óseos difusos, menor contraste, y disminución de los centros de osificación. La histopatología ósea es característica (ver Osteomalacia, más adelante en esta sección)(30) .
Nota
Existen otras formas de raquitismo no nutricional, cuya fisiopatología y tratamiento son diferentes, y sobre las que no nos podemos extender acá.
En nuestro país se realizó un estudio para evaluar la incidencia de raquitismo nutricional en la Argentina, evaluando la incidencia por 1.000 internaciones por año en la población de 0 a 14 años. Se observó que desde el nacimiento a los 14 años la incidencia de raquitismo nutricional era 2,7 veces mayor en la Patagonia (39° a 54° S) comparada con la de la región pampeana y 8,5 veces mayor que la del resto del país, y que a medida que la latitud aumentaba en la Patagonia la incidencia también, siendo 15 veces mayor en Santa Cruz que en el noreste. Esta mayor incidencia no se daba solo en los niños del primer año de vida sino también en niños mayores, probablemente asociada a niveles bajos de 25OHD observados en todas las edades, como se ha descripto en el Sur del país(27).
Efecto del déficit de vitamina D sobre la masa ósea pico
El pico de masa ósea (masa ósea máxima alcanzada entre la 2ª y la 3ª décadas según el área esquelética evaluada) está determinado por factores endógenos (genéticos y hormonales) y exógenos (nutrición, actividad física). El efecto de la deficiencia de vitamina D y de la suplementación con vitamina D sobre la masa ósea ha sido escasamente estudiado a nivel mundial, y los resultados son controvertidos(31-35). Con el objeto de investigar el efecto de los bajos niveles invernales de vitamina D sobre la masa ósea pico, se estudió un grupo de población adulta joven (18-30 años y de ambos sexos) que habían vivido en Ushuaia (55° S) durante su infancia, adolescencia y juventud, y que nunca recibieron suplementos de vitamina D (excepto algunos en el primer año de vida). Ushuaia se caracteriza por poseer radiación ultravioleta baja, incluso nula durante el invierno(36). Este grupo se comparó con un grupo similar en edad y sexo de residentes habituales de Buenos Aires (34° S), que tiene todo el año una adecuada radiación ultravioleta. En ambas poblaciones se evaluó la densidad mineral ósea de radio distal y ultradistal y no se halló ninguna diferencia en la masa ósea entre ambas poblaciones. Sin embargo, se encontró una densidad mineral menor en radio distal en el subgrupo de mujeres de Ushuaia con ingesta habitual de calcio menor a 800 mg/día que en aquellas con ingesta mayor de 800 mg/día de calcio(37).
Las características clínicas de la osteomalacia en adultos incluyen dolor óseo, debilidad muscular, y dificultad para caminar. La debilidad muscular es a predominio proximal, y los pacientes no pueden incorporarse de una silla, subir escaleras, o quitarse una camiseta.
El laboratorio muestra las mismas características que en el raquitismo. Radiológicamente hay osteopenia y menor nitidez en los márgenes óseos. Puede haber pseudofracturas (zonas de Looser): trazos radiolúcidos a través de la placa cortical, a veces con márgenes escleróticos. En la centelleografía ósea estas zonas aparecen como puntos hipercaptantes. La densitometría ósea indica valores bajos; como la cantidad de osteoide no mineralizado es alta, al instituir el tratamiento pueden documentarse notables aumentos (hasta del 50 %) en la densidad mineral ósea. La histopatología, hecha en hueso sin descalcificar, muestra un volumen de osteoide no mineralizado superior al 5 %-y generalmente superior al 10 %- del volumen total del hueso; los osteoclastos son numerosos ya que la resorción está acelerada; cuando se hace marcación con tetraciclina las bandas dobles no son visibles o resultan difusas, de muy baja intensidad. Las fracturas por fragilidad son otra consecuencia clínica de la afección(30).
Nota
Existen otras formas de osteomalacia no nutricional, cuya fisiopatología y tratamiento son diferentes, y sobre las que no nos podemos extender acá.
1.3 Adultos jóvenes, mujeres posmenopáusicas y adultos mayores
1.3.1 Hipovitaminosis en adultos jóvenes
- Evidencia
Este grupo etario es uno de los menos estudiados en cuanto a prevalencia de deficiencia de vitamina D. El estudio NHANES III (1988-1994) evaluó varios grupos dentro de EUA. Uno de los evaluados fueron las mujeres de 15-49 años en edad reproductiva de diferentes razas, comunicando que el 42 % de las afroamericanas y el 4,2 % de las caucásicas tenían niveles inferiores a 15 ng/ml, siendo el color de la piel factor de riesgo para tener niveles disminuidos de vitamina D, además de residir en áreas urbanas y tener obesidad(38). En el NHANES 2002-2004, 29 % de los hombres de 20-49 años y 35 % de las mujeres presentaban niveles de 25OHD < 20 ng/ml, y 73 % de los hombres y mujeres niveles < 30 ng/ml, valores inferiores a los observados en el NHANES III 1988-1994, quizás por la tendencia a mayor uso de protectores solares, menor actividad al aire libre y mayor índice de masa corporal(39).
En Buenos Aires se evaluó un grupo de jóvenes de edad promedio 29,8 años, que al final del invierno presentaban niveles promedio de 25OHD de 17,1 ng/ml (70,6 % < 20 ng/ml) y en verano 32,5 ng/ml, con solo el 15,6 % por debajo de 20 ng/ml(40). En un grupo de hombres y mujeres de 24 a 52 años de Buenos Aires los niveles invernales eran de 20,7 ng/ml (63 % con < 20 ng/ml)(41).
- Recomendaciones
Recomendamos suplementar con dosis de 1.000-2.000 UI diarias (1/⊕⊕⊕⊕).
1.3.2 Hipovitaminosis en mujeres posmenopáusicas
- Evidencia
Un estudio multicéntrico que incluyó 2.589 mujeres posmenopáusicas de 18 países de 5 continentes, la mayoría de ellas con fracturas (50 %) o T-score inferior a -2,5, halló en promedio niveles inadecuados (= 30 ng/ml) en el 59 %, con un rango entre 50,8 y 80,6 %, correspondiendo este último a mujeres de Medio Oriente, debido principalmente a que a pesar de tener buena radiación UV, por razones culturales no se exponen al sol(42). Los factores de riesgo con mayor asociación con niveles inadecuados eran, entre otros: raza asiática, índice de masa corporal mayor de 30 kg/m2, vivir en latitudes lejanas del Ecuador, tener una salud delicada, no haber conversado previamente con su médico la importancia de la suplementación con vitamina D, poseer piel más oscura, no haber recibido suplementación con vitamina D o tenerla en dosis menores a 400 UI diarias. En Asia y Medio Oriente se han publicado niveles promedio muy bajos de 25OHD (4-12 ng/ml) y en África los menores niveles corresponden a los países con mayoría de población musulmana (Argelia, Túnez, Etiopía), principalmente en mujeres que utilizan velos, o cobertura total (niqab).
En la Argentina diferentes trabajos-principalmente en mujeres que consultaban en servicios especializados para evaluar la presencia de osteoporosis- se estudiaron los niveles de 25OHD, reportándose en mujeres posmenopáusicas de 40-59 años niveles inferiores a 20 ng/ml en 35-43 % al final del invierno y en 13-21 % al final del verano(43) En diferentes grupos de mujeres de 60 años de edad promedio con densidad ósea normal o disminuida, los niveles al final del invierno estaban entre 12 y 15 ng/ml(44).
Un estudio reciente determinó que hay una curva dosis/respuesta en mujeres posmenopáusicas suplementadas con vitamina D3. Una dosis diaria de 800 UI pudo elevar el nivel sérico de 25OHD a más de 20 ng/ml en 97 % de las pacientes(45).
- Recomendaciones
Recomendamos suplementar con dosis de 1.000-2.000 UI diarias (1/⊕⊕⊕⊕).
1.3.3 Hipovitaminosis en adultos mayores
- Evidencia
Con el envejecimiento se producen varias alteraciones en el metabolismo de la vitamina D y el metabolismo mineral en general. Existe una disminución de la formación de vitamina D por disminución del sustrato en la piel. Se ha demostrado que ante el mismo estímulo de radiación ultravioleta el individuo mayor (entre 62-80 años) produce aproximadamente un 73 % menos de vitamina D que el adulto joven, lo cual sumado a menor exposición a la radiación solar por disminución de la movilidad, y aún más por internación en geriátricos, lleva a tener menores niveles circulantes de 25OHD, con una alta incidencia de insuficiencia/deficiencia de vitamina D. Paralelamente los niveles del metabolito activo, calcitriol, disminuyen, así como el número de los receptores intestinales de vitamina D, por lo que cae la absorción de calcio. Los niveles de PTH aumentan en respuesta a estos cambios, lo mismo que la resorción ósea, causando una disminución de la masa ósea. La insuficiencia/deficiencia tiene efecto sobre la función muscular observándose mayor número de caídas, las cuales favorecen (junto con los factores previamente nombrados) las fracturas osteoporóticas(2).
La prevalencia de deficiencia de vitamina D en ancianos varía entre 40 y 90 % en Europa (Euronut-Seneca), siendo mayor en países con menor latitud que los escandinavos, probablemente por la mayor ingesta de vitamina D en estos últimos, tanto por la fortificación de sus alimentos como por la ingesta de pescados grasos. También se ha descrito alta incidencia de deficiencia de vitamina D e hiperparatiroidismo secundario en pacientes con fracturas osteoporóticas(46,47).
Un estudio realizado por la Asociación Argentina de Osteología y Metabolismo Mineral en mayores ambulatorios sanos de 65 años de las zonas Norte, Central y Sur del país mostraron porcentajes de deficiencia de 25OHD (< 20 ng/ml) en 52, 64 y 87 %, respectivamente; y niveles inadecuados (< 30 ng/ml) en 82, 90 y 98 %, respectivamente(48). En la ciudad de Buenos Aires los que tenían menores niveles de 25OHD eran los de menor ingreso, menor ingesta de alimentos ricos en vitamina D y menor exposición solar(49).
Otros estudios en ancianos ambulatorios de edad promedio 71 años, hallaron niveles de 25OHD de 17 ng/ml en invierno, con < 20 ng/ml en el 65 %; en verano los niveles promediaron 28,6 ng/ml, con < 20 ng/ml en 47 %. Los institucionalizados mostraron niveles promedio muy bajos de 25OHD: 7-12 ng/ml en invierno y 14 ng/ml en verano(50,51).
- Recomendaciones
Recomendamos suplementar con dosis de 1.000-2.000 UI diarias (1/⊕⊕⊕⊕).
2.0 GRUPOS CON RIESGO DE PRESENTAR DÉFICIT DE VITAMINA D
La "Guía de Evaluación, Tratamiento y Prevención de la deficiencia de Vitamina D" elaborada por los expertos designados por la Endocrine Societyy publicada en 2011 establece que no hay evidencia que justifique un tamizaje masivo de la población buscando el déficit(6). Agregan que este debería investigarse en los grupos de riesgo. Sin duda, la lista de enfermedades y fármacos asociados a hipovitaminosis D se fue incrementando en las últimas décadas:
1) Osteoporosis
2) Síndromes de malabsorción: enfermedad celíaca, enfermedad inflamatoria intestinal, enfermedad de Crohn, cirugía bariátrica, enteritis posradiación(42)
3) Enfermedad renal crónica(53,54)
4) Insuficiencia hepática
5) Hiperparatiroidismo
6) Fármacos: anticonvulsivantes, glucocorticoides, ketoconazol, colestiramina, algunos tratamientos del SIDA
7) Adultos mayores con historia personal de caídas o de fracturas no traumáticas
8) Obesidad (definida por IMC > 30 kg/m2)
9) Enfermedades granulomatosas, linfomas
10) Enfermedades neurológicas crónicas: parkinsonismos, esclerosis múltiple, etc.
11) Cáncer
12) Trasplantados
Osteoporosis
Durante muchos años se ha medicado a los pacientes osteoporóticos sin realizar dosajes de vitamina D sérica, con las dosis que teóricamente estaban indicadas. El aporte de calcio en la dieta (o mediante suplementos farmacológicos) para asegurar 1-1,5 g/día de ese elemento, y la suplementación con vitamina D (800-1.000 UI/día) es la recomendación corriente para pacientes con osteopenia u osteoporosis que deban iniciar o continuar un programa terapéutico o preventivo(56,57).
Sin embargo, la comprobación de que pacientes en teoría bien tratados tienen niveles de 25OHD inferiores a 30 ng/ml hace pensar que si el nivel basal previo es muy bajo, nunca se llegará al nivel objetivo con las dosis "usuales" de tratamiento. Por lo tanto, resulta conveniente el dosaje en estos pacientes, para permitir la adecuación de la dosis.
Recordemos que los pacientes con osteoporosis posmenopáusica y senil son un grupo de riesgo: en ellos la deficiencia de vitamina D es común(58 ), y debería procurarse su diagnóstico y tratamiento adecuado(2,59-61).
La suplementación con vitamina D contribuye a atenuar el hiperparatiroidismo secundario, tan frecuente en ancianos. La administración de vitamina D en ancianos disminuye la frecuencia de caídas entre 13 y 22 %(62). Se ha encontrado una asociación positiva entre los niveles de calcidiol y la función muscular (velocidad de marcha, rapidez en incorporarse desde la posición sentada, mejoría del balance corporal y de la función de los miembros inferiores)(63).
La recomendación actual es favorable a la inclusión de vitamina D en cualquier plan terapéutico antiosteoporótico, y sobre todo en pacientes de edad avanzada(64,65).
Insuficiencia hepática crónica
Los niveles de 25OHD pueden ser bajos por alteración de su síntesis, pero sería necesario un compromiso severo de su función para que ésto ocurra. La enfermedad hepática puede también producir disminución de su absorción por alteración de la producción de ácidos biliares o por edema intestinal asociado a la hipertensión portal. Además, la hipovitaminosis D y la baja masa ósea son complicaciones conocidas de cualquier hepatopatía "colestásica" que altere la producción o el flujo de bilis (la cirrosis biliar primaria es el principal ejemplo)(55). Un estudio de 118 pacientes con enfermedad hepática mostró una prevalencia de hipovitaminosis del 92 % en pacientes con hepatitis C (la mitad con cirrosis)(66,67).
Se ha reportado que muy bajos niveles de vitamina D pueden aumentar los efectos colaterales del interferón, que se utiliza como tratamiento en algunos casos; incluso existen reportes de que pacientes con hepatitis C responden peor al tratamiento con interferón si existe déficit de vitamina D(68).
Antiepilépticos
Los anticonvulsivantes fenitoína, fenobarbital y primidona tienen una clara asociación con densidad mineral ósea disminuida; la carbamazepina y el valproato tienen un efecto similar. Todas estas drogas pueden inducir osteomalacia posiblemente por inducción del catabolismo de la vitamina D(69).
Glucocorticoides
Un reciente estudio comparó el nivel de 25OHD entre usuarios de corticoides y no usuarios, encontrando un nivel menor de 10 ng/ml en 11 % de los usuarios frente a un 5 % de los no usuarios(70).
Obesidad
La grasa corporal "secuestra" la vitamina D. Wortsman y col. compararon hace ya una década a sujetos con IMC mayor de 30 con otros de menos de 25. Ante una exposición a rayos UV (UV-B) ambos grupos aumentaron su nivel de 25OHD a las 24 horas, pero en los obesos el aumento fue la mitad que en los controles. El contenido del precursor en la piel y su transformación en vitamina D fue similar en ambos grupos. También administraron vitamina D2 en alta dosis, y el aumento observado en sangre no fue diferente, aunque fue menor en los obesos, concluyendo que éstos necesitan dosis mayores(71). Estudios en niños y adolescentes también confirmaron el déficit en la obesidad(72). Recientemente se ha publicado un estudio nacional que mostró correlación negativa entre IMC y nivel de vitamina D(73).
Enfermedades granulomatosas, linfomas
El déficit de 25OHD se produce por aumento de la síntesis de calcitriol.
Enfermedades neurológicas crónicas
Se ha descripto una alta prevalencia de hipovitaminosis D en pacientes con esclerosis múltiple(74). y con extrapiramidalismo(75).
Trasplantes
Todos los trasplantes de órganos han sido asociados a osteoporosis y fracturas. Cada uno de ellos presenta características especiales, ya que la fisiopatología por la que presentan este problema pretrasplante difiere según la falla sea cardíaca, renal, hepática, etc. Se agrega luego la pérdida inducida por los medicamentos inmunosupresores que acompañan al trasplante, y el reposo posterior. El déficit de vitamina D debe ser pesquisado y corregido previamente a la intervención(52).
3.0. Situaciones especiales
3.1 Sujetos que habitan en zonas con poca irradiación solar: esto ha sido expuesto en la Sección Epidemiología, que antecede. Pero conviene mencionar acá un particular grupo de riesgo: el constituido por los integrantes de las campañas antárticas, que (partiendo de zonas centrales del país), presentan adecuados niveles de 25OHD al comenzar las mismas, los que disminuyen un 50 % durante su estadía en la Antártida(76).
3.2 Sujetos que requieren filtros solares altos por patología dermatológica: melanoma, lupus, entre otros.
4.0 Nuevas asociaciones de déficit de vitamina D con numerosas enfermedades
En los últimos tiempos se ha reportado asociación de distintas afecciones con el déficit, tal el caso de hipertensión, diabetes tipo 2, cáncer (especialmente de mama y de colon), esquizofrenia, depresión, asma, enfermedades autoinmunes (diabetes tipo 1, artritis reumatoidea, lupus), infecciones, esclerosis múltiple, enfermedad de Parkinson, y otras1. No existen trabajos que muestren que la administración de vitamina D prevenga o mejore la evolución de estas enfermedades, aunque es posible que esto ocurra en el futuro. En algunas de ellas existen trabajos que muestran que los sujetos con los niveles más bajos de vitamina D, seguidos por años, desarrollan con más frecuencia esas afecciones que los que tienen los niveles más altos, que de esa manera parecerían prevenir la enfermedad. Esto se ha observado en cáncer de colon y otros cánceres, esclerosis múltiple, enfermedad de Parkinson, insulinorresistencia y diabetes tipo 2.
5.0 Metodología de dosaje de 25 hidroxivitamina D
El primer ensayo de 25 hidroxivitamina D (25OHD) fue desarrollado por Haddad y col. en 1971(77). Ese ensayo usaba como ligando a la proteína transportadora de vitamina D y requería de una purificación de la muestra con cromatografía a baja presión. Belsey y col.(78) intentaron simplificarlo eliminando el paso cromatográfico, generando así los llamados ensayos "directos". Con el tiempo se concluyó que estos ensayos tenían muchos problemas de matriz y que informaban resultados más elevados por interferencias de metabolitos que no eran purificados en el proceso cromatográfico.
El primer radioinmunoensayo utilizando un anticuerpo coespecífico para 25OHD2 y 25OHD3 fue publicado por Hollis y col. en 1985 usando como trazador 25OHD tritiada(79). Luego, este ensayo fue modificado en 1993 con la incorporación del 25OHD iodinado como trazador(80).
Este proceso de mejora continua fue acompañado por el desarrollo de técnicas como HPLC y cromatografía líquida-espectrometría de masa (LC-MS). Ambos métodos pueden cuantificar por separado la 25OHD2 y la 25OHD3 pero no separan el isómero 3-epi-25OHD3 de la 25OHD3. Requieren personal especializado, equipos que no están al alcance de todos los laboratorios, y en general la producción de resultados es más lenta.
Durante más de una década se ha usado el radioinmunoensayo para reportar el estado nutricional de vitamina D en todo el mundo y para definir niveles de corte clínicos(80). Actualmente se han desarrollado ensayos de 25OHD adaptables a varias plataformas automáticas de más fácil acceso para los laboratorios. La mayoría de estos ensayos comerciales usan anticuerpos coespecíficos para 25OHD2 y 25OHD3. A la fecha de escritura de estos comentarios, se esperan mayores datos y experiencia internacional para evaluar el desempeño de los mismos y concluir si estos datos son comparables con ensayos anteriores. Numerosos trabajos han sido publicados y podemos concluir que es imprescindible que cada método sea evaluado con precaución, ya que dos métodos pueden ser comparables en ciertos rangos de concentración de 25OHD y no en otros rangos(81). Las diferencias entre métodos publicados hasta la fecha ponen en duda el uso de un único valor de corte y sugieren que la prevalencia de déficit es ensayodependiente.
Se ha propuesto a la LC-MS con dilución isotópica, con buena exactitud y precisión y baja susceptibilidad a la interferencia de otros metabolitos(82). Este método ha sido reconocido por el Joint Committee for Traceability in Laboratory Medicine y puede proveer la base para que sean evaluados otros métodos. Más recientemente, otro laboratorio ha publicado su propuesta como método de referencia(83).
Muchos trabajos publicados y comparaciones entre laboratorios han reportado enormes discrepancias entre los datos de 25OHD. Una de las razones (no la única), de estas discrepancias era la ausencia de un Estándar de Referencia Internacional de 25OHD que pudiera utilizarse en la calibración de los ensayos(84).
Se sabe que si distintos laboratorios con igual metodología (p. ej., LC-MS) utilizan un mismo estándar, mejora significativamente el desempeño de ese ensayo(85). El Instituto Nacional de Estándares y Tecnología de los Estados Unidos (NIST) ha desarrollado un calibrador primario, el SRM 2972, que consiste en soluciones de calibradores (tanto de 25OHD2 como de 25OHD3) útiles para calibrar los instrumentos que dosan 25OHD. Estas soluciones están en altas concentraciones, con el fin de poder diluirlas y construir curvas de calibración.
El mencionado Instituto también ha desarrollado un material de referencia para la 25OHD. El SRM 972 consiste en cuatro pools de suero, cada uno con valores asignados de 25OHD3, 25OHD2, de ambos y de 3 epi-25OHD3 con el objetivo de ofrecer un punto (reproducible), de comparación y así validar la exactitud(86). Cabe destacar que este material presenta problemas de conmutabilidad por lo que se está desarrollando otro (SRM 972a). Actualmente se esperan resultados de un importante estudio de estandarización (del cual participan proveedores de ensayos) en el que se busca que los métodos sean trazables al Método de Referencia (calibrado con SRM 2972 y validado con SRM 972).
5.3 Informe del laboratorio
Como en la República Argentina están aprobadas la vitamina D2 (ergocalciferol) y la vitamina D3 (colecalciferol) para prescripción farmacéutica, se aconseja utilizar métodos que cuantifiquen tanto la 25OHD2 como la 25OHD3; es decir, convendría que los laboratorios informaran la vitamina D total. Para los laboratorios que puedan cuantificar individualmente los dos metabolitos (25OHD2 y 25OHD3), no se recomienda informarlos por separado, ya que ello puede generar confusión en el médico clínico no especializado.
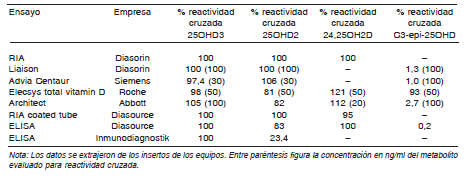
Listado de ensayos comerciales disponibles
6.1 Niveles séricos adecuados de 25OHD
- Evidencia
La correlación inversa entre PTH y 25OHD ha sido observada en sujetos de toda edad, incluso niños y ancianos(87,88). Se han publicado diversos niveles de corte por debajo de los cuales se considera que se produce un hiperparatiroidismo secundario, pero la mayoría se concentra entre 28 y 32 ng/ml(89,90).
No solo se ha considerado la concentración normal de PTH sérica para definir el nivel adecuado de calcidiol sérico, sino que también se ha tomado en cuenta la más efectiva absorción intestinal de calcio: comparando dos grupos de mujeres posmenopáusicas, Heaney y col. hallaron que la absorción de calcio era 65 % mayor en las que tenían un nivel sérico de 35 ng/ml que en las que tenían 20 ng/ml(91). Otro indicador es la tasa de pérdida ósea, mayor en sujetos que tienen niveles de calcidiol inferiores a 30 ng/ml(1), y la asociación de una mayor DMO con niveles superiores a 35-40 ng/ml(92).
La suficiencia de vitamina D asegura, además, una buena función neuromuscular, y contribuiría a disminuir las caídas en población añosa(93), la que por otra parte sufre una disminución en el número de VDR en el tejido muscular, mayor cuanto mayor la edad e independiente de los niveles séricos de calcidiol(94).
- Recomendaciones
Nosotros consideramos como óptimos los niveles superiores a 30 ng/ml, tanto para las acciones clásicas como para las no clásicas (1/⊕⊕⊕⊕).
Los niveles séricos se consideran "normales" cuando superan los 30 ng/ml (1/⊕⊕⊕⊕).
Se consideran "insuficientes" cuando están entre 20 y 29 ng/ml (1/⊕⊕⊕).
Se consideran "deficientes" cuando están entre 10 y 19 ng/ml (1/⊕⊕⊕).
La deficiencia se considera severa cuando los niveles están por debajo de 10 ng/ml (1/⊕⊕⊕).
6.2 Esquemas de administración de vitamina D
Los esquemas terapéuticos son varios y deben ser adecuados a cada paciente: la suplementación del calciferol puede ser diaria, semanal, quincenal, mensual o trimestral, y las dosis varían de acuerdo al intervalo de administración. El esquema semanal tiende a favorecer la adherencia en personas ancianas (p. ej., 5 gotas/semana de una solución que contiene 60.000 UI/ml aporta un promedio diario de 2.100 UI de vitamina D, y es fácil de recordar).
El aumento del calcidiol sérico parece ser inversamente proporcional al nivel basal del sujeto suplementado(95).
Deberían considerarse dos etapas en el tratamiento con vitamina D para un sujeto cuya concentración sérica de 25OHD es inferior a 30 ng/ml:
- Una fase de corrección del déficit, que durante un tiempo utiliza dosis altas de vitamina D(96).
- Una etapa de mantenimiento, donde las dosis administradas tienen como objetivo mantener la concentración sérica de 25OHD en el rango deseable.
Durante estas dos fases, con frecuencia es necesario administrar dosis mayores que las ingestas recomendadas (ver el Apéndice 1).
La ventana terapéutica de la vitamina D es amplia, y el riesgo de intoxicación es bajo; casi nunca ocurre con niveles de 25OHD inferiores a 150 ng/ml(95). Diversos estudios han demostrado que dosis de hasta 4.000 UI/día no tienen consecuencias sobre la calcemia o la calciuria(97).
Las dosis para corregir el déficit serán 2.000-5.000 UI/día, 50.000 UI/semana, o 100.000 UI cada 15-30 días, hasta alcanzar niveles adecuados, lo que generalmente ocurre en un lapso cercano a 2-3 meses. (1/⊕⊕⊕⊕) Se sugiere controlar los niveles alcanzados a los 3 meses, por la variedad de repuesta individual(98).
En pacientes urémicos en hemodiálisis, una dosis eficaz es la de 100.000 UI mensuales, por tiempo indefinido(99). (2/⊕⊕)
Para mantener un nivel sérico de 25OHD superior a 30 ng/ml se puede administrar una dosis diaria (800-2.000 UI), o 1 frasco de 100.000 UI cada 1-3 meses (1/⊕⊕⊕) dependiendo de la preferencia del paciente y de lo que indiquen los análisis durante el seguimiento (1/3 de los pacientes logran el objetivo con la dosis mensual, 1/3 con la dosis bimestral, y 1/3 con la dosis trimestral)(97). Algunos expertos consideran que 4.000 UI diarias es una dosis de mantenimiento aceptable.
Los niveles máximos de ingesta se han establecido según el grupo etario: 1.000 UI de 0 a 6 meses, 1.500 entre 6 y 12 meses, 2.500 de 1 a 3 años, 3.000 de 4 a 6 años y 4.000 de 9 años en adelante(100). En mayores de 19 años pertenecientes a grupos de riesgo la dosis nunca debería superar las 10.000 UI diarias(6). (1/⊕⊕⊕⊕)
Estas recomendaciones se aplican también a hombres en riesgo de sufrir hipovitaminosis D o que probadamente la tengan(101).
6.3 ¿Debe administrarse vitamina D2 o D3?
No hay ningún estudio que demuestre un efecto diferente de estos isómeros sobre el receptor de vitamina D. A los fines prácticos, tienen similar acción biológica. Desde el punto de vista del seguimiento con dosajes de 25OHD sérica, como hay una tendencia generalizada al uso de ensayos que miden vitamina D sérica "total" (D2 + D3), no debería haber problema en evaluar el impacto del tratamiento. En todo caso, cuando se indican intervalos largos entre dosis, conviene indicar vitamina D3, ya que su vida media sérica es mayor que la de D2(102).
El Apéndice 2 enumera todas las especialidades farmacéuticas que se comercializan en el país, y que contienen vitamina D2 (ergocalciferol) o vitamina D3 (colecalciferol) como monodroga.
Agradecimiento: Los autores agradecen al Dr. Claudio González por sus valiosas sugerencias sobre la calificación de la evidencia.
Conflictos de interés: A. Sánchez ha recibido honorarios de Spedrog Caillon como disertante y de TRB Pharma como autor de una monografía; J. L. Mansur ha recibido honorarios de TRB Pharma como autor de una monografía; B. Oliveri ha recibido honorarios de TRB Pharma como disertante. Los demás autores no declaran conflictos de interés.
CONTROVERSIA SOBRE NIVEL ÓPTIMO Y DOSIFICACIÓN
La Endocrine Societypublicó en 2011 sus Guías de Práctica Clínica sobre Evaluación, Tratamiento y Prevención del Déficit de Vitamina D.(6) El Institute of Medicine (IOM) ya había publicado sus recomendaciones sobre ingesta dietaria de calcio y vitamina D(100). Había discrepancias con respecto a los niveles séricos óptimos de 25OHD y a las dosis convenientes de la vitamina. Después la polémica continuó, y los expertos de ambas instituciones han vuelto a exponer sus argumentos por escrito. En abril de 2012 el Journal of Clinical Endocrinology and Metabolism publicó en el mismo número los artículos de ambos grupos, con puntos de vista contrapuestos(103,104).
El IOM no está de acuerdo con el concepto de que un nivel sérico de 25OHD de 30 ng/ml sea más beneficioso para la salud que uno de 20 ng/ml, y menciona que considerar "en riesgo" a los grupos enumerados por la Endocrine Societyocasionaría estudiar a un número muy amplio de personas con costos económicos considerables para la salud pública. Por su parte, los expertos de la Endocrine Societyconsideran que las opiniones del IOM son incorrectas, y además dirigidas solo a políticas sanitarias y de fortificación de alimentos, pero no aplicables para la atención de pacientes.
Considerando que el nivel "deseable" de 25OHD se ha establecido en base a los efectos biológicos sobre el metabolismo mineral y óseo (valor por debajo del cual la PTH se eleva para compensar el déficit, con consecuencias negativas para la DMO y el riesgo de fractura), y que cada vez más se ha asociado a la vitamina D con efectos "no clásicos" (prevención de enfermedad cardiovascular, hipertensión, cáncer, enfermedades autoinmunes, esclerosis múltiple, complicaciones del embarazo, infecciones, cáncer, etc.), es posible que en el futuro se establezcan dosis mayores de vitamina D para la prevención de algunas de estas enfermedades.
APÉNDICE 2
PRODUCTOS COMERCIALES EN EL MERCADO ARGENTINO QUE CONTIENEN VITAMINA D COMO MONODROGA

1. Sánchez A. Vitamina D. Actualización. Rev Med Rosario 76:70-87, 2010 [ Links ]
2. Sánchez A, Puche R, Zeni S. y col. Papel del calcio y la vitamina D en la salud ósea. Rev Esp Enf Metab Óseas 11: 201-17, 2002 (Parte I); 12:14-29, 2003 (Parte II) [ Links ]
3. Bikle D, Adams J, Christakos S. Vitamin D: production, metabolism, mechanism of action, and clinical requirements. En: Primer on the metabolic bone diseases and disorders of mineral metabolism, 7th edition (Rosen, C.J.; editor principal). Washington DC; Am Soc for Bone Mineral Res, 2008. Págs 141-9 [ Links ]
4. Mithal A, Wahl DA, Bonjour J. y col. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int 20:1807-20, 2009 [ Links ]
5. Ross A, Manson J, Abrams S. y col. The 2011 report on dietary reference intakes for calcium and vitamin D from the Institute of Medicine: What clinicians need to know. J Clin Endocrinol Metab 96:53-8, 2011 [ Links ]
6. Holick M, Binkley N, Bischoff-Ferrari H. y col. Evaluation, Treatment, and Prevention of vitamin D deficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 96: 1911-30, 2011 [ Links ]
7. Bodnar L. Maternal vitamin D deficiency increases the risk of preeclampsia. J Clin Endocrinol Metab 92:3517-22, 2007 [ Links ]
8. Hollis B. Vitamin D supplementation during pregnancy: double blind, randomized clinical trial of safety and effectiveness. J Bone Miner Res 26: 2341-57, 2011 [ Links ]
9. Leerbeck E, Søndergaard H. The total content of vitamin D in human and cow´s milk. Br J Nutr 44:1276-86, 1980 [ Links ]
10. Molla A, Al Badawi M, Hammoud M. y col. Vitamin D status of mothers and their neonates in Kuwait. Pediatr Int 47:649-52, 2005 [ Links ]
11. Sachan A, Gupta R, Das V, Agarwal A, Awasthi P, Bhatia V. High prevalence of vitamin D deficiency among pregnant women and their newborns in northern India. Am J Clin Nutrition 81:1060-4, 2005 [ Links ]
12. Lee J, Smith J, Philipp B, Chen T, Mathieu J, Holick M. Vitamin D deficiency in a healthy group of mothers and newborn infants. Clin Ped (Phila) 46:42-4, 2007 [ Links ]
13. Bowyer L, Catling-Paull C, Diamond T, Homer C, Davis G, Craig M. Vitamin D, PTH and calcium levels in pregnant women and their neonates. Clin Endocrinol 70:372-7, 2009 [ Links ]
14. Bodnar L, Simhan H, Powers R, Frank M, Cooperstein E, Roberts J. High prevalence of vitamin D insufficiency in black and white pregnant women residing in the northern United States and their neonates. J Nutr 137:447-52, 2007 [ Links ]
15. Bassir M, Laborie S, lapillone A. y col. Vitamin D deficiency in Iranian mothers and their neonates: a pilot study. Acta Paediatr 90:577-9, 2001 [ Links ]
16. Nicolaidou P, Hatzistamatiou Z, Papadopoulou A, y col. Low vitamin D status in mother-newborn pairs in Greece. Calcif Tissue Int 78:337-42, 2006 [ Links ]
17. Tau C, Bonifacino M, Scaiola E. y col. Niveles circulantes de 25-hidroxivitamina D en población materno infantil de zonas de riesgo del país: provincias de Chubut, Santa Cruz y Tierra del Fuego. Med Inf 9:199-204, 2004 [ Links ]
18. Oliveri M, Mautalen C, Alonso A. y col. Estado nutricional de vitamina D en madres y neonatos de Ushuaia y Buenos Aires. Medicina (B Aires) 53: 315-20, 1993 [ Links ]
19. Oliveri B, Parisi M, López L, Brito G, Zeni S, Fernández C. Calcium and vitamin D nutritional status during pregnancy (Abstract). J Bone Miner Res 24 (Suppl 1), 2009. Disponible en: http://www.asbmr.org/Meetings/AnnualMeeting/AbstractDetail.aspx?aid=51d4e88b-f79d-47e2-a15b-134f0c57b52e [ Links ]
20. De-Regil L, Palacios C, Ansary A, Kulier R, Peña-Rosas J. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev 2: CD008873, 2012 [ Links ]
21. Wagner C, Greer F. American Academy of Pediatrics Section on Breastfeeding; American Academy of Pediatrics Committee on Nutrition. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics 122:1142-52, 2008 [ Links ]
22. Gordon C, DePeter K, Feldman H, Grace E, Emans S. Prevalence of vitamin D deficiency among healthy adolescents. Arch Pediatr Adolesc Med 158:531-7, 2004 [ Links ]
23. Sullivan S, Rosen C, Halteman W, Chen T, Holick M. Adolescent girls in Maine are at risk for vitamin D insufficiency. J Am Diet Ass 105:971-4, 2005 [ Links ]
24. Fraser D. Vitamin D-deficiency in Asia (review). J Steroid Biochem Mol Biol 89-90(1-5):491-5, 2004 [ Links ]
25. Foo L, Zhang Q, Zhu K. y col. Relationship between vitamin D status, body composition and physical exercise of adolescent girls in Beijing. Osteoporos Int 20:417-25, 2009 [ Links ]
26. González-Gross M, Valtueña J, Breidenassel C. y col. Vitamin D status among adolescents in Europe: the Healthy Lifestyle in Europe by Nutrition in Adolescence study. Br J Nutr 17:1-10, 2011. [ Links ]
27. Oliveri M, Ladizesky M, Sotelo A, Griffo S, Ballesteros G, Mautalen C. Nutritional rickets in Argentina. En: Nestlé Nutrition Workshops: Rickets. Raven Press, New York, (21), págs 233-45, 1991 [ Links ]
28. Wondale Y, Shiferaw F, Lulseged S. A systematic review of nutritional rickets in Ethiopia: status and prospects. Ethiop Med J 43:203-10, 2005 [ Links ]
29. Underwood P, Margetts B. High levels of childhood rickets in rural North Yemen. Soc Sci Med 24:37-41, 1987 [ Links ]
30. Lips P, van Schoor N, Braverboer N. Vitamin D-related disorders. En: Primer on the metabolic bone diseases and disorders of mineral metabolism, 7th edition (Rosen, C.J.; editor principal). Washington DC; American Society for Bone and Mineral Research, pág. 329-35, 2008 [ Links ]
31. Winzenberg T, Powell S, Shaw K, Jones G. Effects of vitamin D supplementation on bone density in healthy children: systematic review and meta-analysis. BMJ 342: c7254, 2011. doi: 10.1136/bmj.c7254 [ Links ]
32. Outila T, Kärkkäinen M, Lamberg-Allardt C. Vitamin D status affects serum parathyroid hormone concentrations during winter in female adolescents: associations with forearm bone mineral density. Am J Clin Nutr 74:206-10, 2001 [ Links ]
33. Lehtonen-Veromaa M, Möttönen T, Nuotio I, Irjala K, Leino A, Viikari J. Vitamin D attainment of peak bone mass among peripubertal Finnish girls: a 3-year prospective study. Am J Clin Nutr 76:1446-53, 2002 [ Links ]
34. Kristinsson J, Valdimarsson O, Sigirdsson G, Franzson L, Olafsson I, Steingrimsdottir L. Serum 25(OH)D levels and bone mineral density in 16-20 years-old girls: lack of association. J Intern Med 243:381-8, 1998 [ Links ]
35. Välimäki VV, Alfthan H, Lehmuskallio E. y col.Vitamin D status as a determinant of peak bone mass in young Finnish men. J Clin Endocrinol Metab 89:76-80, 2004 [ Links ]
36. Ladizesky M, Lu Z, Oliveri M, San Román N, Holick M, Mautalen C. Solar ultraviolet-B radiation and photoproduction of vitamin D in Central and Southern areas of Argentina. J Bone Min Res 10:545-9, 1995 [ Links ]
37. Oliveri M, Wittich A, Mautalen C, Chaperón A, Kizlansky A. Peripheral bone mass is not affected by winter vitamin D deficiency in children and young adults from Ushuaia. Calcif Tissue Int 67:220-4, 2000 [ Links ]
38. Nesby-O'Dell S, Scalon K, Cogswell M. y col. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: Third National and Nutrition Examination Survey, 1988-1994. Am J Clin Nutr 76: 187-92, 2002 [ Links ]
39. Looker A, Pfeiffer C, Lacher D, Schleicher R, Picciano M, Yetley E. Serum 25-hydroxyvitamin D status of the US population: 1988-1994 compared with 2000-2004. Am J Clin Nutr 88:1519-27, 2008 [ Links ]
40. Fassi J, Russo Picasso M, Furci A, Sorroche P, Jáuregui R, Plantalech L. Variaciones estacionales de 25-hidroxivitamina D en jóvenes y ancianos de la ciudad de Buenos Aires. Medicina (B Aires) 63:215-20, 2003 [ Links ]
41. Ladizesky M, Oliveri B, Mautalen C. Serum levels of 25-hydroxyvitamin D in the normal population of Buenos Aires: its seasonal variation]. Medicina (B Aires) 47:268-72, 1987 [ Links ]
42. Lips P. Vitamin D status and nutrition in Europe and Asia. J Steroid Biochem Mol Biol 103(3-5):620-5, 2007 [ Links ]
43. Fradinger E, Zanchetta J. Niveles de vitamina D en mujeres de la ciudad de Buenos Aires. Medicina (B Aires) 59:449-52, 1999 [ Links ]
44. Seijo M, Mastaglia S, Somoza J, Bagur A, Oliveri B. Efecto de la suplementación de diferentes dosis de vitamina D2 y D3 sobre los niveles de 25 hidroxivitamina D y el metabolismo óseo (resumen). Actual Osteol 4(Supl. 1):S71, 2008 [ Links ]
45. Gallagher J, Sai A, Templin T I, Smith, L. Dose response to vitamin D supplementation in postmenopausal women. A randomized trial. Ann Intern Med 156:425-37, 2012 [ Links ]
46. van der Wielen R, Lowl M, van der Berg H. y col. Serum 25OHD concentrations among elderly people in Europe. Lancet 346:207-10, 1995 [ Links ]
47. Gloth F, Gunberg C, Hollis B, Haddad JG, Tobin J. Vitamin D deficiency in homebound elderly persons. JAMA 274:1683-6, 1995 [ Links ]
48. Oliveri B, Plantalech L, Bagur A. y col. High prevalence of vitamin D insufficiency in healthy elderly people living at home in Argentina. Eur J Clin Nutr 58:337-42, 2004 [ Links ]
49. Plantalech L, Fassi J, Pozzo M, y col. Hypovitaminosis D in elderly people living in an overpopulated city: Buenos Aires. En: Focus in Nutrition Research. Tony P. Starks, editor. New York; Nova Science Publishers, 2006. Págs 149-63 [ Links ]
50. Plantalech L, Knoblovits P, Cambiasso E. y col. Hipovitaminosis D en ancianos institucionalizados de Buenos Aires. Medicina (B Aires) 57:29-35, 1997 [ Links ]
51. Portela M, Mónico A, Barahona A, Dupraz H, Sol Gonzales-Chaves M, Zeni S. Comparative 25-OH-vitamin D level in institutionalized women older than 65 years from two cities in Spain and Argentina having a similar solar radiation index. Nutrition 26:283-9, 2010 [ Links ]
52. Bikle D. Vitamin D insufficiency/deficiency in gastrointestinal disorders. J Bone Miner Res 22(Suppl 2): V50-4, 2007 [ Links ]
53. Holick M. Vitamin D for health and in chronic kidney disease. Semin Dial 18:266-75, 2005 [ Links ]
54. Del Valle E, Negri A, Aguirre C, Fradinger E, Zanchetta J. Prevalence of 25(OH) vitamin D insufficiency and deficiency in chronic kidney disease stage 5 patients on hemodialysis. Hemodial Int 11: 315-21, 2007 [ Links ]
55. Fisher L, Fisher A. Vitamin D and parathyroid hormone in outpatients with noncholestatic chronic liver disease. Clin Gastroenterol Hepatol 5:513-20, 2007 [ Links ]
56. Schurman A, Bagur A, Claus-Hermberg H, Messina OD, Negri AL, Sánchez A, González C, Diehl M, Rey P, Gamba J, Chiarpenello J, Moggia MS, Mastaglia S. Guías 2012 para el diagnóstico, la prevención y el tratamiento de la osteoporosis. Medicina (B Aires) 73:55-74, 2013 [ Links ]
57. Salica D, Buceta A, Palacios S, Sánchez A, y col. Consenso Iberoamericano de Osteoporosis SIBOMM 2009. Osteoporosis: Prevención, Diagnóstico y Tratamiento. Rev Argent Osteol 9:4-44, 2010 [ Links ]
58. Guardia G, Parikh N, Eskridge T, Phillips E, Divine G, Rao D. Prevalence of vitamin D depletion among subjects seeking advice on osteoporosis: a five-year cross-sectional study with public health implications. Osteoporos Int 19:13-9, 2008 [ Links ]
59. Geller J, Adams J. Vitamin D therapy. Curr Osteoporos Rep 6:5-11, 2008 [ Links ]
60. de Paula F, Rosen C. Osteoporosis. En: Conn's Current Therapy, 1st ed. (Bope ET, Kellerman RD, eds). New York: Saunders, 2012. Págs 583-7 [ Links ]
61. Pérez-López F, Brincat M, Tamer Erel C. y col. EMAS position statement: Vitamin D and postmenopausal health. Maturitas 71:83-8, 2012 [ Links ]
62. Bolland M, Bacon C, Horne A. y col. Vitamin D insufficiency and health outcomes over 5 y in older women. Am J Clin Nutr 91:82-9, 2010 [ Links ]
63. Looker A, Dawson-Hughes B, Calvo M, Gunter E, Sahyoun N. Serum 25-hydroxyvitamin D status of adolescents and adults in two seasonal subpopulations from NHANES III. Bone 30:771-7, 2002 [ Links ]
64. Rizzoli R, Bruyère O, Cannata-Andía J. y col. Management of osteoporosis in the elderly. Curr Med Res Opin 25:2373-87, 2009 [ Links ]
65. Dawson-Hughes B. Calcium and vitamin D. En: Primer on the metabolic bone diseases and disorders of mineral metabolism, 7th edition (Rosen, C.J.; editor). Washington DC; American Society for Bone and Mineral Research, págs 231-3, 2008 [ Links ]
66. Nair S. Vitamin D deficiency and liver disease. Gastroenterol Hepatol (NY) 6:491-3, 2010 [ Links ]
67. Arteh J, Narra S, Nair S. Prevalence of vitamin D deficiency in chronic liver disease. Dig Dis Sci 55:2624-8, 2010 [ Links ]
68. Petta S, Camma C, Scazzone C. y col. Low vitamin D serum level is related to severe fibrosis and low responsiveness to interferon-based therapy in genotype 1 chronic hepatitis C. Hepatology 51: 1158-67, 2010 [ Links ]
69. Pack A, Morrell M. Epilepsy and bone health in adults. Epilepsy Behav 5(Suppl 2): S24-9, 2004 [ Links ]
70. Skversky A. Association of glucocorticoid use and low 25 hidroxivitamin D levels: results from the Nacional Health and Nutrition Examination Survey (NHANES): 2001-2006. J Clin Endocrinol Metab 96:3838-45, 2011 [ Links ]
71. Wortsman J, Matsuoka L, Chen TC, Lu Z, Holick M. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr 72:690-3, 2000 [ Links ]
72. Alemzadeh R, Kichler J, Babar G, Calhoun M. Hypovitaminosis D in obese children and adolescents: relationship with adiposity, insulin sensitivity, ethnicity, and season. Metabolism 57:183-91, 2008 [ Links ]
73. Larroudé M, Moggia M, Lichtcajer G, Pérez Sainz M, Man Z. Déficit de vitamina D en mujeres osteoporóticas posmenopáusicas con sobrepeso / obesidad. Actual Osteol 2012 (En prensa) [ Links ]
74. Nieves J, Cosman F, Herbert J, Shen V, Lindsay R. High prevalence of vitamin D deficiency and reduced bone mass in multiple sclerosis. Neurology 44:1687-92, 1994 [ Links ]
75. van den Bos F, Speelman A, van Nimwegen M. y col. Bone mineral density and vitamin D status in Parkinson's disease patients. J Neurol 2012 (En prensa) [ Links ]
76. Oliveri M, Mautalen C, Bustamante l, Gómez García V. Serum levels of 25 hydroxyvitamin D in a year of residence in the Antarctic continent. Eur J Clin Nutr 48:397-401, 1994 [ Links ]
77. Haddad J, Chyu K. Competitive protein-binding radioassay for 25-hydroxycholecalciferol. J Clin Endocrinol Metab 33:992-5, 1971 [ Links ]
78. Belsey R, DeLuca H, Potts J Jr. A rapid assay for 25OHvitamin D without preparative chromatography. J Clin Endocrinol Metab 38:1046-51, 1974 [ Links ]
79. Hollis B, Napoli J. Improved radioimmunoassay for vitamin D and its use in assessing vitamin D status. Clin Chem 31:1815-9, 1985 [ Links ]
80. Hollis B, Kamerud JQ, Selvaag S, Lorenz J, Napoli J. Determination of vitamin D status by radioimmunoassay with an 125I-labeled tracer. Clin Chem 39:529-33, 1993 [ Links ]
81. Farrell S, Martin S, McWhinney B, Straub I, Williams P, Herrmann M. State of the art Vitamin D assays. Comparison of automated immunoassays with liquid chromatographytandem mass spectrometry methods. Clin Chem 2012 [En prensa] [ Links ]
82. Tai S, Bedner M, Phinney K. Development of a candidate reference measurement procedure for the determination of 25-hydroxyvitamin D3 and 25-hydroxyvitamin D2 in human serum using isotope-dilution liquid chromatography/tandem mass spectrometry. Anal Chem 82:1942-8, 2010 [ Links ]
83. Stepman H, Vanderroost A, Van Utylanghe K, Thienpont L. Candidate reference measurement procedures for serum 25-hydroxyvitamin D3 and 25-hydroxyvitamin D2 by using isotope-dilution liquid chromatography-tandem mass spectrometry. Clin Chem 57:441-8, 2011 [ Links ]
84. Fradinger E. 25-hidroxivitamina D: aspectos metodológicos y niveles óptimos. Actual Osteol 1:22-7, 2005 [ Links ]
85. Carter G, Jones J. Use of a common standard improves the performance of liquid chromatography-tandem mass spectrometry methods for serum 25-hydroxyvitamin D. Ann Clin Biochem 46:79-81, 2009 [ Links ]
86. Phinney K. Development of a standard reference material for vitamin D in serum (review). Am J Clin Nutr 88:511-2S, 2008 [ Links ]
87. Looker A, Dawson-Hughes B, Calvo M, Gunter E, Sahyoun N. Serum 25-hydroxyvitamin D status of adolescents and adults in two seasonal subpopulations from NHANES III. Bone 30:771-777, 2002 [ Links ]
88. Gordon C, Feldman H, Sinclair L, y col. Prevalence of vitamin D deficiency among healthy infants and toddlers. Arch Pediatr Adolesc Med 162: 505-12, 2008 [ Links ]
89. Bischoff-Ferrari H, Giovannucci E, Willett W, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr 84:18-28, 2006 [ Links ]
90. Dawson-Hughes B, Heaney R, Holick M, Lips P, Meunier P, Vieth R. Estimates of optimal vitamin D status. Osteoporos Int 16:713-6, 2005 [ Links ]
91. Heaney R, Dowell M, Hale C, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr 22:142-6, 2003 [ Links ]
92. Bischoff-Ferrari H, Kiel D, Dawson-Hughes B. y col. Dietary calcium and serum 25-hydroxyvitamin D status in relation to BMD among U.S. adults. J Bone Miner Res 24:935-42, 2009 [ Links ]
93. Dhesi J, Jackson S, Bearne L. y col. Vitamin D supplementation improves neuromuscular function in older people who fall. Age and Ageing 33:589-95, 2004 [ Links ]
94. Bischoff-Ferrari H, Borchers M, Gudat F, Dürmüller U, Stähelin H, Dick W. Vitamin D receptor expression in human muscle tissue decreases with age. J Bone Miner Res 19:265-9, 2004 [ Links ]
95. Heaney R, Davies K, Chen T, Holick M, Barger-Lux M. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr 77: 204-10, 2003. Erratum en: Am J Clin Nutr 78:1047, 2003 [ Links ]
96. Mastaglia S, Mautalen C, Parisi M, Oliveri B. Vitamin D2 dose required to rapidly increase 25OHD levels in osteoporotic women. Eur J Clin Nutr 60:1-7, 2006 [ Links ]
97. Souberbielle J. Vitamina D. Buenos Aires: Anejo, Págs 57-74, 2012 [ Links ]
98. Dawson-Hughes B, Mithal A, Bonjour J. y col. IOF position statement: Vitamin D recommendations for older adults. Osteoporos Int 21:1151-4, 2010 [ Links ]
99. Jean G, Souberbielle J, Chazot C. Monthly cholecalciferol administration in hemodialysis patients: A simple and efficient strategy for vitamin D supplementation. Nephrol Dial Transplant 24:3799-805, 2009 [ Links ]
100. IOM (Institute of Medicine). Dietary reference intakes for calcium and vitamin D. Washington, DC: The National Academies Press. Págs 260-2, 2011 [ Links ]
101. Watts N, Adler R, Bilezikian J. y col. Osteoporosis in men: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 97:1802-22, 2012 [ Links ]
102. Rosen C, Abrams S, Aloia J, y col. IOM Committee members respond to Endocrine Society Vitamin D Guideline. J Clin Endocrinol Metab 97:1146-52, 2012 [ Links ]
103. Holick M, Binkley N, Bischoff-Ferrari H. y col. Guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J Clin Endocrinol Metab 97:1153-8, 2012Links ] Helvetica, sans-serif">














