Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de endocrinología y metabolismo
versão On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.52 no.4 Ciudad Autónoma de Buenos Aires set. 2015
TRABAJO ORIGINAL
Prueba de calcitriol en el diagnóstico diferencial del hiperparatiroidismo
Test with Calcitriol in the Differential Diagnosis of Hyperparathyroidism
Gamez JM1; Martínez MP2; Kogovsek N1; Salerni HH1,2
1 Hospital Carlos G. Durand, Div. Endocrinología. CABA
2 Cicemo. CABA
Correspondencia: Helena Salerni. Av. Rivadavia 4961 Piso 9 Dto. A, CP: 1424. Tel: 49023039. Fax: 49031834. e-mail: helenasalerni@gmail.com
RESUMEN
El hiperparatiroidismo primario (HPP) clásico presenta hipercalcemia y PTH elevada. Actualmente, se describen formas atípicas con calcemia y/o PTH normal. El calcitriol inhibe la secreción de PTH en ausencia de autonomía. Para evaluarla, realizamos una prueba de inhibición con calcitriol en 103 pacientes con elevación mínima, intermitente o ausente de calcio iónico (CaI), calcio total (CaT) y/o PTH. Se midió CaT, CaI y PTH séricos, y calcio/creatinina urinaria de 24 y 2 horas previo y posterior a la administración oral de 0,75 ug de calcitriol por 10 días. Se excluyeron aquellos con 25OHD menor a 20 ng/ml y/o seguimiento inferior a un año. La respuesta se clasificó en dos grupos: A) hipercalcemia con PTH alta o normal (HPP) o B) descenso de PTH sin aumentar la calcemia (hiperparatiroidismo secundario). El HPP fue confirmado por imágenes y/o cirugía. Ambos grupos fueron similares en edad y 25OHD, con un seguimiento promedio de 70 ± 34 meses. El CaT y CaI basales y pos prueba fueron significativamente mayores en el grupo A que en el B, donde se mantuvieron estables. La calciuria se incrementó en ambos grupos por igual, en forma dependiente (grupo A) e independiente (grupo B) de la calcemia. La PTH basal fue similar en ambos grupos. Posprueba, se produjo un descenso significativamente mayor en el grupo B (44 % ± 18) que en el A (15 % ± 27), sugiriendo resistencia al calcitriol. Con curvas ROC, una inhibición menor al 30 % posee una sensibilidad (S) y especificidad (E) de 85 % y 88 % para el diagnóstico de HPP. Dos pacientes del grupo B desarrollaron HPP clásico a los 17 y 37 meses de seguimiento lo que otorga a la prueba una S 90 % y E 100 % para el diagnóstico de HPP, constituyendo una herramienta útil y rápida para evidenciar la autonomía paratiroidea.
Los autores declaran no poseer conflictos de interés.
Palabras clave: Prueba de calcitriol; Hiperparatiroidismo primario
ABSTRACT
Primary hyperparathyroidism (PHP) is a disorder characterized traditionally by hypercalcemia and elevated levels of parathyroid hormone (PTH). However, this complete biological pattern is sometimes lacking. Some PHP patients display either normal or intermit tently elevated serum calcium level as well as hypercalcemia with normal PTH levels. PTH synthesis is negatively controlled by calcitriol through the vitamin D receptor (VDR). We assessed the diagnostic value of a PTH inhibition test with calcitriol in the diagnosis of PHP, in 103 patients who have minimal, intermittent, or no elevation of the levels of total or ionized calcium, and/or intact PTH. Patients with 25OHD < 20 ng/ml or less than a year follow up were excluded. We measured serum total calcium (CaT), ionized calcium (CaI), PTH and urinary calcium in 47 patients before and after the oral administration of calcitriol 0.75 ug once daily for 10 days. The biochemical response was classified as A) increase in serum calcium with high or normal PTH levels (PHP) or B) PTH suppression without hypercalcemia (secondary hyperparathyroidism). PHP was confirmed by images or surgery. The two groups were similar in age and 25 OHD levels. The mean follow up was 70 ± 34 months. Basal serum CaT and CaI were higher in group A. After the loading, this difference was even bigger, what gives additional specificity to the measure. Urine calcium was equally augmented by calcitriol in both groups, with coincident elevation of serum calcium in group A but not in B, in which serum calcium remained stable. Basal PTH levels were similar in both groups, so they cannot reliable distinguish between both types of hyperparathyroidism. After the calcitriol load, PTH dropped 44 % ± 18 in group B versus 15 % ± 27 in group A, suggesting some degree of resistance to the hormone action in PHP. ROC curves shows that a reduction of less than 30 % in PTH levels can diagnose PHP with 85% sensibility and 88% specificity. Only two patients in group B behaved as PHP at 17 and 37 months follow up, what gives the test 90 % sensibility and 100 % specificity for the diagnosis of PHP. So, this well-tolerated and easily performed test could be used for the diagnosis of PHP in patients suspected for the disease despite the normality of some basal biological markers.
No financial conflicts of interest exist.
Key words: Test with calcitriol; Primary hyperparathyroidism
INTRODUCCIÓN
El hiperparatiroidismo primario (HPP) es la causa más frecuente de hipercalcemia en el paciente ambulatorio y se caracteriza por una producción desregulada y autónoma de parathormona (PTH)(1, 2).
En su descripción inicial se presentaba como una enfermedad sintomática y progresiva con hipercalcemia severa y complicaciones(3) como osteoporosis y fracturas(4), litiasis e insuficiencia renal(5). Más recientemente, el HPP se sospecha en pacientes asintomáticos sobre la base del descubrimiento casual de hipercalcemia con niveles no suprimidos de PTH(6,7). Sin embargo, en algunos casos la ausencia del patrón biológico completo da lugar a nuevas presentaciones atípicas (8). Tal es así que algunos pacientes presentan niveles normales de calcio total (CaT) y/o calcio iónico (CaI) en forma permanente (9,10) o intermitente(11,12), o bien PTH normal pero inadecuada para los niveles elevados de calcemia(13,14). A su vez, las concentraciones de CaT pueden presentar discrepancias con las determinaciones de CaI(15). En pacientes con patología paratiroidea demostrada por histología puede hallarse solo hipercalcemia iónica o total en forma aislada(16).
Sobre la base de una menor sensibilidad a la retroalimentación negativa ejercida por el calcio en el tejido paratiroideo anormal(17-20) se han diseñado diferentes test dinámicos de sobrecarga cálcica para diferenciar pacientes con función paratiroidea normal de pacientes con HPP(21-28). Se han descripto modalidades con diferentes vías de administración, dosis y tiempos de extracción de la muestra así como también diferentes marcadores de hiperfunción paratiroidea como clearance de fósforo(21), AMPc nefrogénico(22), o PTH intacta(23-28). Sin embargo, ninguno de dichos test ha sido estandarizado para el diagnóstico diferencial.
La pérdida de la modulación de la secreción de PTH por el receptor sensor de calcio (CaSR) observada en la enfermedad paratiroidea se atribuye comúnmente a la disminución de su expresión(19,20). Dicha expresión es muy variable en los adenomas paratiroideos. La falta de correlación entre la abundancia del CaSR y la cinética de respuesta de PTH frente al calcio indica que otros mecanismos independientes pueden contribuir a la expresión del sensor y a la aberrante relación calcio/PTH en la enfermedad paratiroidea(29).
El calcitriol es un importante regulador fisiológico de la síntesis y secreción de PTH(30). Independientemente de los cambios sobre la absorción intestinal de calcio, el calcitriol reprime la transcripción del gen de la PTH por unión al receptor de vitamina D (VDR)(31-34). Dicho efecto fue observado por numerosos autores en pacientes con enfermedad renal crónica e hiperparatiroidismo secundario, en los cuales se administró calcitriol o sus análogos con el objeto de reducir los niveles de PTH(35-39).
Respecto al HPP, se ha demostrado que existe una disminución en el número de VDR y consecuentemente menor sensibilidad a la acción inhibitoria del calcitriol que sería en parte responsable de la secreción autónoma de PTH(40-42). La supresión de PTH con calcitriol podría representar una herramienta para demostrar la producción autónoma de PTH. En base a la evidencia y a la necesidad en la práctica clínica de un test diagnóstico sencillo y ambulatorio, es que pusimos en práctica una prueba de supresión de PTH con calcitriol.
OBJETIVO
Comunicar nuestra experiencia para realizar el diagnóstico diferencial entre el HPP y el HPS con uso de la prueba de calcitriol.
MATERIALES Y MÉTODOS
Se implementó la prueba de calcitriol en 103 individuos (95 mujeres, 8 varones) seleccionados en base a la elevación mínima, intermitente o ausente de al menos uno de estos parámetros: CaI, CaT y/o PTH en más de una muestra de sangre.
Previo y posterior a la sobrecarga con calcitriol se tomaron muestras de sangre en ayunas para la determinación de CaT, CaI, PTH y de orina de 24 y 2 horas para la determinación de la relación calcio/creatinina (Ca/Cr). Para asegurar la estabilidad de los analitos, las muestras de sangre fueron centrifugadas y el suero se procesó en el día. La determinación de CaT en sangre y orina se realizó por método colorimétrico (Roche MODULAR), la de creatinina en orina por método Jaffé cinético colorimétrico (Roche MODULAR). El CaI se midió en suero por método ion selectivo (Roche AVL) y la PTH por método electroquimioluminiscente de segunda generación (Roche Elecsys). La determinación de 25OHD2/D3 (25OHD) se efectuó previo a la prueba por quimioluminiscencia (Diasorin Liaison).
Los rangos de referencia para muestras en suero fueron: CaT 8,6-10,4 g/dl, CaI 4,5-5,5 mg/dl y PTH 15,0-65,0 pg/ml. Se consideró hipercalciuria a una relación Ca/Cr mayor igual a 0,30 en muestras de orina de 24 h y mayor igual a 0,11 en muestras de 2 h.
La prueba consistió en la toma de 0,75 µg de calcitriol en ayunas, durante 10 días consecutivos en los que se aseguró el aporte dietario o farmacológico de al menos un gramo de calcio. Al finalizar dicho periodo y coincidentemente con el día décimo, se recolectó una nueva orina de 24 hs. La muestra de sangre y la orina 2 h se obtuvieron el día undécimo.
Se excluyeron del estudio aquellos pacientes que en la primera muestra de sangre presentaron niveles de 25 OHD menor a 20 ng/ml, considerándolos como hiperparatiroidismo secundario (HPS) por deficiencia. También se excluyeron los pacientes que presentaban otras causas de HPS como enfermedad renal, trastornos malabsortivos, fármacos (como tiazidas y litio), hipercalciuria persistente y aquellos con un seguimiento menor a 1 año. La respuesta bioquímica de los 47 pacientes seleccionados (2 varones, 45 mujeres) fue clasificada en 2 grupos: A al aumento de CaT y/o CaI con PTH elevada o normal (inadecuada), lo que sugiere HPP, o bien B: descenso de PTH sin aumento de CaT y CaI (HPS). En el seguimiento de aquellos pacientes que presentaron una respuesta de tipo A, el HPP fue confirmado con estudios de imágenes (ecografía y centellograma de paratiroides con Sesta MIBI) y/o cirugía.
La comparación de los resultados pre y posprueba se realizó mediante test T para muestras pareadas (two tailed). Para comparar los grupos entre sí, se utilizó el test T para muestras no pareadas. Se consideró significativo un valor de p≤ 0,05. La sensibilidad y especificidad de la prueba de calcitriol y las determinaciones pre y pos prueba de PTH, CaT y CaI para el diagnóstico de HPP fueron evaluadas mediante análisis de curvas ROC. El análisis estadístico se realizó utilizando el programa MedCalc versión 14.8.1.
RESULTADOS
Los resultados previos y posteriores a la prueba se muestran en la Tabla I. Ambos grupos fueron similares en cuanto a edad y 25 OHD, con niveles promedio de esta última superiores a 30 ng/ml.
TABLA I. Valores de CaI, CaT, PTH séricos y Ca/Cr urinaria pre versus pos prueba en grupos A y B.
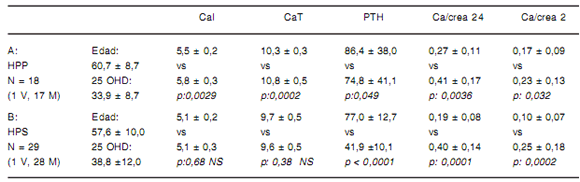
De acuerdo a nuestro criterio a priori para la clasificación en grupos enunciado previamente, los niveles de CaT y CaI luego de la administración de calcitriol aumentaron significativamente en el grupo A, mientras que permanecieron sin cambios en el B. Los valores PTH disminuyeron francamente en el grupo B (p < 0,0001), en cambio los pacientes del grupo A solo presentaron una leve reducción de los mismos (p: 0,049) y la media se mantuvo por encima del límite superior de referencia, lo que resulta inapropiado para dichos niveles de calcemia y sugiere una menor sensibilidad a la regulación negativa ejercida por el calcitriol. La calciuria de 24 y 2 hs aumentó en forma similar y significativa en ambos grupos respecto al basal.
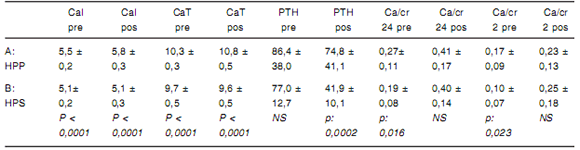
Se comparó cada uno de los parámetros (pre y pos prueba) entre grupos para determinar su utilidad en el diagnóstico del HPP (Tabla II). Los niveles basales de CaT y CaI fueron significativamente mayores en el grupo A. Esta diferencia se incrementó sustancialmente luego de la administración de calcitriol. Es importante destacar que los niveles basales de PTH no presentaron diferencias significativas entre ambos grupos, por lo que no permiten distinguir en forma fiable entre ambas formas de hiperparatiroidismo. Luego de la administración de calcitriol, se produce un descenso de PTH que es significativamente mayor en el grupo B. Así, la brecha entre ambos grupos se vuelve muy significativa, aumentado el potencial discriminatorio de dicha determinación pos ingesta de calcitriol. En el grupo A la hipercalciuria pos prueba podría explicarse por el aumento de la calcemia y por consiguiente de la carga filtrada, al igual que sucede en el HPP clásico. En cambio, en el grupo B la calciuria aumentó en el 82 % de los pacientes (24/29) en forma independiente de la calcemia (que se mantuvo estable) lo que orienta hacia un mecanismo de pérdida tubular a nivel renal. En el seguimiento de algunos de dichos pacientes, la administración de tiazidas logró reducir la calciuria y normalizar los niveles de PTH sin incrementar la calcemia, lo que sugeriría la presencia de HPS por hipercalciuria subclínica en los mismos.
TABLA II. Diferencias de CaI, CaT, PTH séricos y Ca/Cr urinaria entre grupos A y B
En todos los pacientes del Grupo A, el HPP fue confirmado por imágenes y/o cirugía. En el seguimiento a largo plazo (70 ± 34 meses), solo dos pacientes del grupo B se comportaron como un HPP clásico a los 17 y 37 meses, respectivamente. Así la prueba demostró, con la curva ROC, una sensibilidad y especificidad del 90 % y 100 % respectivamente para el diagnóstico de HPP (Figura 1).
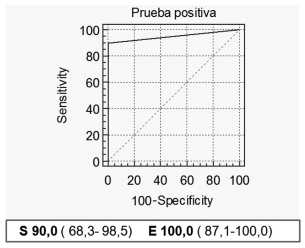
Figura 1. Curva ROC que muestra la sensibilidad (S) y especificidad (E) de la prueba de calcitriol para el diagnóstico de hiperparatiroidismo primario (HPP).
Analizando las curvas de cada parámetro en forma individual, observamos que respecto a la calcemia (total e iónica) la prueba de calcitriol aumenta significativamente la especificidad de dichas determinaciones (92,3 % y 100 % para valores de corte de 10,3 mg/dl y 5,5 mg/dl, respectivamente) y por lo tanto incrementa su valor predictivo positivo en el diagnóstico de HPP (Figuras 2 y 3).
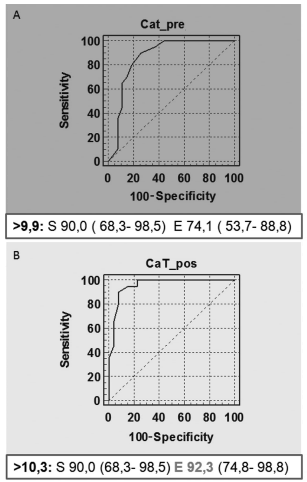
Figura 2. Curva ROC de calcio total (CaT) pre (A) y pos prueba (B). Se muestra la S y E para el punto de corte establecido por el programa para el diagnóstico de HPP.
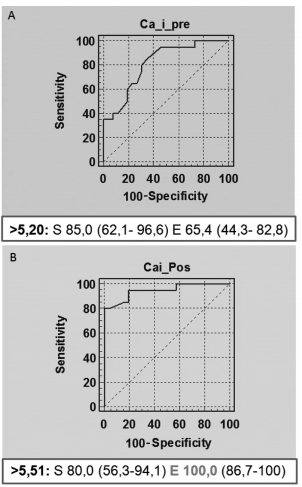
Figura 3. Curva ROC de calcio iónico (CaI) pre (A) y pos prueba (B). Se muestra la S y E para el punto de corte establecido por el programa para el diagnóstico de HPP.
Respecto al análisis de PTH, la curva muestra un aumento de la sensibilidad de dicha determinación a un 70 % luego de la prueba, con un valor de corte de 50,6 pg/ml (Figura 4). Resulta aún más interesante analizar la variación porcentual de los valores de PTH basales y luego de la administración de calcitriol. La reducción promedio para el grupo A fue de 15 % ± 27 mientras que la del grupo B de 44 % ± 18. Nuevamente, con el análisis de curvas ROC, podemos considerar un punto de corte de 30 % por debajo del cual la inhibición con calcitriol posee una sensibilidad del 85 % y una especificidad del 88 % para el diagnóstico de HPP (Figura 5).
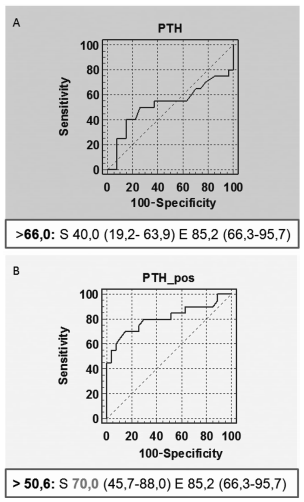
Figura 4. Curva ROC de PTH pre (A) y pos prueba (B). Se muestra la S y E para el punto de corte establecido por el programa para el diagnóstico de HPP.
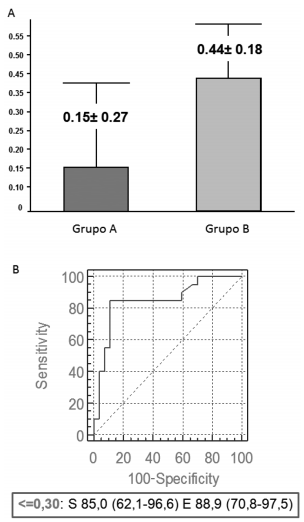
Figura 5. Reducción porcentual de PTH con calcitriol en grupos A y B (panel superior). Curva ROC de reducción porcentual pos prueba. Se muestra la S y E para el punto de corte establecido por el programa para el diagnóstico de HPP (panel inferior).
DISCUSION
El hiperparatiroidismo primario se caracteriza por la producción desregulada y autónoma de PTH(1,2). Actualmente se describen formas clínicas atípicas que dificultan el diagnóstico diferencial con el hiperparatiroidismo secundario(8-14).
Nuestro trabajo incluye pacientes en cuya evaluación bioquímica inicial presentaron una elevación mínima, intermitente o ausente de CaI, CaT y/o PTH en más de una muestra de sangre, con niveles de 25 OHD mayores a 20 ng/ml (media superior a 30 ng/ml) y sin otra causa de HPS.
En condiciones normales, el calcio extracelular inhibe la secreción de PTH a través de la activación de su receptor (CaSR) en la célula paratiroidea(30). Por otro lado, el calcitriol actúa de manera directa inhibiendo la transcripción del gen de preproPTH a través de su unión al receptor de vitamina D (VDR) en el núcleo de la célula paratiroidea, independientemente de su acción sobre la absorción intestinal de calcio(31-34). Dicho efecto inhibitorio justifica su utilización en pacientes con HPS a enfermedad renal con el fin de reducir los valores de PTH y sus comorbilidades(35-39).
Se ha demostrado que en el HPP la expresión de CaSR(19,20,46,47,48) y VDR(40-42) se reduce en forma significativa produciendo resistencia paratiroidea a la acción inhibitoria del calcio y el calcitriol. A raíz de este hecho, se han descripto pruebas de sobrecarga de calcio como herramienta de diagnóstico diferencial(21-28). En la descripción inicial de Broadus y col, el HPP presenta elevación de los niveles de calcemia e inapropiada supresión de PTH luego de la sobrecarga cálcica(22). En nuestro trabajo buscamos demostrar la autonomía en la producción de PTH a través de la inhibición con calcitriol asegurando un aporte adecuado de calcio.
Se utilizó una dosis diaria de 0,75 ug, similar a la dosis necesaria para lograr inhibición de iPTH mayor al 50% del basal en pacientes con hiperparatiroidismo secundario a enfermedad renal crónica en diálisis peritoneal(37).
La dosis se administró por 10 días consecutivos, buscando disminuir la síntesis de preproPTH y asegurar la depleción de la hormona disponible para ser secretada ante el estímulo(43).
Luego de la administración de calcitriol, los pacientes caratulados como HPP (Grupo A) incrementaron la calcemia, con reducciones promedio de 15 % en los valores de PTH, permaneciendo los mismos en su mayoría por encima de los valores de referencia. Estos resultados concuerdan con los de Mochink y col quienes encontraron luego de la sobrecarga oral con calcio una reducción de PTH promedio cercana al 17 % en pacientes con HPP leve, pero sin incrementar la calcemia(25). Esto último contrasta con nuestra experiencia, y la de otros autores en la que la administración de calcio oral provocó un aumento significativo de la calcemia con inadecuada supresión de PTH(22,27,28).
Los pacientes con HPS (Grupo B) se comportaron disminuyendo la PTH a valores normales, con un delta superior al 30 % (media 44 %) manteniendo calcemias normales, lo que evidencia la indemnidad del mecanismo de regulación fisiológica ejercido por el calcitriol. En dicho grupo la prueba desenmascaró la presencia de hipercalciuria sin modificar los niveles de calcemia, lo que sugiere un origen tubular renal independiente de la carga filtrada(44). En dichos pacientes, la administración posterior de tiazidas normalizó la PTH lo que abogaría en ese mecanismo fisiopatológico subyacente(45). La calciuria depende parcialmente de la ingesta de calcio y su elevación puede ser intermitente lo que dificulta su detección en algunos casos(49). Probablemente el aporte adecuado de calcio sumado al estímulo del calcitriol sobre la absorción intestinal permitieron poner de manifiesto la hipercalciuria subyacente.
Los niveles basales de PTH no permitieron diferenciar en forma fiable entre ambas entidades (sensibilidad 40 %, especificidad 85,2 %). La inhibición con calcitriol logró incrementar la sensibilidad diagnóstica de dicha determinación a un 70 % al poner en evidencia la autonomía de la célula paratiroidea. El análisis con curva ROC del porcentaje de reducción de PTH permitiría establecer que una disminución menor al 30 % sugiere el diagnóstico de HPP con una S 85 % y E 88%.
El seguimiento a largo plazo mostró que en el grupo A, el HPP fue confirmado posteriormente en el 100 % de los pacientes por cirugía y/o métodos de imagen. Solo 2 pacientes del grupo B se comportaron bioquímicamente como HPP clásico a los 17 y 37 meses, respectivamente, por lo que la prueba presentó una sensibilidad del 90 % y una especificidad del 100 % para el diagnóstico de HPP. Es interesante destacar que en dichos pacientes, a pesar de no haber elevado los niveles de calcemia en forma significativa, el porcentaje de supresión de PTH fue inferior al 30 % (25 % y 27 %), lo que podría sugerir cierto grado de autonomía subclínica que puede desarrollarse de manera gradual afectando diferentes grupos celulares dentro de una misma glándula. Algunos datos demuestran la presencia de distintos estatus funcionales de las células oxífilas y principales dentro de los adenomas paratiroideos y aportan pruebas de que el HPP puede surgir tanto por mecanismos clonales como policlonales(50).
Una de las fortalezas del trabajo es el tiempo de seguimiento de los pacientes (media 70 meses), en particular de los que se comportaron inicialmente como HPS, ya que el mismo permitió confirmar los resultados iniciales. Los alcances de la prueba podrían ser limitados ya que un pequeño porcentaje de pacientes (6,9 %) no mostró una respuesta típica. La utilidad de la prueba radicaría en la posibilidad de determinar la existencia de autonomía paratiroidea en forma rápida y poco invasiva, sobre todo en situaciones en las cuales el paciente tiene indicación quirúrgica por patología tiroidea a corto plazo.
1. Fraser WD. Hyperparathyroidism. Lancet 374:145-158, 2009 [ Links ]
2. Bilezikian JP, Silverberg SJ. Clinical spectrum of primary hyperparathyroidism. Rev Endocr Metab Disord 1:237-245, 2000 [ Links ]
3. Mundy GR, Coue DIT, Fisken R. Primary hyperparathyroidism: changes in the pattern of clinical presentation. Lancet 1:1317-1320, 1980 [ Links ]
4. Khosla S, Melton L III, Wermers RA, Crowson CS, O'Fallon W, Riggs B. Primary hyperparathyroidism and the risk of fracture: a population-based study. J Bone Miner Res 14:1700-1704, 1999 [ Links ]
5. Bilezikian JP, Brandi ML, Rubin M, Silverberg SJ. Primary hyperparathyroidism: new concepts in clinical densitometric and biochemical features. J Intern Med 257:6-17, 2005 [ Links ]
6. Bilezikian JP, Silverberg SJ. Asymptomatic primary hyperparathyroidism. N Engl J Med 350:1746-1751, 2004 [ Links ]
7. NIH Conference. Diagnosis and management of asymptomatic primary hyperparathyroidism: consensus development conference statement. Ann of Int Med 114:593-597, 1991 [ Links ]
8. Resnick LM, Laragh JH. Calcium metabolism and parathyroid function in primary hyperparathyroidism. Am J Med 78:385-390, 1985 [ Links ]
9. Tordjman KM, Greenman Y, Osher E, Shenkerman G, Sern N. Characterization of normocalcemic primary hyperparathyroidism. Am J Med. 117:861-3, 2004 [ Links ]
10. Lowe H, McMahon DJ, Rubin MR, Bilezikian JP, Silverberg SJ. Normocalcemic primary hyperparathyroidism: further characterization of a new clinical phenotype. J Clin Endocrinol Metab. 92:3001-5, 2007 [ Links ]
11. Broadus AE, Horst RL, Littledike ET, Mahaffey JE, Rasmussen H. Primary hyperparathyroidism with intermittent hypercalcaemia: serial observations and simple diagnosis by means of an oral calcium tolerance test. Clin Endocrinol (Oxf) 12:225-35, 1980 [ Links ]
12. Forster J, Monchik JM, Martin HF. A comparative study of serum ultrafiltrable, ionized, and total calcium in the diagnosis of primary hyperparathyroidism in patients with intermittent or no elevation in total calcium. Surgery 104:1137-1142, 1988 [ Links ]
13. Hollenberg AN, Arnold A. Hypercalcemia with low-normal serum intact PTH: a novel presentation of primary hyperparathyroidism. Am J Med 91:547-8, 1991 [ Links ]
14. Wallace LB, Parikh RT, Ross LV, Mazzaglia PJ, Foley C, Shin JJ, Mitchell JC, Berber E, Siperstein AE, Milas M. The phenotype of primary hyperparathyroidism with normal parathyroid hormone levels: how low can parathyroid hormone go?. Surgery 150:1102-12, 2011 [ Links ]
15. Ong GS, Walsh JP , Stuckey BG, Brown SJ, Rossi E, Ng JL, Nguyen HH, Kent GN, Lim EM. The importance of measuring ionized calcium in characterizing calcium status and diagnosing primary hyperparathyroidism. J Clin Endocrinol Metab 97:3138-45, 2012 [ Links ]
16. Nordenström E, Katzman P, Bergenfelz A. Biochemical diagnosis of primary hyperparathyroidism: Analysis of the sensitivity of total and ionized calcium in combination with PTH. Clin Biochem 44:849-52, 2011 [ Links ]
17. Khosla S, Ebeling PR, Firek AF, Burritt MM, Kao PC, Heath H. Calcium infusion suggests a set-point abnormality of parathyroid gland function in familial benign hypercalcemia and more complex disturbances in primary hyperparathyroidism. J Clin Endocrinol Metab 76:715-720, 1993 [ Links ]
18. Nygren P, Gylfe E, Larsson R, Johansson H, Juhlin C, Klareskoq L, Akerstrom G, Rastad J. Modulation of the Ca2C-sensing function of parathyroid cells in vitro and hyperparathyroidism. Biochim Biophys Acta 968:253-260, 1998 [ Links ]
19. Corbetta S, Mantovani G, Lania A, Borgato S, Vicentini L, Beretta E, Faglia G, Di Blasio AM, Spada A. Calcium-sensing receptor expression and signaling in human parathyroid adenomas and primary hyperplasia. Clin Endocrinol (Oxf) 52:339-348, 2000 [ Links ]
20. Gogusev J, Duchambon P, Hory B, Giovannini M, Goureau Y, Sarfati E. Depressed expression of calcium receptor in parathyroid gland tissue of patients with hyperparathyroidism. Kidney Int 51:328-336, 1997 [ Links ]
21. Howard JE, Hopkins TR, Connor TB. On certain physiologic responses to intravenous administration of calcium salts into normal, hyperparathyroid and hypoparathyroid persons. J Clin Endocrinol Metab 13:1-19, 1953 [ Links ]
22. Broadus AE, Deftos LJ, Bartter FC. Effects of the intravenous administration of calcium on nephrogenous cyclic AMP: use as a parathyroid suppression test. J Clin Endocrinol Metab 46:477-487, 1978 [ Links ]
23. Carmignani G, Belgrano E, Puppo P, Repetto U, Giusti M, Giordano G, Giuliani L. PTH radioimmunoassay and loading tests in the diagnosis of patients with primary hyperparathyroidism. Eur Urol 8:102-108, 1982 [ Links ]
24. McHenry CR, Rosen IB, Walfish PG, Pollard A. Oral calcium load test: diagnostic and physiologic implications in hyperparathyroidism. Surgery 108:1026-1031, 1990 [ Links ]
25. Monchik JM, Lamberton RP, Ruth U. Role of the oral calcium loading test with measurement of intact parathyroid hormone in the diagnosis of symptomatic subtle primary hyperparathyroidism. Surgery 112:1103-1109, 1992 [ Links ]
26. Bergenfelz A, Valdermarsson S, Ahren B. Suppression by calcium of serum levels of intact parathyroid hormone in primary hyperparathyroidism. Horm Res 39:146-151, 1993 [ Links ]
27. Gomes A, Lage M, Lazaretti-Castro M, Vieira JGH, Heilberg IP. Response to an oral calcium load in nephrolithiasis patients with fluctuating parathyroid hormone and ionized calcium levels. Braz J Med Biol Res 37:1379-1388, 2004 [ Links ]
28. Cadiot G, Houillier P , Allouch A, Paillard M, Mignon M. Oral calcium tolerance test in the early diagnosis of primary hyperparathyroidism and multiple endocrine neoplasia type 1 in patients with the Zollinger-Ellison syndrome. Gut 39:273-278, 1996 [ Links ]
29. Koh J, Dar M, Untch BR, Dixit D, Shi Y, Yang Z, Adam MA, Dressman H, Wang X, Gesty-Palmer D, Marks JR, Spurney R, Druey KM, Olson JA Jr. Regulator of G protein signaling 5 is highly expressed in parathyroid tumors and inhibits signaling by the calcium-sensing receptor. Mol Endocrinol 25:867-76, 2011 [ Links ]
30. Kumar R, Thompson JR. The regulation of parathyroid hormone secretion and synthesis. J Am Soc Nephrol 22:216-24, 2011 [ Links ]
31. Cantley LK, Russell J, Lettieri D, Sherwood LM: 1,25-Dihydroxyvitamin D3 suppresses parathyroid hormone secretion from bovine parathyroid cells in tissue culture. Endocrinology 117: 2114-2119, 1985 [ Links ]
32. Russell J, Lettieri D, Sherwood LM: Suppression by 1,25(OH)2D3 of transcription of the pre-proparathyroid hormone gene. Endocrinology 119:2864-2866, 1986 [ Links ]
33. Silver J, Russell J, Sherwood LM: Regulation by vitamin D metabolites of messenger ribonucleic acid for preproparathyroid hormone in isolated bovine parathyroid cells. Proc Natl Acad Sci U S A 82:4270-4273, 198 [ Links ]
34. Russell J, Bar A, Sherwood LM, Hurwitz S: Interaction between calcium and 1,25-dihydroxyvitamin D3 in the regulation of preproparathyroid hormone and vitamin D receptor messenger ribonucleic acid in avian parathyroids. Endocrinology 132:2639-2644, 1993 [ Links ]
35. Bover J, Egido J, Fernández-Giráldez E, Praga M, Solozábal-Campos C, Torregrosa JV, Martínez-Castelao A. Vitamin D, vitamin D receptor and the importance of its activation in patients with chronic kidney disease. Nefrología 35:28-41, 2015 [ Links ]
36. Ong LM, Narayanan P, Goh HK, Manocha AB, Ghazali A, Omar M, Mohamad S, Goh BL, Shah S, Seman MR, Vaithilingam I, Ghazalli R, Rahmat K, Shaariah W, Ching CH. Randomized controlled trial to compare the efficacy and safety of oral paricalcitol with oral calcitriol in dialysis patients with secondary hyperparathyroidism. Nephrology 18:194-200, 2013 [ Links ]
37. Jamaluddin EJ, Gafor AH, Yean LC, Cader R, Mohd R, Kong NC, Shah SA. Oral paricalcitol versus oral calcitriol in continuous ambulatory peritoneal dialysis patients with secondary hyperparathyroidism. Clin Exp Nephrol 18:507-14, 2014 [ Links ]
38. Rodriguez M, Munoz-Castaneda JR, Almaden Y. Therapeutic use of calcitriol. Curr Vasc Pharmacol 12:294-9, 2014 [ Links ]
39. Haiyang Zhou, Chenggang Xu. Comparison of intermittent intravenous and oral calcitriol in the treatment of secondary hyperparathyroidism in chronic hemodialysis patients: a meta-analysis of randomized controlled trials. Clin Nephrol 71:276-85, 2009 [ Links ]
40. Varshney S, Bhadada SK, Saikia UN, Sachdeva N, Behera A, Arya AK, Sharma S, Bhansali A, Mithal A, Rao SD. Simultaneous expression analysis of vitamin D receptor, calcium-sensing receptor, cyclin D1, and PTH in symptomatic primary hyperparathyroidism in Asian Indians Eur J Endocrinol 69:109-16, 2013 [ Links ]
41. Latus J, Lehmann R, Roesel M, Fritz P , Braun N, Ulmer C, Steurer W, Biegger D, Ott G, Dippon J, Alscher MD, Kimmel M. Involvement of a-klotho, fibroblast growth factor, vitamin D and calcium-sensing receptor in 53 patients with primary hyperparathyroidism. Endocrine 44:255-63, 2013 [ Links ]
42. Yano S, Sugimoto T, Tsukamoto T, Chihara K, Kobayashi A, Kitazawa S, Maeda S, Kitazawa R. Decrease in vitamin D receptor and calciumsensing receptor in highly proliferative parathyroid adenomas. Eur J Endocrinol 148:403-11, 2003 [ Links ]
43. Delmez JA, Tindira C, Grooms P , Dusso A, Windus DW, Slatopolsky E. Parathyroid hormone suppression by intravenous 1,25-dihydroxyvitamin D. A role for increased sensitivity to calcium. J Clin Invest 83:1349-55, 1989 [ Links ]
44. Broadus AE, Dominguez M, Bartter FC. Pathophysiological studies in idiopathic hypercalciuria: use of an oral calcium tolerance test to characterize distinctive hypercalciuric subgroups. J Clin Endocrinol Metab 47:751-60, 1978 [ Links ]
45. Eisner BH, Ahn J, Stoller ML. Differentiating primary from secondary hyperparathyroidism in stone patients: the "thiazide challenge". J Endourol 23:191-2, 2009 [ Links ]
46. Brown EM. Clinical lessons from the calcium-sensing receptor. Nat Clin Pract Endocrinol Metab 3:122-133, 2007 [ Links ]
47. Kantham L, Quinn SJ, Egbuna OI, Baxi K, Butters R, Pang JL, Pollak MR, Goltzman D, Brown EM. The calcium-sensing receptor (Ca-SR) defends against hypercalcemia indepen dently of its regulation of parathyroid hormone secretion. Am J Physiol Endocrinol Metab 297:E915-923, 2009 [ Links ]
48. Kifor O, Moore FD Jr, Wang P, Goldstein M, Va-ssilev P, Kifor I, Hebert SC and Brown EM. Reduced immunostaining for the extracellular Ca2+- sensing receptor in primary and uremic secondary hyperparathyroidism. J Clin Endocrinol Metab 81:1598-1606, 1996 [ Links ]
49. Coe FL, Favus MJ, Crokett T, Strauss AL, Parks JH, Porat A, Gant C & Sherwood LM. Effects of low calcium diet on urine calcium excretion, parathyroid function and serum 1.25(OH)2D3 levels in patients with idiopathic hypercalciuria and normal subjects. Am J Med 72:25-32, 1982 [ Links ]
50. Shi Y, Hogue J, Dixit D, Koh J, Olson JA Jr. Functional and genetic studies of isolated cells from parathyroid tumors reveal the complex pathogenesis of parathyroid neoplasia. Proc Natl Acad Sci U S A. 111:3092-7, 2014 [ Links ]














