Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista argentina de endocrinología y metabolismo
versão On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.52 no.4 Ciudad Autónoma de Buenos Aires set. 2015
MONOGRAFÍA
Rol del laboratorio en el diagnóstico del hiperaldosteronismo primario
Laboratory Role in the Diagnosis of Primary Aldosteronism
Azpiroz MB1, Calvo M1, Hunt MM1, Kutasz E1, Gutiérrez GA1, Romano L1, Santamaria S1, Zaidman VE1, Fenili C2, Ruibal G3
1 Alumnos III Curso de Especialista en Bioquímica Endocrinológica
2 Tutor III Curso de Especialista en Bioquímica Endocrinológica
3 Directora III Curso de Especialista en Bioquímica Endocrinológica
Correspondencia: Correspondencia: Cecilia Andrea Fenili - Tacuari 1389 7° B CABA (1139AAB) Teléfono: 54-11- 43116900. Mail: cecifenili@hotmail.com
RESUMEN
El aldosteronismo primario se considera actualmente el causante de un 8 a 12 % de los casos de hipertensión arterial. El aumento de su prevalencia es consecuencia de cambios en los criterios diagnósticos. El tamizaje inicial se realiza en el laboratorio determinando la relación aldosterona/actividad de renina plasmática, para lo que se requieren estrictas condiciones preanalíticas; condiciones de reposo o deambulación, evitando interferencias de drogas terapéuticas que pueden afectar el resultado, de obtención y de conservación de la muestra, entre otras. Debido a la alta variabilidad en la medición de la actividad de renina plasmática, (radioinmunoensayo operador dependiente), se está proponiendo el uso de la relación aldosterona/concentración de renina, (donde la concentración de renina se determina por un método automatizado) aunque aún no hay consenso. El método de tamizaje es fundamental para el inicio del estudio de un paciente e influye en la prevalencia actual. Una vez establecidos los valores de corte para cada laboratorio, los pacientes con tamizajes positivos deben ser sometidos a pruebas confirmatorias, por ejemplo sobrecarga con sodio, o supresión con fludrocortisona, para evidenciar la secreción autónoma de aldosterona. Una vez confirmada se debe diferenciar la causa; las principales son adenoma productor de aldosterona e hiperplasia adrenal bilateral. El diagnóstico temprano permite el tratamiento correcto, evitando comorbilidades causadas por la hipertensión arterial (HTA) y remodelaciones vasculares y cardíacas por el exceso de aldosterona. Los tratamientos clásicos para la HTA no siempre son de utilidad en el aldosteronismo primario, por ello es importante el diagnóstico de la patología.
Los autores declaran no poseer conflictos de interés.
Palabras claves: Aldosterona; ARP; Aldosteronismo primario; Renina
ABSTRACT
Primary aldosteronism is nowadays considered the cause of 8 to 12 % cases of hypertension. The increase in its prevalence is due to changes in diagnostic criteria. Initial screening is performed in the laboratory by obtaining the aldosterone to plasma renin activity ratio, for which strict preanalytical conditions are required, including; supine or upright posture; interaction of therapeutic drugs which may alter results; sample extraction and conservation, among others. Given the high variability in the measurement of plasma renin activity and its complexity (RIA), the use of the aldosterone to renin concentration ratio is proposed (where renin concentration is determined by an automated immunoassay), although no consensus has been reached in this matter. The screening method is essential to primarily identify those patients who should be further studied, and it influences the statistics on actual prevalence of primary aldosteronism. Once cutoff values have been determined for each laboratory, patients with positive screening results must be further submitted for confirmation tests, such as salt-loading test or fludrocortisone suppression test, in which the autonomous secretion of aldosterone is confirmed. Then, the cause of the excessive aldosterone production must be determined. The most common are aldosterone producing adenoma and bilateral adrenal hyperplasia. Early diagnosis allows for the correct treatment, minimizing comorbidities caused by hypertension and by vascular and cardiac remodelation due to the excess of aldosterone. Classic treatment for hypertension is not always useful in patients with primary aldosteronism; this is why it is important to know how to diagnose the underlying pathology.
No financial conflicts of interest exist.
Key words: Aldosterone; Plasma renin activity; Primary aldosteronism; Renin
AP ALDOSTERONISMO PRIMARIO
HAB HIPERPLASIA ADRENAL BILATERAL
GRA GLUCOCORTICOID REPRIMIBLE ALDOSTERONISM
APA ADENOMAS PRODUCTORES ALDOSTERONA
AGT I ANGIOTENSINA 1
AGT II ANGIOTENSINA 2
ECA ENZIMA CONVERTIDORA DE ANGIOTENSINA
RAA RELACIÓN ALDOSTERONA: ACTIVIDAD DE RENINA PLASMÁTICA
A ALDOSTERONA
ARP ACTIVIDAD DE RENINA PLASMÁTICA
CR CONCENTRACIÓN DE RENINA
SRAA SISTEMA RENINA ANGIOTENSINA ALDOSTERONA
R RENINA
PR PRORRENINA
IE INMUNOENSAYOS
CDP CONCORDANCIA DIAGNOSTICA PRESUNTIVA
RIA RADIOINMUNOENSAYO
HPLC CROMATOGRAFIA DE ALTA PERFORMANCE
QLIA QUIMIOLUMINSCENCIA
MS ESPECTROMETRIA DE MASA
SIT PRUEBA DE INFUSIÒN SALINA
SOLT PRUEBA DE SOBRECARGA ORAL DE SODIO
FST PRUEBA DE SUPRESION CON FLUDROCORTISONA
CAPT PRUEBA DE CAPTOPRIL
AVS CATETERISMO VENOSO ADRENAL
INTRODUCCIÓN
La hipertensión es una enfermedad común que afecta alrededor del 20 % de la población y se considera que el 95 % de estos pacientes presentan hipertensión esencial o idiopática(1).
Dentro de las causas secundarias de esta enfermedad, el aldosteronismo primario (AP) ha emergido como la forma más común de hipertensión arterial de causa endócrina(2). Su diagnóstico permite una terapia específica y dirigida, que lleva a mejorar la calidad de vida de los pacientes.
Definición
El AP incluye a un grupo de desórdenes en los cuales existe una producción inapropiadamente elevada de aldosterona (A), relativamente autónoma, y no suprimible por la sobrecarga salina. El AP puede ser causado por adenomas adrenales productores de A (APA), hiperplasia adrenal uni o bilateral (HAB), o en casos raros, por aldosteronismo suprimible con glucocorticoides (GRA, del Inglés: glucocorticoid remediable aldosteronism)(3).
Epidemiología
Tradicionalmente se consideraba que la prevalencia mundial de AP en pacientes con hipertensión arterial era menor al 1 %(4). Sin embargo, en la actualidad se puede afirmar, que la prevalencia es en realidad mayor(4) (Ver Tabla I). Esto se debe a la mayor detección de AP con el uso de nuevos criterios diagnósticos y métodos de tamizaje.
TABLA I. Prevalencia de pacientes hipertensos con AP no diagnosticados
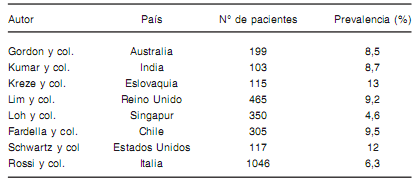
Modifcado de Young y col, 2003(4)
En la Argentina, hay pocos estudios realizados en el tema. Uno de los más relevantes es un estudio multicéntrico el cual dio como resultado una prevalencia de AP en una población de hipertensos de al menos un 3,2 %(5).
Fisipatología y Cuadro Clínico del AP
La renina (R) se sintetiza en el aparato yuxtaglomerular renal en forma de una proenzima, llamada prorrenina (PR). Se libera por estímulos específicos, como la disminución de la presión sanguínea y de la volemia. Los primeros 43 aminoácidos son escindidos para generar la molécula activa R, la cual es liberada a circulación. Esta enzima convierte el péptido hepático Angiotensinógeno en Angiotensina I (AGT I). Por la acción de la Enzima Convertidora de Angiotensina (ECA), que cliva la AGT I, se produce la Angiotensina II (AGT II); la cual estimula a la glándula adrenal para la síntesis de A(6). La A lleva a un aumento de la presión sanguínea por varios mecanismos: por el aumento de reabsorción de sodio con excreción de potasio en el túbulo colector; a nivel endotelial, por aumento de síntesis de endotelina, aumento de sensibilidad a mediadores constrictores y disminución de síntesis de óxido nítrico; y generando además un aumento del tono simpático(6) (Ver figura 1).
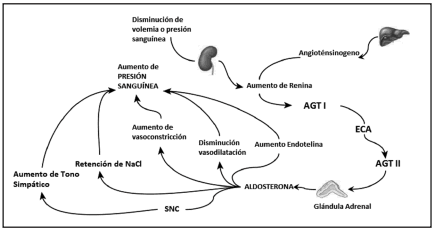
Figura 1. Mecanismos mediante los que la aldosterona aumenta la presión sanguínea.
La producción de aldosterona es regulada por el sistema Renina-Angiotensina-Aldosterona (SRAA). Entre los múltiples efectos de la aldosterona, hay acciones en el Sistema Nervioso Central (SNC), con la activación del tono simpático; estimulación renal para la retención de sodio; aumento en la vasoconstricción; disminución de la respuesta vasodilatadora; y estimulación de síntesis de endotelina. Modificado de Weiner D y col, 2013(6).
Existen dos causas principales de AP: APA y HAB(7). Otras causas menos frecuentes incluyen carcinomas adrenales y GRA(7). Esta última entidad se origina por la formación de una enzima quimérica que sintetiza A bajo la regulación de ACTH (1,3,7).
En el AP, la producción desregulada de la hormona A por parte de la corteza adrenal genera la retención excesiva de sodio, lo cual lleva al desarrollo de hipertensión arterial. Además, en algunos casos, se observa una excreción aumentada de iones potasio e hidrógeno, que en caso de ser prolongada y severa, puede llevar a hipokalemia(3) y alcalosis metabólica(8).
El exceso de A puede presentar además inflamación, remodelamiento y fibrosis en tejidos cardiovasculares y renales. Estos efectos parecen ser independientes de la elevación en la presión arterial(8).
El AP también se asocia a un aumento en la morbilidad cardiovascular dada por infarto de miocardio y arritmias(8).
La importancia del diagnóstico de AP radica tanto en la mayor morbimortalidad en estos pacientes respecto a hipertensos esenciales(2,3) y en la posibilidad de instauración de un tratamiento efectivo.
Tamizaje de AP
La Sociedad de Endocrinología (The Endocrine Society) redactó la Guía de recomendaciones para la detección, diagnóstico y tratamiento de pacientes con AP(3). Allí se propone estudiar grupos de pacientes que pueden presentar elevada prevalencia de AP, entre los cuales se incluyen:
● Pacientes hipertensos en estadío 2: presión arterial sistólica > 160-179 mm Hg y presión arterial diastólica > 100-109 mm Hg.
● Pacientes hipertensos en estadío 3: presión arterial sistólica > 180 mm Hg y presión arterial diastólica > 110 mm Hg.
● Pacientes con hipertensión resistente a drogas
● Pacientes afectados con hipokalemia "espontánea" o hipokalemia inducida por diuréticos.
● Pacientes hipertensos con incidentaloma adrenal.
● Pacientes hipertensos con historia familiar de hipertensión temprana o accidente cerebrovascular a temprana edad (<40 años).
● Familiares en primer grado de pacientes con AP.
La Sociedad Endocrinológica Japonesa recomienda realizar el tamizaje para AP a todo individuo que presente hipertensión arterial(10).
Aunque la hipokalemia ha sido considerada por muchos años como el elemento clásico para el diagnóstico de AP, estudios recientes demuestran que sólo el 20 % de los pacientes con AP presenta niveles disminuidos de potasio(1,11).
La implementación de la relación aldosterona: actividad de renina plasmática (RAA) descrita en 1981 por Hiramatsu y col(12) presenta un mayor valor predictivo positivo que la determinación aislada de A y Actividad de renina plasmática (ARP) para el tamizaje de AP(13,14).
Actualmente no existe consenso respecto al valor de corte para RAA debido a la alta variabilidad interensayo e interlaboratorio a valores bajos de ARP, a los diferentes inmunoensayos (IE) utilizados y a las distintas poblaciones estudiadas(1,5,13,15).
Al respecto, Pardes y col. en un estudio multicéntrico en nuestro país, establecieron un valor de corte para la RAA de 36 para pacientes con A >15 ng/dL(5). Recientemente el grupo chileno de Fardella y col. determinó un valor de corte de 24(1). En un estudio retrospectivo, Weinberger y col. hallaron que la combinación de RAA > 30 y una concentración de A mayor a 20 ng/dl presenta una sensibilidad del 90 % y una especificidad del 91 % para APA(15). Tiu y col. demostraron que un valor de corte de 66.9 presenta un 100 % de especificidad y un 64.5 % de sensibilidad, mientras que considerando un cut off de 23,6 la sensibilidad y la especificidad eran de 96.8 % y 94.1 % respectivamente(13).
Actualmente es posible la determinación de la concentración de R (CR) mediante IE. En losúltimos años diferentes grupos han realizado estudios de comparación entre CR y ARP, y aunque no está recomendado aún para el tamizaje, se ha demostrado que existe una buena correlación entre ambas determinaciones(9,16).
ROL DEL LABORATORIO
Aspectos preanalíticos
Tanto la ARP como la CR deben ser medidas en plasma con EDTA-K3 (EDTA tripotásico), éste quela los cofactores necesarios para la ECA, inhibiendo la conversión de AGT I en AGT II(17). La A puede ser medida tanto en plasma como en suero. Glinicki y col. mostraron que los niveles de A medidos por radioinmunoensayo (RIA) en fase sólida eran marcadamente superiores en plasma que en suero, observando diferencias desde 37 a 144 %(18). Taylor y col. describen lo mismo al medir A por cromatografía de alta performance (HPLC) y espectrometría de masa en tándem (MS/MS)(19).
La PR sérica puede activarse cuando se expone el plasma al frío y a bajo pH, esto puede llevar a la sobrestimación de los niveles de ARP. La Endocrine Society recomienda mantener las muestras a temperatura ambiente y congelar inmediatamente luego de separado el plasma para evitar la crioactivación de la PR.
La postura del paciente es un factor importante a considerar para determinar ARP, CR y A. Las muestras pueden obtenerse en posición erecta (luego de 2 hs de deambulación) o supina, luego de media hora de reposo. Cuando se adopta una postura erecta por un tiempo prolongado se produce la activación del Sistema Renina Angiotensina Aldosterona (SRAA) y el aumento consecuente de los niveles de A. Esto ocurre en 2/3 de los pacientes con AP, lo cual aumenta la sensibilidad de las pruebas de tamizaje. La Endocrine Society recomienda la toma de muestra luego de mantener una posición erecta durante 2 hs (sentado, parado o caminando) y de 5 a 15 minutos de estar sentado previo a la toma de muestra(3,20).
Debido a que la secreción de la A es ACTH dependiente, presenta ritmo circadiano, por lo que se sugiere la toma de la muestra de 8 a 9 de la mañana(22,23).
La restricción de sal en la dieta produce un aumento en los valores de ARP reduciendo el cociente RAA, por lo que no se recomienda su restricción(8,24).
Los fármacos utilizados habitualmente para el tratamiento de la hipertensión pueden influir en los resultados de las pruebas de distinta manera, ya que intervienen a distintos niveles del SRAA (ver Figura 2 y Tabla 2). Lo ideal es realizar las determinaciones antes de instaurar el tratamiento o con previa suspensión de la medicación, si fuese posible. Sin embargo si esto no fuese posible, debería considerarse la rotación a fármacos que no interfieran con las determinaciones de A y ARP o, en todo caso, mantener la medicación y evaluar los resultados del tamizaje considerando la influencia de los mismos(21).
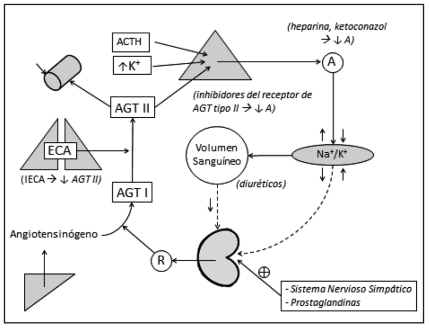
Figura 2. El SRAA y los principales factores farmacológicos que lo afectan AGI: Angiotensina I; AGT II: Angiotensina II; ECA: Enzima convertidora de angiotensina; IECA: inhibidores de la enzima convertidora de Angiotensina. Modificado de Myśliwiec y col., 2012(33)
TABLA II. Efectos de distintos fármacos sobre los valores de A, ARP y RAA.

A: Aldosterona; ARP: Actividad de renina plasmática; RAA: relación Aldosterona/ Actividad de renina plasmática; AGTII: Angiotensina II. Modifcado de Fardella y col., 2014(1)
MÉTODOS PARA DETERMINACION DE CR Y ARP
No existe un método de referencia para la medición de R, pero según la guía de la Endocrine Society, se recomienda la utilización de un método validado de ARP o CR(3).
Dado que la RAA es altamente dependiente del denominador, los ensayos de ARP deben ser lo suficientemente sensibles como para detectar valores bajos de actividad.
La determinación de la ARP por RIA es el método más utilizado con propósitos diagnósticos y de seguimiento. Sin embargo, este método es laborioso, complejo, consume mucho tiempo y por ser operador-dependiente, es difícil la comparación de resultados entre laboratorios(9).
Por otro lado, existen actualmente IE que miden CR, los cuales tienen algunas ventajas sobre los ensayos que miden ARP. Son menos laboriosos y tienen el potencial de una mejor estandarización y automatización, con lo cual reduce la variación entre laboratorios(16).
Mientras que al determinar ARP solo se mide la R bioactiva, los IE que cuantifican CR miden tanto la enzima activa como la inhibida (en los casos de tratamiento con inhibidores de R). El mismo anticuerpo de captura se puede utilizar tanto para la detección de PR y R porque se une a una región común a ambas moléculas que está distante del sitio activo; es el caso de los IE que miden R total, que cuantifican tanto la R como la PR en su conformación abierta y cerrada.
Por el contrario, existen otros IE para CR que utilizan en su diseño un anticuerpo de detección dirigido a una región adyacente al sitio activo que se expone cuando el prosegmento está ausente o cuando existe una conformación abierta de PR, pero que no se une cuando existe una conformación cerrada de PR ya que el prosegmento enmascara el sitio de unión; estos IE tienen una relación más cercana a los ensayos de ARP(25).
Determinación de ARP
El ensayo para determinación de ARP cuantifica la producción de AGT I (por RIA) generada por la R que actúa sobre el angiotensinógeno endógeno del plasma(26). En la interpretación de la ARP, se deben tener presentes no sólo las condiciones que afectan la concentración de R, sino también aquellas que afectan a la concentración de angiotensinógeno. Este se ve incrementado durante el embarazo, exceso de glucocorticoides, y en la administración de estrógenos y disminuye en la enfermedad hepática(27).
Una de las ventajas de esta metodología radica en la posibilidad de aumentar la sensibilidad de la misma, ajustando los tiempos de incubación de acuerdo con la ARP esperada(28). Esto resulta especialmente útil en pacientes con AP en los cuales se espera una ARP baja.
Determinación de Concentración de R
Los IE para la medida de CR son de tipo no competitivos y la marca del anticuerpo puede ser radiactiva o quimioluminiscente. Estos ensayos ofrecen ventajas particulares respecto de la ARP en cuanto a la especificidad y al límite de detección, ya que requiere el reconocimiento por parte de dos anticuerpos monoclonales diferentes, y la presencia de anticuerpos en exceso tanto de captura como de detección.
La especificidad de estos IE es variable y algunos pueden detectar, además de la R, la molécula de PR.
¿ARP, CR o ambos?
En un estudio realizado por Gruson y col. al comparar las mediciones de ARP y CR se obtuvo una correlación significativa entre los dos ensayos(10).
Dado que estos IE no miden la misma variable, solo es posible evaluar la Concordancia Diagnóstica Presuntiva (CDP) de sus resultados(9). Sin embargo está en discusión si la información brindada por los ensayos de CR aportan la misma información que la ARP. Estudios realizados por Fierro y col. muestran que existe una correlación altamente significativa entre los resultados de ARP y CR, con una CDP del 83 % para concentraciones medias y altas de ARP(9). Sin embargo, la CDP es menor y no aceptable para concentraciones bajas de ARP (< 1,3 ng/mL/hora). El método de CR sería de utilidad para un estudio inicial del paciente con el fin de descartar AP. Para CR bajas, debería recurrirse a la medición de ARP que presenta mayor sensibilidad para valores bajos de R. Otro estudio realizado por Glinicki y col. con 62 pacientes demostró una buena correlación entre RAA y el cociente A/CR tanto en posición supina como de pie luego de 2 hs de deambulación(29).
Determinación de Aldosterona
La cuantificación de aldosterona se puede realizar por RIA, Quimioluminiscencia (QLIA) y HPLC.
Los anticuerpos utilizados en los IE varían en cuanto a su afinidad y especificidad(27), repercutiendo en los resultados obtenidos. Schirpenbach y col. describen en su trabajo(27) una menor sensibilidad para el QLIA, en comparación al RIA, pero con una buena correlación entre ambos métodos. Se reporta una diferencia de la media de A de hasta tres veces, dependiendo del método utilizado, lo cual es atribuido a las distintas especificidades de los anticuerpos y a la falta de estandarización de los métodos. Finalmente sugieren una comparación a futuro con un método de referencia como MS.
El grupo de Taylor y col.(19) tomó esta sugerencia y validó un método semiautomatizado de HPLC-MS/MS y lo comparó con un IE (DPC Coat-a-Count™ aldosterone kit; DiagnosticProductsCorp). Ellos encontraron que la separación con HPLC aumenta la especificidad eliminando las interferencias que generan reacción cruzada en los IE.
A pesar que los métodos que implican separación cromatrográfica parecen tener una mejor reproducibilidad y especificidad son técnicas muy complejas por lo que requieren personal altamente especializado y equipamiento adecuado, de manera que no suelen utilizarse en el laboratorio de diagnóstico clínico.
La falta de estandarización unificada, la poca reproducibilidad interlaboratorios, y la limitada comparabilidad entre diferentes IE, producen muchas dificultades para medir A y, por lo tanto se requiere que cada laboratorio establezca sus propios valores de referencia y así poder definir valores de corte para diagnosticar AP(30).
Determinación de Aldosterona urinaria
La cuantificación de A en orina de 24 hs es utilizada en la etapa de confirmación diagnóstica de AP (ver más adelante).
Esta determinación es más sensible que una sola medición de A sérica ya que proporciona una estimación de los niveles de A del individuo durante todo un día(31) eliminando las variaciones diurnas. Sin embargo, la recolección de orina de 24 hs es incómoda y dificultosa.
Los métodos disponibles son RIA y HPLC-MS/MS.
Es importante considerar que la A se encuentra en la orina tanto libre como conjugada, formando distintos metabolitos entre ellos la aldosterona-18- glucurónido. Por lo tanto, algunos RIA pueden requerir un pretratamiento de hidrólisis ácida y extracción(32). Otros RIA prescinden de dicho pretratamiento y por lo tanto solo cuantifican la A libre urinaria.
PRUEBAS CONFIRMATORIAS PARA EL DIAGNÓSTICO DE AP
Los pacientes con tamizaje positivo deben ser sometidos a alguna de las pruebas confirmatorias para AP, cuyo objetivo es poner en evidencia la secreción autónoma de A.
En la guía de la Endocrine Society(3), se recomiendan las siguientes 4 pruebas:
. Prueba de Infusión salina (SIT)
. Prueba de sobrecarga oral de sodio (SOLT)
. Prueba de supresión con Fludrocortisona (FST)
. Prueba de Captopril (CAPT)
Dado que las mismas tienen distintas ventajas y desventajas (ver TABLA III) no es posible recomendar alguna por sobre las otras.
TABLA III. Ventajas y desventajas de las pruebas confirmatorias para el diagnóstico de AP

SIT: Prueba de Infusión salina; SOLT: Prueba de sobrecarga oral de sodio; FST: Prueba de supresión con fudrocortisona; CAPT: Prueba de Captopril; A: Aldosterona; ARP: Actividad de renina plasmatica. Información obtenida de(2,3,8,30,33-36)
1) SIT: consiste en la administración endovenosa de 2 litros de solución 0,9 % NaCl en el transcurso de 4 horas. Se dosa A basal y post infusión. La sobrecarga de sodio suprimiría al SRAA esperándose una disminución en el valor de A en condiciones normales. Los pacientes con AP presentan valores elevados de A luego de la prueba.
2) SOLT: el paciente es sometido a una dieta rica en sodio durante 3 días, luego de la cual debe recolectar orina de 24 horas para la determinación de A urinaria. Valores elevados de la misma ponen en evidencia la falta de supresión frente a una sobrecarga de sodio.
3) FST: se hospitaliza al paciente por 4 días durante los cuales se le administra oralmente cada 6 horas acetato de fludrocortisona, realizando también una dieta rica en sodio y recibiendo suplemento de cloruro de potasio para mantener los niveles de kalemia dentro de los valores normales. Al cuarto día se mide A, ARP (a las 10 de la mañana), y cortisol (a las 7 y a las 10 de la mañana). Como la fludrocortisona es un mineralocorticoide sintético su administración provoca la supresión del SRAA, por lo tanto una A elevada con una ARP suprimida es indicativo de AP. Es deseable que el cortisol de las 7 am sea mayor al de las 10 am, para excluir la influencia de la secreción de ACTH sobre la A.
4) CAPT: se administra una dosis de captopril (inhibidor de la ECA) al paciente el cual debe permanecer de pie o sentado durante la hora previa. En condiciones normales el captopril al bloquear la ECA aumentaría la determinación de renina y debería disminuir la concentración de Aldosterona. En pacientes con AP esto no se observa y la Aldosterona y la RAA se encuentra elevada a las 2 horas post dosis.
Más allá de la prueba elegida por cada centro, es importante que se establezcan las condiciones preanalíticas óptimas para su realización y se determinen los puntos de corte que permitan alcanzar la mejor especificidad y sensibilidad para confirmar el diagnóstico de AP.
CLASIFICACIÓN DE LOS SUBTIPOS DE AP
Cuando el resultado de alguna prueba confirmatoria es positiva, se debe proseguir con la clasificación del subtipo de AP.
Inicialmente se recomienda la realización de una tomografía computada. Esta metodología tiene importantes limitaciones para la subtipificación dado que:
- muchos APA son pequeños y el aspecto de la glándula resulta normal
- ciertas áreas hiperplásicas pueden aparentar microadenomas adrenales
- los macroadenomas adrenales unilaterales no funcionantes son frecuentes (especialmente en pacientes mayores de 40 años).
La resonancia magnética tampoco resulta de mayor utilidad, teniendo además como desventaja el mayor costo y una resolución espacial menor que la tomografía computada. Es por ello que se recomienda la realización del cateterismo venoso adrenal (AVS, del inglés adrenal venous sampling) en todo paciente que se plantea someter a cirugía.
El objetivo del AVS es evidenciar si el exceso de A se debe a la producción autónoma proveniente de una sola glándula adrenal (en general esto se debe a un APA) o por ambas glándulas (siendo en este caso, sugestivo de una HAB). El resultado de esta intervención es muy importante ya que del mismo va a depender el tratamiento que será instaurado al paciente. La sensibilidad y especificidad del estudio para la detección de la hiperproducción unilateral de A es del 95 % y 100 % respectivamente(3).
Se realiza el cateterismo de ambas venas adrenales y se toman al menos 2 muestras de cada una.
Al mismo tiempo se toman muestras de sangre periférica. Puede realizarse con o sin estimulación con ACTH y la toma de las muestras puede ser en simultáneo o secuencial.
Una vez tomadas las muestras se debe determinar A y cortisol. Este permite evaluar la correcta cateterización de las venas adrenales comparando la concentración del mismo en la muestra de sangre proveniente de la vena adrenal con la periférica.
Si la cateterización ha sido correcta se compara la concentración de A entre las muestras tomadas en ambas venas adrenales. Dependiendo del protocolo utilizado, con o sin estimulación con ACTH, relaciones mayores a 4:1 o 2:1, respectivamente, son indicativos de unilateralidad en la hiperproducción de A y por lo tanto de APA.
La medición de A y cortisol de las venas adrenales requiere mucho cuidado ya que las concentraciones pueden ser muy elevadas, y errores mínimos en la dilución de la muestra y la técnica del ensayo pueden tener un efecto mayor en los resultados(8).
CONCLUSIÓN
El AP es una patología caracterizada por una producción inapropiadamente alta de A, siendo la forma más común de hipertensión arterial de causa endócrina. La prevalencia mundial de la misma se encuentra subestimada debido a que: no se sospecha, a la falta de consenso en los criterios diagnósticos, y a la ausencia de estandarización de los métodos utilizados.
Según la Endocrine Society, el tamizaje debe realizarse mediante la RAA en todos los pacientes con alta probabilidad de AP. Aunque debe tenerse en cuenta que no existe un valor de corte consensuado para la RAA, ni una estandarización en las metodologías utilizadas para la evaluación de A y ARP y que aún existen controversias en cuanto a las condiciones preanalíticas necesarias para la correcta determinación de estos analitos.
La ARP se determina por RIA, y a pesar de poder incrementar la sensibilidad de la misma ajustando los tiempos de incubación, este método es laborioso, complejo y operador dependiente, por lo que se desarrollaron IE que miden CR. La determinación de CR es útil para el descarte inicial de AP. En los casos de CR baja es obligatorio confirmar el resultado con determinación de ARP debido a su mayor sensibilidad para valores bajos de R.
Estos ensayos no miden la misma variable, sin embargo en varios trabajos se demuestra una alta CDP.
La A puede cuantificarse por RIA, QLIA y HPLC, siendo los dos primeros los más utilizados en el diagnóstico clínico.
Los pacientes con tamizaje positivo deben ser sometidos a algunas de las pruebas confirmatorias. Una vez confirmado el diagnóstico se debe determinar el subtipo de AP, para la instauración del tratamiento adecuado.
Dadas la dificultades citadas anteriormente se recomienda que cada laboratorio tenga en cuenta las condiciones preanalíticas necesarias, la anamnesis del paciente y determine sus propios valores de referencia y puntos de corte para los métodos utilizados. Siendo, a su vez, importante que el seguimiento del paciente se realice con la misma metodología.
1. Fardella CE, Mosso GL, Gomez SC, Cortes PP, Soto MJ, Gomez L, Pinto M, Huete GA,Montero LJ, Oestreicher E, Foradori CA.Primary Hyperaldosteronism in Essential Hypertensives :Prevalence, Biochemical Profile and Molecular Biology.J Clin. Endocrinol. Metab. 85(5):1863-1867, 2014 [ Links ]
2. Mulatero P, Milan A, Fallo F, Regolisti G, Pizzolo F, Fardella C, Mosso L, Marafetti L, Veglio F, Maccario M. Comparison of confirmatory tests for the diagnosis of primary aldosteronism..J. Clin. Endocrinol.Metab. 91(7):2618-23, 2006 [ Links ]
3. Funder JW, Carey RM, Fardella C, Gomez-Sanchez CE, Mantero F, Stowasser M, Young WF Jr, Montori VM. Case detection, diagnosis, and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline.J. Clin. Endocrinol.Metab. 93(9):3266-81, 2008 [ Links ]
4. Young WF Jr. Minireview:primary aldosteronism-changing concepts in diagnosis and treatment. Endocrinology. 144(6):2208-13, 2003 [ Links ]
5. Pardes E, Belli S, Cornaló D, Contreras L, Costa L, Chervin R, Damilano S, Fenili C. Determinación del valor de corte de la relación aldosterona / actividad de renina plasmática para la detección de hiperaldosteronismo primario en hipertensión arterial esencial :estudio multicéntrico. Rev. Argent. Endocrinol. Metab .47(2):27-39, 2010 [ Links ]
6. Weiner DI. Endocrine and hypertensive disorders of potassium regulation:Primary aldosteronism. Semin. Nephrol. 33(3):265-276, 2013 [ Links ]
7. Andreas Moraitis and Constantine Stratakis. Adrenocortical Causes of Hypertension. International Journal of Hypertension, vol. 2011, Article ID 624691, 10 pages, 2011 [ Links ]
8. Stowasser M, Taylor PJ, Pimenta E, Ahmed AH, Gordon RD. Laboratory Investigation of Primary Aldosteronism. Clin Biochem Rev. 31(2):39-56, 2010 [ Links ]
9. Fierro MF, Lupi S, Ilera V, Damilano S, Glikman P, Fenili C. Medición de la concentración plasmática de renina inmunoreactiva por un método automatizado y su correlación con la actividad de renina plasmática. Rev. Argent. Endocrinol. Metab. 50(2):71-77, 2013 [ Links ]
10. Nishikawa T, Omura M, Satoh F, Shibata H, Takahashi K, Tamura N, Tanabe A, Task Force Committee of Primary Aldosteronism , The Japan Endocrine Society. Guidelines for the diagnosis and treatment of primary aldosteronism - The Japan Endocrine 2009. Endocr. J. 58(9):711-721, 2011 [ Links ]
11. Loh KC, Koay ES, Khaw MC, Emmanuel SC, Young WF Jr. Prevalence of primary aldosteronism among asian hypertensive patients in Singapore .J. Clin. Endocrinol. Metab. 85(8):2854-2859, 2000 [ Links ]
12. Hiramatsu K, Yamada T, Yukimura Y, Komiya I, Ichikawa K, Ishihara M, Nagata H, Izumiyama T. A screening test to identify aldosterone-producing adenoma by measuring plasma renin activity. Results in hypertensive patients.Arch. Intern. Med. 141(12):1589-1593, 1981 [ Links ]
13. Tiu SC, Choi CH, Shek CC, Ng YW, Chan FK, Ng CM, Kong AP.The use of aldosterone-renin ratio as a diagnostic test for primary hyperaldosteronism and its test characteristics under different conditions of blood sampling. J. Clin. Endocrinol. Metab.90 (1):72-8, 2005 [ Links ]
14. Perschel FH, Schemer R, Seiler L, Reincke M, Deinum J, Maser-Gluth C, Mechelhoff D, Tauber R, Diederich S. Rapid screening test for primary hyperaldosteronism:ratio of plasma aldosterone to renin concentration determined by fully automated chemiluminescence immunoassays. Clin. Chem. 50(9):1650-5, 2004 [ Links ]
15. Weinberg MH, Fineberg NS. The Diagnosis of primary aldosteronism and separation of two major subtypes.Arch. Intern. Med.153(18):2125-2129, 1993. [ Links ]
16. De Bruin RA, Bouhuizen A, Diederich S, Perschel FH, Boomsma F, Deinum J. Validation of a new automated renin assay, Clin. Chem. 50(11):2111-2116, 2004 [ Links ]
17. Eley JD, Kelly JH. Importance of incubation conditions in measuring renin activity. Clin. Chem. 23(10):1944-1945, 1977 [ Links ]
18. Glinicki P, Jeske W, Gietka-Czernel M, Bednarek-Papierska L, Kruszynska A, Slowinska-Srzednicka J, Zgliczynski W. The effect of blood collection procedure on plasma renin activity (PRA) and concentrations of direct renin (DRC) and aldosterone. Journal of the Renin-Angiotensin Aldosterone System. Vol. 16(2):339-343, 2015 [ Links ]
19. Taylor PJ, Cooper DP, Gordon RD, Stowasser M. Measurement of aldosterone in human plasma by semiautomated HPLC-tandem mass spectrometry. Clin. Chem.. 55(6):1155-62, 2009 [ Links ]
20. J. Brossaud and J.-B.Corcuff. Pre-analytical and analytical considerations for the determination of plasma renin activity., Clin. Chim.Acta., vol. 410, no. 1-2, pp. 90-2, Dec. 2009 [ Links ]
21. Mulatero P, Rabbia F, Milan A, Paglieri C, Morello F, Chiandussi L, Veglio F. Drug Effects on Aldosterone/Plasma Renin Activity Ratio in Primary Aldosteronism", Hypertension, vol. 40, no. 6, pp. 897-902, Oct. 2002 [ Links ]
22. Gordon RD, Wolfe LK, Island DP, Liddle GW. A diurnal rhythm in plasma renin activity in man., J. Clin. Invest. 45(10):1587-1592, 1966 [ Links ]
23. Gordon RD. The challenge of more robust and reproducible methodology in screening for primary aldosteronism. J. Hypertens. 22(2):251-255, 2004 [ Links ]
24. Tuck ML, Dluhy RG, Williams GH. Sequential responses of the renin-angiotensin-aldosterone axis to acute postural change:effect of dietary sodium. J. Lab. Clin. Med. 86(5):754-763, 1975 [ Links ]
25. Campbell DJ, Nussberger J, Stowasser M, Danser HJ, Morganti A, Frandsen E, Ménard J. Activity assays and immunoassays for plasma Renin and prorenin:information provided and precautions necessary for accurate measurement. Clin. Chem., vol. 55, N° 5, pp. 867-77, May 2009 [ Links ]
26. Bragat AC, Blumenfeld J, Sealey JE. Effect of high-performance liquid chromatography on plasma angiotensin II measurements in treated and untreated normotensive and hypertensive patients. J. Hypertens.15(5):459-65, 1997 [ Links ]
27. Degos F, Benhamou JP, Menard J, Salmon J, Raynaud JP. Plasma renin substrate sensitivity to oestrogens and oestrogen metabolism in cirrhosis. Eur. J. Clin. Invest. 8(4):243-248, 1978 [ Links ]
28. Sealey JE. Plasma renin activity and plasma prorenin assays. Clin Chem. 37(10):1811-1819, 1991 [ Links ]
29. Glinicki P, Jeske W, Bednarek-Papierska L, Kruszynska A, Gietka-Czernel M, Rosłonowska E, Słowinska-Srzednicka J, Kasperlik-Załuska A, Zgliczynski W.The ratios of aldosterone / plasma renin activity (ARR) versus aldosterone / direct renin concentration (ADRR). Journal of the Renin-AngiotensinAldosterone System. 1-8, 2014 [ Links ]
30. Mulatero P, Dluhy RG, Giacchetti G, Boscaro M, Veglio F, Stewart PM. Diagnosis of primary aldosteronism:from screening to subtype differentiation. Trends Endocrinol. Metab.16:114-9, 2005 [ Links ]
31. Abdelhamid S, Blomer R, Hommel G, Haack D, Lewicka S, Fiegel P, Krumme B. Urinary tetrahydroaldosterone as a screening method for primary aldosteronism:a comparative study. Am. J. Hypertens. 16(7):522-30, 2003 [ Links ]
32. Ceral J, Malirova E, Ballon M, Solar M. The role of urinary aldosterone for the diagnosis of primary aldosteronism. Horm. Metab.Res. 46(9):663-7, 2014 [ Links ]
33. Mysliwiec and M. Górska. Primary aldosteronism:A common and important problem A practical guide to the diagnosis and treatment. EndokrynologiaPolska, vol. 63, no. 4. pp. 324-336, 2012 [ Links ]
34. K. Nanba, T. Tamanaha, K. Nakao, S.-T. Kawashima, T. Usui, T. Tagami, H. Okuno, A. Shimatsu, T. Suzuki, and M. Naruse. "Confirmatory testing in primary aldosteronism.," J. Clin. Endocrinol. Metab., vol. 97, N° 5, pp. 1688-94, May 2012 [ Links ]
35. W. Arlt. "A detour guide to the Endocrine Society Clinical Practice Guideline on case detection, diagnosis and treatment of patients with primary aldosteronism.," Eur. J. Endocrinol., vol. 162, no. 3, pp. 435-438, 2010 [ Links ]
36. Rossi GP, Belfiore A, Bernini G, Desideri G, Fabris B, Ferri C, Giacchetti G, Letizia C, Maccario M, Mallamaci F, Mannelli M, Palumbo G, Rizzoni D, Rossi E, Agabiti-Rosei E, Pessina AC, F. Mantero F. "Comparison of the captopril and the saline infusion test for excluding aldosteroneproducing adenoma.," Hypertension, vol. 50, no. 2, pp. 424-431, 2007 [ Links ]














