Introducción
Los estados hiperandrogénicos son entidades clínicas que cursan con un exceso de andrógenos. Se determina por niveles aumentados de Testosterona total (TT), de T biodisponible (Tbio) y/o de T libre (TL). Resulta útil también la valoración de los precursores de T como la DHEA sulfato (DHEAs) y la Androstenediona (A4), así como de otros metabolitos los cuales son importantes y cuyo significado clínico discutiremos en el desarrollo de esta revisión1-4. El andrógeno de mayor potencia biológica es la 5 alfa dihidrotestosterona (5α DHT) producida por la acción de la 5α reductasa (5α R) sobre la T. Aunque han sido descriptos trabajos que evalúan este esteroide, todavía no es de aplicación rutinaria debido a sus escasos niveles circulantes y a que no se han desarrollado técnicas de difusión masiva con la sensibilidad apropiada para poder evaluarlo. Haremos un resumen de lo que se ha presentado en la literatura y discutiremos técnicas indirectas para evaluar la actividad 5α R. Clínicamente, las pacientes hiperandrogénicas se caracterizan por presentar hirsutismo, acné, seborrea y/o alopecia; además, pueden estar asociadas entre otras patologías a oligo-anovulación, infertilidad y manifestaciones de insulino-resistencia (IR). En general, la significación clínica de mayor relevancia y frecuencia para evaluar los niveles androgénicos en mujeres está dado en las siguientes situaciones:
● En el diagnóstico de hirsutismo idiopático conjuntamente con otras determinaciones, con imágenes y la clínica2. ● En el diagnóstico del síndrome de ovario poliquístico (SOP)3-4. ● En el estudio de mujeres con tumores virilizantes.
Esta revisión se centralizará en parte en la importancia de la determinación de TT y TL y su significación en el diagnóstico del SOP, particularmente en los fenotipos de los mismos. El énfasis de esta presentación estará dado en la revisión bibliográfica y en la discusión de nuestros resultados referidos a los métodos previos y actuales respecto a las modificaciones en la sensibilidad, especificidad y precisión de su determinación. También se discutirán las limitaciones de dichas metodologías y los criterios de validación de las mismas. A) Parámetros relevantes para la fenotipificación del SOP. Diversos consensos realizados El SOP es considerado cuando la paciente presenta todas o algunas de las siguientes características: ● Cuadro clínico compatible con hiperandrogenismo clínico y/o bioquímico con niveles aumentados de TT y/o algunos de sus precursores. ● Imágenes de ovarios poliquísticos. ● Alteraciones del ciclo menstrual. Las distintas reuniones de consensos realizados por expertos en el marco de diferentes sociedades científicas han definido distintos fenotipos que fueron apareciendo con el transcurrir del tiempo. Esto no significó que una nueva fenotipificación haya invalidado la anterior. En diferentes trabajos actuales los distintos investigadores adoptan como criterio de selección aquel que considera más relevante para el estudio que se desea realizar. En general, las de mayor difusión son tres, y el resumen de los criterios consensuados se muestra en la fig. 1:
1. Conferencia de expertos auspiciado por el National Institute of Child Health and Human Disease. National Institute of Health (NIH) 16-18 de abril, 19905.
2. Consenso Rötterdam 2003
Modificaciones al consenso de 1990 respecto al criterio diagnóstico del SOP6.
Con este consenso, se considera SOP cuando la paciente presente al menos dos de los tres criterios enunciados6. 3. Posición de la Androgen Excess Society-Polycystic Ovary Syndrome (AES-PCOS)7.
Se considera a una paciente con SOP cuando presenta hiperandrogenismo clínico y/o bioquímico con uno o ambos criterios de la disfunción ovárica7.
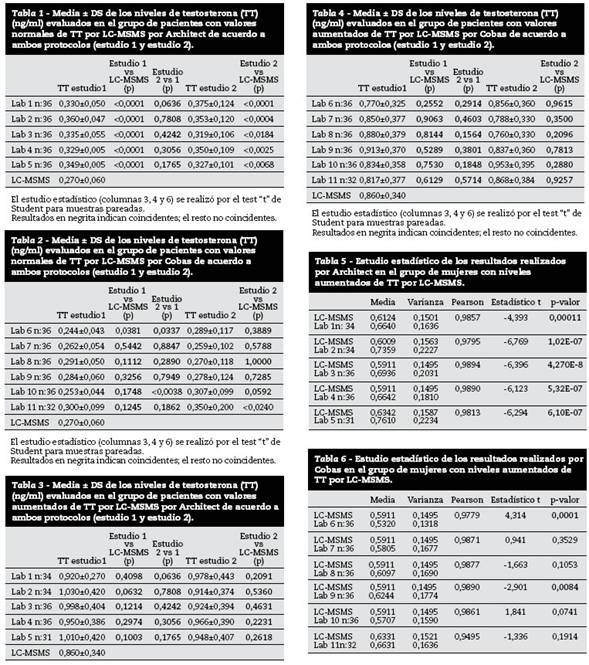
Tabla 1 Media ± DS de los niveles de testosterona (TT) (ng/ml) evaluados en el grupo de pacientes con valores normales de TT por LC-MSMS por Architect de acuerdo a ambos protocolos (estudio 1 y estudio 2).
Para los tres consensos deben excluirse pacientes que presenten otros excesos de andrógenos o patologías relacionadas tales como: disfunción tiroidea, hiperprolactinemia, hiperplasia adrenal no clásica (CYP21), Síndrome de Cushing, Neoplasmas Secretores de Andrógenos y HAIR - AN.
Según el criterio NIH 1990, se considera SOP los fenotipos A, B, D, E, G y H. El uso de este criterio no evalúa la imagen ecográfica ovárica (fig. 1-B). El criterio es hiperandrogenismo con anovulación crónica.
Adoptando el criterio de Rötterdam, son considerados SOP todos los fenotipos descriptos (fig. 1-C). Según este criterio, es posible el diagnóstico de SOP sin hiperandrogenismo (fenotipo J) así como pacientes ovulatorias (fenotipos C, F y H). Según el criterio adoptado por la AES PCOS, no son consideradas SOP pacientes sin hiperandrogenismo clínico y/o bioquímico, fenotipo J (fig. 1-D).
Es posible definir como SOP pacientes con resultados positivos para uno de los criterios de disfunción ovárica sin hiperandrogenismo clínico pero con niveles aumentados de andrógenos (fenotipos G, H e I) o con niveles androgénicos normales pero con hiperandrogenismo clínico (fenotipos D, E y F). El comité de expertos del NIH elaboraron un documento (Final Report National Institute of Health. Evidence - based methodology. Workshop on Polycystic Ovary Syndrome (PCOS), diciembre 3-5/2012 https://prevention.nih.gov/docs/programs/ pcos/FinalReport.pdf) cuyos principales resultados han sido resumidos y comunicados recientemente8. De acuerdo con este criterio se recomienda mantener el criterio más amplio del consenso de Rötterdam pero focalizando la necesidad para la identificación del fenotipo en cada paciente, resultando la identificación en cuatro fenotipos posibles: 1. Hiperandrogenismo clínico (HC) y/o bioquímico (HB) y anovulación crónica (AC). 2. HC y/o HB y ovarios poliquísticos (OP) pero con ciclos ovulatorios. 3. AC y OP sin HC o HB. 4. HC y/o HB, AC y OP. Es posible definir como SOP pacientes con resultados positivos para uno de los criterios de disfunción ovárica sin hiperandrogenismo clínico pero con niveles aumentados de andrógenos (fenotipos G, H e I) o con niveles androgénicos normales pero con hiperandrogenismo clínico (fenotipos D, E y F o fenotipos 1), 2) y 4) del consenso NIH 2012). De lo expresado anteriormente surge la importancia de que la determinación de TT sea realizada por una técnica validada para evitar que falsos positivos o negativos modifiquen la fenotipificación de pacientes con SOP. La definición de la imagen de ovarios poliquísticos ha sido parcialmente modificada recientemente. El estudio realizado por el Grupo de Tareas de la Androgen Excess and Polycystic Ovary Syndrome Society (AES-PCOS), estudiando un grupo control vs SOP con métodos estadísticos apropiados, convergen hacia el valor umbral para considerar un incremento del número de folículos por ovario a ≥25 folículos en mujeres de 18-35 años, mientras que mantienen el criterio del volumen ovárico de ≥ a 10 ml. Este grupo usando el número de folículos por ovario a ≥25 folículos para la definición de la morfología ovárica del SOP recomienda que deba realizarse con tecnología de ultrasonido de alta definición con un transductor de frecuencia de ≥8 MHz. De no disponer de esta aparatología sugieren usar el volumen ovárico9. Por este consenso, al no dividir en fenotipos que presenten solamente hiperandrogenismo clínico o bioquímico agrupándolos como hiperandrogenismo clínico y/o bioquímico, resulta difícil la comparación con el criterio de los fenotipos de Rötterdam. El fenotipo 1 según NIH-2012 corresponde a los fenotipos B, E y H según los criterios de Rötterdam. El fenotipo 2 ovulatorio, según criterio del NIH-2012, correspondería a los C, F e I de Rötterdam. El fenotipo 3 (NIH-2012) sin hiperandrogenismo correspondería al fenotipo J de Rötterdam. El fenotipo 4 según criterio de NIH-2012 a los fenotipos A: hiperandrogenismo clínico y bioquímico; D: hiperandrogenismo clínico, y G: hiperandrogenismo bioquímico; los 3 subgrupos con alteraciones del ciclo menstrual y ovarios poliquísticos. La complejidad del diagnóstico de SOP desde su denominación a su correcta tipificación es actualmente motivo de preocupación. En cuanto a la denominación de ovarios poliquísticos, Andrea Dunaif y Carles Kettering (http:// education.questdiagnostics.com/presentations/from-distractionto- traction-redefining-polycystic-ovary-syndrome-pcos-as-amajor- metabolic-disorder?presentation_id=370) postulan que el SOP es una definición inapropiada debido a que los autores consideran que no son quistes sino estructuras realmente normales de los folículos ováricos, los cuales contienen ovocitos en proceso de maduración. Debido a un desbalance hormonal, la maduración de esos folículos se detiene en un tamaño aproximado de 10 mm. Se observa un incremento en el número de estos folículos aunque no están debidamente aclaradas las razones de este fenómeno. Se plantea en el futuro una reunión para tratar de definir apropiadamente esta patología. Las distintas sociedades científicas en reuniones de consenso de expertos en el tema, trataron de unificar los criterios en la definición y métodos que permita una fenotipificación apropiada que a su vez facilite una terapéutica adecuada. Diferentes guías, elaboradas entre otras por la Sociedad Europea de Endocrinología; la Asociación Americana de Clínicos Endocrinólogos; la Sociedad Australiana de Endocrinología y la Endocrine Society, han sido publicadas donde plantearon como muy importante resolver aspectos relacionadas a métodos diagnósticos, particularmente la cuantificación de andrógenos, aspectos relacionados al SOP en la adolescencia y menopausia, y cuál o cuáles fenotipos son los de mayor riesgo de desarrollar diabetes tipo 2, estado inflamatorio o enfermedad cardiovascular10-13. Respecto a la disfunción ovulatoria ha sido comunicado un criterio con algunas modificaciones; a saber: ● Oligomenorrea son ciclos de más de 35 días pero menos de 6 meses. ● Pacientes en amenorrea, aquellas con falta de menstruación por 6 a 12 meses luego que se haya establecido un patrón cíclico14. Ovario poliquístico se define según el criterio del comité de expertos del NIH quienes elaboraron el Final Report National Institute of Health. Evidence - based methodology. Workshop on Polycystic Ovary Syndrome, diciembre 3-5/2012. Se ha postulado que para el diagnóstico de SOP, uno o ambos de los criterios de ovarios poliquísticos o de disfunción ovárica son suficientes15. B) Hiperandrogenismo bioquímico Los marcadores bioquímicos para definir el hiperandrogenismo bioquímico son la TT, TL, DHEAs, A4 y de relevancia para el cálculo de la TL la SHBG, también como posible biomarcador de Resistencia a la Insulina (RI).
Testosterona total
La TT es el andrógeno de mayor concentración circulante y es el recomendado de primera elección para la evaluación del exceso de andrógenos en la mujer. Sin embargo se ha comunicado una considerable sobreposición de los niveles de TT en hirsutas con los valores obtenidos comparativamente en mujeres normales. Esto probablemente sea debido en parte a la falta de sensibilidad entre los diferentes kit comerciales. La mayoría de los laboratorios realizan la determinación de TT con kit comerciales empleando suero total sin extracción, los cuales resultan de escasa exactitud, particularmente en los valores obtenidos en mujeres normales.
Numerosos inmunoensayos reportan valores significativamente diferentes a los obtenidos empleando cromatografía gaseosa acoplada con espectrometría de masa (GC-MS) o cromatografía líquida en tándem con espectrometría de masa (LC-MSMS), metodología que ha sido recomendada como gold standard para la evaluación de esteroides.
Numerosas publicaciones demostraron que los métodos manuales o automatizados resultaron de baja performance para la determinación de TT a concentraciones baja de la hormona. Entre otras, las seleccionadas en esta revisión corresponden a las citas 16-21. Sin embargo en la literatura existen numerosas otras publicaciones en el mismo sentido y con la misma seriedad científica, no comunicadas en esta publicación solo por razones de espacio. Swerdloff resume la evolución de las diferentes metodologías para la evaluación de los esteroides sexuales (http://education.questdiagnostics. com/insights/65). Etapa inicial: Los inmunoensayos con anticuerpos por ejemplo RIA y ELISA, en principio manuales y luego los automatizados, permitieron resultados rápidos y baratos, pero en desmedro de la calidad, exactitud, precisión y reproducibilidad de los mismos. Clínicamente, el método debe ser reproducible y específico. Los inmunoensayos presentan gran variabilidad intra e inter laboratorios, especialmente a niveles bajos, en particular los esteroides en mujeres, hombres hipogonádicos y prepúberes. La especificidad depende del anticuerpo usado. Idealmente no debería reconocer moléculas de estructuras parecidas o isómeras; por ejemplo, un anticuerpo de TT ideal, no debería reconocer la epiT, 5α o 5β DHT u otras sustancias estructuralmente relacionadas. Etapa actual: LC tándem MS-MS. Muy preciso y exacto. Elimina las proteínas y puede separar la T de otros compuestos de estructura similar de la muestra. Consenso del Centers for Disease Control and Prevention (CDC)’s Hormone Standardization Project (CDCHoST Program). https://www.cdc.gov/labstandards/pdf/hs/ Testosterone_Protocol.pdf El Laboratorio de Ciencias del Centro Nacional de Salud Ambiental (USA) en consenso con los principales referentes de los inmunoensayos por numerosas publicaciones que demostraron las dificultades para determinar TT, especialmente las importantes diferencias entre las distintas técnicas, planificó un proyecto de estandarización, en base a la siguiente guía: ● Establecer un calibrador común (estándar primario). ● Especificar la matriz de cada kit comercial para calibrar los ensayos. ● Referir la técnica respecto a un método de referencia (El goal estándar para la calibración de los métodos en CDC: LC-MSMS). CDC reúne un conjunto de expertos en un esfuerzo para armonizar los ensayos, a efectos de que el resultado para una hormona sea el mismo en los distintos laboratorios con los mismos o diferentes métodos pero que hayan calificado en este programa.
Actualmente algunos fabricantes de reactivos en los insertos de sus kits de determinación de TT establecen que su método está referido a los resultados obtenidos por LC-MSMS o que en su momento fue validado por CDC. Bajo este nuevo concepto, decidimos realizar un nuevo estudio comparando métodos convalidados y no convalidados por CDC20.
Evaluamos los niveles de TT en 11 mujeres normales y 12 hirsutas cuyos criterios de inclusión o exclusión fueron previamente publicados22. En todas las muestras individuales de ambos grupos se evaluó TT por LC-MSMS (laboratorio Quest USA) y por los siguientes kits comerciales, algunos de ellos utilizados por más de 1 laboratorio: Architect 2G (laboratorio Abbott) método validado por LC-MSMS, Cobas 411(laboratorio Roche) metodología validada por CDC. Los restantes kits comerciales utilizados en este estudio refieren en sus respectivos insertos las características del perfil de calidad de sus ensayos pero no están validados o calibrados por LC-MSMS: RIA Immunotech, Access, Centauro e Immulite. La determinación de TT por LC-MSMS demostró que todos los valores en el grupo control fueron normales. En el grupo de mujeres hirsutas, 2 de las 12 pacientes tenían niveles de TT normales, en las restantes los valores fueron superiores al nivel de corte superior al método de referencia.
Respecto a las pacientes hirsutas se obtuvieron falsos positivos en uno o en los dos casos con valores de TT normal por LC-MSMS en los kits de Centauro, Immulite, RIA y Access. No se obtuvieron falsos positivos por Architect y Cobas. Nótese que estos dos últimos métodos fueron calibrados por LC-MSMS o validados por CDC, reforzando el concepto de la necesidad de normatizar la calibración de los métodos por LC-MSMS. En ninguno de los métodos se obtuvieron falsos negativos en el grupo de hirsutas.
El empleo de métodos automatizados o manuales requiere que la tecnología a emplearse esté validada contra un método gold standard, una posibilidad es hacerlo en el CDC. Es muy dificultoso que cada laboratorio valide en CDC el método que utiliza. Al emplear kit comerciales, los fabricantes de los mismos son quienes deberían validar su metodología. Ante esta situación estudiamos una manera indirecta de validar los métodos empleados. Utilizamos el criterio de aceptabilidad del CDC, que especifica que el bias en un número apropiado de muestras con concentraciones desde niveles de prepuberales hasta de hombres normales sea de ± 6,4% del bias del método de referencia (LC-MSMS), junio 2016 (http:www.cdc.gov/labstandars/pdf/hs/CDC_Certified_ Testosterone_Procedures.pdf)
Como hemos referido en el párrafo anterior, en este estudio empleamos una validación indirecta en niveles de TT determinados por LC-MSMS de 0,15 a 1,75 ng/ml. Calculamos el bias de cada laboratorio con su método y lo comparamos con el obtenido en las mismas muestras, determinando la TT por LC-MSMS, realizado por Quest Diagnostics, método validado en CDC en mayo del 2012 y revalidado anualmente hasta el presente. Los resultados obtenidos demostraron que los métodos de Roche y Abbott cumplieron satisfactoriamente los requisitos de validación en el grupo de mujeres hirsutas. Bias 2,3; 4,6 y 14,7 para Abbott y -6,4; -3,0; -8,5 y 18,9 para Roche. Los demás métodos no cumplieron los requisitos de aceptabilidad. En el grupo control, ninguno de los métodos cumplió satisfactoriamente el criterio de performance según la aceptabilidad para la validación del CDC22.
De modo que con niveles inferiores a 0,5 ng/ml, valor límite superior en mujeres normales, los resultados aunque aceptables presentan una gran variabilidad. A pesar de que resulta promisorio la performance de los kits de Abbott y Roche, los mismos presentan variabilidad entre laboratorios que los utilizan.
Actualmente estudiamos la variabilidad entre el mismo método en diferentes laboratorios, focalizado en la posibilidad de que estas diferencias pudieran deberse a diferentes lotes, errores en la calibración o problemas inherentes al equipo. Estas variables fueron los objetivos de este estudio tendiente a tratar de uniformar los resultados por lo menos en los dos fabricantes de kits con mejor performance. Se evaluaron alícuotas del mismo suero preparado por duplicado de 40 mujeres para determinar por los reactivos de Abbott (5 laboratorios) y Roche (6 laboratorios), en dos diferentes estudios:
● Por la técnica que habitualmente emplean los laboratorios, y ● Empleando de cada fabricante el mismo lote del kit calibradores y controles.
Una alícuota de cada suero fue enviada a Quest para la valoración de TT por LC-MSMS.
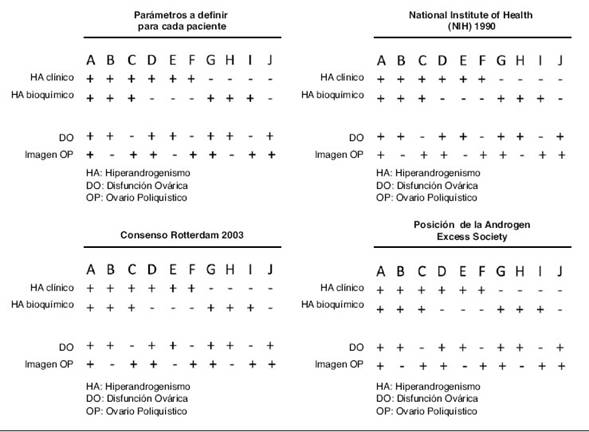
Figura 1 Diversos parámetros clínicos y bioquímicos para el diagnóstico de SOP (arriba izquierda). Sobre la base de esos parámetros, diversos consensos establecieron diferentes fenotipos (consensos identicados en la gura). Los criterios de cada uno de ellos resultan de la combinación de diversos parámetros que se circulan en rojo.
Los valores obtenidos por LC-MSMS permitieron dividir a las mujeres estudiadas en dos grupos: ● Con valores normales de TT. ● Con valores aumentados de TT. Los estudios estadísticos de los resultados de ambos métodos fueron realizados comparativamente a LC-MSMS23. Los resultados obtenidos por LC-MSMS en el grupo a): valores normales de TT (media ± DS ng/ml) 0,27 ± 0,06 y en el grupo b) valores aumentados de TT (media ± DS ng/ml) 0,86 ± 0,34. Los resultados obtenidos en esas mismas muestras en los laboratorios que usaron el kit de Abbott o el de Roche en los dos estudios se muestran en las figs. 2 y 3 y en las tablas 1 a 4.
Es posible concluir de estos estudios que en mujeres normales con niveles de TT menor a 0,5 ng/ml ni Architect ni Cobas fueron totalmente aceptables. Debe destacarse que tanto en el estudio 1 como en el 2, los resultados fueron no coincidentes con LC-MSMS. Sin embargo, los valores obtenidos fueron coincidentes entre los dos estudios efectuados en cada laboratorio y no se obtuvieron casos de falsos positivos. Los resultados realizados con Cobas, a niveles más bajos de TT se obtuvieron con una menor desviación que Architect respecto a LC-MSMS. Sin embargo en dos laboratorios se obtuvieron resultados no coincidentes. Los resultados con el test “t” de Student fueron coincidentes con los obtenidos con el bias de cada laboratorio respecto a LC-MSMS.
En síntesis, a niveles normales de TT, todos los laboratorios que usaron Abbott son significativamente diferentes respecto al método de referencia según el análisis de varianza y el coeficiente de correlación de Pearson. El estudio por bias evidencia un sesgo positivo; todos dieron resultados más altos que LC-MSMS. Con los mismos parámetros evaluados con Roche, 4 de los 6 laboratorios arrojaron resultados coincidentes con el método de referencia (p >0,05). Dos laboratorios que presentaron resultados significativamente diferentes con LC-MSMS, laboratorios 6 y 9, presentaron bias superior al límite de aceptabilidad (figs. 4, 5 y 6 y tablas 5 y 6). Los resultados del segundo estudio para ambos kits no fueron significativamente diferentes de los del primer estudio tanto para valores de TT normales como aumentados, indicando que las diferencias entre los valores obtenidos no parecería depender de distintos lotes de los kits, calibradores, controles empleados o servicio técnico de los equipos previos a las determinaciones23.
Para niveles de TT superiores a 0,5 ng/ml, ambos métodos resultaron totalmente aceptables.
Por todo lo mencionado anteriormente en la evaluación de TT para el diagnóstico de los diferentes fenotipos del SOP, adquiere singular importancia la exactitud en los resultados obtenidos, que dependerá de la metodología utilizada. Avalan este concepto diversas circunstancias, tales como:
● Emplear métodos validados cuando el laboratorio informa niveles aumentados de TT.
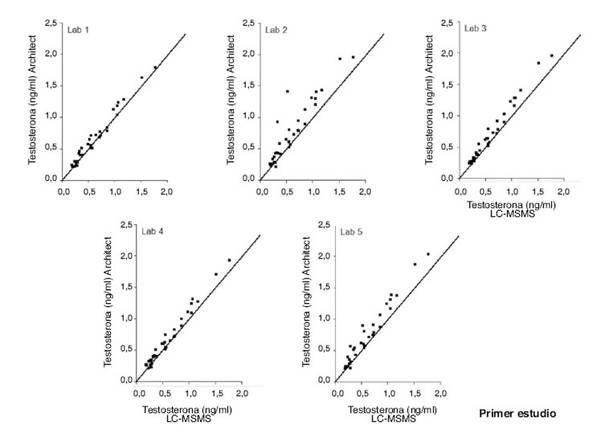
Figura 2 Relación entre los niveles de Testosterona determinados por 5 laboratorios que usaron el kit 2nd G de Abbott y los niveles del andrógenos en las mismas muestras determinados por LC-MSMS.
● Emplear métodos validados para definir la concentración de TT, indispensable para realizar el cálculo correcto de la TL y/o de la Tbio. ● La utilidad de la TT en la correcta tipificación de pacientes con SOP.
Este último punto es fundamental. Tomemos como base la nueva fenotipificación en 4 grupos de paciente con SOP. Si en los grupos 1 o 2, las pacientes que no presentan hirsutismo o que solo presentan una imagen de ovarios poliquísticos y la evaluación de TT se encuentra erróneamente en el rango normal, estas pacientes no serán fenotipificadas como SOP. Corresponderían erróneamente a anovulatorias. Si en pacientes del grupo 3 sin hirsutismo, los niveles de TT informados erróneamente normales se encontraban aumentados, estas pacientes no pertenecerían al grupo 3 sino al 4. La misma situación sería a la inversa: paciente sin hirsutismo del grupo 4 con niveles erróneamente aumentados de TT deberían corresponder al grupo 3. Estos casos inducirían una sobre o deficiente identificación de pacientes con SOP conllevando una posible acción terapéutica no apropiada.
Testosterona libre
La TT circula unida a proteínas de transporte, siendo la SHBG y la Albúmina las que han sido mayormente estudiadas. La TT se une a la SHBG con una constante de afinidad (Ka) de 1,6 x 109 M-1 y a la Albúmina con Ka de 104 M-1, vale decir 100.000 veces menor. La Ka es inversamente proporcional a la velocidad de disociación del complejo TT: proteína de transporte siendo > de 20 segundos y < de 20 segundo, para la SHBG y la Albúmina, respectivamente. Una porción de la TT circula sin unirse a las proteínas y constituye la fracción TL. Dado que 20 segundos es el tiempo de transporte para que una molécula pase de un vaso aferente a un capilar, la TL y la TT unida a la albúmina son capaces de entrar en un órgano, que si tiene receptores para ese esteroide, será un órgano blanco donde la TT ejercerá su acción biológica. En síntesis, una parte de la TL y el remanente de la TL + la unida a la albúmina, fracción biodisponible (Tbio) constituyen las fracciones biológicamente activas de la TT. Los niveles de TL y de Tbio dan la misma información fisiopatológica del nivel de acción androgénica debido a que ambas fracciones dependen directamente de la concentración de SHBG.
La determinación de la TL ha sido intentada por RIA empleando análogos isotópicamente marcados, sin embargo estos métodos están totalmente descartados debido a que sus resultados no son comparables con los obtenidos con el método gold standard25-26.
El índice de Andrógenos Libre (IAL) calculado como la relación entre la TT y la SHBG posiblemente sea la valoración más sensible para la evaluación del hiperandrogenismo en el SOP7. También es posible calcular la TL y Tbio adaptando la ecuación de la Ley de Masa27.














