Introducción
Las bacterias intestinales son importantes para el mantenimiento de la salud pues proporcionan energía, nutrientes y protección inmunológica contra especies patogénicas1. Por esta razón, la composición específica de la microbiota intestinal (reinos Firmicutes, Bacteroidetes y Actinobacteria) es crítica para el establecimiento y mantenimiento del equilibrio en la mucosa intestinal1,2. Las proporciones de bacterias en estos reinos difieren en dependencia del entorno demográfico y de los parámetros de salud3. Algunos estudios en humanos asocian la obesidad con la reducida representación de Bacteroidetes, disminución en la diversidad bacteriana y con el incremento en la expresión de los genes relacionados con las vías metabólicas para la utilización de lípidos y carbohidratos en las bacterias intestinales y su representación en el microbioma4. Diversos trabajos acerca de la asociación entre la microbiota intestinal y el desarrollo de la diabetes mellitus tipo 2 recomiendan establecer las principales especies bacterianas que se localizan en el intestino, con el fin de desarrollar terapias basadas en la manipulación de la microbiota como alternativa terapéutica5. Algunos países europeos participaron en el proyecto “Metagenoma” del tracto intestinal humano (MetaHit) que generó una amplia base de datos e información sobre el papel de la microbiota y las posibilidades de este conocimiento para su aplicación traslacional en diagnóstico y tratamiento de enfermedades. Porque sin lugar a dudas, no se es más saludable donde más se coma, sino cuanto mejor sepamos comer.
Mallorca tiene una tradición alimentaria caracterizada por su diversidad, propia de la llamada “dieta Mediterránea” que defiende el consumo rico en frutas, verduras, cereales y legumbres, derivados lácteos, pescado, aceites vegetales y un menor consumo de carne roja y grasas animales. Sin embargo, estudios nutricionales recientes6 desarrollados en esta región apuntan a cambios desfavorables en estos patrones y, por tanto, un incremento en las enfermedades metabólicas.
El objetivo del presente trabajo fue caracterizar el contenido de algunos de los principales géneros bacterianos presentes en heces fecales de sujetos sanos, diabéticos y obesos; así como su posible relación con variables bioquímicas y el consumo habitual de alimentos en una región de Mallorca (España).
Materiales y métodos
Aspectos éticos. Los estudios con muestras humanas (heces, sangre y orina) fueron aprobados por el Comité Ético de las Islas Baleares (IB 1621/11 PI), como un proyecto de colaboración.
Sujetos y muestras. Los criterios para la selección de los sujetos se basaron en el diagnóstico clínico, el índice de masa corporal (IMC) y las variables bioquímicas (glucosa, insulina, hemoglobina glucosilada y microalbúmina). El rango de IMC fue: peso normal (18,5-24,9 kg/m2); sobrepeso (25-29,9 kg/m2); obesidad (30-34,9 kg/m2); obesidad severa (35-39,9 kg/m2); obesidad severa (>40 kg/m2). Los sujetos (en un rango de edades de 18-70 años) fueron incluidos en tres grupos: Control (n = 23), “Obesos no diabéticos” (n = 24) y “Diabéticos no obesos” (n = 12). En todos los casos no padecían de enfermedades inflamatorias, no se encontraban bajo tratamiento con antibióticos o inmunosupresores, 3 meses antes del inicio de la colección de las muestras en el Hospital Comarcal de Inca (Mallorca, España). Las muestras de heces, sangre y orina fueron recogidas en condiciones de ayuno, el mismo día. Las heces fueron colectadas de manera aséptica en un recipiente y procesadas inmediatamente. Extracción del ADN bacteriano a partir de las muestras de heces.
El ADN bacteriano fue extraído usando el Mini Kit QIAamp® DNA Stool for Pathogen Detection Method (QIAGEN, España). El ADN se cuantificó en tampón AE del kit, a través del método de absorbancia a 260 nm (A260nm) y la relación (A260nm/A280nm).
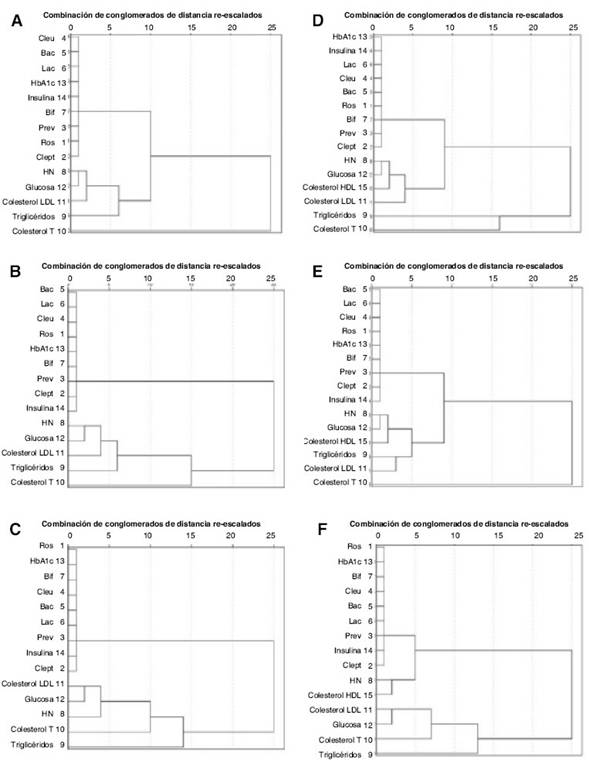
Figura 1 Análisis de distancias y del grado de relación entre variables bioquímicas en sangre, el contenido de bacterias y la calidad del patrón de alimentación (IAS) (Dendrograma que utiliza una vinculación media entre grupos, SPSS). 1A. Control; 1B. Obesos; 1C. Diabéticos.
Análisis del contenido bacteriano a través del método PCR a tiempo real. Se determinó la presencia de ADN de Roseburia (Ros), Clostridium leptum (Clept), y Clostridium coccoides- Eubacterium rectale (Cleub) (reino Firmicutes); Prevotella (Prev) y Bacteroides (Bac) (reino Bacteroidetes) y Bifidobacterium (Bif) (reino Actinobacteria) como se refiere previamente7,8, utilizando cebadores específicos para la amplificación de la región V4 del gen 16S ARNr bacteriano. Se utilizó un cebador Universal (Univ) para la amplificación del mismo gen y como referencia de la cantidad total de bacterias. El método PCR se realizó con el uso de la tecnología SYBR Green en un termociclador LightCycler (Roche Diagnostics). La amplificación consistió en un programa de preincubación para la desnaturalización del ADN (95oC, 10 min), seguida de 45 ciclos de un paso desnaturalización, “annealing” y extensión en las condiciones propuestas en la tabla 1. Después de cada ciclo se midió la fluorescencia a 72ºC. La especificidad de los productos de amplificación se confirmó a través del análisis de las curvas “melting” y por electroforesis en gel de agarosa. Los valores de Ct obtenidos se analizaron a través de GenEx Standard Software 5.3.6 (MultiD Analyses, Goteborg, Sweden) y la eficiencia de la reacción fue considerada para cada gen. Los resultados fueron expresados en Log10 [contenido de copias ADN/5ng ADN total] y en abundancia relativa del género bacteriano (%).

Tabla 1 Secuencias de los oligonucleótidos cebadores y condiciones utilizadas para la ampli cación en PCR a tiempo real
Variables sanguíneas y de orina. Fueron determinadas en un analizador Beckman Coulter AU, con un sistema de determinación Beckman Coulter: colesterol plasmático, triglicéridos, colesterol-LDL, colesterol-HDL, glucosa, insulina, microalbúmina y hemoglobina glucosilada (HbA1c). Estudio del consumo de alimentos. Se realizaron cuestionarios recordatorio por espacio de 1 mes llevados a cabo por la nutricionista del grupo de investigación, acerca del consumo frecuente (por sujeto de estudio) de 87 productos que forman parte de la alimentación habitual de Mallorca, considerando en los cuestionarios como: no consumo (punto 1), consumo ocasional (punto 2 cuando se consumen una vez a la semana), consumo frecuente y estacional (punto 3 cuando es diario o al menos 3 veces en la semana). Se propusieron dos variantes para la valoración del consumo de alimentos: La variante 1 se refirió a la valoración del Índice de Alimentación Saludable (IAS o HIN), de acuerdo a lo sugerido y contrastado por Norte y Ortiz9 (IAS: rango saludable >80; dieta necesita cambios = 50-80; alimentación no saludable <50) y por la Guía Española para la Alimentación Saludable10 que valoran la agrupación de los alimentos en nueve grupos generales (cereales, verduras, frutas, leche y sus derivados, carne, productos cárnicos, legumbres, comidas dulces, bebidas sin alcohol). La variante 2 se refirió a la cuantificación relativa de los alimentos organizados por grupos según lo recomendado por algunos autores11-13 y por la Base de datos de alimentación “Food Standard Australia-New Zealand (NUTTAD 2010): carbohidratos fructo-oligosacáridos (FOS) [cebolla, ajo, cebolleta, endivia, puerro, guisantes, tirabeques, acelga, alcachofas, espárrago, tomates, leguminosas, plátano, maíz, patatas, soja en grano, pipas de girasol, avellanas, almendras, nueces, anacardos, cacahuetes]; galacto-oligosacáridos (GOS) [yogur, kerfir, leche, queso]; isomalto-oligosacáridos (IMOS) [harina de trigo, de centeno, de avena, de maíz]; mananooligosacáridos (MOS) [fermentados como cerveza, aceituna, vinos, salsa de soja]; xilo-oligosacáridos (XOS) [calabaza, caqui, chirimoya, miel, salsa soja]; combinaciones entre ellos: GOS/XOS [manzana, higo chumbo, ciruela, pasas, orejones, dátiles, ciruelas secas]; FOS/XOS [pimiento verde, pimiento rojo, col de bruselas]; FOS/IMOS [trigo, centeno, avena]; rafinosa (remolacha); proteína (carne roja y blanca); grasas de origen animal [mantequilla, manteca de cerdo, huevos, quesos, panceta o tocino, chuleta de cerdo, chuleta de vacuno, jamón, solomillo de cerdo, solomillo vacuno, embutidos, cordero, pollo] y vegetal [aceite oliva y de girasol, chocolate, pipas de girasol, avellanas, almendras, nueces, anacardos], monoinsaturadas y poliinsaturadas.
Análisis estadístico
Las variables cuantitativas continuas se expresaron como las medias + error estándar (ES) y su distribución se evaluó con la prueba Shapiro-Wilk y las gráficas de probabilidad normal. La significación entre géneros bacterianos y variables bioquímicas para los tres grupos de sujetos se evaluó a través de las pruebas Kruskal-Wallis y U-Mann Whitney (significación p <0,05). Se determinaron los coeficientes de correlación de rangos de Spearman, así como el coeficiente de Pearson (donde se requirió) para evaluar la relación entre variables. Se utilizó la prueba t-Student para la comparación de medias en distribuciones normales. Las variables cualitativas se analizaron a través de la prueba chi cuadrado (χ2) para determinar grado de asociación y se determinó el porcentaje de ingesta por cada grupo de alimentos, frecuencia y porcentaje de consumidores. Se realizó un análisis multicomponente de la cantidad de bacterias por géneros y la ingesta frecuente por grupo de sujetos.
Resultados
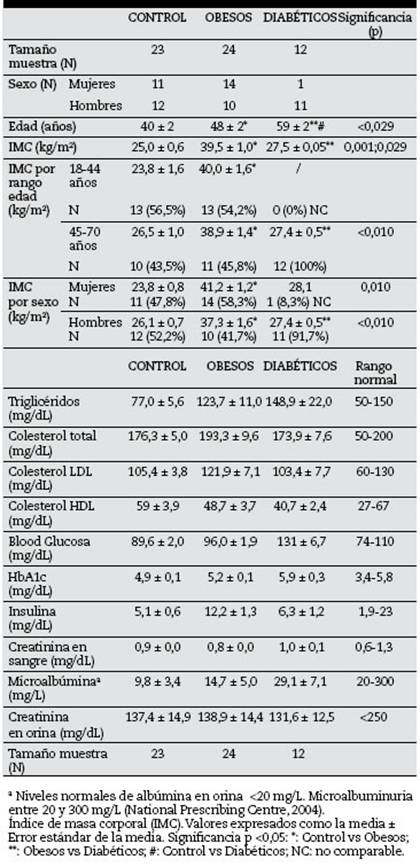
Caracterización de la muestra de sujetos seleccionada: variables demográficas, antropométricas y bioquímicas. Se seleccionó la región demográfica de Inca (Islas Baleares) para realizar este estudio; porque reunía las condiciones teóricamente ideales para encontrar una población con tradiciones alimentarias al estilo Mediterráneo; predominando las costumbres tradicionales en la elaboración de productos procedentes de la zona. De un total de 59 sujetos, se seleccionó un grupo Control (n = 23) integrado por sujetos sin síntomas ni diagnóstico de algún tipo de patología, que constituyera sesgo en el estudio (enfermedades inflamatorias digestivas, respiratorias, cardiovasculares, traumatológicas ni reumatoides) y, además, presentaron IMC, en el rango normal o en el rango de sobrepeso y las variables bioquímicas, en el rango normal. Se seleccionaron los sujetos obesos (no diabéticos, n = 24) y diabéticos (no obesos, n = 12), siguiendo el criterio del IMC, el diagnóstico clínico y bioquímico. En la tabla 2 se muestran los datos antropométricos y demográficos, los cuales demostraron que es frecuente encontrar obesos no diabéticos (18-70 años) en esta región. La proporción de mujeres que padecen obesidad mórbida y severa es grande, mientras que los diabéticos no obesos (en el rango 18-44 años) son menos frecuentes. No obstante, no se detectó una clara asociación entre la edad y el IMC (p = 0,213).
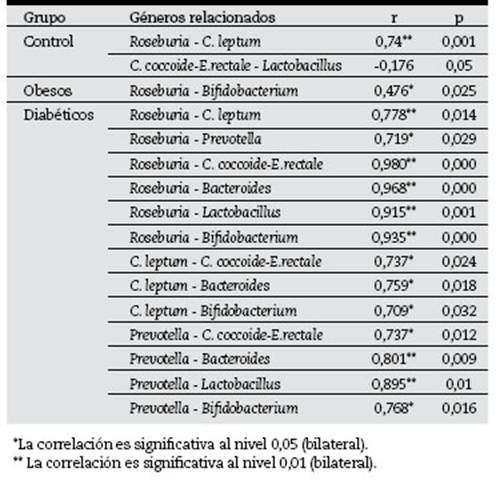
Tabla 3 Medida del grado de relación en el contenido de bacterias entre géneros presentes en heces fecales en sujetos sanos y enfermos

Tabla 4 Variación bacteriana asociada con el patrón de consumo de alimentos en los tres grupos de sujetos estudiados
El grupo Control mostró un patrón normal en las variables bioquímicas (tabla 2); sin embargo, como era de esperarse, se mostraron diferencias con relación a los grupos de enfermos (pruebas de Kruskal-Wallis y U-Mann Whitney). En Obesos, los niveles de insulina fueron superiores al resto (p = 0,027) y el grupo Diabéticos mostró niveles por encima del rango normal en cuanto a triglicéridos (p = 0,011), glucosa en sangre (p = 0,001), HbA1c (p = 0,035) y microalbuminuria (p = 0,004). Los niveles de insulina en el grupo Diabéticos fueron comparables con el grupo Control (p = 0,426) y en los tres grupos, los valores de colesterol-HDL fueron adecuados. Análisis de la relación entre el consumo habitual de alimentos, la microbiota intestinal y las variables bioquímicas en sangre. Establecer esta relación constituyó el reto fundamental de este trabajo. Se analizó la variante 1, la cual se aplica tradicionalmente en la valoración cualitativa nutricional. El análisis de contingencia demostró la asociación entre los hábitos de consumo de alimentos y el estado de salud del sujeto (χ2 = 0,003); de modo que, de acuerdo a la valoración aportada por el IAS, el 52,9% de los sujetos mantuvo una alimentación saludable y el 47,1% fue mejorable en el grupo Control, muy similar al patrón obtenido en el grupo de Diabéticos (55,6% con alimentación saludable y 44,4% mejorable). Sin embargo, en el grupo de Obesos, el 8,7% mantuvo una alimentación saludable y el 91,3%, mejorable. El análisis de la prueba t-student para los valores de IAS confirmó la significación entre los grupos Control y Obesos (p = 0,001), no significativo entre Control y Diabéticos (0,099) y Obesos y Diabéticos (p = 0,248), lo cual sugirió que el patrón de consumo de Diabéticos es intermedio entre Control y Obesos. La correlación positiva obtenida entre el IAS y el contenido de Roseburia (p = 0,039) y Clostridium leptum (p = 0,038) es otro elemento a valorar. Estos géneros no resultaron estar asociados a las variables bioquímicas. Con el propósito de profundizar en estos resultados, se realizó un análisis de distancias entre las variables bioquímicas, el contenido de bacterias y el IAS, sin incluir la variable colesterol-HDL (figs. 1A, B y C) e incluyéndola (figs. 1D, E y F).
Una interpretación plausible podría ser que en el grupo Control (fig. 1A) los niveles de Clostridium coccoides- Eubacterium rectale (Cleub), Bacteroides (Bac) y Lactobacillus (Lac) podrían estar sujetos a un adecuado “ajuste” a través del sistema de señalización en el que participan, entre otros, los niveles de insulina y HbAc1; en segunda instancia, estar sujetos a “vigilancia” por los niveles de Bifidobacterium (Bif) y Prevotella (Prev). En este caso, Bifidobacterium es el punto de contacto entre microbiota, calidad de la ingesta y las variables sanguíneas. Sin embargo, en el perfil de Obesos (fig. 1B), Prevotella pasa a ser el punto de contacto con el clúster 2 (variables sanguíneas), a la que podría atribuírsele también un papel regulador dentro del clúster 1. Por su parte, en Diabéticos (fig. 1C), la distribución de los dos clúster es similar, sólo que las bacterias cambian ligeramente su orden de relación, de tal manera que Roseburia podría modular la representación del resto de los géneros sin que, directamente, influya en el control de las variables sanguíneas. Sin embargo, Prevotella sigue siendo el conector entre ambos clúster.

Figura 3 Análisis de asociación entre el contenido de bacterias y las variables bioquímicas en sangre (análisis multicapa perceptron). Contenido expresado como Log10 [contenido de copias ADN/5ng ADN total. Cambio de covariables: estandarizado.
En cambio, la inclusión de colesterol-HDL cambia el patrón de conglomerados. Bifidobacterium y Prevotella continúan siendo los conectores. Sin embargo, en Control, la relación de Bifidobacterium fue estrecha con la batería de LDL, HDL y glucosa (fig. 1D). En Obesos, el clúster 1 quedó sin variación (fig. 1E), aunque HDL pasa a ser un posible intermediario del efecto positivo de Prevotella sobre las grasas y la glucosa. En cambio, la relación de Prevotella se distancia de los niveles de glucosa y el resto de las grasas, considerablemente, en Diabéticos, y el clúster 2 se subdivide en calidad de la alimentación y colesterol-HDL (fig. 1F).
Esta podría ser sólo una ramificación del complejo sistema de relaciones entre todas estas variables. Se propuso, además, un análisis que permitió determinar la contribución de cada género bacteriano en la variabilidad de las variables bioquímicas.
Análisis de la relación de la microbiota intestinal y las variables bioquímicas, a través del análisis perceptron o neuronal. Para establecer el grado de asociación entre las variables bioquímicas y la cantidad de géneros de bacterias presentes en las heces de los sujetos de cada grupo, se analizó previamente el contenido de ADN expresado en Log10 [contenido de copias ADN/5ng ADN total]. La media del contenido total de bacterias por grupo de sujetos indicó que es mayor en Control (Media: Control: 39; Obesos: 32; Diabéticos: 31 Log10 [contenido de copias ADN/5ng ADN total]). Se aplicaron los análisis Kruskal-Wallis y U-Mann Whitney a la abundancia bacteriana y se encontraron diferencias entre grupos de pacientes y sujetos sanos (fig. 2), en cuanto al contenido de Clostridium coccoide-Eubacterium rectale (Chi2=6,136, p = 0,047), con una mayor significancia entre controles y obesos (U = 84,5, Z = -2,44, p = 0,015). Las diferencias encontradas en este trabajo podrían justificar el posible desbalance que producen estos géneros, en la relación obtenida de Firmicutes/Bacteroidetes (F:B): mayor en Obesos (2,22) y Diabéticos (1,97), con relación a los sujetos sanos (1,53).
Está descrito que un solo tipo de bacterias no es responsable de los trastornos inflamatorios y metabólicos8 , por lo que se determinó la correlación (coeficiente de correlación de Pearson) entre los niveles de bacterias, con el objetivo de poder sugerir puntos de control entre ellas. En la tabla 3 se resume esta relación.
Los niveles de Roseburia y C. leptum (pertenecen a la misma clase Clostridia) están relacionados en el caso de Control y en Diabéticos. Roseburia está relacionada en menor grado con Bifidobacterium (diferentes reinos) en Obesos y mayor, en Diabéticos. Este último grupo de enfermos es la mejor representación de la relación entre géneros del mismo o diferentes reinos.
La distribución bacteriana en ambos sexos en Control mostró diferencias en cuanto a Bacteroides, en hombres (p = 0,043; varianza: 2,82), y en Lactobacillus (p = 0,023; varianza: 3,99), en mujeres; sin embargo, el sexo en Obesos no influyó en el contenido bacteriano (p = 0,226-0,971). Las dificultades para encontrar mujeres diabéticas no obesas en la población de estudio no permitieron discernir el papel del sexo en la microbiota de este grupo de enfermos.
Para completar la información se evaluó la contribución del contenido de bacteriano en los marcadores bioquímicos, a través de un análisis multicapas perceptron (SPSS). Cuando se incluyeron los marcadores en orina, el modelo obtenido resultó ser complejo, por lo que se seleccionaron solo los marcadores sanguíneos. Los resultados mostraron cinco marcadores principales que contribuyen a la mayor variabilidad asociada con los marcadores sanguíneos. En la fig. 3 se muestran dos nodos internos: uno de mayor peso, relacionado con el criterio “Enfermedad” (H1:1), en el que ocupan el papel principal los géneros Clostridium coccoide- Eubacterium rectale, Bacteroides, Bifidobacterium, asociados con los altos niveles de triglicéridos, glucosa y HbAlc en Diabéticos, y con el incremento de la insulina en sangre en Obesos. Un segundo nodo (H1:2) de menor peso estuvo relacionado con el criterio “Saludable”, en el que el género Prevotella contribuyó significativamente al mantenimiento de los niveles normales de colesterol-LDL y colesterol total, para los tres grupos de sujetos y, probablemente, de los valores normales de triglicéridos para Obesos. En este segundo nodo, Lactobacillus podría tener un papel secundario regulador. El sistema mostró un error relativo global de 0,951. Al respecto, Qin y col.13 se refirieron a la presencia de cuatro marcadores principales en diabetes mellitus tipo 2 (Bacteroides, Prevotella y Bifidobacterium), incluyendo Ruminococcus de la clase Clostridia. En el modelo perceptron propuesto en este trabajo se detectó un sesgo asociado con la variable triglicéridos, probablemente, por lo referido por Brenner y Heiss14, en cuanto a que existe una extraordinaria variabilidad intraindividual en los niveles de triglicéridos en ayunas, lo cual casi siempre conduce a sesgos en los estudios epidemiológicos. La segunda valoración nutricional (variante 2) consistió en determinar el aporte cualitativo de los alimentos clasificados en grupos específicos (FOS, XOS, IMOS, etc.), de acuerdo al tipo de carbohidratos, proteínas, grasas o procedencia (animal, vegetal).
El análisis de contingencia entre los grupos de sujetos (en cuanto al no consumo, consumo ocasional y consumo frecuente) no mostró diferencias entre individuos dentro del mismo grupo de estudio (análisis χ2, con valores de p superiores a 0,3 en todos los casos). Se observó que la incorporación de MOS y de grasas poliinsaturadas (χ2 = 0,021; 0,021) depende de la prioridad de los sujetos para incluirlos en la dieta habitual.
El consumo frecuente expresado en porcentaje de consumidores se representa en la fig. 4. El patrón alimentario del grupo Control estuvo caracterizado por un alto consumo de carne blanca (82,4%), grasas monoinsaturadas contenidas en aceituna y aceite de oliva (88,2%), alimentos ricos en galacto-, manano- y fructooligosacáridos (76-88%), mientras que el consumo de pescado fue menor (12-23%) que el de carne roja (35,3%), a pesar de que es una población procedente de islas. Los sujetos sanos consumían frecuentemente cebolla, ajo, tomate, banana, manzana, legumbres, patata y otras frutas (95-100% de los sujetos), huevo (100%), yogur y derivados lácteos (95-100%), jamón (70%), pavo (90%), nueces y semillas (45-50%), pimiento rojo y verde (60%) y productos fermentados, incluyendo el vino (55%); mientras que se observó un nulo consumo de productos derivados de IMOS (relacionados con bollería industrial, mermeladas y confituras).
En cambio, Obesos mostró un número menor de consumidores de alimentos tipo FOS, GOS, MOS y grasas poliinsaturadas, con mayor consumo frecuente de carne blanca, pescado blanco, azul y grasa de origen animal. Mientras que el consumo de FOS, GOS, grasas monoinsaturadas y carne blanca en Diabéticos fue similar a Control; pero menor en cuanto a carne roja, XOS y MOS (fig. 4).
Por último, se realizó un análisis multicomponente, teniendo en cuenta la proporción de consumo habitual de cada producto (por grupo de alimentos) para cada sujeto y el contenido de bacterias. Los resultados mostraron un efecto dominante (16,9% de varianza) del componente variabilidad bacteriana, representado por Clostridium coccoides- Eubacterium rectal, Bacteroides, Lactobacillus, Bifidobacterium (r = 0,727 a 0,877); un segundo componente en orden de importancia (13,9% de varianza), relacionado con las fuentes prebióticos y probióticos (FOS, MOS, grasas poliinsaturadas y monoinsaturadas), con un elemento adicional relacionado con el efecto negativo observado en cuanto al consumo de GOS (r = -0.597). El tercer componente fue la fuente animal (10,8% de varianza), el cual incluyó cane roja (r = 0,694), grasa animal (r = 0,688), carne blanca (r = 0,59) e IMOS (r = 0,588). El aporte de los grupos de consumo en la variación del contenido bacteriano se representa en la tabla 4.
Discusión
Un considerable número de trabajos avalan la relación entre la microbiota intestinal y el estado saludable, el desarrollo de la obesidad, enfermedades cardiovasculares y síndromes metabólicos como la diabetes tipo 2 en modelos animales y en humanos5,15. Recientemente, dos trabajos importantes relacionados con la caracterización del perfil microbiano y el patrón cuantitativo de ingesta en sujetos procedentes de la región norte de España (Asturias) se han publicado, con criterios y procedimientos similares a los desarrollados en el presente trabajo en añadidura; en este se propone un análisis cualitativo de los términos nutricionales. Los resultados obtenidos por estos autores demostraron que pueden existir diferencias en el propio grupo de sujetos clínicamente sanos. Aun cuando la ingesta nutricional fue similar en sujetos sanos, existieron divergencias en la asociación de la ingesta de nutrientes con el patrón de microbiota. Los principales marcadores bacterianos relacionados con alteraciones en los lípidos (ácidos grasos libres) fueron Akkermansia y Lactobacillus, para esta población sana asturiana16. En nuestro estudio, no se detectaron diferencias en el patrón de ingesta de los alimentos dentro del mismo grupo Control; no obstante, la mitad de los sujetos debe mejorar su estilo de nutrición (según análisis de IAS).
El establecimiento de la vía general de interacción entre las bacterias intestinales y el huésped es un reto. En unos casos, el contenido y diversidad de las bacterias pueden ser una causa; pero, en otros casos, el efecto. El patrón puede variar de acuerdo con factores demográficos, hábitos de consumo o factores genéticos característicos de la población de estudio. Por esta razón es importante el aporte constante a la información epidemiológica, si se tiene en cuenta que cada día se avanza en el diagnóstico y seguimiento de las enfermedades asociadas con las variaciones bacterianas. La actualización permitirá el diseño de tratamientos personalizados y métodos diagnóstico rápidos complementarios a los de referencia. Nuestros resultados confirman que el patrón cualitativo de ingesta está asociado con las variables bioquímicas en diferentes niveles de relación, interconectando el sistema a través de la posible señalización de la insulina y la implicación de los géneros Clostridium coccoide-Eubacterium rectale, Bacteroides, Bifidobacterium, Lactobacillus y Prevotella como principales reguladores de las variables sanguíneas. No obstante, Roseburia y C. leptum podrían ser puntos de regulación filogenéticos, aunque no hayan mostrado asociación con las variables sanguíneas, lo cual explicaría su asociación a las variaciones en el patrón de ingesta de algunos alimentos y la marcada relación con el resto de los géneros en Diabéticos.
Estos puntos de regulación están relacionados con moléculas y enzimas inductoras que se exponen a través de vesículas de membrana externas naturales por algunas especies bacterianas y regulan los niveles de otras18. La presencia de un género u otro de bacterias está también regulada por las llamadas moléculas inductoras presentes en los alimentos (ejemplo, la glucosa regula la densidad del género Prevotella en rumen)19. Estos mecanismos son los llamados sistemas de señalización química entre reinos que mantienen el ecosistema adecuado para la colaboración mutualista con el huésped.
Es necesario destacar en este trabajo el papel de dos géneros: Prevotella como uno de los posibles agentes reguladores o regulables a través del consumo de FOS y FOS/ IMOS en sujetos sanos y por el consumo de pescado azul en Diabéticos, los niveles de los géneros identificados dentro del criterio “Enfermedad” (fig. 3, tabla 3), y por el género Roseburia en Diabéticos. Prevotella ha sido asociado con la pérdida de peso en niños africanos alimentados con productos vegetales, en cuyas heces se encontraron niveles significativos de este género y genes característicos de las vías de hidrólisis de celulosa y xilano; totalmente ausentes en niños europeos alimentados mayoritariamente al estilo “Western”20. Prevotella tiene un repertorio funcional que permite incrementar la capacidad de la microbiota para fermentar polisacáridos complejos procedentes de la dieta y protege contra la intolerancia a la glucosa inducida por Bacteroides 21,22. El género Bifidobacterium resultó ser el conector entre ingesta, variables sanguíneas y contenido de microbiota intestinal en el grupo Control, lo cual está en correspondencia con el papel que se le confiere en la regulación de la homeostasis de glucosa, reducción de la ganancia de peso y masa corporal, y en el restablecimiento de la secreción de insulina mediada por glucosa, en modelos de ratones alimentados con FOS y dietas ricas en grasas23. Los grupos Control y Diabéticos presentaron similares patrones de valoración en cuanto a calidad de su nutrición: ambos deben mejorar sus estilos de consumo, sobre todo en aquellos sujetos que no consumen pescado, productos fermentados (MOS), alimentos tipo FOS/IMOS (trigo, centeno y avena) tan importantes para el incremento de Prevotella y en cuanto a la ingesta de frutas (XOS, GOS/XOS). Igual sucede con los sujetos obesos con bajo consumo de estos alimentos y para los que sólo el 8% persigue un patrón saludable.
Este trabajo no pretende establecer un núcleo definitivo de bacterias intestinales, teniendo en cuenta que pudiese cuestionarse que el número de muestras no resulta ser suficiente para representar una población aproximada de 30.944 habitantes (Inca). Sin embargo, uno de los propósitos de este estudio es dotar de las herramientas sencillas complementarias al trabajo del nutricionista, para el diseño de posibles dietas personalizadas, seguimiento y reajuste en los tratamientos que forman parte de ensayos clínicos. La utilización de la tecnología de PCR podría considerarse relativamente barata y rápida al no requerir de una infraestructura de análisis informatizado compleja. El análisis de una muestra podría tener un costo aproximado de 1,54 €/ muestra (una vez se amortice la estandarización), mientras que la utilización de la metagenómica supone un costo aproximado de 58 €/muestra (datos obtenidos por los autores en estudios de microbiota en enfermedades inflamatorias).
Conclusión
La variabilidad en el consumo de alimentos estuvo relacionada con cinco marcadores bacterianos principales que contribuyeron a la mayor variabilidad de marcadores bioquímicos entre grupos de sujetos: Clostridium coccoide- Eubacterium rectale, Bacteroides, Bifidobacterium, Prevotella y Lactobacillus, en una población de Mallorca (España). Declaración del consejo revisor institucional El estudio fue revisado y aprobado por el Comité Ético para Ensayos Clínicos y proyectos de investigación de las Islas Baleares (CEIC) y por el Comité de Investigación del Hospital Comarcal de Inca (Mallorca, España).