Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. v.15 n.2 Ciudad Autónoma de Buenos Aires ago./dic. 2007
Estudio de genotoxicidad de Picrasma crenata (Vell.) Engl. -Simaroubaceae-
Roldán, Roxana M.; Noriega, Maria F.; Wagner, Marcelo L.; Gurni, Alberto A. y Bassols Graciela B.*
Cátedra de Fármacobotánica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires Junín 956 Piso 4 (1113) Buenos Aires. República Argentina.
* Correspondencia: Bassols Graciela. Catedra de Farmacobotanica. Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Junín 956 Piso 4 (1113) Buenos Aires. República Argentina. TEL: 4964 - 8261. E-mail: gbassols@ffyb.uba.ar
Resumen: En la medicina popular se utiliza el leño de Picrasma crenata en infusión como pediculicida y como tónico amargo no astringente. Los principios activos responsables de la actividad son los quasinoides. Los objetivos de este trabajo son: determinar la actividad de las infusiones sobre el desarrollo de raíces y la división celular mediante el Test de Allium cepa; analizar la correlación de las concentraciones y los parámetros macro y microscópicos e interpretar la posible genotoxicidad de la infusión. Las concentraciones empleadas fueron 2,5 mg%; 5,0 mg%, 10,0 mg%, 20,0 mg% y 40,0 mg%. Se observó una correlación estadísticamente significativa de las concentraciones con las longitudes de las raíces y las anomalías macroscópicas; además, una correlación significativa de los índices mitóticos con las longitudes de las raíces y las anomalías microscópicas. Así, se puede inferir que los extractos en las concentraciones ensayadas podrían presentar actividad genotóxica.
Palabras clave: Picrasma crenata; Test de Allium cepa; Genotoxicidad.
Abstract: Genotoxicity study on Picrasma crenata (Vell.) Engl.-Simaroubaceae-. Infusions of Picrasma crenata woods are used in folk medicine against lice and as a non astringent bitter tonic. The active principles responsible for the activity are the quasinoides. The objectives of this work are: to establish the activity of the infusions on the development by roots and the cellular division by means of the Test of Allium cepa; to analyze the correlation of the concentrations with macro and microscopic parameters and to conclude about the possible genotoxicity of the infusion. The used concentrations were 2.5 mg%; 5,0 mg%, 10,0 mg%, 20,0 mg% and 40,0 mg%. A statistically significant correlation between the concentrations and the roots lengths and macroscopic aberrations and a significant correlation between the mitotic index and the roots lengths and microscopic aberrations have been observed. Thus, it is possible to deduce that the extracts in the tested concentrations could present genotoxic activity.
Key words: Picrasma crenata; Allium cepa test; Genotoxicity.
Palavras chaves: Picrasma crenata; Teste da Allium cepa; Genotoxicidade.
INTRODUCCIÓN
Picrasma crenata (Vell.) Engl. [= Aeschrion crenata Vell., Picrasma palo amargo (Speg.) Speg.] - (Simaroubaceae), es un árbol que crece en el este de Brasil y el noroeste de la República Argentina principalmente en la provincia de Misiones. Es conocida en la región con los nombres vulgares de "palo amargo", "cuasia", "paraih", entre otros (1,2).
En la medicina tradicional argentina, el tallo entero se emplea, en forma de infusión, como antiperiódico, antisifilítico y tónico (1). El leño se utiliza como amargo en la composición de bebidas alcohólicas y aperitivos (Foto 1); también se lo usa como insecticida y en la elaboración de tinturas alcohólicas como sustituto de la Quassia amara L. y de Picrasma excelsa (Swartz) Planchon. para el tratamiento de la pediculosis (3).

Foto 1: leño de Picrasma crenata
Polonsky y Lederer, en 1959, aislaron del leño de palo amargo 2,6-dimetoxibenzoquinona y cuassina (4,5). Posteriormente se han aislado varios alcaloides con estructura 2-carbolina: 1-carbometoxi- 2-carbolina; 1-etil-4-metoxi-2-carbolina (crenatina) y 1-etil-4,8-dimetoxi-2-carbolina (crenatidina) (5). Además, se aislaron tres cuasinoides: 12-norcuasina, paraína e isoparaína (6).
Los cuasinoides son los compuestos que se encuentran en mayor cantidad en el leño de P. crenata. Son principios amargos y poseen actividades farmacológicas importantes como antiviral, antimalárico, amebicida, antitumoral, antileucémico y citotóxico (4,7). En la actualidad se están estudiando los principios amargos para ser utilizados como insecticidas en cultivos y en alimentos almacenados (8).
Los objetivos del presente trabajo son :
a) Determinar la correlación entre la actividad de las diferentes concentraciones de la infusión, el desarrollo de las raíces y la división celular (mitosis) mediante el test de Allium cepa (test de primera aproximación).
b) Analizar la correlación de las diferentes concentraciones de la infusión y los parámetros macro y microscópicos.
c) Interpretar, en base a los resultados obtenidos, la posible actividad genotóxica del extracto.
MATERIALES Y MÉTODOS
Se emplearon muestras comerciales de leño autenticadas, provenientes de la provincia de Misiones, República Argentina.
Se trabajó con infusiones preparadas según Farmacopea Nacional Argentina VI edición (9).
Las concentraciones empleadas para dicho estudio fueron 2,5 mg%; 5,0 mg%; 10,0 mg%; 20,0 mg% y 40,0 mg%
El ensayo genotóxico utilizado fue el Test de Allium cepa siguiendo el modelo de Fiskesjö (test de primera aproximación)(10).
Se seleccionaron 50 bulbos de cebollas (Allium cepa L. -Alliaceae-), de 5 cm de diámetro promedio adquiridos en el comercio. Se lavaron, se despojaron de las catáfilas externas, sus discos se rasparon y eliminaron las raíces preexistentes, con el fin de dejar expuestos los primordios radicales. Así preparados se colocaron en agua durante 48 horas. Luego se realizó una selección de las cebollas tomando como parámetro el buen desarrollo de sus raíces. Se dividieron en lotes de 5 bulbos cada uno, para las concentraciones a testear y para los controles. Posteriormente se pusieron en contacto con las distintas infusiones a ensayar por el término de tres días. Al tercer día se retiraron 5 raíces de cada bulbo y se realizó el "squash" de cada ápice a fin de analizar los parámetros microscópicos. Los "squash" se tiñeron con una solución de orceína lactopropiónica. Al cuarto día se cuantificaron las raíces restantes, se midieron sus longitudes y se analizaron los parámetros macroscópicos (tipificación de anormalidades). Se utilizó como control negativo agua mineral cuya relación Ca2+/ Mg2+ fuera de 50-70 mg/l y como control positivo una solución de dicromato de potasio (Cr2O7K2) 2.10-5 M.
Determinación de la toxicidad aguda
Los parámetros macroscópicos analizados fueron: longitud de las raíces, cuantificación y tipificación de las anomalías apicales tales como ganchos, tumores, necrosis, estrías, coloración y gelatinización (10).
Determinación de la genotoxicidad
Se realizó en base a los parámetros microscópicos observados en el "squash". Se analizaron 1000 células por ápice y se determinaron los siguientes parámetros:
• Índice número de células en división
mitótico = ------------------------ x 1000
(IM) número de células totales
• Índice número de células en cada fase
de fases = --------------------------- x 1000
(IF) número total de células en división
• Cuantificación de anomalías de cada fase y totales.
• Tipificación de anormalidades: cromosomas arrestados (Foto 2), pegajosos, c-mitosis (Foto 3), "vagrant" (Foto 4), puentes cromosómicos, entre otros.

Foto 2: Cromosomas arrestados

Foto 3: Cromosomas en c-mitosis

Foto 4: Cromosomas en "vagrant"
• Análisis estadístico: para el análisis estadístico se empleó el método de regresión lineal y correlación.
RESULTADOS
a) Determinación de toxicidad aguda:
Sobre el total de raíces que se desarrollaron se calculó el porcentaje de anomalías macroscópicas (Tabla 1):
Tabla 1. Anomalías macroscópicas observadas.

Concentración al 2,5 mg%: tumores (2,5 %), ganchos (3,8 %) y puntas necrosadas (8,8 %).
Concentración al 5,0 mg%: tumores (6,8 %), ganchos (5,1 %) y puntas necrosadas (18,2 %).
Concentración al 10,0 mg%: tumores (6,4 %), ganchos (7,1 %) y puntas necrosadas (18,6 %).
Concentración al 20,0 mg%: tumores (25,0%), ganchos ( 5,8%) y puntas necrosadas ( 3,8%).
Concentración al 40,0 mg%: tumores (23,3%), ganchos (6,7 %) y puntas necrosadas (6,7 %).
Además, se midieron las raíces cuyos promedios y rangos se muestran en la Tabla 2.
Tabla 2. Índices mitóticos y de cada fase, longitudes de las raíces obtenidas y relación porcentual de la anomalías macroscópicas observadas en cada concentración.
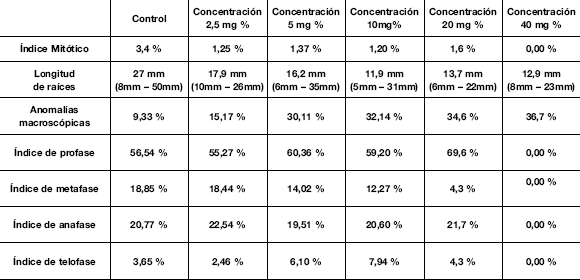
b) Determinación de genotoxicidad:
Las anomalías microscópicas observadas para cada concentración (Tabla 3) fueron:
a) 2,5 mg%: cromosomas pega-josos y/o rezagados, vagrant, anafases arrestadas, con efecto cmitosis.
b) 5,0 mg%: cromosomas pega-josos y/o rezagados, vagrant, anafases arrestadas, con efecto c-mitosis y puentes.
c) 10,0 mg%: cromosomas pegajosos y/o rezagados, vagrant, anafases arrestadas, con efecto c-mitosis.
d) 20,0 mg%: anafases arrestadas, con efecto c-mitótico.
e) 40,0 mg%: no se observaron anomalías microscópicas.
Tabla 3. Anomalías microscópicas observadas.

Sobre la base del conteo de células en cada fase y totales se calcularon los distintos índices mitóticos y de fases cuyos resultados aparecen en la Tabla 2.
De acuerdo con los resultados anteriores se determinaron las siguientes correlaciones:
a) 92 % entre las longitudes de las raíces y las concentraciones (0,02 < p < 0,05)
b) 91 % entre las anomalías macroscópicas y las concentraciones (0,02 < p < 0,05)
c) 93 % entre los índices mitóticos y las longitudes de las raíces (0,02 < p < 0,05)
d) 91 % entre los índices mitóticos y las anomalías microscópicas (0,02 < p < 0,05)
DISCUSIÓN Y CONCLUSIONES
Los valores obtenidos muestran una correlación de las concentraciones analizadas con las longitudes de las raíces y las anomalías macroscópicas; así como de los índices mitóticos con las longitudes de las raíces y las anomalías microscópicas.
Por lo tanto, se puede establecer que existe una relación directa entre las concentraciones estudiadas y las anomalías macro y microscópicas.
Se observó que a altas concentraciones se produce el arresto de la división mitótica. Esto demuestra actividad genotóxica de este material en el ensayo. El fenómeno genotóxico también se asocia a la presencia de cromosomas en c-mitosis y pegajosos. De acuerdo con esto se puede inferir que las concentraciones empleadas por la población serían seguras debido a que las anomalías se presentan a concentraciones mas altas que las utilizadas tradicionalmente.
Este test de Allium cepa es de carácter preliminar, orientativo y constituye el punto de partida para la realización de análisis mas específicos y sensibles (cultivos de linfocitos para la evaluación de biomarcadores como test del cometa, intercambio de cromátides hermanas, cinética de proliferación celular, etc.) para poder evaluar un posible riesgo genotóxico humano, ya que estos ensayos son in vitro y no permiten una exacta correlación con lo que ocurre in vivo debido a las modificaciones que ocurren en el organismo.
1. Toursarkissian, M. (1980). Plantas Medicinales de la Argentina. Sus nombres botánicos, vulgares, usos y distribución geográfica. Editorial Sur, Buenos Aires. [ Links ]
2. Ragonese, A.E. y Milano, V.A. (1984). Vegetales y substancias tóxicas de la flora argentina. Enciclopedia Argentina de Agricultura y Jardinería, 2da. Edición, Tomo II, Fascículo 8-2. Editorial ACME S.A.C.I., Buenos Aires, 190. [ Links ]
3. Márquez, A., Borri, K., Dobrecky, J., Gurni, A.A. and Wagner, M.L. (1999). New aspects in quality control of "palo amargo" (Aeschrium crenata Vell. -Simaroubaceae-). Acta Hort. 503, 111-115. [ Links ]
4. Polonsky, J., Bhatnagar, S. and Moretti, C. (1984). 15-deacetylsergeolide, a potent antileukemic quassinoid from Picrolemma pseudocoffea. Journal of Natural Products. 47 (6), 994-996. [ Links ]
5. Sánchez, E. and Comin, J. (1971). Two new 2-carbolide alkaloids from Aescchrion crenata. Phytochemistry, 10 (9), 2155-2159. [ Links ]
6. Vitagliano, J.C. and Comin, J. (1972). Quassinoids from Aeschrion crenata. Phytochemistry 11 (2), 807-810. [ Links ]
7. Okano, M., Fukumiya, N., Aratani, T., Juichi, M. and Lee, K. (1974). Antitumor agents, 74. Bruceanol-A and -B, two new antileukemic quassinoids from Brucea antidysenterica. Journal of Natural Products, 48 (6), 972-975. [ Links ]
8. Stoll, G. (1989). Protección natural de cultivos en las zonas tropicales. Editorial Científica Josef Margraf, Berlin. 184 pp. [ Links ]
9. Farmacopea Nacional Argentina VI edición. 1978. [ Links ]
10. Fiskesjö, G. (1993). Allium test I: a 2-3 day plant test for toxicity assessment by measuring the mean root growth of onions (Allium cepa L.). Environmental Toxicology and Water Quality: An International Journal, 8, 461-470. [ Links ]














