Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. v.17 n.2 Ciudad Autónoma de Buenos Aires ago./dic. 2009
ARTÍCULOS ORIGINALES
Optimización y validación metodológica de la cuantificación de arsénico por inyección en flujo-generación de hidruros- espectrometría de absorción atómicas (IF-GH-EAA) previa derivatizacíon con L-Cisteína
Navoni, Julio A.; Olivera, Nancy M.; Villaamil Lepori, Edda C.
Cátedra de Toxicología y Química Legal, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Laboratorio de Asesoramiento Toxicológico Analítico (CENATOXA) Junín 956 7o piso, (1113) Buenos Aires, Argentina. Tel/fax: 54-11-4964-8283, 54-11-4964-8284.
jnavoni@ffyb.uba.ar
Resumen: Optimización y validación metodológica de la cuantificación de arsénico por inyección en flujo-generación de hidruros- espectrometría de absorción atómicas (IF-GH-EAA) previa derivatizacíon con L-Cisteína. El arsénico (As) es un contaminante natural que afecta una amplia zona de Argentina. El nivel de As en agua de consumo es utilizado para evaluar la fuente de exposición y en orina para evaluar exposición a este tóxico.
El presente trabajo tuvo como objetivo la optimización y validación metodológica de una técnica para la cuantificación de As [As suma = As inorgánico (AsI) + especies metiladas: ácido monometilarsónico (MMA) y ácido dimetilarsínico (DMA)], producto del metabolismo del AsI, por inyección en flujo- generación de hidruros- espectrometría de absorción atómica (IF-GH-EAA), previa derivatización con L-cisteína. La recuperación de las especies estudiadas: AsI (AsIII y AsV), MMA y DMA fue cercana al 100% en todos los casos. Los límites de detección y cuantificación encontrados fueron para agua y orina: 2 y 3 μg/L; 5 y 8 μg/L respectivamente y el rango dinámico de trabajo establecido fue desde 5 a 75 μg/L, permitiendo cuantificar As en muestras de agua cercanos a los estándares internacionales vigentes para valores máximos de As en agua de consumo y en orina en niveles comparables con los establecidos en población laboralmente no expuesta. Esta propuesta metodológica es una alternativa para evaluar la exposición al As en muestras de agua y orina, sin necesidad de utilizar prolongados pre-tratamientos de muestra, de forma más rápida y económica.
Palabras claves: Arsénico; Validación metodológica; Generación de hidruros; Monitoreo biológico.
Abstract: Optimización and validation method for arsenic quantification by flow injection-hydride generation - atomic absorption spectrometry (fi-hg-aas) after L-Cysteine derivatization. Arsenic (As) is a natural contaminant that affects a large area of Argentina. Quantification of As in drinking water has been used to evaluate the source of exposure and As in urine to assess exposure to this toxic.
This study aimed to optimize and validate a methodological technique for the quantification of As [As sum = inorganic As (AsI) + methylated species: monometilarsonic acid (MMA) and dimetilarsinic acid (DMA)], product of AsI metabolism by flow injectionhydride generation-atomic absorption spectrometry (FI-GH-AAS), after derivatization with L-cysteine. The recovery of the studied species: AsI (AsIII and AsV), MMA and DMA was close to 100% in all cases. The limits of detection and quantitation were found for water and urine: 2 and 3 μg/L; 5 and 8 μg/L respectively and a linear working range from 5 to 75 μg/L, allowing quantify As in water close to international standards of maximum As values for drinking water and urine samples with levels comparables with those found in people non exposed ocupacionally . This methodology is a valid alternative for assessing exposure to As in water and urine samples without the need of prolonged pre-treatment sample, more quickly and inexpensively.
Keywords: Arsenic; Method validation; Hydride generation; Biological monitoring
Introducción
El arsénico (As) es un elemento ampliamente distribuido en el ambiente. Las especies inorgánicas de este elemento son las principales formas químicas presentes en el agua subterránea, de superficie, suelo y también en la mayoría de los alimentos (1).
La exposición a As inorgánico a través de la dieta puede provocar efectos adversos sobre la salud que incluyen cáncer de piel, vejiga y pulmón. Varios países como India, China, Taiwán, México, Chile y la Argentina, presentan zonas endémicas de hidroarsenicismo, existiendo en la actualidad millones de personas expuestas a concentraciones elevadas de As a través del agua, consideradas perjudiciales para la salud (2-4).
En la Argentina, al menos 2 millones de personas consumen agua con contenidos de As superiores a los valores máximos permisibles (4,5). La cuantificación de As en muestras de agua de consumo ha sido útil para evaluar las fuentes de exposición a este elemento (5,6).
Entre los marcadores de dosis efectiva de exposición, la cuantificación de As urinario (AsU) es considerada la mejor herramienta disponible para establecer exposición reciente a este contaminante (7,8). La mayoría de las técnicasmutilizadas en la actualidad para la determinación de AsU requieren una mineralización previa de la muestra (9-12). Mediante este tratamiento
se produce la destrucción total de la materia orgánica presente llevando el As total a su máximo estado de oxidación en su forma inorgánica. La presencia, en alimentos producto de la pesca, de arsenobetaína (AsB) o de arsenocolina (AsC) (especies de nulo o muy bajo impacto toxicológico) puede llevar a sobreestimar el contenido de AsU proveniente del consumo de As inorgánico a través de la dieta (13).
Por este motivo, cuando se aplica la metodología antes señalada la interpretación del resultado requiere información adicional acerca de los hábitos alimenticios del paciente.
En la bibliografía se describen metodologías capaces de cuantificar selectivamente el As total, producto del metabolismo del As inorgánico, a fin de evitar posibles sobreestimaciones (14-16). Sin embargo, este tipo de metodologías analíticas no prosperaron, debido al advenimiento de las técnicas de especiación, pudiendo ser alternativas para aquellos laboratorios que no cuentan con la infraestructura necesaria para implementar procedimientos de especiación. El objetivo de este trabajo fue optimizar y validar una metodología que permita cuantificar selectivamente el contenido de As inorgánico (AsI), (AsIII, AsV) en muestras de agua y del producto del metabolismo del AsI en muestras de orina (AsIII, AsV, MMA y DMA).
Materiales y métodos
Reactivos
Todos los reactivos sólidos y líquidos fueron de grado analítico. El ácido monometilarsónico fue provisto por Chem Service EEUU. El ácido dimetilarsínico fue provisto por Sigma, St Louis, MO, EEUU. Los estándares de AsIIIy AsV junto con el ácido clorhídrico, el tetrahidroborato de sodio, el hidróxido de sodio y la L-cisteína fueron provistos por Merck Química Argentina.
El nitrógeno, aire y acetileno fueron de calidad ultrapura provistos por INDURA S.A. Para todos los procesos se empleó agua desionizada (18,2 MΩ cm).
Equipamiento
La cuantificaci ón de As fue realizada usando un espectrómetro de absorción atómica (EAA) (modelo AA 475, Varian®) equipado con un generador de hidruros (GH) (VGA77, Varian®) y una celda de cuarzo calentada con una llama de aire/acetileno. La inyección en flujo de muestras y estándares fue realizada utilizando un sistema de inyección manual (Reodyne 7125) provisto con un lazo de inyección de 200 μL, acoplado al generador de hidruros. Las señales espectrométricas obtenidas fueron recolectadas on line y analizadas utilizando un software para análisis de datos cromatográficos ChromquestTM Chromatography Workstation, Thermo Quest, USA.
Determinación de AsI
As inorgánico (AsIII, AsV) y sus formas metiladas, MMA y DMA. El análisis del contenido de As en orina así como en agua fue realizado por inyección en flujo -generación de hidrurosespectrometría de absorción atómica (IF-GHEAA), metodología desarrollada a partir de los trabajos descriptos por Guo y col. (1997) (14), Le y col. (1994) (15) y Carrero y col. (2001) (16)
Fundamento: el procedimiento se basa en que el arsénico inorgánico (AsIII + AsV) y los metabolitos metilados (MMA + DMA) son especies arsenicales que generan arsinas cuando éstas son sometidas a un medio ácido y reductor, formando las respectivas arsinas con velocidades de reacción diferentes entre sí. El As al reaccionar previamente con la L-cisteína en medio ácido, origina compuestos tioderivados que generan arsinas a velocidades similares lo cual permite la cuantificación de la suma de ellos sin la sobreestimación o subestimación de otras especies. La AsB y AsC, especies arsenicales presentes en alimentos productos de la pesca y de nulo impacto toxicológico, no generan arsinas en las condiciones señaladas y por ende no son capaces de dar una señal espectral que pueda llevar a la sobreestimación del contenido de As de importancia toxicológica. Los tioderivados formados reaccionan con NaBH4 y HCl para generar las correspondientes arsinas que son arrastradas por una corriente de N2 hacia una celda abierta de cuarzo que es calentada por una llama, produciéndose la descomposición de las mismas, liberándose el As que pasa a estado fundamental (Asº) capaz de absorber a la longitud de onda característica del elemento.
Condiciones espectrométricas
Las condiciones instrumentales del espectrómetro de absorción atómica fueron: longitud de onda 193,7 nm; apertura de rendija de 0,5 nm; fuente de energía, lámpara de cátodo hueco de As a una intensidad de corriente de 6 mA.
Soluciones estándar, muestras de orina y materiales de referencia certificados
Se prepararon soluciones stock de cada especie del arsénico estudiada en una concentración final de 1000 μg/L en solución acuosa.
Dichas soluciones fueron utilizadas para la preparación de las soluciones de trabajo y de las muestras de orina fortificadas con cada una de las especies por separado, logrando concentraciones finales de cada analito de 2,5; 5,0; 10,0; 25,0; 50,0; 75,0 y 100,0 μg/L.
La muestra de orina, utilizada como matriz, estuvo constituida por un pool de orinas recolectadas de voluntarios clínicamente sanos no expuestos al As. Todas las soluciones, blancos de orina y muestras cargadas fueron conservadas a 4º C hasta el momento de su análisis.
La veracidad del proceso fue examinada con materiales certificados de referencia: EP-H-2 (EnviroMAT Drinking Water) lote SC181305 y Lyphochek® nivel 2 (Biorad) lote 69121 para agua y orina respectivamente.
Derivatización de soluciones estándares/ muestras de agua y orina
Alícuotas de estándares acuosos, muestras de agua y orina y materiales de referencia certificados (0,5 mL), fueron derivatizados por medio del agregado de 0,5 mL de una solución de Lcisteína al 4% p/v en HCl 0,03M manteniéndolas durante 30 min a temperatura ambiente. Blancos de agua y orina fueron preparados separadamente siguiendo el procedimiento antes descripto.
Validación metodológica
Se tuvieron en cuenta los requerimientos de validación siguientes: robustez, recuperación, precisión, linealidad, límite de detección (LD), límite de cuantificación (LC) y veracidad (17-19).
Optimización de generación de hidruros
Se establecieron las condiciones óptimas de generación de hidruros para cada especie ensayada. Los parámetros evaluados fueron: concentración del reductor (NaBH4) en concentraciones de 0,5; 1,0 y 1,5 % p/v, concentración del NaOH (como medio de dilución del reductor) en concentraciones de 0,05; 0,1 y 0,5 % p/v y concentración del medio ácido (HCl) en concentraciones de 0,01; 0,05; 0,1 y 0,2 Molar, sobre muestras de orina blanco fortificadas con 100 μg/L de cada especie arsenical ensayada.
Estabilidad de las soluciones estándares/ muestras
La estabilidad a temperatura ambiente y a 4ºC de las soluciones estándares/muestras y de estas luego de efectuada la derivatización fue estudiada.
Recuperación
Comparación interespecies de respuesta espectrométrica
Se investigó la respuesta espectral post derivatización de muestras de orina blanco fortificadas independientemente con cada especie a concentraciones de 10,0; 50,0 y 100,0 μg/L. La respuesta de detección hallada fue comparada con la lograda a partir de estándares acuosos de AsV de similares concentraciones. La tasa de recuperación relativa a AsV fue calculada.
Precisión
La precisión intra-ensayo (repetibilidad) incluyó la medición por quintuplicado del mismo estándar acuoso en concentraciones de 10,0; 50,0 y 75,0 μg/L de AsV en el mismo día. La precisión inter-ensayo (reproducibilidad) incluyó la estimación de la variabilidad entre corridas de la misma muestra en las concentraciones arriba indicadas durante tres días consecutivos. El coeficiente de variación (CV%) fue calculado para cada caso.
Linealidad de la curva de calibración
Soluciones acuosas de AsV en concentraciones finales de 2,5; 5,0; 10,0; 25,0; 50,0 ;75,0 y 100,0 μg/L fueron analizados por quintuplicado para evaluar la linealidad de la curva de calibración.
Límite de detección (LD) y límite de cuantificación (LC)
El LD definido como la menor concentración que un proceso analítico puede diferenciar confiablemente del ruido instrumental, y el LC, definido como la menor concentración que puede ser medida con un nivel de confianza prefijado, se determinaron utilizando dos criterios. El primero define el LC como la menor concentración, ensayada por quintuplicado en una matriz determinada, que presenta menos del 20% de coeficiente de variación (CV%).
El segundo criterio utilizado fue estimar estos parámetros por cálculo. El LD fue estimado a través de la inyección de blancos de agua destilada u orina, analizando el ruido de la línea de base del sistema y calculando el desvío estándar del blanco (SDb) para cada caso. El LD fue calculado como 3SDb/m donde "m" es la pendiente de la curva de calibración. El LC fue calculado como 10SDb/m (18-20).
Resultabos y discusíon
El desarrollo analítico fue iniciado optimizando las condiciones de generación de hidruros para cada especie ensayada. Esta etapa es considerada el punto más crítico en la reproducibilidad impactando directamente en la robustez del método. El Grafico 1 describe la respuesta de la generación de arsinas utilizando muestras de orina fortificadas con 100 μg/L de cada especie. Se pudo observar una amplia variabilidad de respuesta en las condiciones ensayadas. Para los tres niveles de reductor utilizados, se comprobó la mayor respuesta a concentraciones de ácido inferiores a 0,1 M. La concentración de ácido seleccionado fue la de 0,05 M. El nivel de reductor no incidió significativamente en la respuesta. Sin embargo, a la concentración de 1,0% p/v, se observó la menor variabilidad de respuesta interespecie (menor al 5%) indicando una cinética de reacción unificada.
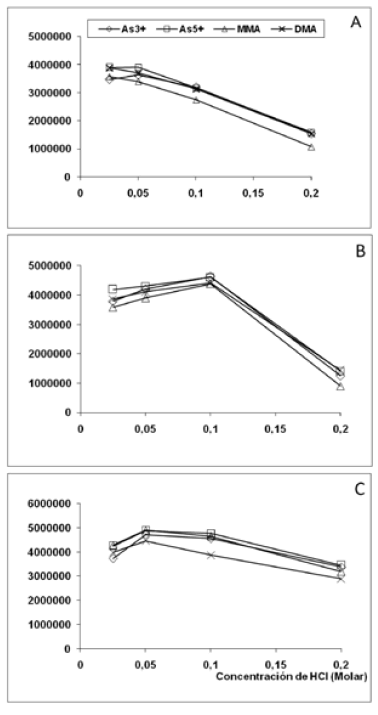
Grafico 1. Optimización de la generación de hidruros: efecto de la concentración de HCl y NaBH4 sobre la formación de arsinas.
Respuesta de detección utilizando orina blanco fortificada con 100 μg/L de cada especie. Resultados obtenidos con NaBH4 preparado en NaOH 0.05%p/v. Concentración de NaBH4 0,5 % (A), 1,0 % (B) y 1,5 % (C).
La concentración de hidróxido utilizado en la preparación del reductor no afecto significativamente la generación de hidruros (datos no presentados). Se seleccionó la menor concentración ensayada ya que ésta permitió, en el mismo tiempo de reacción, una formación de arsinas uniforme y menos violenta asegurando el correcto funcionamiento del separador gas líquido. Las condiciones óptimas de reacción (Tabla 1) estuvieron dentro del rango de condiciones descriptas por otros autores (14-16).
Tabla 1. Condiciones optimizadas de generación de hidruros.

En la bibliografía se indica la estabilidad de las especies estudiadas al ser conservadas a temperatura ambiente y 4ºC, siendo mayor en ésta última condición (21). En esta experiencia se evaluó la estabilidad a lo largo de un mes de preparadas las soluciones de trabajo y las muestras de orina fortificadas (datos no expuestos). No se observaron diferencias significativas dentro del período evaluado. Sin embargo, tanto las muestras como los estándares, luego de ser derivatizados presentaron una estabilidad de una semana en ambas condiciones, observándose posteriormente la aparición de un precipitado blanco, posiblemente como producto de oxidación de la L cisteína. La derivatización con L-cisteína en medio ácido unifica la velocidad de reacción (15,16). Para ratificar esta observación, se analizó la recuperación relativa de las especies AsIII, AsV, MMA y DMA en muestras de orina fortificadas, respecto a soluciones acuosas de AsV, la cual estuvo comprendida entre el 95 y el 105% para todo el rango de concentraciones ensayado (Tabla 2). De esta forma se ratificaron las observaciones realizadas por los autores antes citados (15,16). La paridad de los resultados obtenidos entre las distintas especies evidenció una cinética de reacción similar, además de ausencia de efecto matricial. Este hecho permitió la interpolación de muestras de agua y orina en curvas realizadas en medio acuoso.
Tabla 2. Recuperación porcentual de especies arsenicales.

En la experiencia se ensayaron concentraciones desde 2,5 hasta 100 μg/L. En la (Tabla 3) se describen los parámetros de curva de calibración. Los puntos de 10 y 5,0 μg/L estuvieron dentro de los criterios de una imprecisión menor del 15% y 20% para la aceptación como punto mínimo de la curva y como límite de cuantificación, respectivamente (17-19). El LD y LC fueron calculados como se describió previamente (Tabla 4). Los datos obtenidos por cálculo a partir de la dispersión encontrada en los blancos ensayados, fueron similares a los definidos a través del criterio de imprecisión anteriormente señalado. A partir de estos resultados se definió como límite de decisión la concentración de 10 μg/L lo cual permite la cuantificación de As a niveles de interés, desde el punto de vista regulatorio con respecto a valores de As máximos permitidos en muestras de agua, (4, 6, 20). Se estableció como concentración máxima de la curva al punto de 75 μg/L. El Grafico 2 describe el ajuste lineal obtenido. La concentración de 100 μg/L fue eliminada debido a que se pudo establecer la saturación del sistema, lo que provocó una pérdida del ajuste lineal de la curva. La reproducibilidad del proceso se valoró analizando la precisión intra e inter-ensayo en el rango de trabajo seleccionado (Tabla 5). El sistema presentó una repetibilidad y una reproducibilidad dentro de los requerimientos analíticos de imprecisión.
Tabla 3. Parámetros de la curva de calibración.

Tabla 4. Límites de detección (LD) y cuantificación (LC) calculado para cada matriz estudiada


Gráfico 2. Curva de calibrado.
Tabla 5. Coeficientes de variación intra-ensayo e inter-ensayo para cada nivel de concentración.

La veracidad del proceso se evaluó mediante el análisis de materiales de referencia certificados. Los resultados obtenidos no indicaron diferencias significativas con los valores declarados para las dos matrices estudiadas, (Tabla 6). Si bien los resultados son alentadores, solamente se dispuso de materiales de referencia certificados para niveles altos de As para dichas matrices por lo que será necesaria la evaluación de este parámetro a menores concentraciones cubriendo todo el rango dinámico de trabajo propuesto. El metabolismo en humanos del arsénico inorgánico lleva a la formación de metabolitos metilados (MMA y DMA) junto a una fracción que permanece en su forma inorgánica (22,23). Recientemente se ha establecido que la variabilidad en la capacidad metilante en las poblaciones estudiadas está asociada a distintos factores tales como edad, sexo, nivel de exposición y polimorfismo enzimático del sistema enzimático involucrado (22,23). La variabilidad en las proporciones relativas de estos intermediarios podría afectar el resultado del total de As si estos no presentasen la misma cinética de reacción. En esta experiencia, se constató in vitro la similitud en la respuesta de las distintas especies que hizo posible la cuantificación sin subestimar o sobreestimar el resultado por presentar una composición variable de especies.
Tabla 6. Valores de referencia y valores hallados en los materiales certificados.

Conclusíon
Los resultados obtenidos indican que la metodología propuesta presenta una performance analítica útil para la cuantificación de As inorgánico y sus metabolitos en muestras de agua y orina en forma rápida y confiable en niveles de concentración compatibles con los estándares internacionales vigentes para el monitoreo de la exposición al As inorgánico. Una futura comparación con metodologías de referencia junto a un bioensayo para evaluar el efecto de especies no vinculadas al metabolismo y de escasa o nula toxicidad, permitirá establecer los verdaderos alcances de esta potencial herramienta analítica.
1. Meza, M.M.; Kopplin, M.J.; Burgués, J.L.; Gandolfi, A.J. (2004). Arsenic drinking water exposure and urinary excretion among adults in the Yaqui Valley, Sonora, Mexico. Env Res. 96, 119-126. [ Links ]
2. Mukherjee, A.; Sengupta, M.K.; Hossain, M.A.; Ahamed, S.; Das, B.; Nayak, B.; Lodh, D.; Rahman, M.; Chakraborti, D. (2006). Arsenic contamination in groundwater: A global perspectives with emphasis on the Asian scenario. J Health Popul Nut. 24 (2), 143-163. [ Links ]
3. Caussy, D. (2004). Case studies of the impact of understanding bioavailability: arsenic. Ecotoxicol Environ Safety. 56, 164-173. [ Links ]
4. World Health Organization (WHO). (2004). Guidelines for Drinking-Water Quality, Vol. 1. Recommendations. Third Edition, WHO, Geneva. [ Links ]
5. Bundschuh, J.; Farias, B.; Martin, R.; Storniolo, A.; Bhattacharya, P.; Cortes, J.; Bonorino, G.; Albouy, R. (2004). Groundwater arsenic in the Chaco-Pampean Plain, Argentina: case study from Robles county, Santiago del Estero Province. App Geochem. 19, 231-243. [ Links ]
6. Código Alimentario Argentino (CAA). Capítulo XII. Bebidas hídricas, agua y agua gasificada [en línea]. Disponible en http//www.anmat.gov. ar/codigoa/capitulo XII.pdf. (Consulta Marzo de 2009). [ Links ]
7. Hinwood, A.; Sim, M.; Klerk, N.; Drummer, O.; Gerostamoluos, J.; Bastone, E. (2002). Are 24-Hour urine samples and creatinine adjustment required for analysis of inorganic arsenic in urine in population studies? Environ Res Sect A. 88, 219-224. [ Links ]
8. International Programme on Chemical Safety (IPCS). (2004). Arsenic and Arsenic Compounds. 224. [en línea]. Disponible en http:// www.inchem.org/documents/ehc/ehc/ehc224. htm (Consulta Junio de 2009). [ Links ]
9. Gong, Z.; Lu, X.; Ma, M.; Watt, C.; Le, C. (2002). Arsenic speciation analysis. Talanta. 58, 77-96. [ Links ]
10. Michalke, B. (2003). Element speciation definitions, analytical methodology and some examples. Ecotoxicology and Environmental Safety. 56, 122-139. [ Links ]
11. Dang, T.M.; Tran, Q.T.; Vu, K.V. (1999). Determination of arsenic in urine by atomic absorption spectrophotometry for biological monitoring of occupational exposure to arsenic. Toxicology Letters. 108,179-183. [ Links ]
12. Caceres, D.; Pino, P.; Montesinos, N.; Atalah, E.; Amigo, H.; Loomis, D. (2005). Exposure to inorganic arsenic in drinking water and total urinary arsenic concentration in a chilean population. Environ Research. 98, 151-159. [ Links ]
13. Suzuki K.; Mandal B.; Ogra, Y. (2002). Speciation of arsenic in body fluids. Talanta. 58, 111-119. [ Links ]
14. Guo, T.; Maasner, J.; Tsalev, D. (1997). Fast automated determination of toxicologically relevant arsenic in urine by flow injection-hydride generation atomic absorption spectrometry. Analytica Chimica Acta. 349, 313-318. [ Links ]
15. Carrero, P.; Malavé, A.; Burguera, J.; Buerguera, M.; Rondón, C. (2001). Determination of various arsenic species by flow injection hydride generation atomic absorption spectrometry: Investigation of the effects of the acid concentration of different reaction media on the generation of arsines. Analytica Chimica Acta. 438, 195-204. [ Links ]
16. Le, X.C.; Cullen, W.; Reimer, K. (1994). Effect of cysteine on the speciation of arsenic by using hydride generation atomic absorption spectrometry. Analytica Chimica Acta. 285, 277-285. [ Links ]
17. International Union of Pure and Applied Chemistry (IUPAC) Tehnical Report. (2002). Harmonized guidelines for single-laboratory validation of methods of analysis. Pure Appl Chem. 74, 835-855. [ Links ]
18. U.S. Department of Health and Human Services. (2001). Guidance of Industry Bioanalytical Method Validation. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Center for Veterinary Medicine (CVM). [en línea]. Disponible en http://www.fda.gov/ downloads/Drugs/GuidanceComplianceRegulatoryInformation/ Guidances/UCM070107.pdf. (Consulta Junio 2009). [ Links ]
19. Official Journal of the European Communities 17.8.2002. Implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results. [en línea]. Disponible en http://eur-lex. europa.eu/LexUriServ/LexUriServ.do?uri=OJ: L:2002:221:0008:0036:EN:PDF. (Consulta Junio 2009). [ Links ]
20. American Conference of Governmental Industrial Hygienists (ACGIH). (2003). Arsenic and soluble inorganic compounds: BEI ® 7th edition, Documentation. Publication # 7DOC- 665, ACGIH®, Cincinatti. [ Links ]
21. Palacios, M.; Gómez, M.; Cámara, C.; Lopez, M. (1997). Stability studies of arsenate, monomethylarsonate, dimethylarsenate, arsenobetaine and arsenocholine in deionized water, urine and clean-up dry residue from urine samples and determination by liquid chromatography with microwave-assisted oxidation-hydride generation atomic absorption spectrometric detection. Analytica Chimica Acta. 340, 209-220. [ Links ]
22. Lindberg, A.L.; Ekstrom, E.C.; Nermell, B.; Rahman, M.; Lonnerdal, B.; Persson, L.; Vahter, M. (2008). Gender and age differences in the metabolism of inorganic arsenic in a highly exposed population in Bangladesh. Environ Res. 106, 110-120. [ Links ]
23. Concha, G.; Nermell, B.; Vahter, M. (1998). Metabolism of inorganic arsenic in children with chronic high arsenic exposure in northern Argentina. Environ Health Perspect. 106, 355-359. [ Links ]














