Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. vol.22 no.2 Ciudad Autónoma de Buenos Aires set. 2014
ARTÍCULOS
Análise preliminar da citotoxicidade dos aditivos alimentares urucum e cúrcuma
Cytotoxicity of the food additive annatto and turmeric
Chagas, Luma Cipriano; Meireles de Deus, Maria do Socorro; Peron, Ana Paula*
Universidade Federal do Piauí. Campus Senador Helvídio Nunes de Barros (CSHNB) Departamento de Ciências da Natureza. Curso de Ciências Biológicas. Endereço: Rua Cícero Duarte, 940. Bairro Junco. Picos, Piauí, Brasil. CEP 64600-640. Fone (89) 3422-1024.
Recibido: 31 de octubre de 2013
Aceptado: 14 de marzo de 2014
Resumo. Este trabalho teve por objetivo avaliar a ação dos aditivos alimentares urucum e cúrcuma em células meristemáticas de pontas de raízes de Allium cepa nas doses de 5 e 10 g, nos tempos de exposição de 24 e 48 horas. Utilizou-se para cada dose um grupo de cinco bulbos de cebolas, que primeiramente foram enraizados em água destilada, e em seguida transferidos para as suas respectivas doses. Analisaram-se células em todo ciclo celular, totalizando 5.000 para cada controle e tempo de exposição. Os dados obtidos foram submetidos à análise estatística do Qui-quadrado (p<0,05). A partir dos resultados observou-se que as doses do urucum e do cúrcuma tiveram efeito antiproliferativo significativo sobre o ciclo celular deste sistema-teste. Também foi verificado número significativo de aberrações celulares nos dois tempos de exposição avaliados de todas as doses estudadas. Portanto, nas condições analisadas, o urucum e o cúrcuma mostraram-se citotóxicos e genotóxicos.
Palavras-chave: Bixa orellana L; Curcuma longa L.; Divisão celular; Aberrações celulares.
Abstract. This study aimed to evaluate the effect of food additives annatto and turmeric tip cells of Allium cepa roots in doses of 5 or 10 g in exposure times of 24 and 48 hours. A group of five onion bulbs was used for each dose. Each dose was first embedded in distilled water and then transferred to their respective doses. Cells were analyzed throughout the cell cycle, totaling 5000 for each control and exposure time. The obtained data were subjected to statistical analysis Chi-square (p <.05). From the results it was observed that the doses of turmeric and annatto had significant antiproliferative effect on the cell cycle of this test system. They also found a significant number of cellular aberrations in the two exposure times evaluated all doses studied. Therefore, under the conditions studied, annatto and turmeric proved cytotoxic and genotoxic.
Keywords: Bixa orellana L.; Curcuma longa L.; Cell division; Cellular aberrations
INTRODUÇÃO
Atualmente, os hábitos alimentares associados ao estilo de vida expõem o homem a fatores de risco para o desenvolvimento de doenças crônicas não transmissíveis (Feng et al. 2009). Dentre estes fatores está à realização de dietas desequilibradas e amplamente constituídas por aditivos alimentares sintéticos, como temperos, conservantes, corantes, aromatizantes e emulsificantes (Cheeseman 2012). Estes aditivos, apesar de terem baixo custo de produção e proporcionarem maior tempo de validade aos alimentos, são polêmicos quanto a sua ação no organismo e apontados como responsáveis em causar várias reações adversas (Sayed et al. 2012). Dessa forma, os aditivos alimentares vegetais, em função de sua origem natural e, dependendo da planta, por suas propriedades medicinais, são preferíveis e recomendados à população por profissionais da saúde para o preparo de alimentos e também na escolha de alimentos industrializados (Wolstad e Culver 2011). Dentre estes aditivos podese citar o urucum e o cúrcuma.
O urucuzeiro (Bixa orellana L., Família Bixaceae), também conhecido como urucum, é um arbusto nativo do Brasil, no entanto, é encontrado em toda a América Latina. Suas se- mentes moídas são valorizadas mundialmente como tempero e como corantes, em função de haver em seu pericarpo os apocarotenóides bixina e norbixina, compostos estes que proporcionam a cor vermelha. Porém, muitos outros compostos químicos são encontrados nestas sementes, como açúcares, óleos essenciais, proteínas, outros carotenóides e vitaminas. Ainda e conforme relatado na literatura científica às sementes desta planta tem ações antifebril, antidiarreica, antioxidante (Santos et al. 2012) e quimiopreventiva (Tsurama et al. 2012). Na América do Sul, a utilização mais conhecida do urucum é o produto obtido da mistura de suas sementes moídas com o fubá de milho, conhecido como colorau, que proporcio- na coloração amarelo-avermelhada a alimentos como arroz, bifes, frangos, farofas, molhos, queijos, massas, cereais e rações animais (Avancini et al. 2008).
Os rizomas da Curcuma longa (Família Zingiberaceae), planta popularmente conhecida como cúrcuma, são ricamente constituídos por amido, óleos essenciais e curcuminóides. As raízes desta planta, principalmente moídas, são utilizadas como temperos e na coloração de alguns alimentos como queijos processados, páprica, produtos à base de gordura e pasta de mostarda, dando-os coloração amarelada, característica esta proporcionada, principalmente, pelo curcuminóide curcumina (Pan et al. 2008).
Estes rizomas, de acordo com a literatura, mostraram ter propriedades medicinais como ações anti-inflamatórias, inibidora do crescimento de microrganismo em colicistite (Kim et al. 2012) e propriedade antioxidante (Pan et al. 2008). Também demonstrou, em testes de laboratório, ter potencial para desacelerar vias de peroxidação lipídicas (Reddy et al. 2005), ter ação preventiva na iniciação de alguns tipos de câncer (Mahfouz et al. 2011), inibir a proliferação de células neoplásicas em roedores (Bulku et al. 2012) e inibir a angiogênese induzida pelo fator de crescimento de fibroblastos desacele- rando a formação de metástases neoplásicas (Ejaz et al. 2009).
Assim, a presença marcante do urucum e da cúrcuma no preparo de alimentos e as suas propriedades farmacológicas fazem destes aditivos umas das substâncias mais consumidas no mundo (Pollar-Cabrera et al. 2010). Os valores da Ingestão Diária Aceitável (IDA), se- gundo Brasil (Resolução RDC 276 2005), para o urucum e o cúrcuma é de 2,5 mg/Kg/dia e 0,5 mg/Kg/dia, respectivamente, porém, segundo Bautista et al. (2004), plantas, bem como os seus produtos, na maioria das vezes, são ingeridas de forma indiscriminada pela população que as rotula como naturais e, erroneamente, como inócuas. Dessa forma, torna-se relevante avaliar os potenciais efeitos tóxicos, em nível celular, destes dois aditivos alimentares.
Os bioensaios com plantas são considerados adequados e rápidos para o monitoramento de efeitos tóxicos de compostos químicos (USE- PA) (Grant 1999; Herrero et al. 2012) e a Allium cepa (cebola) é um eficiente organismo bioindicador de citotoxicidade de extratos oriundos de plantas (Fachinetto et al. 2007; Sabini et al. 2011) por suas propriedades cinéticas de pro- liferação e por possuir cromossomos grandes e em número reduzido (2n=16), o que facilita a sua análise (Caritá e Marin-Morales 2008; Herrero et al. 2012). Este sistema teste também é eficiente na avaliação de genotoxicidade visto que por meio dele é possível observar anomalias do ciclo mitótico, como metáfase colchícinica, pontes anáfasicas e telofásicas; e anomalias interfásicas, como micronúcleos e células binucleadas (Matsumoto et al. 2006; Leme e Marin-Morales 2008).
Portanto, devido à ampla utilização do cúrcuma e do urucum em alimentos e considerando a A. cepa como um bioensaio adequado para avaliação de compostos químicos em nível celular, este trabalho teve por objetivo avaliar a ação destes dois aditivos alimentares vegetais, na forma in natura, sobre o ciclo celular das células meristemáticas de raízes de A. cepa.
Materiais e método
Este trabalho foi desenvolvido no Laboratório de Citogenética Vegetal e Animal do Campus Senador Helvídio Nunes de Barros da Universidade Federal do Piauí (UFPI), Município de Picos, Estado do Piauí, no período de outubro de 2011 a junho de 2012.
Obtenção dos aditivos alimentares e de suas doses
As sementes de B. orellana e as raízes de C. longa foram obtidas em um horto medicinal localizado na cidade de Teresina, Estado do Piauí, no mês de setembro de 2012. As doses de 5 g e 10 g foram obtidas triturando cinquenta sementes de urucum em 20 ml de água destilada em liquidificador, por cinco minutos, o que produziu uma solução bastante vermelha e oleosa.
Para obtenção das doses de cúrcuma, de 5 e 10 g, três raízes, com 200 g cada, foram cortadas em pequenos pedaços que foram colocados para desidratar por 24h, a sombra e a temperatura ambiente. Em seguida, os pedaços, juntamente com 20 ml de água destilada, foram triturados em liquidificador, por cinco minutos, o que produziu uma solução amarela e oleosa. A água destilada adicionada foi com o intuito de apenas facilitar a trituração destes dois aditivos em liquidificador.
As doses de 5 e 10 g estabelecidas neste estudo são consideradas altas para o sistema teste em questão. Optou-se por elas em função de que plantas, partes de plantas ou os seus produtos, na maioria das vezes e conforme citado por Bautista et al. (2010), são utilizados indiscriminadamente pela população. Dessa forma, achou-se pertinente avaliar a toxicidade em nível celular de dosagens mais elevadas do urucum e do cúrcuma.
É importante esclarecer que para esta avaliação de toxicidade utilizou-se o macerado bruto tanto do urucum como do cúrcuma, ou seja, não foi realizado o isolamento de nenhum dos seus compostos químicos. Assim, as raízes das cebolas foram colocadas diretamente em contato com as soluções obtidas, onde se teve o cuidado de verificar se as raízes de cada bulbo estavam em contato adequado com as doses estudadas.
Também é pertinente esclarecer que junto ao macerado de urucum e cúrcuma moídos encontrados a venda no comércio ocorre a adição de ingredientes, como por exemplo, de fécula, amido e substâncias antioxidantes artificiais, que, aparentemente, diminuem o teor de oleosidade destes aditivos. Neste trabalho não foi adicionado nenhum ingrediente aos extratos obtidos dos dois aditivos em questão.
Obtenção de células meristemática para a análise citogenética
As cebolas (A. cepa), em média com 300g cada, foram colocadas para enraizar em frascos com água destilada, à temperatura ambiente (± 25ºC) e aerada, até a obtenção de raízes com cerca de 2,5 cm de comprimento. Para análise de cada dose estabeleceu-se um grupo experimental com cinco bulbos de cebola.
Antes de se colocar as raízes em contato com as suas respectivas doses, algumas raízes foram coletadas e fixadas para servirem de controle (CO) do próprio bulbo. A fixação das raízes se deu em Carnoy 3:1 (etanol: ácido acético), a temperatura ambiente, por 24 horas. Em seguida, as raízes restantes foram colocadas em suas respectivas doses, por 24 horas, proprocedimento este denominado de tempo de exposição 24 horas (TE 24h).
Após este tempo foram retiradas algumas raízes e fixadas. Feito este procedimento, as raízes restantes de cada bulbo foram devolvidas as suas respectivas doses onde permaneceram por mais 24 horas, o que se denominou de tempo de exposição 48 horas (TE 48h). Após este período, raízes novamente foram coletadas e fixadas. Os tempos de exposição de 24 e 48h foram escolhidos com o intuito de se avaliar a ação dos extratos em mais de um ciclo celular, visto que, cada ciclo de divisão celular em células meristemática de raízes de A. cepa é de, em média, 20h. Para cada coleta de raiz, retirou-se, em média, três raízes por bulbo de cebola.
Preparo e leitura das lâminas, e análise dos dados
As lâminas, em média três por bulbo, foram feitas seguindo o protocolo proposto por Guerra e Souza (2002). Cada lâmina foi corada com duas gotas de orceína acética a 2% (Fachinetto e Tedesco 2009) e analisada em microscópio óptico, em objetiva de 40X. Para cada bulbo analisou-se 1.000 células, totalizando 5.000 células para cada controle e tempo de exposição. Observaram-se células em interfase, prófase, metáfase, anáfase e telófase. Foi calculado o número de células em intérfase e em divisão de cada controle e tempo de exposição e determinado o índice mitótico.
Avaliou-se também o potencial genotóxico das concentrações por meio do número de células micronucleadas, de metáfases colchícinicas, pontes anáfasicas e telofásicas, células com aderências, brotos nucleares e anáfases multipolares. A análise estatística dos dados foi realizada pelo teste do Qui-quadrado (χ2), com nível de probabilidade <0.05, por meio do software estatístico BioEstat 3.0 (Ayres 2007).
Resultados
Na Tabela 1, é apresentado o número de células em interfase, o número de células em di- visão e os valores de índice mitóticos obtidos de células meristemáticas de raízes de A. cepa tratadas com água destilada e com duas doses de urucum e de cúrcuma, nos TE 24 e 48h.
Tabela 1. Número de células em intérfase, número de células em divisão e os valores de índice mitóticos obtidos de células meristemáticas de raízes de A. cepa tratadas com água, e com cúrcuma e urucum nas doses de 5 e 10 g, nos TE 24 e 48h.
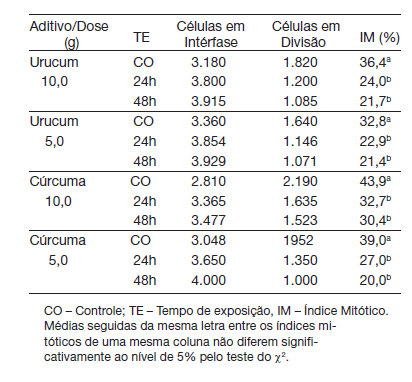
A partir dos resultados obtidos verificou-se que as duas doses testadas de cúrcuma e urucum inibiram significativamente o índice mitótico (IM) das células meristemáticas de raízes de A. cepa nos dois TE quando confrontado com o IM dos seus respectivos controles. Quando comparados os IM entre os TE de uma mesma dose verificou-se que os mesmos não foram estatisticamente significativos entre si.
Na Tabela 2, é apresentado o número de células com pontes em anáfases e telófases, células micronucleadas, e o total de aberrações celulares presentes nas células de tecido meristemático de raízes de A. cepa tratadas com água e com os aditivos urucum e cúrcuma, nos TE 24 e 48h.
Tabela 2. Número de pontes anáfasicas e telofásicas, células micronucleadas e total de aberrações celulares encontradas em cada CO e nas doses de 5 e 10 g de cúrcuma e urucum, nos tempos de exposição de 24 e 48h.

Os extratos de cúrcuma e de urucum nas duas doses e nos dois tempos de exposição avaliados apresentaram um número de aberrações celulares estatisticamente significativas pelo teste do Qui-quadrado com nível de significância igual a 5% em relação aos seus controles. Porém, quando confrontado os valores obtidos de aberrações entre os dois tempos de exposição, em cada dose avaliada, observou-se que o resultado obtido não foi estatisticamente significativo para nenhum dos aditivos por este teste estatístico com os mesmo nível de significância.
Discussão
A substituição crescente dos aditivos alimentares sintéticos por aqueles de origem natural exige que os estudos toxicológicos disponíveis para os estudos de avaliação de risco à saúde humana e animal sejam tão bem definidos quanto os dos aditivos sintéticos. Segundo Orsolin e Nepomuceno (2009), o uso adequado do cúrcuma e urucum trazem muitos benefícios ao organismo. Porém, de acordo com Volp et al. (2009), ainda não se sabe o quanto o uso indiscriminado destes dois aditivos pode ser prejudicial, visto que, seus efeitos citotóxicos, genotóxicos, mutagênicos e carcinogênicos ainda não foram estabelecidos de forma satisfatória em função dos poucos estudos realizados até o momentos avaliando-os em nível celular.
Os resultados obtidos neste trabalho mostraram que estes dois aditivos tiveram ação antiproliferativa à ponta de raízes de A. cepa já no TE 24h, e, como pode se visto, esta inibição se acentuou no TE 48h. Para os dois aditivos, as doses testadas induziram aberrações cromossômicas em número significativo nas células do sistema teste utilizado. Assim, nas condições analisadas, as duas doses testadas do cúrcuma e do urucum foram citotóxicas as células meristemáticas de raízes de cebola.
Não foram encontrados na literatura estudos de avaliação de toxicidade em nível celuusando diretamente o macerado bruto de cúrcuma obtido a partir da trituração de suas sementes. Os estudos encontrados foram avaliando apenas a curcumina, como o realizado por Mukhopadhyay et al. (1998) que avaliaram a ação da curcumina isolada em células de medula óssea de camundongos e verificaram que estes compostos na superdosagem de 5mg, tiveram ação citotóxica e mutagênica.
Antunes et al. (1999) verificaram em células de ovário de hamster chinês que doses acima de 2mg, consideradas super-dosagens para o sistema teste utilizado, de curcumina isolada induziram alterações cromossômicas em número significativo neste sistema-teste. Estes pesquisadores ainda observaram um aumento, estatisticamente significativo, de micronúcleos quando as mais elevadas doses de curcumina foram associadas com a desoxirribomicina, uma droga clastogênica. Em 2009, Orsolin e Nepomuceno observaram que doses acima de 5mg do extrato de cúrcuma foi carcinogênica a Drosophila melanogaster, a popular mosca da fruta. Estes resultados de toxicidade em nível celular com a curcumina corroboram aos resultados obtidos aqui neste trabalho com doses elevadas do extrato bruto da cúrcuma em A. cepa.
Já em relação ao urucum, da mesma forma que para o cúrcuma, não foram encontrados estudos de avaliação de toxicidade em nível celular usando diretamente o macerado bruto deste aditivo e sim somente com a bixina e a norbixina isoladas, como o realizado por Agner et al. (2005) que induziram danos ao DNA de ratos com o clastogênico N-dietil nitrosamina, e após o tratamento com a bixina, em dose normal de ingestão, verificaram que a mesma não aumentou os danos a esta molécula.
Em outro estudo, Lima et al. (2003), por meio de um tratamento subcrônico de sete dias, incluíram doses, entre 1,5 a 3,0mg, consideradas ideais para o bioensaio utilizado, do aditivo urucum na dieta de camundongos, e verificaram que o mesmo não teve ação antiproliferativa e nem mutagênica. Estes resultados não corroboram aos obtidos neste trabalho, porém, é importante destacar que as dosagens utilizadas aqui em A. cepa são consideradas elevadas, diferentemente das dosagens testadas, que foram consideradas ideais para os sistemas testes das pesquisas relatadas. Outro ponto importante é que nos trabalhos citados somente a curcumina foi avaliada, e neste trabalho utilizou-se o extrato bruto que continha todos os componentes químicos da semente.
Segundo Antunes et al. (2005), dados toxicológicos em nível celular do aditivo urucum ainda são considerados escassos. Estes mesmos autores afirmam que os valores da IDA deste aditivo alimentar são grandemente ultrapassado em países da América do Sul e América Latina, necessitando de maior atenção dos pesquisadores em avaliar o potencial tóxico do mesmo.
Dessa forma, os resultados obtidos aqui somados aos já disponíveis na literatura sobre a toxicidade em nível celular destes dois aditivos podem servir de norteadores aos profissionais da área da saúde e aos comitês responsáveis pelo estabelecimento das IDA, como por exemplo, a Agência Nacional de Vigilância Sanitária (ANVISA) na delimitação de quantidades ideais de utilização destes aditivos alimentares, bem como estimular a realização de novas pesquisas sobre a avaliação de toxicidade em nível celular do urucum e do cúrcuma.
Os resultados obtidos na presente pesquisa também reforçam a importância do sistema-teste A. cepa, já que o mesmo apresenta muitas vezes, resultados semelhantes aos resultados obtidos com outros bioensaios. Também é importante ressaltar, conforme citado por Fachinneto et al. (2007) e Peron et al., (2008) que mesmo que o metabolismo vegetal seja diferente dos bionsaios com animais e com cultura de células, os resultados obtidos por este organismo de prova são excelentes parâmetros de análise citotóxica, e o mesmo tem sido muito utilizado como indicativo para prevernir a população humana sobre o consumo de determinados alimentos e medicamentos sintéticos e naturais.
Conclusão
Outros trabalhos avaliando a toxicidade em nível celular do urucum e do cúrcuma devem ser realizados para se somarem aos já existentes e assim estabelecer, com propriedade, sua real ação em nível celular. Os resultados obtidos aqui, apesar de preliminares, indicam que, no momento, a utilização destes dois aditivos alimentares pela população, de forma indiscriminada, requer cautela.
Referências
1. Agner A.R., Bazo A.P., Ribeiro L.R., Salvadori D.M. DNA damage and aberrant crypt foci as putative biomarkers to evaluate the chemopreventive effect of annatto (Bixa orellana L.) in rat colon carcinogenesis. Mut Res. 2005;582:146–54. [ Links ]
2. Antunes L.M., Araújo M.C., Dias F.L., Takahashi CS. 1999. Modulatory effects of curcumin on the chromosomal damage induced by doxorubicin in Chinese hamster ovary cells. Teratog Carcinog Mutagen. 1999;191:1-8. [ Links ]
3. Antunes L.M., Pascoal L.M., Bianchi M.L., Dias FL. 2005. Evaluation of the clastogenicity and anticlastogenicity of the carotenoid bixin in human lymphocytes cultures. Mut Res. 2005;585:113-9. [ Links ]
4. Avancini C., Wiest J.M., Dalla`Agnol R., Haas J.S., Von Poser G.L. Antimicrobial activity of plants used in the prevention and control of bovine mastitis in southern Brazil. Lat American J Pharm. 2008;27:894-99. [ Links ]
5. Ayres M., Ayres J.R.M., Ayres D.L., Santos A.S. BioEstat 5.0 - Aplicações Estatísticas nas Áreas das Ciências Biológicas e Médicas: Sociedade Civil Mamirauá, Belém. CNPq: Brasília, 2007. [ Links ]
6. Bautista A., Miranda M.S., Batista M.S., Moreira E.L.T., Silva I.M., Gomes I.C.S. 2004. Avaliação da toxicidade oral subcrônica da bixina para ratos. Braz J Pharm Sci. 2004;40:10-14. [ Links ]
7. Bulku E., Stohs S.J., Cícero L., Brooks T., Halley H., Ray S.D. Curcumin exposure modulates multiple pro-apoptotic signaling pathways to antagonize acetaminophen- induced toxicity. Curr Neurovasc Res. 2012;9: 58-71. [ Links ]
8. Caritá R., Marin-Morales M.A. 2008. Induction of chromosome aberrations in the Allium cepa test system caused by the exposure of seeds to industrial effluents contaminated with azo dyes. Chemosphere 2008;72:722-25. [ Links ]
9. Cheeseman M.A. 2012. Artificial food color additives and child behavior. Environ Health Perspect. 2012;20:15-16. [ Links ]
10. Ejaz A., Wu D., Kwan P., Meydani M. Curcumin inhibits adipogenesis in 3T3-L1 adipocytes and angiogenesis and obesity in C57/BL mice. J Nut 2009;139:919-25. [ Links ]
11. Fachinetto J.M., Bagatini M.D., Durigon A.C.F.S., Tedesco S.B. 2007. Efeito anti-proliferativo das infusões de Achyrocline satureioides DC (Asteraceae) sobre o ciclo de celular de Allium cepa. Rev Bras Farmacog. 2007;17: 49-54. [ Links ]
12. Feng J., Cerniglia C.E., Chen H. Toxicological significance of azo dye metabolism by human intestinal microbiota. Front Biosci (Elite Ed.) 2010;4:568-586. [ Links ]
13. Grant W.F. 1999. Chromosome aberration assays in Allium. Mut Res. 1999;99:273-291. [ Links ]
14. Guerra M., Souza M.J. 2002. Como observar os cromossomos: um guia de técnicas em citogenética vegetal, animal e humana. Ribeirão Preto: FUNPEC, 2002. [ Links ]
15. Herrero O., Perez J.M.M., Fernández P.F. Toxicological evaluation of three contaminant of emerging concern by use of Allium cepa test. Mut Res. 2012;7431: 24-34. [ Links ]
16. Kim J.H., Gupta S.C., Park B., Yadau U.R., Aggarnal B.B. 2012. Tumeric (Curcuma longa L.) unhibits inflammatory nuclear factor (NF) – kB and NF-kB- regulated gene products and induced chemosensitization and suppressed osteoclastohenesis. Mol Nutr Food Res. 2012;563: 454-65. [ Links ]
17. Leme, D.M., Marin-Morales M.A. 2008. Chromosome aberration and micronucleus frequencies in Allium cepa cells exposed to petroleum polluted water – a case study. Mut Res. 2008;650:80-86. [ Links ]
18. Lima R.O.A., Azevedo L., Ribeiro L.R, Salvadori D.M. 2003 Study on the mutagenicity and antimutagenicity of a natural food colour (annatto) in mouse boné marrow cells. Food Chem Toxicol. 2003;41:189-192. [ Links ]
19. Mahfouz M.M., Zhou Q., Kummeron F.A. Effect of curcumin on LDL oxidation in vitro and lipid peroxidation and antioxidant enztmes in cholesterol fed rabbits. Int J Vitam Nutr Res. 2011;81:378-371. [ Links ]
20. Matsumoto S.T., Mantovani M.S., Malagutti M.I.A., Dias A.L., Fonseca I.C., Marin-Morales M.A. Genotoxixity and mutagenicity of water contamined with tannery, as evaluated by the micronucleus test and comet assay using the fish Oreochromis niloticus and chromosome aberration in onion root-tips. Gen Mol Biol. 2006;29:148-158. [ Links ]
21. Mukhopadhway M.J., Saha A., Mukheriee A. Studies on the anticlastogenic effect of turmeric and curcumin on cyclophosphamide and mitomycin C in vivo. Food Chem Toxicol. 1998;361:73-76. [ Links ]
22. Orsolin P.C., Nepomuceno J.C. 2009. Potencial carcinogênico do açafrão (Curcuma longa L.) identificado por meio do teste para detecção de clones de tumor em Drosophila melanogaster. Rev N Int Pesq Ext UNIPAM. 2009;6:55-69. [ Links ]
23. Pan R, Qiu S, Lu DX, Dong J. Curcumin improves learning and memory ability and its neuroprotective mechanism in mice. Chin Med J. 2008;121:832-839. [ Links ]
24. Peron A.P., Marcu M.C., Vicentini V.E.P. Avaliação do potencial citotóxico dos chás de Camellia sinensis L. e Cassia angustifolia vahl em sistema teste vegetal. Arq Ciên Saúde Unipar. 2008;12:1-10. [ Links ]
25. Polar-Cabrera K., Huo T., Schwartz S.J., Failla M.L. Digestive stability and transporto f norbixin, a 24 carbon carotenoid, across monolayers of caco-2 cells. J Agric Food Chem. 2010;58:5789-5794. [ Links ]
26. Reddy M.K., Alexander-Lindo R.L., Nair M.G. 2005. Relative inhibition of lipid peroxidation, cyclooxygenase enzymes, and human tumor cell proliferation by natural food color. J Agric Food Chem. 2005;53:9268-9273. [ Links ]
27. Resolução RDC n. 276, de 22 de setembro de 2005. Aprova regulamento técnico para especiarias, temperos e molhos. 2005. BRASIL. [ Links ] [on-line]. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. [Consulta em 10 outubro de 2012]. Disponível em: http//:www.e-legis.anvisa.gov.br.
28. Sabini M.C., Cariddi L.N., Escobara F.M., Bachetti R.A., Sutil S.B., Contigiani M.S., Zanon S.M., Sabini L.I. 2011. Evaluation of cytogenotoxic effects of cold aqueous extract from Achyrocline satureioides by Allium cepa L test. Nat Prod Commun. 2011;6:995-998. [ Links ]
29. Santos G.S., Mendonça L.M., Antonucci G.A., Santos A.C., Antunes L.M., Bianchi M.L. 2012. Protective effect of bixin on cisplatin-induced genotoxicity in PC12. J Agricultural Food Chem. 2012;50:335-340. [ Links ]
30. Sayed H.M., Foudad D., Ataya F.S., Hassan N.H., Fahmy M.A. The modifying effect of selenium and vitamins A, C and E on the genotoxicity induced by sunset yellow in male mice. Mut Res. 2012;744:145-53. [ Links ]
31. Tsuruma K., Shimazaki H., Nakashima K., Yamauchi M., Sugitani S., Shimazawa M., Linuma M., Hara H. 2012. Annatto prevents retinal degeneration induce by endoplasmic reticulatium stress in vitro and in vivo. Mol Nutr Food Res. 2012;56:713-724. [ Links ]
32. Volp A.C.P., Renhe I.R.I., Stringueta P.C. 2009. Natural bioactives pigments. Alim Nut. 2009;20:157-166. [ Links ]
33. Wrolstad R.E., Culver C.A. Alternatives to those artificial FD&C food colorants. Annu Rev Food Sci Technol. 2011;3:59-77. [ Links ]














