Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Acta toxicológica argentina
versão On-line ISSN 1851-3743
Acta toxicol. argent. vol.22 no.3 Ciudad Autónoma de Buenos Aires dez. 2014
REVISIONES
Etanol e isopropanol: genotoxicidad y teratogénesis evaluada aplicando el modelo de Drosophila melanogaster
Ethanol and isopropanol: genotoxicity and teratogenicity evaluated using Drosophila melanogaster as a model system
Palermo, Ana María1*; Mudry, Marta Dolores2
1CITEDEF (Instituto de Investigaciones Científicas y Técnicas para la Defensa), JB de La Salle 4397, Villa Martelli, Buenos Aires. Argentina;
2GIBE (Grupo de Investigación en Biología Evolutiva); FCEyN; UBA; IEGEBA-CONICET (Facultad de Ciencias Exactas y Naturales - Universidad de Buenos Aires; Instituto de Ecología, Genética y Evolución de Buenos Aires; Consejo de Investigaciones Científicas y Técnicas). Ciudad Universitaria, Intendente Güiraldes 2620, Pabellón 2, 4to. Piso, Labs 43-46; (1428EHA) Buenos Aires, Argentina.
Recibido: 13 de noviembre de 2013
Aceptado: 23 de febrero de 2014
Resumen. El etanol y el isopropanol son, de los alcoholes alifáticos de cadena corta, los más frecuentemente asociados a la actividad humana tanto a nivel industrial como en el entorno doméstico. En este trabajo se presentan los principales hallazgos reportados en la literatura para ensayos de genotoxicidad y teratogénesis en modelos experimentales de distinto nivel de complejidad, con especial énfasis en Drosophila melanogaster. El metabolismo de estos alcoholes es semejante en Drosophila y en humanos por lo cual la mosca es un buen modelo in vivo para la evaluación de sus potenciales efectos tóxicos, genotóxicos y teratogénicos.
Palabras clave: Etanol; Isopropanol; Genotoxicidad; Teratogénesis.
Abstract. Ethanol and isopropanol are two of the short chain aliphatic alcohols more frequently associated to the human environment, both in the industrial and domestic conditions. The aim of this work was to present the main findings reported in the literature about their genotoxicity and teratogenicity in experimental models of different level of complexity, with special emphasis in Drosophila melanogaster. Taking into account that the metabolism of both alcohols in Drosophila and humans is similar, the fly is a good model for the evaluation of their potentially toxic, genotoxic and teratogenic effects.
Keywords: Ethanol; Isopropanol; Genotoxicity; Teratogenicity.
Introducción
La exposición a etanol (EtOH) ocurre principalmente por ser ingrediente activo de bebidas que forman parte de la dieta humana y comparte con el isopropanol (IPA) su uso como solvente y desinfectante. La exposición ambiental no se considera peligrosa para la salud humana ni para el ecosistema, por degradarse ambos fácilmente tanto en aire como en aguas subterráneas y superficiales (Amstrong 1999). Sin embargo, el riesgo ocupacional asociado a la producción de estos alcoholes o sus derivados a nivel industrial, lo mismo que el uso del EtOH como aditivo de naftas y pesticidas, debe ser tenido en cuenta al momento de evaluar los riesgos de su uso. Por otra parte, desde que Jones y Smith (1973) describieron el síndrome alcohólico fetal (SAF), se considera la primera causa prevenible de defectos congénitos y deficiencia mental.
El metabolismo de estos alcoholes, que es oxidativo, es semejante en Drosophila melanogaster y en humanos. Las enzimas del metabolismo hepático (el principal) y extrahepático en humanos son básicamente equivalentes a las de la mosca, con la diferencia de que en esta última ocurre en cada una de las células ya que no poseen un órgano equivalente al hígado (para una revisión completa del metabolismo del etanol en humanos, Aragon y col. 2002; Zakhari 2006). En particular, el modelo del insecto ha sido ampliamente validado para el estudio de adicciones en humanos, con particular atención al etanol por las semejanzas entre los sistemas metabólicos de ambos organismos (Guarnieri y Heberlein 2003; Devineni y Heberlein 2012 y 2013; Robinson y col. 2013)
Asimismo, el sistema respiratorio del insecto, que llega directamente a la intimidad de los tejidos, y el carácter volátil de los alcoholes hacen de éste un excelente modelo in vivo para la evaluación de los potenciales efectos, genotóxicos y teratogénicos de los alcoholes, sobre todo si se compara con los sistemas bacterianos o los ensayos de corto plazo in vitro, que requieren de sistemas de activación metabólica artificiales.
El conocimiento de los efectos genéticos relacionados con la exposición a alcoholes alifáticos de cadena corta como el EtOH y el IPA, es escaso y a veces contradictorio a pesar de su uso muy difundido en el ambiente doméstico (Household Products Database, www.hss.gov) En este trabajo se presentan los principales hallazgos reportados en la literatura para ensayos de genotoxicidad y teratogénesis de ambos alcoholes en modelos experimentales de distinto nivel de complejidad, con especial énfasis en Drosophila.
Características principales del modelo
Drosophila melanogaster ha sido por muchos años una herramienta básica en los estudios de genética y mutagénesis que derivaron en numerosos ensayos para detectar mutágenos y carcinógenos. Si bien las pruebas en bacterias son parte de los sistemas de relevamiento más rápidos, la mayor ventaja de Drosophila es su carácter de organismo eucarionte con una organización genética que permite inferencias más fácilmente aplicables al hombre. La activación metabólica de promutágenos y procarcinógenos ocurre en cada una de las células de la mosca y los eventos mutacionales se cuentan como segregaciones reflejando alteraciones genéticas nucleares y eliminando la posibilidad de que sean eventos no nucleares o no mutacionales (Kilbey y col. 1981; Valencia y col. 1984). Su tiempo de generación corto (10 días a 25ºC), los caracteres morfológicos fácilmente identificables, la existencia de una diversidad de mutantes y de cepas bien caracterizadas, la facilidad para criar un número grande de individuos con medios de cultivo económicos e instalaciones sencillas, la posibilidad de tratar adultos o larvas y la disponibilidad de diferentes vías de administración (ingestión, inhalación o inyección) son ventajas adicionales (Palermo 2006). La Figura 1 ilustra las fases del ciclo de vida de Drosophila y las diferencias que permiten distinguir hembras de machos para realizar cruzamientos controlados.
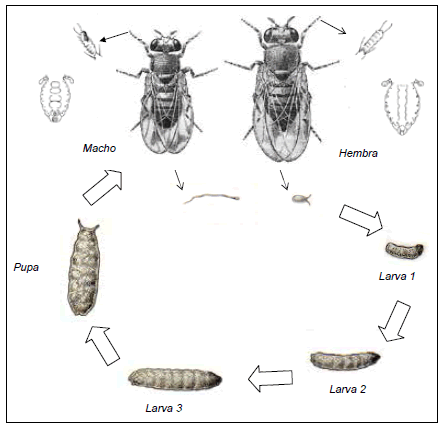
Figura 1. Ciclo de vida de D. melanogaster
Drosophila como modelo para el estudio de patologías humanas
La aplicación de enfoques combinados con tecnologías genómicas sugieren que Drosophila tiene aún mucho para ofrecer en la investigación de procesos celulares básicos implicados en el desarrollo de cáncer, afecciones neurológicas del tipo Alzheimer o Parkinson, acción de hormonas (insulina), ritmos circadianos, sueño y regulación de apoptosis o respuesta inmune (Lasko 2002; Tickoo y Russell 2002; Hendricks y Sehgal 2004; Kango- Singh y Halder 2004; Marshy Thompson 2004). Un análisis detallado de la base de datos Online Mendelian Inheritance in Man mostró que el 75% de las enfermedades genéticas tienen secuencias importantes en común con genes de Drosophila (Reiter y col. 2001).
Los ensayos para la detección de mutación y recombinación somática (SMART) desarrollados en la mosca, no sólo permiten caracterizar genotóxicos, sino que son potencialmente útiles para estudiar enfermedades de origen o desarrollo relacionado con mutación y recombinación somática. Ambos procesos pueden tener efectos importantes en las células en las que ocurren: la mutación puede ser letal para la célula o puede desencadenar en ella procesos de transformación; la recombinación puede cambiar las capacidades bioquímicas de la células tal como ocurre en el origen de las inmunoglobulinas o puede poner de manifiesto mutaciones preexistente que desencadenen procesos de transformación celular (Yu y Lieber 2003). La Tabla 1 resume las enfermedades originadas en los más diversos tipos de mutaciones somáticas que resultan en mosaicismos, incluidos o no en la línea germinal (Erickson 2003).
Tabla 1. Enfermedades de origen relacionado con mutaciones somáticas.

Drosophila como modelo para toxicidad
La Toxicología se ocupa del estudio de los efectos adversos de sustancias químicas o agentes físicos sobre los organismos vivos (Toxicology Tutorials en http://sis.nlm.nih.gov/enviro/toxtutor.html). En el siglo XX, el descubrimiento del ADN y el estudio de la regulación bioquímica de todas las funciones corporales, llevó a reconocer que virtualmente todos los efectos tóxicos sobre células u órganos son debidos a cambios en moléculas específicas. Los estudios de sustancias que afectaban al ADN o a otros blancos celulares implicados en la división, dieron origen a la Toxicología Genética que vincula los principios de la Genética con los fundamentos de la Toxicología. Finalmente, los últimos avances en el campo molecular y genético han dado origen a una nueva rama de la Toxicología, la Toxicogenómica, que ha sido definida como "el estudio de las relaciones entre la estructura y la actividad del genoma (el complemento de genes de la célula) y los efectos biológicos de agentes exógenos" (Aardema y MacGregor 2002; Waters y col. 2003).
Es importante tener en cuenta que, cuando se propone estudiar los efectos genotóxicos de un agente, primero debe establecerse cuál es su toxicidad. Para cada agente puede obtenerse una curva dosis-respuesta y a partir de ella extrapolar la toxicidad de una dosis específica, teniendo en cuenta que una toxicidad muy alta puede enmascarar el efecto genotóxico del agente en estudio (Palermo 2006). En Drosophila se trabaja en general con la dosis de exposición salvo que se utilice la vía inyectable (dosis administrada) o que se haga dosimetría mediante el uso de compuestos marcados (dosis absorbida). El esquema general de los pasos a seguir en los estudios de toxicidad en Drosophila se indica en la Figura 2.

Figura 2. Prueba de toxicidad en D. melanogaster
Drosophila como modelo en Toxicología Genética
Drosophila es un modelo excelente para estudiar los mecanismos de mutagénesis, con ella se han desarrollado una variedad de ensayos de corto plazo (ECP) notablemente útiles para la caracterización de efectos mutágenicos, teratogénicos y/o carcinogénicos. Hasta mediados de los ’80, estos ensayos estuvieron restringidos al análisis de daño genético en línea germinal (principalmente masculina), siendo el más utilizado el test de letales recesivos ligados al sexo (SLRL: sex-linked recessive lethals), para el que existe una base de datos de más de 750 químicos (Vogel y col. 1999). Otros ensayos disponibles permiten detectar un amplio espectro de daño genético: mutaciones letales recesivas; mutaciones letales dominantes; mutaciones visibles; translocaciones; pérdida o ganancia de cromosomas; no disyunción cromosómica; mutación y recombinación somática (Palermo 2006). Las bases de datos Flybase, (a database of Drosophila genes and genomes) y Fruitfly (Berkeley Drosophila Genome Project) tienen información genética sobre este organismo.
Los ECP de desarrollo más reciente en este organismo estuvieron dirigidos a la detección de mutación y recombinación somática y de aneuploidías, procesos que resultan en cambios cualitativos y/o cuantitativos del genoma de la célula afectada. A partir de los años ´80 se reconoció la importancia de la recombinación como mecanismo capaz de originar daño genético (cuando es desigual o cuando actúa como mecanismo post-replicativo de reparación), o de producir pérdida de heterocigosis para el alelo normal de un gen y así, poner de manifiesto mutaciones deletéreas preexistentes. La aneuploidía es un mecanismo que también produce pérdida de heterocigosis en un solo paso y, como la recombinación, se ha convertido en objetivo frecuente de las evaluaciones de genotoxicidad. Por otra parte en el complejo proceso de carcinogénesis se ha reconocido la importancia de la aparición de homocigosis o hemicigosis para mutaciones recesivas deletéreas, como fenómeno temprano o tardío en el proceso de transformación (Graf y col. 1984, 1994, 1998). El ejemplo mejor conocido es el caso del retinoblastoma familiar (Griffith y col. 2002).
Etanol e isopropanol como agentes genotóxicos
La base de datos ChemIDplus Advanced Specialized Information Services, incluida en la red TOXNET, Toxicology Data Network, provee información completa sobre las propiedades fisicoquímicas de estos alcoholes y su toxicidad en diferentes organismos. Asimismo, la red incluye otras bases donde se pueden encontrar referencias de su potencial carcinogénico, teratogénico o mutagénico, aunque en lo que hace a estos aspectos la información no siempre está actualizada.
Etanol
La más reciente revisión disponible en la literatura sobre genotoxicidad del EtOH es la de Phillips y Jenkinson (2001). En ella los autores resumen la información existente para diferentes sistemas de ensayo y concluyen que la mayoría de los estudios son incompletos, sin activación metabólica, con número de dosis insuficiente o concentración ensayada muy alta y que son muy pocos los estudios hechos con protocolos aceptables como para evaluar la genotoxicidad de este alcohol como producto industrial. Sin embargo, el EtOH ha sido propuesto como mutágeno clase 2 por la Comisión MAK y el European Chemical Bureau (documento No. ECBI/74/95-Add 3).
La mayoría de los resultados de ensayos en bacterias son negativos (test de Ames con/ sin activación; Zeiger y col. 1992; Phillips y Jenkinson 2001). Solamente De Flora y col. (1984 a y b) informan resultados positivos aunque débiles.
En hongos el EtOH no induce mutaciones o daño cromosómico en Aspergillus nidulans aunque causa disturbios en la segregación cromosómica que resultan en aneuploidías y polipoidías (Crebelli y col. 1989). En Saccharomyces cereviciae se ha descripto un aumento en la frecuencia de mutaciones mitocondriales (petite) pero no conversiones génicas (Ristow y col. 1995).
Las pruebas de aberraciones cromosómicas (AC) in vitro muestran resultados negativos en cultivo de linfocitos humanos, líneas celulares linfoides humanas, células HeLa, células de hámster chino y cuando el EtOH se usa como solvente en experiencias con linfocitos humanos, CHO y CHL con/sin activación metabólica (Phillips y Jenkinson 2001). Los ensayos con otras células de mamíferos, células S49 (Friederich y Naas 1983) y células L5178y (tk+/tk-) de linfoma de ratón, dan resultados negativos (Wangenheim y Bolcsfoldi 1988).
No existen evidencias concluyentes de que el EtOH induzca micronúcleos (MN) en roedores, siendo las respuestas negativas en tratamientos crónicos a ratones o ratas con concentraciones de 5% a 40% (Chaubey y col. 1977; Tates y col. 1980; Balansky y col. 1993). Solamente aparecen en la literatura dos informes de resultados positivos, Baraona y col. (1981) con un aumento pequeño aunque significativo en la frecuencia de MN en médula ósea para tratamientos de 6 semanas (12-16 g/kg/día) y Badr y col. (1977) que refieren un aumento de MN no dosis-dependientes por tratamientos inyectables. Por otra parte las pruebas AC in vivo también reportan resultados negativos.
Los resultados de ensayos de letalidad dominante en roedores son contradictorios y la mayoría cuestionables por no incluir suficientes animales o por no utilizar métodos adecuados para determinar la incidencia de mortalidad fetal, sin embargo los estudios más confiables, muestran resultados negativos (Phillips y Jenkinson 2001).
Otros efectos genéticos del EtOH tales como formación de aductos de ADN (Izzotti y col. 1998) o el intercambio de cromátidas hermanas (ICH) in vitro también son negativos (Phillips y Jenkinson 2001). Sin embargo, estudios equivalentes in vivo muestran efectos positivos aunque menores al doble de la frecuencia de control, lo que podría deberse a un efecto indirecto del alcohol a través de algún metabolito activo, probablemente el acetaldehido. Estudios in vitro en linfocitos y en células de mucosa gástrointestinal mediante el ensayo del cometa indicarían que el EtOH induce roturas de cadena en el ADN (Blasiak y col. 2000), lo que sugiere un efecto directo del alcohol sobre el ADN, aunque los autores no descartaron que el efecto pueda deberse a alteraciones en la estructura del ácido nucleico consecuencia de las condiciones del ensayo. Posteriormente, otros estudios indicaron también que el EtOH es en sí mismo genotóxico (Lamarche y col. 2003, 2004; Kido y col. 2006). Finalmente, Kayani y Parry (2010) utilizando el ensayo in vitro CBMN (micronúcleos con bloqueo de la citocinesis) y de kinetocoros marcados por inmunofluorescencia, pudieron establecer que tanto el etanol como el acetaldehído producen aumentos en la frecuencia de MN que son significativos y dosis dependiente. El análisis de kinetocoros permitió establecer que los MN inducidos por etanol se originaban por mecanismos de aneugénesis mientras que el acetaldehído lo hacía por clastogénesis.
En plantas, la mayoría de los resultados respecto de la inducción de daño cromosómico es positiva. Esto indicaría que los vegetales son más sensibles que las células de mamífero al efecto del EtOH como clastógeno o que tienen la capacidad metabólica para transformar al alcohol en un clastógeno activo (Phillips y Jenkinson 2001). Darroudi y Natarajan (1987) encontraron que extractos vegetales podían potenciar el efecto del EtOH en células de mamíferos in vivo.
Un aspecto interesante a tener en cuenta son los numerosos hallazgos que indican aumentos estadísticamente significativos en los niveles de AC, ICH y MN en alcohólicos, efectos que desaparecen luego de un período de abstinencia (Obe y Anderson 1987; Castelli y col. 1999). Tanto que las AC y los MN han sido propuestos como biomarcadores de abuso de alcohol a ser incluidos en los programas de prevención de cáncer en alcohólicos (Maffei y col. 2002). Sin embargo no puede concluirse que el EtOH es el responsable directo de este efecto porque los alcohólicos tienen hábitos dietarios, nutrición y metabolismo alterados, las bebidas alcohólicas tienen otros componentes además del alcohol y el hábito está generalmente asociado al tabaquismo (Reidy y col. 2011). Además, las concentraciones de acetaldehído que se producen como consecuencia de su metabolismo son altas y es éste el compuesto altamente reactivo que produce diversos aductos cuando interactúa con las proteínas o con el ADN (Zakhari 2006; Guo y Ren 2010; Brooks y Zakhari 2014). Por otra parte se ha observado que también puede influir el genotipo para polimorfismos de la acetaldehído dehidrogenasa 2, ALDH2 (Ishikawa y col. 2006)
En los estudios de inducción, de no disyunción y aneuploidía por tratamientos con EtOH aparece una mayor frecuencia de resultados positivos. Se ha encontrado aumento de aneuploidías en linfocitos de alcohólicos (Mitelman y Wadstein 1978; Kucheria y col. 1986) y se ha asociado el alcoholismo con una mayor frecuencia de esperma aneuploide en hombres jóvenes (Robbins y col. 1997). En roedores se han informado resultados positivos en células germinales (espermatocitos) y somáticas (embriones) originados a partir de machos tratados con EtOH (Barilyak y Kozachuk 1981; Alvarez 1983; Hunt 1987), aunque en línea germinal masculina de hamster chino no se encontraron efectos aneugénicos inducidos por EtOH. El tratamiento de huevos in vitro y el estudio de mórulas en hembras que habían sido tratadas con EtOH al momento del apareamiento, dio aumentos significativos en la incidencia de aneuploidías lo que llevó a postular que la no disyunción inducida por este alcohol era responsable de parte de los abortos espontáneos en humanos (Kaufmann 1983; Kaufman y Bain 1984).
Isopropanol
En los últimos 10 años no han aparecido estudios nuevos del potencial mutagénico del IPA (Palermo y Mudry 2011). Los resultados de mutagénesis inducida en sistemas bacterianos con/sin activación metabólica (Salmonella typhimurium y E.coli WP2 UvrA) son negativos (Shimizu y col. 1985; Zeiger y col. 1992; IARC 1999). También son negativos los efectos en sistemas in vitro de células V79 con/sin activación S-9 (von der Hude y col. 1987) y en células CHO/gen HGPRT así como la inducción de MN en médula ósea de ratón in vivo (Kapp y col. 1993; 1996) y de no disyunción meiótica en Neurospora crassa (Brockman y col. 1984).
En D. melanogaster ambos alcoholes presentan semejanzas en cuanto a sus efectos genotóxicos. El EtOH no modifica las frecuencias de SLRL, de translocaciones recíprocas y de pérdidas cromosómicas en células posmeióticas en machos, tampoco aumenta la frecuencia de mutación y recombinación somática en larvas, sin embargo aumenta significativamente la frecuencia de no disyunción para el cromosoma X si se tratan hembras antes de cruzarlas (Muñoz 1990; Rey y col. 1992; Palermo y col. 1994). El principal efecto del IPA en la mosca es el aumento de ND, aunque para producirlo debe estar presente en el momento de continuación de la meiosis después de la fertilización, por otra parte el alcohol no afectaría directamente al ADN ya que no induce mutaciones recesivas ligadas al sexo y sólo aumenta levemente la mutación somática. El efecto del IPA podría deberse a alteraciones en la membrana nuclear (Palermo y Mudry 2011).
El EtOH se clasifica en el Grupo 1 (carcinógeno humano) (IARC 1988; Baan y col. 2007) ya que se ha podido establecer una asociación causal entre el consumo de alcohol y el cáncer de cavidad oral, faringe, laringe, esófago, hígado, colon, recto, y de mama (en mujeres) y se sospecha una asociación con cáncer de páncreas y de pulmón (Boffetta y Hashibe 2006). El IPA se incluye en el Grupo 3 (no calificable respecto de su carcinogénesis en humanos) por ser inadecuada la evidencia disponible tanto en animales como en humanos. Los aumentos en la incidencia de cáncer de senos paranasales y de laringe en trabajadores que participan en la fabricación de IPA por el proceso ácido, incluyen el proceso en el Grupo 1 (IARC 1999).
Si bien la capacidad de un compuesto para inducir mutaciones presagia su potencial como carcinógeno, la existencia de mutágenos no carcinógenos indicaría que la mutación es uno (o más) de los pasos en el proceso de múltiples pasos involucrados en la carcinogénesis en mamíferos (Zeiger 2001).
Teratogénesis
Desde los años 70 el EtOH es reconocido como teratógeno en humanos (Adams y col. 2002). El consumo de alcohol en humanos y ratones durante la preñez tiene efectos adversos sobre el desarrollo del feto (síndrome alcohólico fetal), altera la fertilidad y el ciclo reproductivo, aumenta la frecuencia de abortos, de retrasos en el desarrollo intrauterino y de nacimientos prematuros y/o de bajo peso al nacer (Grodstein y col. 1994; Connor y Streissguth 1996; Cebral y col. 2000; Hannigan y Armand 2000). En modelos murinos el tratamiento de hembras poco antes o después del apareamiento produce hipoploidías, reabsorciones, muerte post-implantacional o anormalidades anatómicas en los fetos resultantes (Washington y col. 1985; Soltes y col. 1996).En ratones CF-1 la ingestión sub-crónica de alcohol produce anormalidades espermáticas y nucleares en oocitos, probablemente debidas a su efecto genotóxico (Cebral y col. 2011). En Drosophila el EtOH disminuye la fertilidad de las hembras, altera el desarrollo larval normal y aumenta significativamente la frecuencia de malformaciones congénitas (Rey y col. 1992; Palermo y col. 1994).
La información sobre los efectos de desarrollo y reproductivos del IPA es conflictiva (Nelson y col. 1988; WHO 1990; Tyl y col.1994). Kapp y col. (1996) revisaron la toxicidad del IPA y concluyeron que este alcohol secundario tiene un grado bajo de toxicidad aguda y crónica, no produce efectos adversos sobre la reproducción, no es teratógeno, ni tóxico para el desarrollo embrionario, ni neurotóxico. Faber y col. (2008), en su revisión de la toxicidad reproductiva y de desarrollo, concluyen que el IPA no afecta el índice de apareamiento ni la fertilidad de machos, aunque en hembras puede disminuir la sobrevida de la descendencia. Los datos sobre fertilidad en hembras son escasos, en Drosophila este alcohol disminuye el número de descendientes por hembra aunque los efectos no son irreversibles, sin embargo no es teratogénico (Palermo y Mudry 2011).
Drosophila se ha convertido en un modelo ampliamente aceptado para hacer el relevamiento preliminar de sustancias con efectos sobre el desarrollo y/o teratogénicos con posible acción incluso en el hombre (Vogel y Nivard 2000; Palermo y col. 2004). El modelo también es útil, como se mencionó antes, para el estudio de afecciones neurológicas, acción de hormonas, ritmos circadianos y sueño, tumorigénesis y otros. Un caso particular es el del retinoblastoma humano familiar en el que, si el individuo es portador del alelo recesivo para la enfermedad (rb+/rb), por mecanismos de pérdida de heterocigosis se puede originar un clon homocigoto para rb que dará lugar a un retinoblastoma en el ojo del paciente (Griffith y col. 2002). Otro ejemplo es el que ilustra la Figura 3 con la aparición de un clon sin color en el ojo rojo de Drosophila comparable al clon claro en el ojo humano, ambos originados por pérdida de heterocigosis. Mecanismos semejantes pueden resultar en la inactivación de genes supresores de tumores o en la activación de proto-oncogenes. De hecho, en células de pacientes que sufren enfermedades que predisponen al cáncer, las frecuencias de recombinación y de reordenamientos genómicos aparecen elevadas (Livingstone y col. 1992; Meyn 1993; Ellis 1996).

Figura 3. a) mancha blanca en el ojo de Drosophila melanogaster (adaptado de Vogel y col., 2000); b) mancha clara en ojo humano.
Bibliografía citada
1. Aardema M.D., MacGregor J.T. Toxicology and Genetic in the new era of ‘toxicogenomics": impact of "-omics" technologies. Mutat Res. 2002;499:13-25.
2. Adams J., Bittner P., Buttar H.S., Chambers C.D., Collins T.F.X., Daston G.P., Filkins K., Flynn T.J., Graham J.M. Jr., Jones K.L., Kimmel C.,Lammer E., Librizzi R., Mitala J., Polifka J.E. Statement of the Public Affairs Committee of the Teratology Society on the Fetal Alcohol Syndrome. Teratology. 2002;66:344-347. [ Links ]
3. Alvarez M.R. Numerical chromosome variation in mouse spermatogonia resulting from alcohol consumption. J Hered. 1983;74:58. [ Links ]
4. Amstrong S.R. Ethanol, Brief Report on its Use in Gasoline. Cambridge Environmental Inc. Cambridge MA. England.1999. [ Links ]
5. Aragón C., Miguel M., Correa M., Sanchis- Segura C. Alcohol y Metabolismo Humano. En: Gual A. Monografía Alcohol, Adicciones 2002;14 (Supp1):25-44.
6. Baan R., Straif K., Grosse Y., Seretan B., El Ghissassi F., Bouvard V., Altieri A., Cogliano V. Carcinogenicity of alcoholic beverages. The Lancet. 2007;8:292-293. [ Links ]
7. Badr F.M., Badr R.S., Asker R.L., Hussain F.H. Evaluation of the mutagenic effects of ethyl alcohol by different techniques. Adv. Exp. Med. Biol. 1977;85(A):25-46. [ Links ]
8. Balansky R.M., Blagoeva P.M., Mircheva Z.I., De Flora S. Co-clastogenicity of ethanol with cigarette smoke in rat erythroblasts and anticlastogenicity in alveolar macrophages. Cancer Lett. 1993;72:183-189. [ Links ]
9. Baraona E., Guerra M., Lieber C.S. Cytogenetic damage of bone marrow cells produced by chronic ethanol consumption. Life Sci. 1981;29:1797-1802. [ Links ]
10. Barilyak I.R., Kozachuck S.Y.Effects of ethanol on the genetic apparatus of mammalian germ cells. Tsitol Genet. 1981;17:57-60. [ Links ]
11. Blasiak J., Trzeciak A., Malecka-Panas E., Drzewoski J., Wojewódzka M. In vitro genotoxicity of ethanol and acetaldehyde in human lymphocytes and in the gastrointestinal tract mucosa cells. Toxicol in vitro. 2000;14:287-295. [ Links ]
12. Boffetta P., Hashibe M. Alcohol and cancer. The Lancet. 2006;7:149-156. [ Links ]
13. Brockman H.E., de Serres F.J., Ong T.M., De- Marini D.M., Katz A.J., Griffith A.J., Stafford R.S. Mutation Tests in Neurospora crassa. A report of the US Environmental Protection Agency Gene-Tox Program. Mutat Res. 1984;133:87-134. [ Links ]
14. Brooks P.J., Zakhari S. Acetaldehyde and the genome: beyond nuclear DNA adducts and carcinogenesis. Environ Mol Mutagen. 2014;55:77-91. [ Links ]
15. Castelli E., Hrelia P., Maffei F., Fimognari C., Foschi F.G., Caputo F., Cantarelli-Forti G., Stefanini G.F., Gasbarrini G.. Indicators of genetic damage in alcoholics: reversibility after alcohol abstinence. Hepato-Gastroenterol. 1999;46:1664-1668. [ Links ]
16. Cebral E., Abrevaya X.C., Mudry M.D. Male and female reproductive toxicity induced by sub-chronic ethanol exposure in CF-1 mice. Cell Biol Toxicol. 2011;27:237-48. [ Links ]
17. Cebral E., Lasserre A., Rettori V., De Gimeno M.A. Alteration in pre implantation in vivo development after preconceptual chronic moderate alcohol consumption in female mice. Alcohol Alcohol. 2000;35: 336-343. [ Links ]
18. Chaubey R.C., Kavi B.R., Chauhan P.S., Sundaram K. Evaluation of the effect of ethanol on the frequency of micronuclei in the bone marrow of Swiss mice. Mutat Res. 1977;43:441-444. [ Links ]
19. ChemIDplus Advanced. Specialized Information Services. [en línea] US National Library of Medicine, TOXNET, Toxicology Data Network, [actualizado a noviembre 2013; consulta diciembre 2013]. Disponible en http://chem.sis.nlm.nih.gov/chemidplus. [ Links ]
20. Connor P.D., Streissguth A.P. Effects of prenatal exposure to alcohol across the life span. Alcohol Health Res World. 1996;20:170-174. [ Links ]
21. Crebelli R., Conti G., Conti L., Carere A. A comparative study of ethanol and acetaldehyde as inducers of chromosome malsegregation in Aspergillus nidulans. Mutat Res. 1989;215: 187-195. [ Links ]
22. Darroudi F., Natarajan A.T. Induction of chromosomal aberrations and sister chromatid exchange in CHO cells by mutagenic metabolites activated by plant microsomal extract. Biol Zentralbl. 1987;106(2):169-174. [ Links ]
23. De Flora S., Camoirano A., Zanacchi P., Bennicelli C. Mutagenicity testing with Salmonella typhimurium strains TA97 and TA102 of 30 DNA-damaging compounds negative with other Salmonella strains. Mutat Res. 1984b;134:159-165. [ Links ]
24. De Flora S., Zanacchi P., Camoirano A., Bennicelli C., Badolati G.S. Genotoxic activity and potency of 135 compounds in the Ames reversion test and in bacterial DNA repair test. Mutat Res. 1984a;133:161-198. [ Links ]
25. Devineni A.V., Heberlein U. Acute ethanol responses in Drosophila are sexually dimorphic. Proc. Natl. Acad. Sci. U.S.A. 2012;109(51):21087-21092. [ Links ]
26. Devineni A.V., Heberlein U. The Evolution of Drosophila melanogaster as a model for alcohol research. Annu. Rev. Neurosci. 2013;36:121-138. [ Links ]
27. Ellis N.A. Mutation-causing mutations. Nature. 1996;381: 110-111. [ Links ]
28. Environmental Health and Toxicology. Specialized Information Services. [en línea] U.S. Department of Health and Human Services [actualizado a diciembre de 2009, consulta octubre de 2013]. Disponible en http://sis.nlm.nih.gov/Tox/ToxTutor.html [ Links ]
27. Erickson R.P. Somatic gene mutation and human disease other than cancer. Mutat Res. 2003;543:125-136. [ Links ]
28. Faber W.D., Pavkov K.L., Gingell R. Review of reproductive and developmental toxicity studies with isopropanol. Birth Defects Res B, Dev Reprod Toxicol. 2008;83:459-476. [ Links ]
29. Flybase. A database of Drosophila genes and genomes [en línea], [actualizado a enero 2014, consulta febrero 2014]. Disponible en http://flybase.bio.indiana.edu/ [ Links ]
30. Friedrich U., Naas G. Evaluation of a mutation test using S49 lymphoma cells and monitoring simultaneously the induction of dexamethasone resistance, 6-thioguanine resistance and ouabain resistance. Mutat Res. 1983;110:147-162. [ Links ]
31. Fruitfly. Berkeley Drosophila Genome Project [en línea], [actualizado a diciembre de 2013]. Disponible en http://www.fruitfly.org [ Links ]
32. Graf U., Abraham S.K., Guzmán-Rincón J., Würgler F.E. Antigenotoxicity Studies in Drosophila melanogaster. Mutat Res.1998;402:203-209. [ Links ]
33. Graf U., Alonso Moraga A., Castro R., Diaz Carrillo E. Genotoxicity testing of different types of beverages in the Drosophila wing somatic mutation and recombination test, Food Chem Toxicol. 1994;32 (5):423-430. [ Links ]
34. Graf U., Würgler F.E., Katz A.J., Frei H., Juon H., Hall C.B., Kale P.G. Somatic mutation and recombination test in Drosophila melanogaster. Environ Mutagen. 1984;6:153-188. [ Links ]
35. Griffith A.S.F., Miller J.H., Suzuki D.T., Lewontin R.C., Gelbart W.M. Genética, 7a. Ed. 2002; Mc Graw Hill - Interamericana. Madrid. P. 665. [ Links ]
36. Grodstein F., Goldman M.B., Cramer C.W. Infertility in women and moderate alcohol use. Am J Public Health. 1994;84:1429-1432. [ Links ]
37. Guarnieri D.J., Heberlein U. Drosophila melanogaster, a genetic model system for alcohol research. Int Rev Neurobiol. 2003;54:199-228. [ Links ]
38. Guo R., Ren J. Alcohol and acetaldehyde in Public Health: from marvel to menace. Int J Environ Res Public Health. 2010;7:1285-1301. [ Links ]
39. Hannigan J.H., Armand D.R. Alcohol in pregnancy and neonatal outcome. Semin Neonatol. 2000;5:243-254. [ Links ]
40. Hendricks J.C., Sehgal A. Why a fly? Using Drosophila to understand the genetics of circadian rhythms and sleep. Sleep. 2004;27:334-342. [ Links ]
41. Household Products Database [en línea] U.S. Department of Health and Human Services [actualizado a diciembre de 2013, consulta febrero de 2014] Disponible en http://householdproducts.nlm.nih.gov/. [ Links ]
42. Hunt P.A. Ethanol-induced aneuploidy in male germ cells of the mouse. Cytogenet and Cell Genet. 1987;44:7-10. [ Links ]
43. International Agency for Research on Cancer (IARC). Monographs on the Evaluation of Carcinogenic Risks to Humans, Suppl. 7, Overall Evaluations of Carcinogenicity: An Updating of IARC Monographs Volumes 1 to 42, Lyon. 1987;P.229. [consulta febrero de 2014]. Disponible en http://monographs.iarc.fr/.
44. International Agency for Research on Cancer (IARC). Monographs on the Evaluation of Carcinogenic Risks Humans, Alcohol Drinking. Lyon, France; Vol 44.1988. [consulta febrero de 2014]. Disponible en http://monographs.iarc.fr/.
45. International Agency for Research on Cancer (IARC). Monographs on the Evaluation of Carcinogenic Risks to Humans. Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen Peroxide. 1999; Vol.77, pp.1027- 1036. [consulta febrero de 2014]. Disponible en http://monographs.iarc.fr/.
46. International Agency for Research on Cancer (IARC). Review of Human Carcinogenesis Monographs Vol 100 [en línea], [actualizado a junio 2012, consulta octubre 2013]. Disponible en http://monographs.iarc.fr/.
47. Ishikawa H., Miyatsu Y., Kurihara K., Yokoyama K. Gene-environment interactions between alcohol-drinking behaviour and ALDH2 and CYP2E1 polymorphisms and their impact on micronuclei frequency in human lymphocytes. Mutat Res. 2006;594:1-9. [ Links ]
48. Izzotti A., Balansky R.M., Blagoeva P.M., Mircheva Z.I., Tulimiero L., Cartiglia C., De Flora S. DNA alterations in rat organs after chronic exposure to cigarette smoke and/or ethanol ingestion. FASEB J. 1998;12:753-758. [ Links ]
49. Jones K.L., Smith D.W. Recognition of the Fetal Alcohol Syndrome in early infancy. The Lancet. 1973;302:999-1001. [ Links ]
50. Kango-Singh M., Halder G. Drosophila as an emerging model to study metastasis. Genome Biol. 2004;5:216. [ Links ]
51. Kapp R.W., Jr., Marino D.J., Gardiner T.H., Masten L.W., McKee R.H., Tyler T.R., Ivett J.L., Young R.R. In vitro and in vivo assays of isopropanol for mutagenicity. Environ Mol Mutagen. 1993;22:93-100. [ Links ]
52. Kapp R.W.Jr., Bevan C., Gardiner T.H., Banton M.I., Tyler T.R., Wright G.A. Isopropanol: Summary of TSCA Test Rule Studies and Relevance to Hazard Identification. Regul Toxicol Pharmacol.1996;23:183-192. [ Links ]
53. Kaufman M.H., Bain L.M. Influence of ethanol on chromosome segregation during the first and second meiotic divisions in the mouse egg. J Exp Zool. 1984;230:315-320. [ Links ]
54. Kaufmann M.H. Ethanol-induced chromosomal abnormalities at conception. Nature. 1983;302:258-260. [ Links ]
55. Kayani M.A., Parry J.M. The in vitro genotoxicity of ethanol and acetaldehyde. Toxicol in vitro. 2010;24:56-60. [ Links ]
56. Kido R., Sato I., Tsuda S. Detection of in vivo DNA damage by ethanol in multiple organs of pregnant mice using the alkaline single cell gel electrophoresis (COMET) assay. J Vet Med Sci. 2006;68:41-47. [ Links ]
57. Kilbey B.J., MacDonald D.J., Auerbach C., Sobels F.H., Vogel E.W. The use of Drosophila melanogaster in tests for environmental mutagens. Mutat Res. 1981;85:141-146. [ Links ]
58. Kucheria K., Taneja N., Mohan D. Chromosomal aberrations and sister chromatid exchanges in chronic male alcoholics. Indian J Med Res. 1986;83:417-421. [ Links ]
59. Lamarche F., Gonthier B., Singnorini N., Eysseric H., Barret L. Acute exposure of cultured neurons to ethanol results in reversible DNA single strand breaks; whereas exposure causes loss of cell viability. Alcohol Alcohol. 2003;38:550-558. [ Links ]
60. Lamarche F., Gonthier N., Signorini N., Eysseric H., Barret L. Impact of ethanol and acetaldehyde on DNA and cell viability of cultured neurons. Cell Biol Toxicol. 2004;20: 361-374. [ Links ]
61. Lasko P. Diabetic flies? Using Drosophila melanogaster to understand the causes of monogenic and genetically complex diseases. Clin Genet. 2002;62:358-367. [ Links ]
62. Livingstone L.R., White A., Sprouse J., Livanos E., Jacks T., Tlsty T.D. Altered cell cycle arrest and gene amplification potential accompany loss of wild-type p53. Cell. 1992;70:923-935. [ Links ]
63. Maffei F., Cantelli Forte G., Castelli E., Stefanini G.F., Mattioli S., Hrelia P. Biomarkers to assess the genetic damage induced by alcohol abuse in human lymphocytes. Mutat Res. 2002;514:49-58. [ Links ]
64. Marsh J.L., Thompson L.M. Can flies help humans treat neurodegenerative diseases? Bioassays 2004;26:485-496. [ Links ]
65. Meyn MS. High spontaneous intrachromosomal recombination rates in Ataxia Telangiectasia. Science. 1993;260:1327-1330. [ Links ]
66. Mitelman F., Wadstein J. Chromosome aberrations in chronic alcoholics. The Lancet. 1978;1:216. [ Links ]
67. Muñoz E.R., Effect of ethanol pretreatment on genetic damage induced by X-rays in Drosophila melanogaster sperm. Mutat Res. 1990;232:3-10. [ Links ]
68. Nelson B.K., Brightwell W.S., MacKenzie- Taylor D.R., Khan A., Burg J.E., Weigel W.W., Goad P.T. Teratogenicity of n-propanol and isopropanol administered at high inhalation concentrations to rats. Food Chem Toxicol. 1988;26:247-254. [ Links ]
69. Obe G., Anderson D. Genetic effects of ethanol. Mutat Res. 1987;186:177-200. [ Links ]
70. Palermo A.M. Drosophila melanogaster como modelo en estudios de mutagénesis y recombinagénesis ambiental. En: Genética Toxicológica. Mudry M.D. y Carballo M.A. (Eds.). Editorial de los Cuatro Vientos. Buenos Aires, Argentina. Capítulo XIII. 2006; P. 339-358. [ Links ]
71. Palermo A.M., Mudry M.D. Evaluation of genotoxic damage induced by isopropanol in germinal and somatic cells of Drosophila melanogaster. Mutat Res. 2011;726:215- 22. [ Links ]
72. Palermo A.M., Rey M., Muñoz E.R. Protective effect of ethanol on X-ray induced mitotic recombination in Drosophila melanogaster. Environ Mol Mutagen. 1994;24:137-142. [ Links ]
73. Palermo A.M., Reynoso A.S., López Nigro M., Carballo M., Mudry M.D. Teratogenic evaluation of metronidazole and ornidazole using Drosophila melanogaster as an experimental model. Birth Defects Res. Part A. 2004;70:157-162. [ Links ]
74. Phillips BJ, Jenkinson P. Is ethanol genotoxic? A review of published data. Mutagenesis 2001;16:91-102. [ Links ]
75. Reidy J., McHugh E., Stassen L.F.A. A review of the relationship between alcohol and oral cancer. The Surgeon. 2011;9:278-283. [ Links ]
76. Reiter L.T., Potoki L., Chien S., Gribskov M., Bier E. A systematic analysis of human disease-associated gene sequences in Drosophila melanogaster. Genome Res. 2001;11:1114-1125. [ Links ]
77. Rey M., Palermo A.M., Muñoz E.R. Nondisyunction induced by ethanol in Drosophila melanogaster females. Mutat Res. 1992;268:95-104. [ Links ]
78. Ristow H., Seyfarth A., Lochmann E.R. Chromosomal damages by ethanol and acetaldehyde in Saccharomyces cerevisiae as studied by pulsed field gel electrophoresis. Mutat Res. 1995;326:165-170. [ Links ]
79. Robbins W.A., Vine M.F., Truong K.Y., Everson R.B. Use of fluorescence in situ hybridization (FISH) to assess effects of smoking, caffeine and alcohol on aneuploidy load in sperm of healthy men. Environ Mol Mutagen. 1997;30:175-183. [ Links ]
80. Robinson B.G., Khurana S., Atkinson N.S. Drosophila larvae as a model to study physiological alcohol dependence. Communicative & Integrative Biol. 2013; [ Links ]6:2.
81. Shimizu H., Suzuki Y., Takemura N., Goto S., Matsushita H. The results of microbial mutation test for forty-three industrial chemicals. Jpn J Ind Health. 1985;27:400-419. [ Links ]
82. Soltes B.A., Robert Anderson R., Radwanska E. Fetus-placenta-newborn: morphologic changes in offspring of female mice exposed to ethanol before conception. Am J Obstet Gynecol. 1996;175:1158-1162. [ Links ]
83. Tates A.D., De Vogel N., Neuteboom I. Cytogenetic effects in hepatocytes, bone marrow cells and blood lymphocytes of rats exposed to ethanol in the drinking water. Mutat Res. 1980;124:145-151. [ Links ]
84. Tickoo S., Russell S. Drosophila melanogaster as a model system for drug discovery and pathway screening. Curr Opin Pharmacol. 2002;2:555-560. [ Links ]
85. Toxicology Tutorials. Environmental Health and Toxicology. [en línea]. [consulta febrero de 2014]. Disponible en http://sis.nlm.nih.gov/enviro/toxtutor.html. [ Links ]
86. TOXNET, Toxicology Data Network, US National Library of Medicine, [en línea]. [consulta febrero de 2014]. Disponible en http://toxnet.nlm.nih.gov. [ Links ]
87. Tyl R.W., Masten L.W., Marr M.C., Mayers C.B., Slauter R.W., Gardiner T.H., Strother D.E., Mac Kee R.H., Tyler T.R. Developmental toxicity of isopropanol by gavage in rats and rabbits, Fundam Appl Toxicol. 1994;22:139-151. [ Links ]
88. Valencia R., Abrahamson S., Lee W.R., Von Halle E.S., Woodruf R.C., Würgler F.E., Zimmering S. Chromosome mutation tests for mutagenesis in Drosophila melanogaster. A report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutat Res. 1984;134:61-88. [ Links ]
89. Vogel E.W., Graf U., Frei H.J., Nivard M.M. The results of assays in Drosophila as indicators of exposure to carcinogens. IARC Sci Publ. 1999;146:427-470. [ Links ]
90. Vogel E.W., Nivard M.J. Parallel monitoring of mitotic recombination, clastogenicity and teratogenic effects in eye tissue of Drososphila. Mutat Res. 2000;455:141-153. [ Links ]
91. Von der Hude W., Scheutwinkel M., Gramlich U., Fissler B., Basler A. Genotoxicity of threecarbon compounds evaluated in the SCE test in vitro. Environ Mutag. 1987;9:401-410. [ Links ]
92. Wangenheim J., Bolcsfoldi G. Mouse lymphoma L5178y thymidine kinase locus assay of 50 compounds. Mutagenesis.1988; 3:193-205. [ Links ]
93. Washington W.J., Cain K.T., Cacheiro N.L.A., Generoso W.M. Ethanol-induced late fetal death in mice exposed around the time of fertilization. Mutat Res. 1985;147:205-210. [ Links ]
94. Waters MD, Olden K, Tennant RW. Toxicogenomic approach for assessing toxicant-related disease. Mutat Res. 2003;544:415-424. [ Links ]
95. World Health Organization (WHO). Environmental Health Criteria 103: 2-Propanol, Office of Publications, WHO, Geneva, Switzerland, 1990. [ Links ]
96. Yu K., Lieber M.R. Nuclei acid structures and enzymes in the immunoglobulin class switch recombination mechanism. DNA Repair.2003;2:1163-1174. [ Links ]
97. Zakhari S. Overview: how is alcohol metabolized by the body? Alcohol Res Health. 2006;29:245-254. [ Links ]
98. Zeiger E. Mutagens that are not carcinogens: faulty theory or faulty tests? Mutat Res. 2001;492(1-2):29-38. [ Links ]
99. Zeiger E., Anderson B., Haworth S., Lawlor T., Mortelmans K. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ Mol Mutag. 1992;19 (Suppl. 21):2-141. [ Links ]














