Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta toxicológica argentina
On-line version ISSN 1851-3743
Acta toxicol. argent. vol.23 no.1 Ciudad Autónoma de Buenos Aires May 2015
ARTÍCULOS
Biomarcadores hematológicos del sapo común Bufo (Rhinella) arenarum en ecosistemas alterados de la provincia de Córdoba
Hematologic biomarkers of the common toad Bufo arenarum in altered ecosystem of Córdoba province
Salinas, Zulma Anahí *; Salas, Nancy Edith; Baraquet; Mariana; Martino, Adolfo Ludovico.
Ecología, Departamento de Ciencias Naturales, Facultad de Ciencias Exactas, Físico-Químicas y Naturales, Universidad Nacional de Río Cuarto. Ruta Nacional N° 36 - km 601, (X5804BYA) Río Cuarto, Argentina.
Recibido: 30 de mayo de 2014
Aceptado: 25 de octubre de 2014
Resumen. El uso de biomarcadores hematológicos es importante para poder evaluar riesgos ambientales y la exposición a sustancias químicas potencialmente tóxicas y así poder desarrollar medidas que sirvan como señales de alarma temprana en ambientes contaminados. El objetivo de este trabajo fue determinar biomarcadores hematológicos en el sapo común Bufo (Rhinella) arenarum que proporcionen información para el diagnóstico de la salud de distintos ecosistemas de la provincia de Córdoba. Un total de 93 individuos adultos de Bufo (Rhinella) arenarum fueron capturados en cuatro sitios de la provincia de Córdoba y distintas variables ambientales del agua fueron medidas en cada sitio. Las muestras de sangre se obtuvieron mediante la punción de la vena angularis. Luego fueron teñidas con la tinción diferencial May Grünwald-Giemsa y fueron observadas mediante microscopio Zeiss Primo Star iLED para realizar el conteo de glóbulos blancos. Las variables ambientales del agua mostraron diferencias estadísticamente significativas entre las poblaciones, se registraron valores menores en "Alpa Corral", mientras que "Villa Dálcar" presentó los mayores valores para dichas variables. No se encontraron diferencias estadísticamente significativas entre localidades en el recuento de glóbulos blancos (cada 1000 eritrocitos); sin embargo, en "Villa Dálcar" se registraron los ejemplares con mayor cantidad de leucocitos en el conteo de glóbulos blancos (425,48 ± 481,34). Mientras que para la fórmula leucocitaria, los linfocitos fueron las células más abundantes para los ejemplares de todos los sitios; encontrándose diferencias estadísticamente significativas entre cada localidad y "Alpa Corral". Los ejemplares de "Villa Dálcar" presentaron diferencias estadísticamente significativas en relación a los monocitos y basófilos, registrándose altos valores para ambas células en los ejemplares de este sitio; mientras que en los ejemplares de "Cultivo" las diferencias se encontraron en eosinófilos y la relación neutrófilos/linfocitos. Estos resultados revelaron que de las cuatro localidades analizadas, "Villa Dálcar" representa la más afectada por las actividades antrópicas. Estas variaciones registradas en los parámetros hematológicos podrían considerarse evidencia de la posible presencia de agentes contaminantes en el lago "Villa Dálcar".
Palabras claves: Biomarcadores; Leucocitos; Vena angularis; Bufo (Rhinella) arenarum.
Abstract. Hematologic biomarkers are important to assess the environmental and health risks of exposure to potentially toxic chemicals, and for developing measures that serve as early warning signals in polluted areas. The aim of this study was to determine hematologic biomarkers of common toad Bufo (Rhinella) arenarum that provide information for the diagnosis of the health of ecosystems of Córdoba province. A total of 93 adult individuals of Bufo (Rhinella) arenarum were collected from four sites of Córdoba Province and hydric environmental variables were measured on each site. Blood samples were obtained by angularis vein puncture, smears of fresh blood were stained with May Grünwald-Giemsa and observed by using a microscope Carl Zeiss Primo Star (Pack 5), for white blood cell count. Water environmental variables showed statistically significant differences among localities, with the lowest values in "Alpa Corral" and highest values in "Villa Dálcar". There were no statistically significant differences among individuals of different sites for white blood cells count. However, individuals from "Villa Dálcar" showed the highest number of white cells (425.48 ± 481.34). In the leukocyte formula, lymphocytes were most abundant white blood cells in individuals from all study sites. The blood parameters of toads from all sites showed statistically significant differences with individuals from "Alpa Corral". "Villa Dálcar" Individuals exhibited significant differences in relation to monocytes and basophils with the highest values for both cell types. "Cultivo" locality showed significant differences for eosinophils and for the relationship neutrophils/ lymphocytes. These results revealed that "Villa Dálcar" represent the site most affected by human activities. In particular, changes recorded in hematological parameters could be giving evidence of the possible presence of contaminants in Lake "Villa Dálcar".
Keywords: Biomarkers; Leukocytes; Angularis vein; Bufo (Rhinella) arenarum.
Introducción
Las poblaciones de anfibios están disminuyendo en todo el mundo, con un 32 % de especies en peligro de extinción y el 43 % de las especies en riesgo (Stuart y col. 2004). Esta creciente reducción, advertida en las poblaciones de anfibios (Collins y Crump 2009), ha generado en los científicos un interés acerca de las posibles causas de dicho fenómeno (Burkhart y col. 2003; Blaustein y Dobson 2006; Henle y col. 2008). Entre las cuales se pueden citar, las originadas por factores que actúan de manera global y simultánea como el aumento de la radiación ultravioleta, relacionada a su vez con el adelgazamiento de la capa de ozono, el uso indiscriminado de plaguicidas, los múltiples y complejos procesos que resultan en el cambio climático, etc. (Lavilla 2001; Lavilla y Heatwhole 2010). Sin embargo, las declinaciones poblacionales en anuros son el resultado de la acción sinérgica de diversos factores, no solamente a escala mundial sino también algunos a nivel local, como la contaminación del agua, fragmentación de hábitats naturales, etc. (Ross y Stephen 1999; Branch y Hokit 2000; Lavilla 2001; Belden y Blaustein 2002; Blaustein y Kiesecker 2002; Blaustein y Belden 2003).
La pérdida de hábitats originales que sufren estas especies parece ser el factor más importante que lleva a disminución de su tamaño poblacional, así como también, su baja capacidad de recolonizar áreas después de extinciones locales (por presentar baja movilidad y filopatría), agregan más factores a la declinación de las poblaciones de anfibios (Blaustein y col. 1994; Alford y Richards 1999; Houlahan y col. 2000; Kiesecker y col. 2001), lo cual indica que cada vez resulta más esencial incrementar el conocimiento de la diversidad de anfibios y generar la información de base para avanzar en acciones específicas de conservación (Vaira y col. 2012).
Sin embargo, muchas veces estas medidas se encuentran limitadas por la falta de conocimiento sobre las especies y su distribución, asignando un gran número de ellas a la categoría "insuficientemente conocida" (Úbeda y Grigera 2003; Sanabria y Quiroga 2009).
En este contexto, varios trabajos indican que la pérdida de hábitat como resultado del desarrollo de la agricultura puede contribuir a la regresión de la diversidad de anfibios anuros en algunos lugares debido al mayor laboreo de los suelos y la consiguiente pérdida de materia orgánica, aumento de la compactación, disminución de la capacidad de retención por pastoreo del ganado, erosión de cabeceras de cuencas, y aumentos de contaminación química por plaguicidas y fertilizantes (di Tada y col. 1996; Wake 1998; Lavilla 2001; Davidson y col. 2002; Lajmanovich y col. 2002, 2003; Stuart y col. 2004; Beebee y Griffiths 2005; Peltzer y col. 2006; Stuart y col. 2008; Collins y Crump 2009; Bionda y col. 2012).
En Argentina, la expansión de los sistemas agrícolas modernos y la urbanización extrema, ha simplificado el paisaje (McLaughlin y Mineau 1995) además de liberar una amplia gama de pesticidas que se utilizan comúnmente, afectando la biodiversidad de los anfibios anuros (Alford y col. 2001; Kiesecker y col. 2001; Christin y col. 2003; Cabagna y col. 2005; De Sá 2005).
Los anfibios anuros, representan un grupo particularmente sensible a contaminantes ambientales debido a su doble ciclo de vida (acuático y terrestre) y su piel muy permeable que intercambia materiales con el medio (Welsh y Ollivier 1998; Manzanilla y Péfaur 2000; Cabagna y col. 2005; Lascano y col. 2009; Blaustein y col. 2011) por lo que resultan ser buenos bioindicadores de la salud ambiental (Young y col. 2004).
Los cambios en los parámetros sanguíneos pueden ser útiles en algunas especies como marcadores bioquímicos de la toxicidad de ciertos productos químicos (Haratym-Maj 2002).
Entre los anfibios anuros, el recuento diferencial de glóbulos blancos representa una alerta temprana de exposición a distintos agentes contaminantes antes de que puedan ser detectadas respuestas a nivel de comunidad y ecosistema (Peri y col. 1998; Davis y col. 2004).
El objetivo de este trabajo fue determinar biomarcadores hematológicos del sapo común Bufo (Rhinella) arenarum que proporcionen información para el diagnóstico de la salud de los distintos ecosistemas de la provincia de Córdoba.
Materiales y métodos
Se escogieron cuatro sitios, tres de ellos constituyen ambientes urbanos y periurbanos con distintos tipos y grados de alteración ambiental. La importancia en la selección de dichos ambientes para el presente estudio, se basa en los antecedentes de estudios previos sobre modificaciones en los parámetros poblacionales en distintas especies de anfibios, así como cambios en las propiedades de las comunidades, posiblemente por el grado de alteración ambiental (Bionda y col. 2011a, 2011b; Bionda y col. 2012a, 2012b; Pollo y col. 2012; Bionda y col. 2013). El primer sitio de estudio corresponde al Río Barrancas ("Alpa Corral", 32º 42` S 64º 42` O; 880 msnm) considerado como el sitio de menor grado de alteración.
La elección de dicho sitio se debió a que el Río Barrancas pasa por la localidad serrana de "Alpa Corral", donde por tratarse de un lugar turístico, existen distintas políticas de conservación del ambiente con fines de preservar las condiciones naturales autóctonas del lugar. Otro aspecto a tener en cuenta es el hecho de que los efluentes cloacales no se destinan al río, sino a pozos ciegos y además, actividades antrópicas como la agricultura y ganadería se encuentran alejadas de dicho sitio. El segundo sitio pertenece al sistema de charcas, ubicado en el Campus de la Universidad Nacional de Río Cuarto, ("Charco de las Brujas", 33º 10` S- 64º 20` O; 420 msnm). El tercer sitio fue el lago artificial "Villa Dálcar", ubicado dentro del ejido urbano de la ciudad de Río Cuarto (33º 07` S, 64º 20` O; 438 msnm), y por último, el sitio llamado "Cultivo", que posee una pequeña charca ubicada en un área de cultivo de 9 ha de superficie en cercanías a la ciudad de Río Cuarto (33º 05’ S, 64º 26’ O; 467 msnm).
Los ejemplares de Bufo (Rhinella) arenarum (Pyron y Weins 2011) fueron colectados entre los años 2010 y 2011 durante los meses de septiembre y octubre, coincidiendo con el período reproductivo de la especie. In situ se registraron las siguientes variables ambientales del agua: pH, temperatura, conductividad, solutos disueltos totales y salinidad con equipo digital 35-Series TestsTM Multiparámetro 35.425-10.
Luego se procedió a la extracción de sangre mediante la punción de la vena angularis (Nöller 1959). Esta metodología, contraria a la extracción de sangre mediante punción cardíaca, elimina por completo la probabilidad de muerte del individuo contribuyendo así a la conservación de la especie.
Se realizaron frotis sobre portaobjetos, dejándolos secar a temperatura ambiente, para luego ser teñidos con tinción diferencial May Grünwald-Giemsa. Inmediatamente después de la extracción los animales fueron restituidos al sitio donde fueron capturados. Los preparados se observaron con microscopio Zeiss Primo Star iLED a 40X para realizar la descripción de leucocitos (Linfocitos, Monocitos, Neutrófilos, Eosinófilos, Basófilos), considerando las características morfológicas de acuerdo a Hadji-Azimi y col. (1987); Coppo (2003) y Jill Heatley y Johnson (2009).
Se calculó el número total de leucocitos en relación a 10.000 células rojas (eritrocitos) en base a la metodología usada por Davis y col. (2004). Se determinó el índice neutrófilos/linfocitos (N/L), propuesto como medida de los individuos en repuesta al estrés (Davis y col. 2008) y el índice de lobularidad (IL=número de lóbulos contados/número de neutrófilos contados) para evaluar el grado de madurez leucocitario (García y col. 1997). Además, se realizó un recuento de neutrófilos con núcleos ahorquillados de acuerdo a Davis y col. (2004, 2008).
Para el tratamiento de los datos, se utilizó el programa Statgraphics Plus 5.0. Se probó la distribución normal de los datos mediante la prueba de Shapiro-Wilks. Luego se realizaron análisis de ANOVA, con aquellas variables donde se encontró normalidad y el análisis de Kruskal-Wallis, para las variables que no presentaron una distribución normal, para evaluar diferencias entre sexos. Para la comparación del sitio control y los otros sitios se llevó a cabo el Test Mann-Whitney.
Resultados
De todas las variables ambientales analizadas, la salinidad, conductividad y sólidos totales del agua presentaron valores inferiores en "Alpa Corral" con respecto al resto de los sitios estudiados; mientras que "Villa Dálcar" fue el sitio que presentó mayores valores (Figura 1). Los valores de pH del agua también fueron altos en "Villa Dálcar", de aproximadamente 9,775 con respecto al resto de los sitios. "Cultivo" con valores de 9,000, "Alpa Corral" de 8,805 y "Charco de las Brujas" de 7,955.
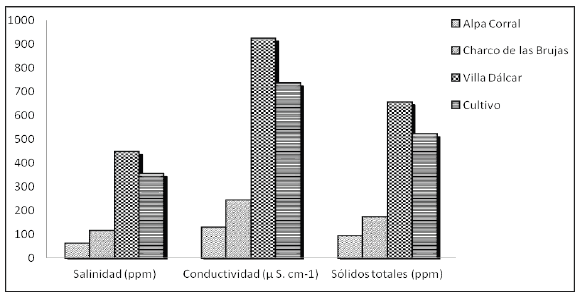
Figura 1. Gráfico de salinidad, conductividad y sólidos totales para cada uno de los sitios de muestreo.
No se encontraron diferencias estadísticamente significativas (ANOVA y Kruskal-Wallis, p< 0,05) entre machos y hembras en el total de leucocitos, ni en la fórmula leucocitaria, por lo que los datos se analizaron sin diferenciación por sexo.
En la Tabla 1 se presentan los datos del total de leucocitos para los sapos de cada sitio de estudio. En la misma se observa que los sapos de "Villa Dálcar" presentaron el mayor promedio de leucocitos (425,48±481,34) con respecto a los sapos del resto de los sitios. Sin embargo, no se registraron diferencias estadísticamente significativas entre los valores hallados en cada uno de los sitios y en "Alpa Corral" (Test Mann-Whitney: "Villa Dálcar", p = 0,783, W = 218; "Charco de las Brujas", p = 0,999, W = 189,5; "Cultivo", p = 0,936, W = 114,5).
Tabla 1. Promedios, desvíos y rangos del conteo de glóbulos blancos/10000 eritrocitos para cada sitio de estudio.

Los porcentajes de cada una de las células de la formula leucocitaria para los ejemplares de cada sitio de estudio se muestran en la Tabla 2. El índice N/L resultó de 0,321±0,307 para los ejemplares de "Alpa Corral"; 0,216±0,207 para los de "Charco de las Brujas"; 0,286±0,308 para los de "Villa Dálcar" y 0,097±0,058 para los de "Cultivo".
Tabla 2. Promedios, desvíos, rango y porcentajes de la fórmula leucocitaria para cada sitio. (L=Linfocitos, N=Neutrófilos, E=Eosinófilos, B=Basófilos, M=Monocitos)

En la comparación de los tres sitios de estudio con "Alpa Corral", se observaron diferencias estadísticamente significativas con las muestras de los animales de "Cultivo" para los eosinófilos y el índice N/L (p = 0,021, W = 175; p = 0,014, W = 179); y con los ejemplares de "Villa Dálcar" para basófilos y monocitos (p = 0,007, W = 103,5; p = 0,001, W = 62,5).
En este estudio se registraron distintos tipos de lobularidad para los neutrófilos: unilobulado, bilobulado, trilobulado, tetralobulado y con núcleo ahorquillado (Figura 2); pudiendo observarse también en baja proporción formas pentalobuladas.
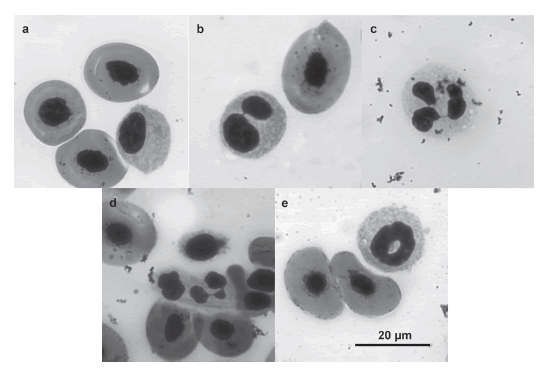
Figura 2. a) Neutrófilo unilobulado, b) neutrófilo bilobulado con característico puente de unión entre los lóbulos, c) neutrófilo trilobulado, d) neutrófilo tetralobulado y e) neutrófilo con núcleo ahorquillado.
Para la comparación entre sitios, respecto al índice de lobularidad, los ejemplares de "Charco de las Brujas" y "Cultivo" tienen valores similares entre sí (1,86 y 1,83, respectivamente) mayores a los valores que presentan los ejemplares de "Alpa Corral" y "Villa Dálcar" (1,48 y 1,46, respectivamente). "Villa Dálcar" representó el sitio con ejemplares de mayor cantidad de núcleos ahorquillados (6 núcleos) respecto al total de neutrófilos; para los ejemplares de "Cultivo", 5 núcleos ahorquillados; y para los de "Charco de las Brujas" y "Alpa Corral" 3.
Discusión
Los estudios realizados sobre los parámetros hematológicos de anfibios se han intensificado en las últimas décadas debido a su capacidad para determinar la calidad de un ambiente. Dichos parámetros hematológicos registran cambios a nivel molecular y celular de organización biológica (interacción inicial de los contaminantes con el organismo) y en base a los cuales podemos desarrollar medidas que sirvan como señales de alarma temprana para los niveles de organización superior (Bucheli y Fent 1995; Cajaraville y col. 2000).
En lo que respecta a las variables ambientales, los valores de pH para "Charco de las Brujas" y "Alpa Corral" se encuentran aproximadamente dentro del rango óptimo (entre 6,5 a 8,5) de agua dulce para la sobrevida y fisiología en la mayoría de los organismos acuáticos; mientras que para los sitios "Cultivo" y "Villa Dálcar", los valores resultan muy alcalinos. Fuera del rango antes mencionado, los efectos tóxicos directos pueden ocurrir y los niveles de estrés serán altos (Addy y col. 2004). En anfibios, los valores límites de pH para el desarrollo normal se consideran un poco más acotados, en algunas especies se ha mencionado un límite inferior de 6,3 y superior de 7,7 (García y Fontúrbel 2003).
La conductividad, por otro lado, es un parámetro relacionado a los Sólidos Totales. En general, a medida que los Sólidos Totales y la conductividad se incrementan, aumenta la Salinidad. De acuerdo a la OMS, la CEE (Comunidad Económica Europea) establece para la conductividad un valor guía para el agua potable de 400 μS/cm (OMS 2004). Esto indica que los sitios "Charco de las Brujas" y "Alpa Corral" presentan valores admitidos, mientras que "Cultivo" y "Villa Dálcar" presentan valores mayores.
Al igual que la mayoría de los trabajos relacionados a hematología sanguínea, no se registraron diferencias estadísticamente significativas con respecto al sexo (Atatür y col. 1999; Sevinc y Ugurtas 2001; Arserim y Member 2008; Davis y Durso 2009; Arikan y col. 2010; Cabagna y col. 2011). En cuanto al conteo de glóbulos blancos, si bien no se registraron diferencias estadísticamente significativas entre los distintos sitios de estudio y "Alpa Corral", el elevado número de leucocitos (leucocitosis) en los individuos de "Villa Dálcar", podría estar relacionado con el transporte de sustancias por escorrentías de las zonas aledañas que ingresan al lago (Pollo y col. 2012).
La fórmula leucocitaria para Bufo (Rhinella) arenarum en este estudio fue similar a la publicada en otros trabajos (Varela y Sellares 1937; Peri y col. 1998; Rosenberg y col. 2003; Cabagna y col. 2005; Chiesa y col. 2006). Siendo la fórmula leucocitaria de los individuos de "Alpa Corral" la que más se asemeja a los valores considerados como basales o normales para la especie (Varela y Sellares 1937). No se registraron diferencias estadísticamente significativas entre sexos para cada tipo de células en relación al conteo diferencial de glóbulos blancos al igual que lo observado en otros trabajos (Davis y col. 2004; Cabagna y col. 2005; Zhelev 2007; Cabagna y col. 2011).
Los linfocitos fueron los leucocitos más abundantes, sin embargo, una marcada disminución en el número de los mismos (linfopenia) se registró en las muestras de animales provenientes de "Villa Dálcar" donde, esta combinación con el aumento en el número de neutrófilos (neutrofilia), puede ser interpretada como signo de estrés (Davis y Durso 2009). Asociado a esto, las muestras de "Cultivo" presentaron la menor neutropenia.
Se ha demostrado que la exposición a plaguicidas provoca alteraciones en la función inmune de los anfibios llevando a los individuos a estar más vulnerables a las infecciones bacterianas y fúngicas (Carey y col. 1999; Gilbertson y col. 2003; Cabagna y col. 2005; Arikan 2010). Las elevadas proporciones de monocitos y basófilos encontradas en los individuos de "Villa Dálcar" respecto a los de "Alpa Corral" puede deberse a una respuesta a infecciones bacterianas y a otros patógenos, así como también al estrés (Turner 1988; Campbell 1996; Nava y col. 2001; Davis y col. 2004). De acuerdo a Zhelev (2007), una exposición a largo plazo de contaminantes produce necrosis que genera una mayor cantidad de desechos tisulares.
Consecuencia de esto, aumenta en el organismo la cantidad de monocitos en el torrente sanguíneo con un incremento en la fagocitosis para eliminar dichos desechos. Mientras que no está claro el papel de los basófilos en el sistema inmune de los anfibios, por razones desconocidas su número varía en gran medida entre las especies de anfibios en todo el mundo, desde el 57 % en el tritón japonés Cynops pyrrhogaster (Pfeiffer y col. 1990) hasta el 1 % en Bufo alvarius (Cannon y Cannon 1979).
Los individuos de "Cultivo" presentaron el menor porcentaje de eosinófilos respecto a los ejemplares de los otros sitios, con diferencias estadísticamente significativas respecto a los de "Alpa Corral". Los eosinófilos, se piensa que están involucrados en la respuesta inmune ante parásitos, siendo en los anfibios la mejor evidencia de esto (Turner 1988; Kiesecker 2002; Thrall 2004). Cuando no existen elevadas cantidades de parásitos para una determinada especie, los eosinófilos también pueden actuar para prevenir infecciones, al igual que como medidas de estrés (Hills y col. 1948; Gordon 1955; Cardinet y col. 1964). Trabajos como el de Cabagna y col. (2005), registran una disminución en el número de eosinófilos en sitios donde se practica cultivo intensivo con soja transgénica; al igual que Kiesecker (2002) quién también registra una supresión del número de eosinófilos por un pesticida, causando un aumento en la susceptibilidad de una especie de rana a infecciones generadas por trematodos.
Los valores de N/L bajos para los individuos de "Cultivo" pueden indicar inmunodepresión (Harmon 1998). En los restantes sitios, a pesar de no presentar diferencias significativas respecto a "Alpa Corral", presentaron valores altos de N/L comparados con "Cultivo". Esto puede deberse a la manipulación de los individuos, que provoca la liberación de una gran cantidad de hormonas como producto del estrés. Dichas hormonas, como la corticosterona, se sabe varían considerablemente los valores de N/L (Davis y col. 2004, 2008). Otra causa, se relaciona con el periodo reproductivo de la especie, momento altamente estresante para los anfibios (Davis y Maerz 2008b).
Con los aportes realizados por el presente estudio, podemos indicar que "Villa Dálcar" y "Cultivo" representarían los sitios más alterados por las actividades antrópicas. Varios estudios se han realizado en el lago "Villa Dálcar", relacionados con la muerte masiva de peces (Mancini y col. 2000), el crecimiento de algas (Novoa y col. 2011), registros de altas frecuencias de micronúcleos y anormalidades nucleares en peces (Pollo y col. 2012) y altas tasas de anormalidades morfológicas en Bufo (Rhinella) arenarum (Bionda y col. 2012) lo que estaría demostrando el grado de contaminación que este sitio ha sufrido en los últimos años.
El número de glóbulos blancos en la especie Bufo (Rhinella) arenarum parece ser un buen biomarcador hematológico para ambientes contaminados. Además, esta especie por presentar una amplia distribución y por lo tanto registrarse en una amplia variedad de ambientes, brinda una herramienta muy eficiente para la medición de la calidad de distintos ambientes.
Agradecimientos: Este trabajo fue realizado con el financiamiento del programa PPI 18/C350 de la Secretaría de Ciencia y Técnica (SECyT) de la Universidad Nacional de Río Cuarto; Beca de Ayudantía de Investigación Nuevas Tradicionales otorgada por la Secretaría de Ciencia y Técnica de la Universidad Nacional de Río Cuarto (Resolución nº 302); y Beca Estímulo a las Vocaciones Científicas otorgada por la Secretaría de Ciencia, Técnica y Arte (Resolución n° 160).
Bibliografía citada
1. Addy K., Green L., Herron E. pH and Alkalinity. URI Watershed Watch. URIWW-3. 2004. [ Links ]
2. Alford R., Richards S. Global Amphibian Declines: A Problem in Applied Ecology Annu Rev Ecol Syst. 1999;30:133-165. [ Links ]
3. Alford R.A., Dixon P.M., Pechmann J.H. Global amphibian population declines. Nature. 2001; 414: 449-500. [ Links ]
4. Arıkan H. A study on the blood cells of the fire- bellied toad, Bombina bombina L. (Anura: Bombinatoridae). Animal Biol. 2010;60:61-68. [ Links ]
5. Arserim S.K. y Member A. Hematology of the Uluda Frog, Rana macrocnemis Boulenger, 1885 in Uluda National Park (Bursa, Turkey). J of Fisheries & Aquatic Scs. 2008;25:39-46. [ Links ]
6. Atatür M.K., Arikan H., Çevik I.E. Erythrocyte Sizes of Some Anurans From Turkey. Tr J of Zoology. 1999;23:111-114. [ Links ]
7. Beebee T.J.C., Griffiths R.A. The amphibian decline crisis: A watershed for conservation biology? Biol Conserv. 2005;125:271-285. [ Links ]
8. Belden L.K., Blaustein A.R. Population differences in sensitivity to UV-B radiation for larval long-toed salamanders. Ecology. 2002;83 (6):1586-1590. [ Links ]
9. Bionda C., Lajmanovich R., Salas N., Martino A., di Tada I. Reproductive Ecology of the Common South American Toad Rhinella arenarum (Anura: Bufonidae): Reproductive Effort, Clutch Size, Fecundity, and Mate Selection. J Herp. 2011a;45:261-264. [ Links ]
10. Bionda C., di Tada I., Lajmanovich R. Composition of amphibian assemblages in agroecosystems from the central region of Argentina. Russ J Herpetol. 2011b;8:93-98. [ Links ]
11. Bionda C.L., Salas N.E., Caraffa E., Baraquet M., Martino A.L. On abnormalities recorded in an urban population of Rhinella arenarum from central Argentina. Herpetology Notes 2012a;5:237-241. [ Links ]
12. Bionda C., Gari N., Luque E., Salas N., Lajmanovich R., Martino A. Ecología trófica en larvas de Rhinella arenarum (Anura, Bufonidae) en agroecosistemas y sus posibles implicancias para la conservación. Rev Biol Trop. 2012b;60(2):771-779. [ Links ]
13. Bionda C., Lajmanovich R., Salas N., Martino A., di Tada I. Demografía poblacional en Rhinella arenarum (Anura: Bufonidae) y Physalaemus biligonigerus (Anura: Leiuperidae) en agroecosistemas de la provincia de Córdoba, Argentina. Rev Biol Trop. 2013;61(3):1389-1400. [ Links ]
14. Blaustein A.R., Belden L. K. Amphibian defenses against ultraviolet-B radiation. Evol Dev. 2003;5(1):89-97. [ Links ]
15. Blaustein A.R., Kiesecker J. M. Complexity in conservation: lessons from the global decline of amphibian populations. Ecol Lett. 2002;5:597-608. [ Links ]
16. Blaustein A.R., Wake D.B., Sousa W. Amphibian Declines: Judging Stability, Persistence& Susceptibility of Populations to Local & Global Extinctions. Conserv Biol. 1994;8:60-71. [ Links ]
17. Blaunstein A.R., Dobson A. Extinctions: A message from the frogs. Nature. 2006;439:143-144. [ Links ]
18. Blaunstein A.R., Han B., Relyea R., Johnson P., Buck J., Gervasi S., Kats L. The complexity of amphibian population declines: understanding the role of cofactors in driving amphibian losses. Ann.N.Y. Acad. Sci. 2011;1223:108-119. [ Links ]
19. Branch L.C., Hokit D.G. Florida Scrub Lizard (Sceloporus woodi). University of Florida, Extension WEC. 2000;139:1-3. [ Links ]
20. Bucheli T., Fent K. Induction of cytochrome P-450 as a biomarker for environmental contamination. Crit. Rev. Env. Sci. Technol. 1995; 25: 201-268. [ Links ]
21. Burkhart J.G., Bidwell J.R., Fort D.J., Sheffield S.R. "Chemical stressors," En: Linder G., Krest S.K., Sparling D.W., editores. Amphibian Decline: An Integrated Analysis of Multiple Stressors. Pensacola, Florida: SETAC Press; 2003. p. 111-128. [ Links ]
22. Cabagna M.C., Lajmanovich R.C., Stringhini G., Sánchez-Hernández J.C., Peltzer P.M. Hematological parameters of health status in the common toad Bufo arenarum in agroecosystems of Santa Fe Province, Argentina Applied Herpetol. 2005;2:373-380. [ Links ]
23. Cabagna M.C., Lajmanovich R.C., Attedemo A.M., Peltzer P.M., Junges C.M., Biancucci G.F., Bassó A. Hematología y citoquímica de las células sanguíneas de Rhinella fernandezae (Anura: Bufonidae) en Espinal y Delta-Islas del río Paraná, Argentina. Rev Biol Tropical. 2011;59(1):17-28. [ Links ]
24. Cajaraville M.P., Bebianno M.J., Blasco J., Porte C., Sarasquete C., Viarengo A. The use of biomarkers to assess the impact of pollution in coastal environments of the Iberian Peninsula: a practical approach. En: Science of the Total Environment. Special issue on towards an integrative approach in Environmental Contamination and Toxicology. MP Cajaraville., editores. Elsevier Science, Oxford; 2000. 247. p. 295-311. [ Links ]
25. Campbell T.W. Clinical pathology. En: Mader D.R. editores. Reptile Medicine and Surgery. W.B. Philadelphia, Pennsylvania, USA: Saunders Company; 1996. p. 248-257. [ Links ]
26. Cannon M.S., Cannon A.M. The blood leukocytes of Bufo alvarius: a light, phase-contrast, and histochemical study. Can J Zool. 1979;57:314-322. [ Links ]
27. Carey C., Cohen N., Rollins-Smith L. Amphibian declines: an immunological perspective. Dev Comp Immunol. 1999; 23: 459-472. [ Links ]
28. Cardinet G.H., Littrell J.F., Schalm O.W. Effects of sustained muscular activity upon blood morphology of the horse. The California Veterinarian. 1964;18:31-35. [ Links ]
29. Chiesa M.E., Rosenberg C.E., Fink N.E., Salibián A. Serum protein profile and blood cell counts in adult toads Bufo arenarum (Amphibia: Anura: Bufonidae): effects of sublethal lead acetate. Arch Environ Contam Toxicol. 2006;50:384-391. [ Links ]
30. Christin M.S., Gendron A.D., Brousseau P., Manard L., Marcogliese D.J., Ruby D.S., Fournier M. Effects of agricultural pesticides on the immune system of Rana pipiens and on its resistance to parasitic infection. Environ Toxicol Chem. 2003;22:1127-1133. [ Links ]
31. Collins J.P., Crump M. Extinction in Our Time. Oxford University Press: New York. 2009. [ Links ]
32. Coppo J.A. El medio interno de la "rana toro" (Rana catesbeiana, Shaw 1802). Revisión bibliográfica. Rev Vet. 2003;14:1. [ Links ]
33. Davidson C., Shaffer H.B., Jennings M.R. Spatial tests of the pesticide drift, habitat destruction, UV-B, and climate-change hypotheses for California amphibian declines. Conserv Biol. 2002;16:1588-1601. [ Links ]
34. Davis A.K., Cook K.C., Altizer S. Leukocyte Profiles in Wild House Finches with and without Mycoplasmal Conjunctivitis, a Recently Emerged Bacterial Disease. EcoHealth. 2004;1:362-373. [ Links ]
35. Davis A.K., Maerz J.C. Comparison of Hematological Stress Indicators in Recently Captured and Captive Paedomorphic Mole Salamanders, Ambystoma talpoideum. Copeia. 2008b;3:613-617. [ Links ]
36. Davis A.K., Maney D.L., Maerz, J.C. The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists. Funct. Ecol. 2008;22:760-772. [ Links ]
37. Davis A.K., Durso A.M. White blood cell differentials of northern cricket frogs (Acris c. crepitans) with a compilation of published values from other amphibians. Herpetologica. 2009;65(3):260-267. [ Links ]
38. di Tada I.E., Zavattieri M.V., Bridarolli M.E., Salas N.E., Martino A.L. Anfibios Anuros de la provincia de Córdoba. En: di Tada I.E., Bucher E.H., editores. Biodiversidad de la provincia de Córdoba. Córdoba, UNRC: Fauna; 1996. p. 191-215. [ Links ]
39. De Sá R.O. Crisis Global de Biodiversidad: Importancia de la Diversidad Genética y la Extinción de Anfibios. Agrociencia. 2005;9(1-2):513- 522. [ Links ]
40. García G., Fontúrbel F. Propuestas para un desarrollo sostenible. Lago Titikaka por estrategas K. Ed. Publicaciones Integrales. La Paz; 2003. p. 105. [ Links ]
41. García B., Rubio F., Carrasco M. Hematología 1. Citología, fisiología y Patología de hematíes y leucocitos. Paraninfo, Madrid, España, 1997. [ Links ]
42. Gilbertson M.K., Haffner G., Rouillard G.D., Albert A., Dixon B. Immuno-suppression in the Northern Leopard Frog (Rana pipiens) Induced by Pesticide Exposure. Environ. Toxicol. Chem. 2003;22:101-110. [ Links ]
43. Gordon A.S. Some aspects of hormonal influences upon the leukocytes. Ann.N.Y. Acad. Sci. 1955;59:907-927. [ Links ]
44. Hadji-Azimi I., Coosemans V., Canicatti C. Atlas of adult Xenopus laevis laevis Hematology. Developmental and comparative inmunology. 1987;11:807-874. [ Links ]
45. Harmon B.G. Avian heterophils in inflammation and disease resistance. Poult. Sci.1998;77:972-977. [ Links ]
46. Henle K., Alard D., Clitherow P., Cobb L., Firbank T., Kull D., McCraken R.F., Moritz J., Niemela M., Rebane D., Wascher A., Watt, Young J. Identifying and managing the conflicts between agriculture and biodiversity conservation in Europe—a review. Agriculture Ecosystems and Environment. 2008; 124: 60-71.
47. Hills A.G., Forsham P.H., Finch C.A. Changes in circulating leukocytes induced by the administration of pituitary adrenocorticotrophic hormone (AC. TH) in man. Blood. 1948;3:755-768. [ Links ]
48. Houlahan J.E., Findlay C.S., Schmidt B.R., Meyer A.H., Kuzmin, S.L. Quantitative evidence for global amphibian population declines. Nature. 2000; 404:752-755. [ Links ]
49. Jill Heatley J., Johnson M. Clinical Technique: Amphibian Hematology: A Practitioner’s Guide. Topics in Medicine and Surgery. J. of Exotic Pet Med. 2009;18(1):14-19.
50. Kiesecker J.M., Blaustein A.R., Belden L. Complex causes of amphibian population declines. Nature. 2001;410:681-684. [ Links ]
51. Kiesecker J.M. Synergism between trematode infection and pesticide exposure: a link to amphibian deformities in nature? Proc of the Nat Ac of Sc. 2002;99:9900-9904. [ Links ]
52. Lajmanovich R.C., Lorenzatti E., de la Sierra P., Marino F., Peltzer P.M. First registrations of organochlorines pesticides residues amphibians of the Mesopotamic Region, Argentina. Froglog. 2002;54:4. [ Links ]
53. Lajmanovich R.C., Sandoval M.T., Peltzer P.M. Induction of mortality and malformation in Scinax nasicus tadpoles exposed by glyphosate formulations. Bull Environ Contam Toxicol. 2003;70:612-618. [ Links ]
54. Lascano C., Sotomayor V., Ferrari A., Venturino A. Alteraciones del desarrollo embrionario, poliaminas y estrés oxidativo inducidos por plaguicidas organofosforados en Rhinella arenarum. Acta Toxicol Argent. 2009;17:8-19. [ Links ]
55. Lavilla E. O. Amenazas, declinaciones poblacionales y extinciones en anfibios argentinos. Cuad Herpetol. 2001;15(1):59-82. [ Links ]
56. Lavilla E.O., Heatwole H. Status of Amphibian conservation and decline in Argentina: 30-78. En: Heatwole, H., editores. Amphibian Biology. (9). Status of decline of Amphibians: Western Hemisphere. Part 1. Paraguay, Chile and Argentina. Surrey Beatty & Sons, Australia. Cuad. Herpetol. 2010. p. 59-82.
57. Mancini M., Rodriguez C., Finola M., Basualdo C., Prosperi C. Mortandad de peces en un lago recreacional del Sur de Córdoba, Argentina. Revista Aquatic. 2000;11:1-7. [ Links ]
58. Manzanilla J., Péfaur J. Consideraciones sobre métodos y técnicas de campo para el estudio de anfibios y reptiles. Rev Ecol Lat Am. 2000;7:17-30. [ Links ]
59. Mclaughlin A., Mineau P. The impact of agricultural practices on biodiversity. Agric, Eco and Env. 1995;55:201-12. [ Links ]
60. Nava M.P., Veiga J.P., Puerta M.L. White blood cell counts in house sparrows (Passer domesticus) before and after moult and after testosterone treatment. Canadian J of Zool. 2001;79:145-148. [ Links ]
61. Novoa M.D., Luque M.E., Lombardo D.L., Martinez de Fabricius A.L. Distribución temporal del fitoplancton en un lago urbano del centro de Argentina (Río Cuarto, Córdoba). Biológicas. 2011;13(2):1-14. [ Links ]
62. Nöller H. G. Eine einfache Technik der Blutentnahme beim Frosch. Pflüger’ s Arch of Physiol. 1959;269:98-100.
63. Organización Mundial de la Salud (OMS). Guías para la Calidad del Agua Potable. Vol 1: Recomendaciones. 3th ed. [en línea] 2006. Versión electrónica para la Web [Consulta 4 de agosto de 2014]. Disponible en http://www. who.int/water_sanitation_health/dwq/es/. [ Links ]
64. Peltzer P.M., Lajmanovich R.C., Attademo A.M., Beltzer A.H. Diversity of anurans across agricultural ponds in Argentina. Biodiv and Cons. 2006;15:3499-3513. [ Links ]
65. Peri S.I., Fink N.E., Salibián A. Hematological parameters in Bufo arenarum injected with sublethal dose of lead acetate. Biomed Environ Sci. 1998;11:70-74. [ Links ]
66. Pfeiffer C.J., Pyle H., Asashima M. Blood cell morphology and counts in the Japanese newt (Cynops pyrrhogaster). J Zoo. Wildl Med. 1990;21:56-64. [ Links ]
67. Pollo F.E., Salas N.E., Mancini M.A., Martino A.L. Estudio comparativo de la frecuencia de micronúcleos y anormalidades nucleares en eritrocitos de tres especies ícticas. Acta Toxicol Argent. 2012;20(2):62-67. [ Links ]
68. Pyron R.A., Wiens J.J. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians. Mol Phyl and Evol. 2011;61:543-583. [ Links ]
69. Rosenberg C.E., Fink N.E., Arrieta M.A., Salibián A. Effect of lead acetate on the in vitro engulfment and killing capability of toad (Bufo arenarum) neutrophils. Comp. Biochem and Physiol Part. C. 2003;136:225-233. [ Links ]
70. Ross A.A., Stephen J.R. Global amphibian declines: A problem in applied ecology. Ann Rev of Ecol and Systematics. 1999;30:133-65. [ Links ]
71. Sanabria E.A., Quiroga L.B., Acosta J.C. Sitios de oviposición y esfuerzo reproductivo en Chaunus arenarum (Anura: Bufonidae) en el desierto del Monte, Argentina. Rev Esp de Herpetol. 2007;21:49-53. [ Links ]
72. Sevinc M., Ugurta I.H. The Morphology and Size of Blood Cells of Lacerta rudis bithynica. Asiatic Herpetol Res. 2001;9:122-129. [ Links ]
73. Stuart S.N., Chanson J.S., Cox N.A., Young B.E., Rodrigues A.S.L., Fishman D.L., Waller R.W. Status and trends of amphibian declines and extinctions. Worldwide Sc. 2004;306:1783-1786. [ Links ]
74. Stuart S.N., Hoffmann M., Chanson J.S., Cox N.A., Berridge R.J., Ramani P., Young B.E. Threatened Amphibians of the World. Lynx Edicions, Barcelona, Spain; IUCN, Gland, Switzerland; and Conservation International, Arlington, Virginia. 2008. [ Links ]
75. Thrall M.A. Hematology of amphibians. En: M.A. Thrall, D.C. Baker, and E.D. Lassen, editores. Veterinary Hematology and Clinical Chemistry: Text and Clinical Case Presentations. Lippincott Williams & Wilkins, Philadelphia, Pennsylvania, USA. 2004. [ Links ]
76. Turner R.J. Amphibia. En: Rowley, A.F. and Ratcliffe, N.A., editores. Vertebrate blood cells. Cambridge: Cambridge University Press; 1988. p. 154-160. [ Links ]
77. Úbeda C., Grigera D. Análisis de la evaluación más reciente del estado de conservación los Anfibios y Reptiles de Argentina. Gayana. 2003;67(1):97-113. [ Links ]
78. Vaira M., Akmentins M., Attademo M., Baldo D., Barrasso D., Barrionuevo D., Basso N., Blotto B., Cairo S., Cajade R., Céspedez J., Corbalán V., Chilote P., Duré M., Falcione C., Ferraro D., Gutiérrez F.R., Ingaramo M.R., Junges C., Lajmanovich R., Lescano J.N., Marangoni F., Martinazzo L., Marti R., Moreno L., Natale G.S., Pérez Iglesias J.M., Peltzer P., Quiroga L., Rosset S., Sanabria E., Sánchez L., Schaefer E., Úbeda C., Zaracho V. Categorización del estado de conservación de los anfibios de la República Argentina. Cuad Herpetol. 2012;26(Supl. 1):131-159. [ Links ]
79. Varela M.E., Sellares M.E. Variaciones estacionales del cuadro hemático en el Bufo arenarum (Hensel). Rev Soc Arg Biol. 1937;13:412-416. [ Links ]
80. Wake D.B. Action on amphibians. Trends Ecol Evol. 1998;13:379-380. [ Links ]
81. Welsh H.H., Ollivier L.M. Jr. Stream amphibians as indicators of ecosystem stress: a case study from California’s Redwoods. Ecol Appl. 1998;8:1118-1132.
82. Young B., Stuart S., Chanson J., Cox N., Boucher T. Joyas que están desapareciendo: El estado de los anfibios en el nuevo mundo. Nature Serve: Arlington, Virginia, 2004. [ Links ]
83. Zhelev Z.M. Investigation on the Blood Differential Formula in Rana ridibunda (Anura, Amphibia) from the Area of the Maritsa- Iztok 1 Steam Power Plant. Acta zool bulg. 2007;59(2):181-190. [ Links ]














