Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta toxicológica argentina
On-line version ISSN 1851-3743
Acta toxicol. argent. vol.23 no.3 Ciudad Autónoma de Buenos Aires Dec. 2015
ARTÍCULOS DE DIVULGACIÓN
El organofosforado clorpirifos como disruptor estrogénico y factor de riesgo para el cáncer de mama
The organophosphorus chlorpyrifos as endocrine disruptor and breast cancer factor risk
Cocca, Claudia1*; Ventura Clara1; Nunez, Mariel1; Randi, Andrea2; Venturino, Andres3
1Laboratorio de Radioisótopos, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Argentina. Junín 956. CABA, Argentina.
2Laboratorio de Efectos Biológicos de Contaminantes Ambientales, Departamento de Bioquímica Humana, Facultad de Medicina, Universidad de Buenos Aires, Argentina. Paraguay 2155, CABA, Argentina.
3Laboratorio de Investigaciones Bioquímicas y Químicas del Ambiente (LIBIQUIMA), Centro de Investigaciones en Toxicología Ambiental y Agrobiotecnología del Comahue (CITAAC), CONICET-Universidad Nacional del Comahue, Buenos Aires 1400. Neuquén, Argentina.
*cmcocca@ffyb.uba.ar
Recibido: 21 de octubre de 2014
Aceptado: 14 de diciembre de 2015
Resumen. El clorpirifos (CPF) es un insecticida de amplio espectro que se utiliza en Argentina y en otros países de Latinoamérica. Se emplea para el control de plagas en la producción de frutas, hortalizas, cereales y plantas ornamentales. El principal mecanismo de acción descripto para este insecticida es la inhibición de la acetilcolinesterasa. Sin embargo, reportes más recientes sugieren múltiples efectos del plaguicida independientes de la inhibición de esa enzima. El objetivo de este trabajo es transmitir a la comunidad los resultados de nuestras investigaciones obtenidos utilizando diferentes dosis de CPF en distintos modelos experimentales, tanto in vitro como in vivo. En relación a esto, hemos evidenciado una acción del CPF sobre el sistema redox celular que conduce al incremento de especies reactivas del oxígeno y consecuentemente a la activación de diferentes vías de señalización. Además, hemos determinado que el insecticida CPF puede comportarse como un disruptor endócrino modulando la acción de los estrógenos y alterando la normal estructura del tejido mamario. Nuestros resultados alertan sobre el impacto que este compuesto podría tener sobre la salud, sugiriendo la necesidad de revisar su uso dado que manifiesta acciones a dosis encontradas en el ambiente.
Palabras clave: Clorpirifos; Cáncer de mama; Estradiol; ERO
Abstract. Chlorpyrifos (CPF) is a broad spectrum insecticide used in Argentina and other Latin American countries. It is commonly used for pest control in the production of fruits, vegetables, cereals and ornamental plants. The main mechanism of action described for this insecticide is the inhibition of acetylcholinesterase activity. However, more recent reports suggest multiple effects for this pesticide in an independent way from the inhibition of this enzyme. The objective of this work is to convey to the community the results of our investigations obtained using different doses of CPF in various experimental models, both in vitro and in vivo. In this connection, we have shown a CPF action on the cellular redox system which leads to increased reactive oxygen species and the consequent activation of different signaling pathways. In addition, we have determined that the insecticide CPF acts as an endocrine disruptor modulating the action of estrogen and altering the normal structure of breast tissue. Our findings warn about the impact that this compound might have on health, suggesting the need to review its use since adverse actions were found at environmentally relevant doses.
Key words: Chlorpyrifos; Breast cancer; Estradiol; ROS
Introducción
La agricultura constituye una de las principales actividades económicas de los países en vías de desarrollo como la Argentina. En estas regiones, el control fitosanitario y la rentabilidad productiva se sostienen en base al uso intensivo de plaguicidas, lo cual representa un factor de riesgo tanto para los trabajadores como para las poblaciones cercanas y el medio ambiente.
Los compuestos organofosforados (OPs) constituyen un grupo de sustancias altamente tóxicas utilizadas en la actividad agrícola para el control de plagas. La aplicación de insecticidas, principalmente organofosforados, representa un alto impacto ambiental contaminando aguas superficiales y subterráneas, afectando poblaciones de especies acuáticas y poniendo en riesgo la salud humana (Loewy y col. 1999). El principal mecanismo de toxicidad de los compuestos OPs es la inhibición de la enzima acetilcolinesterasa (AChE), lo que conduce a un aumento de acetilcolina en los organismos expuestos. Por lo tanto, las exposiciones agudas y crónicas a estos compuestos pueden producir una variedad de efectos sobre el sistema nervioso central y periférico, incluyendo dolores de cabeza, visión borrosa, lagrimeo, excesiva salivación, secreción nasal, mareo, confusión, debilidad o temblores musculares, nauseas, diarrea y cambios bruscos en el ritmo cardíaco (Tan y col. 2009; Rush y col. 2010).
Entre los plaguicidas OPs más utilizados en nuestro país se encuentran el metil-azinfos y el clorpirifos (CPF). Ambos compuestos son teratógenos en especies acuáticas y podrían presentar actividad como disruptores endócrinos (Grünfeld y Bonefeld-Jorgensen 2004).
El CPF se emplea para el control de plagas en la producción de frutas, hortalizas, cereales y plantas ornamentales. La aplicación se realiza mediante pulverización foliar o aplicación directa al suelo. Adicionalmente, este pesticida es utilizado para el control de termitas y hormigas en productos maderables y para el control de pulgas, garrapatas y piojos en animales domésticos y en la producción ganadera. Finalmente, el CPF se utiliza para combatir moscas y mosquitos en espacios públicos y para el control de plagas en césped de golf. El uso residencial del CPF fue prohibido en Estados Unidos en el año 2001, quedando restringida su aplicación a los sectores rurales. En la Argentina, el uso de CPF en productos domisanitarios fue prohibido mediante la disposición 2659 de la ANMAT en el año 2008 (ANMAT 2008).
Las principales vías de absorción del CPF son la vía oral, cutánea y respiratoria. Luego de la administración oral, el CPF y su metabolito, el clorpirifos oxón, son detectados en la sangre, el hígado y en los tejidos ricos en lípidos, incluyendo el cerebro, de los individuos expuestos. Debido a la naturaleza hidrofóbica de este tóxico, el mismo puede acumularse en la leche materna. En estudio realizado en la India se detectó la presencia de CPF en la leche materna en mujeres durante el período de lactancia (Sanghi y col. 2003).
Como se menciona anteriormente, el principal mecanismo de acción del CPF lo constituye su unión irreversible a colinesterasas, lo cual conlleva a la pérdida de actividad de las mismas. Este efecto es importante en el sistema nervioso, debido al rol de la enzima AChE en la metabolización del neurotransmisor acetilcolina. Adicionalmente, el CPF interfiere en la síntesis de macromoléculas (Qiao y col. 2001), interacciona con receptores celulares (Howard y Pope 2002), modula diferentes vías de transducción de señales (Song y col. 1997) y modifica el balance redox celular (Gupta y col. 2010).
En los últimos años, ha cobrado importancia el estudio de los contaminantes ambientales en relación al desarrollo de cáncer, en particular para el cáncer de mama. Esta asociación se debe a que muchos de los plaguicidas de uso corriente actúan como disruptores endócrinos (DEs), afectando la fisiología de órganos dependientes de hormonas.
Los DEs son compuestos que interfieren en la regulación normal del sistema endócrino. Tradicionalmente, la acción de los DEs ha sido relacionada con sus efectos como agonistas o antagonistas de diferentes receptores, sin embargo, estos compuestos también pueden interferir en la síntesis y/o el metabolismo de las hormonas, así como en numerosos procesos que afecten el sistema endócrino y reproductivo (De Coster y Van Larebeke 2012).
Numerosas investigaciones, informan respecto al papel crítico que ejerce el estímulo estrogénico sobre la carcinogénesis mamaria y el desarrollo de otros tipos de cáncer (Clarke y col. 2008). En este sentido, la acción de diferentes plaguicidas como DEs, hace reflexionar acerca de su impacto en la etiología de enfermedades que son afectadas por la desregulación hormonal. Asimismo, recientes estudios epidemiológicos han reportado una relación entre la exposición de trabajadores a CPF y el desarrollo de glioma, cáncer de colon y de pulmón (Lee y col. 2004; Lee y col. 2005; Lee y col. 2007).
El objetivo de la presente publicación consiste en difundir los resultados que hemos obtenido durante los últimos años en nuestro laboratorio, acerca del efecto del CPF sobre la carcinogénesis mamaria utilizando diferentes modelos experimentales.
Efectos del CPF sobre la proliferación celular y el balance redox
En la primera etapa de nuestro trabajo, evaluamos el efecto del CPF sobre dos líneas celulares derivadas de carcinomas mamarios humanos. Una de ellas es la línea celular MCF-7 que responde a los estímulos estrogénicos mediados por los receptores de estrógenos de tipo alfa (REα). La segunda línea empleada, MDA-MB-231, no expresa estos receptores hormonales y, por lo tanto, su crecimiento resulta independiente de estrógenos. En ambos tipos de células estudiamos diferentes parámetros de crecimiento como la viabilidad, la proliferación, el tiempo de duplicación y la muerte de las células expuestas al CPF, así como los mecanismos mediante los cuales el tóxico ejerce sus efectos.
Las concentraciones de CPF utilizadas en nuestros experimentos (comprendidas entre 0 y 50 μM) fueron seleccionadas de acuerdo a las que comúnmente se hallan en agua y suelo de áreas cercanas a sitios de aplicación (Jergentz y col. 2005; Marino y Ronco 2005; Jaipieam y col. 2009; Del Prado Lu 2010; Querejeta y col. 2012).
De acuerdo con nuestros resultados, la exposición de las células a estas concentraciones de CPF no provocó una pérdida importante en la viabilidad celular durante las primeras 24 horas de tratamiento. Sin embargo, cuando las células fueron cultivadas en presencia de la concentración más elevada de CPF (50 μM) por tiempos más prolongados, observamos una disminución en la proliferación, la cual fue acompañada por un incremento en el tiempo de duplicación y en el porcentaje de células necróticas.
Si bien durante las primeras 24 horas de exposición a CPF no observamos modificaciones en la viabilidad celular, las células empezaron acumularse en diferentes fases del ciclo, indicando que el plaguicida podría alterar el control normal del crecimiento celular. Este efecto fue acompañado por un incremento en los niveles de diferentes proteínas claves en la regulación del ciclo celular como las ciclinas D1 y E. Por lo tanto, concluimos que estas modificaciones en el ciclo celular preceden y podrían derivar en la muerte celular observada a tiempos más largos de intoxicación (Ventura y col. 2012).
Además de disminuir la proliferación y alterar el ciclo celular, la exposición de las células a CPF 50 μM incrementó los niveles intracelulares de especies reactivas del oxígeno (ERO). Las ERO son especies químicas altamente reactivas, que se producen durante el metabolismo normal de los organismos aeróbicos y participan en el control fisiológico de diversas funciones celulares. Adicionalmente, la exposición a contaminantes ambientales como plaguicidas y otros químicos, puede alterar la producción de ERO y afectar el estado redox normal de las células.
El incremento de ERO producido por el tóxico fue revertido por el agregado de enzima catalasa (CAT) en la línea celular MCF-7. Esto indicaría que el H2O2 es la especie química preponderante en el desbalance redox. En cambio, en la línea celular MDA-MB-231, el incremento de ERO fue abolido solo parcialmente por la actividad CAT, lo cual indica la existencia de otras especies químicas en el desbalance redox. En esta misma línea celular, observamos además un incremento en las especies reactivas del nitrógeno (ERN) que no fue detectado en las células MCF-7 (Ventura y col. 2015).
Con el fin de asegurar la homeostasis celular, los organismos aeróbicos poseen numerosos mecanismos de defensa ante el incremento de las ERO. Entre estas estrategias se incluyen mecanismos preventivos, de reparación, defensas físicas y defensas antioxidantes. Estas últimas son de gran importancia e incluyen tanto a las enzimas antioxidantes, entre las que se encuentran la superóxido dismutasa (SOD) y la CAT, como a otros compuestos no enzimáticos entre los que se encuentra el glutatión reducido (GSH). En condiciones normales, existe un equilibrio entre las ERO y las defensas antioxidantes.
Las líneas celulares estudiadas, MCF-7 y MDA-MB-231, difieren en sus niveles basales de componentes antioxidantes, siendo las actividades CAT y SOD significativamente mayores en las células MDA-MB-231 que en la línea MCF-7. Esta diferencia podría influir en la sensibilidad de cada línea ante la exposición al tóxico.
Como resultados de nuestros experimentos, encontramos que la exposición de ambas líneas celulares a CPF 50 μM condujo a modificaciones en la actividad de las enzimas CAT y SOD. La actividad CAT aumentó en ambas líneas celulares pero la actividad de la enzima SOD se encontró disminuida sólo en las células MCF-7 cuando las mismas se cultivaron en presencia de CPF 50 μM. Esta inhibición podría deberse tanto a la oxidación enzimática de residuos pertenecientes al sitio activo por parte de las ERO generadas por la exposición a CPF, como a la inhibición por producto que sufre esta enzima. Sin embargo, en la línea celular MDA-MB-231 esta inhibición no fue observada, lo cual podría estar relacionado con los mayores niveles basales de SOD presentes en este tipo celular. Finalmente, el sistema antioxidante no enzimático, evaluado mediante el contenido celular de grupos tioles totales, no fue modificado por la exposición de las células a CPF en ninguna de las concentraciones evaluadas.
Una de las principales consecuencias del desbalance redox, es el daño oxidativo de las diferentes macromoléculas celulares. La oxidación lipídica fue observada en la línea celular MCF-7 expuesta a CPF 50 μM durante 24 horas mientras que, en las células MDA-MB-231, el CPF no generó alteraciones en este parámetro. Estas diferencias podrían también estar relacionadas con el menor poder antioxidante presente en las células MCF-7 respecto a las MDA-MB-231 (Ventura y col. 2015).
Un número importante de investigaciones coinciden en que el estrés oxidativo constituye un elemento clave en la activación de vías de transducción de señales implicadas en diferentes procesos celulares, tales como la muerte, la proliferación y la transformación celular. Entre las señales disparadas por estrés oxidativo, se encuentra la activación de las proteínas quinasas activadas por mitógenos (MAPK). Estas proteínas conforman una familia de quinasas encargadas de trasferir señales desde el exterior hacia el interior de las células regulando una amplia variedad de procesos a través de la activación de diferentes proteínas. En células de mamíferos, se han descripto tres proteínas: p38, JNK y ERK1/2, las cuales pueden ser moduladas por estrés oxidativo (Torres 2003).
En nuestro trabajo, pudimos observar que la exposición de las células a CPF 50 μM durante 15 minutos produjo un incremento en la fosforilación de la proteína ERK1/2 en las líneas celulares estudiadas. Trabajos recientes han relacionado este proceso con el incremento intracelular de los niveles de ERO. En concordancia con estos antecedentes, hemos observamos un incremento de las ERO en ambas líneas celulares expuestas a CPF 50 μM durante 10 minutos, sugiriendo una asociación entre este evento y el incremento en la fosforilación de la proteína ERK1/2. Este resultado fue confirmado mediante el agregado exógeno de catalasa a las células cultivadas en presencia de CPF 50 μM, lo cual fue suficiente para impedir la acción del CPF sobre la fosforilación de ERK1/2 (Ventura y col. 2015).
Adicionalmente, la disminución de la capacidad clonogénica inducida por CPF 50 μM fue revertida tanto por el agregado de catalasa como por la adición del inhibidor de MAPK PD98059 indicando, en primer lugar, que el H2O2 es una especie química clave en la inhibición de la proliferación ejercida por el CPF y, adicionalmente, que este efecto estaría mediado por la fosforilación de ERK1/2.
En resumen, el CPF 50 μM condujo a un incremento de las especies oxidantes intracelulares, lo cual, a su vez, conduce a un incremento en la fosforilación de la proteína kinasa ERK1/2, una disminución en la capacidad clonogénica y posterior muerte de las células (Figura 1).
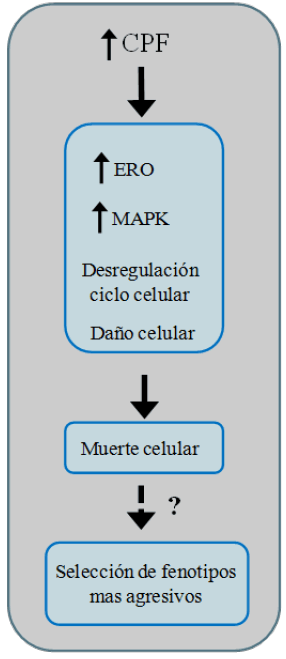
Figura 1. Efectos del CPF 50 μM sobre la muerte celular en líneas derivadas de carcinomas mamarios humanos MCF-7 y MDA-MB-231.
Efectos del CPF como disruptor endócrino
La menor concentración de CPF utilizada en nuestros experimentos fue 0,05 μM. Esta concentración se asemeja a las encontradas en bancos de agua de zonas rurales de nuestro país, las cuales han sido reportadas por diferentes investigadores (Marino y Ronco 2005; Loewy y col. 2011). A diferencia de los resultados observados con concentraciones mayores de CPF, la exposición de las células a CPF 0,05 μM resultó en un incremento de la proliferación celular. Resulta interesante destacar que este efecto solo fue observado en una de las líneas celulares estudiadas, MCF-7, la cual expresa los receptores de hormonas esteroideas y responde al estímulo estrogénico para su división. Por su parte el incremento en la proliferación celular no fue observado en la línea MDA-MB-231, que carece de respuesta ante estímulos estrogénicos.
En los últimos años se han descripto numerosos compuestos químicos capaces de actuar como agonistas estrogénicos, los cuales estimulan la proliferación celular cuando se encuentran en bajas concentraciones en el ambiente. El incremento de la proliferación celular producido por esta concentración de CPF fue revertido por la adición de un inhibidor del REα previo al tratamiento con el tóxico. Adicionalmente, el tratamiento con CPF 0,05 μM incrementó la fosforilación del REα en la tirosina 537, lo cual conduce a la activación de este receptor (Ventura y col. 2012). Estos resultados indican que el incremento de la proliferación celular observado cuando las células dependientes de estrógeno se cultivan en presencia de CPF 0,05 μM es mediado por la fosforilación del REα (Figura 2).

Figura 2. Efectos del CPF 0,05 μM sobre la proliferación celular.
Con el fin de profundizar nuestros estudios del CPF como disruptor endócrino, evaluamos su efecto sobre el desarrollo y la proliferación de la glándula mamaria. Para ello utilizamos ratas hembras de la cepa Sprague-Dawley a las cuales les administramos diferentes dosis de CPF desde los 40 días de vida, en forma crónica, durante un período de 100 días. Las dosis fueron seleccionadas teniendo en cuenta que muchos de los efectos tóxicos producidos por el CPF, son independientes de su capacidad para inhibir a la enzima colinesterasa. Por este motivo decidimos utilizar concentraciones relativamente bajas del tóxico, que no generen signos de toxicidad severa en los animales, permitiéndonos un período prolongado de tratamiento. Se seleccionó una dosis de CPF semejante a la ingesta diaria admisible (IDA) de 0,01 mg/Kg/día y otra comparable a los niveles a los cuales no se observan efectos adversos (NOAEL) de 1,00 mg/Kg/día (Organización Mundial de la Salud 2009). Al finalizar el experimento, los animales fueron sacrificados y se extrajeron muestras de glándula mamaria, hígado y sangre para realizar los diferentes estudios.
Con estos estudios pudimos observar que las dosis de CPF utilizadas no afectaron el peso corporal de los animales. El peso del hígado tampoco fue afectado por el tratamiento con el tóxico, sin embargo, la histología de este órgano presentó focos necróticos y hemorrágicos en los grupos expuestos a CPF, que no se detectaron en el grupo control.
En estas condiciones, evaluamos el efecto del CPF sobre la histología de la glándula mamaria y observamos una hiperplasia moderada en las mamas de los animales expuestos al tóxico. Específicamente, observamos un incremento en el número de estructuras ductales y lobulillares en los tejidos provenientes de ratas expuestas a ambas dosis de CPF. Por otra parte, la presencia de lesiones proliferativas benignas como la hiperplasia florida y la adenosis esclerosante se encontraron incrementadas en los animales expuestos al plaguicida (Ventura y col. en prensa). Estos resultados se encuentran en concordancia con los estudios llevados a cabo en las líneas celulares derivadas de carcinomas mamarios humanos, debido a que un incremento en el número de estructuras y lesiones proliferativas benignas de la glándula mamaria, podría inferir una acción estrogénica del tóxico sobre este tejido.
Como mencionamos anteriormente, los DEs pueden interferir en el sistema endócrino a cualquier nivel. En este sentido, la exposición de las ratas a CPF 1 mg/Kg/día generó modificaciones en la vía estrogénica, disminuyendo significativamente los niveles de estradiol (E2) presente en el suero, junto con una prolongación de la duración del ciclo estral y una disminución de la fosforilación del REα en el tejido mamario. Estos resultados indican que el CPF podría actuar como un DE tanto a nivel local alterando la estructura del tejido mamario y la expresión del REα como a nivel sistémico, modificando los niveles circulantes de hormonas esteroideas.
Finalmente, las modificaciones en el balance redox descriptas anteriormente para las líneas celulares, también fueron observadas en la glándula mamaria de las ratas expuestas a CPF 1 mg/Kg/día. El sistema redox fue evaluado mediante la actividad de la enzima catalasa, el contenido de tioles ácido-solubles como medida del GSH y el daño lipídico presente en el tejido mamario de los animales. A partir de los experimentos realizados, observamos que la exposición de las ratas a CPF 1 mg/Kg/día incrementó las defensas antioxidantes enzimáticas y no enzimáticas en la glándula mamaria respecto a los valores encontrados en los animales control. Por otra parte, en las ratas expuestas a CPF 0,01 mg/Kg/día, se observó un incremento en la actividad de la enzima catalasa, sin modificaciones en los niveles de GSH. Si bien los niveles de especies oxidantes no fueron evaluados, el incremento en los componentes antioxidantes podría interpretarse como una respuesta antioxidante frente al estrés oxidativo generado por el CPF. Finalmente, la medición del daño celular, a través de la peroxidación lipídica, no mostró cambios entre los animales expuestos a CPF y los animales controles.
Efectos de CPF sobre la carcinogénesis mamaria
Los DEs constituyen un factor crucial en el desarrollo de cáncer de mama. Para evaluar el comportamiento del CPF como un DE capaz de impactar en la carcinogénesis mamaria, estudiamos la acción del plaguicida en un modelo de carcinogénesis química inducida en ratas Sprague-Dawley, mediante la inyección de tres dosis de N-Nitroso-N-Metilurea (NMU) por vía i.p. a los 50, 80 y 110 días de vida de los animales. Los animales se dividieron en tres grupos a los cuales se les administró desde los 40 días de vida, diariamente, por v.o.: CPF (0,01 y 1 mg/Kg/día) o vehículo (aceite de maíz). En este modelo de estudio, el tratamiento de las ratas con CPF condujo a una disminución en el período de latencia tumoral, lo cual indica que el tiempo transcurrido desde la primera inyección del carcinógeno hasta la aparición del primer tumor fue menor en los grupos expuestos a CPF respecto a los animales control. Asimismo, demostramos que la exposición al tóxico produjo un incremento en el índice tumoral, calculado como el número de animales que desarrollaron al menos un tumor en función del tiempo. Finalmente, el lote de animales al cual se le administró CPF 1 mg/Kg/día presentó un mayor número de tumores por rata respecto al lote control (Ventura y col. 2014) (Figura 3).

Figura 3. Acciones del CPF sobre: (A) la histología mamaria y los niveles hormonales en ratas intoxicadas de manera crónica; (B) la carcinogénesis mamaria en un modelo experimental químicamente inducido en ratas intoxicadas de manera crónica.
Efectos del CPF sobre la invasión y migración celular
Uno de los factores más importantes en la evolución del cáncer de mama es la aparición de metástasis. Este proceso es un fenómeno complejo en el cual las células deben invadir tejidos adyacentes, con la consecuente ruptura de la membrana basal, ingresar y sobrevivir en los vasos sanguíneos o linfáticos y, finalmente, concretar la extravasación y la implantación en el nuevo tejido.
Para completar nuestros estudios sobre la acción del CPF, analizamos su efecto sobre los procesos de invasión y migración celular utilizando las líneas celulares derivadas de adenocarcinomas mamarios humanos mencionadas al inicio de este texto. En la línea celular MDA-MB-231, observamos un incremento en la migración celular junto con un aumento de la actividad metaloproteasa cuando las células fueron expuestas a bajas concentraciones de CPF. Esta línea celular se caracteriza por presentar una alta capacidad migratoria. La línea celular MCF-7, en cambio, deriva de un adenocarcinoma mamario humano con mayor grado de diferenciación y presenta menor capacidad migratoria. En esta línea celular, observamos una inducción de la invasión celular cuando el cultivo estuvo en presencia de CPF 50 μM. Este resultado puede parecer contradictorio debido a que previamente reportamos una disminución en la proliferación celular vinculada al desbalance redox en estas condiciones de cultivo. Sin embargo, la condición de hipoxia podría actuar como presión de selección derivando en la supervivencia de células con capacidad invasiva.
El conjunto de eventos mediante el cual las células pierden su fenotipo epitelial para adquirir uno mesenquimal con mayor capacidad migratoria se denomina transición epitelio-mesenquimática (TEM). La proteína β-catenina es un componente clave de la TEM. Las células epiteliales se mantienen unidas a través de las llamadas uniones adherentes, en las que participan varias proteínas como la E-cadherina y la β-catenina. Durante la TEM, la proteína β-catenina migra al núcleo celular, en donde actúa como factor de transcripción regulando una gran diversidad de genes. En nuestros experimentos pudimos observar la translocación de β-catenina desde la membrana plasmática hacia el núcleo cuando las células MCF-7 fueron expuestas a CPF. En la línea celular MDA-MB-231, no se observaron modificaciones en la localización subcelular de esta proteína con ninguna de las concentraciones de CPF utilizadas. Otra proteína que forma parte de las uniones adherentes es la E-caderina. Si bien la expresión de esta proteína se encuentra disminuida durante la TEM, no encontramos diferencias en su expresión en nuestro sistema de estudio.
Como describimos previamente, la proteína β-catenina se encuentra en diferentes compartimentos celulares, cumpliendo diferentes funciones en cada uno de ellos. Por un lado, forma parte de las uniones adherentes junto con la proteína E-cadherina y, por otro, cuando no se encuentra formando parte de estas uniones, pasa al citoplasma celular dónde es degradada proteolíticamente tras ser fosforilada por la quinasa GSK-3β. En condiciones de estrés oxidativo, esta quinasa se encuentra inactivada, lo cual conlleva a la acumulación de β-catenina en el citosol y su posterior translocación al núcleo celular en donde actúa como factor de transcripción (Wu y Pan 2011). Con el fin de estudiar el mecanismo subyacente al incremento en la migración e invasión celular inducido por el CPF, evaluamos la fosforilación de GSK-3β en estas células. El cultivo de ambas líneas celulares en presencia de CPF incrementó la fosforilación de la proteína GSK-3β en la serina 9. La inactivación de la proteína GSK-3β en la línea celular MCF-7, podría estar relacionada con la translocación nuclear de β-catenina observada previamente. Dentro del núcleo, esta proteína actúa como factor de transcripción, induciendo la expresión de genes relacionados con la proliferación, como la ciclina D1, y la invasión celular. Cabe mencionar, que estos fenómenos fueron observados al cultivar las células en presencia de CPF (Figura 4).

Figura 4. Efectos del CPF sobre la capacidad invasiva en la línea MCF-7.
Conclusiones y perspectivas
El cáncer de mama es la patología maligna más común entre las mujeres de todo el mundo y los factores ambientales parecen guardar una estrecha relación con la etiología de esta enfermedad (Blair y Kazerouni 1997). Actualmente existe un gran interés en comprender cuál es el papel de los contaminantes ambientales en el riesgo de padecer cáncer de mama. A pesar que las evidencias son cada vez más contundentes, las cuestiones en torno a la relación entre la incidencia de esta enfermedad maligna y la exposición a pesticidas que se aplican en las zonas agrícolas quedan aún sin resolver (Reynolds y col. 2005). Los pesticidas han despertado el interés de distintos investigadores debido a que muchos de estos compuestos o sus metabolitos actúan como los estrógenos (Andersen y col. 2002; Bennett y Davis 2002; Brody y Rudel 2003). Un gran número de los pesticidas de uso común son considerados DEs, dado que pueden actuar a través de receptores de esteroides, receptores de neurotransmisores como por ejemplo de serotonina, dopamina o norepinefrina, receptores huérfanos como el receptor de arilos hidrocarbonados, vías enzimáticas involucradas en la biosíntesis o metabolismo de esteroides y otros numerosos mecanismos que convergen en los sistemas endócrinos o reproductores. El conjunto de moléculas identificadas como DEs es muy heterogéneo e incluye sustancias químicas sintéticas como solventes o lubricantes y sus subproductos, plásticos, plaguicidas, agentes farmacéuticos y metales pesados como cadmio o plomo. De esta manera, resulta imperativo conocer las consecuencias que estos productos ejercen sobre la salud. Varias evidencias señalan la contribución de los DEs en el desarrollo del cáncer de mama (De Coster y Van Larebeke 2012). En este contexto, nos propusimos evaluar los efectos del uso del plaguicida organofosforado CPF sobre el desarrollo del cáncer de mama utilizando diferentes modelos experimentales tanto in vitro como in vivo.
A partir de nuestro trabajo, evidenciamos dos mecanismos de toxicidad del CPF independientes de la inhibición colinesterasa. En principio, la acción del CPF sobre el sistema redox celular, conlleva a activación de diferentes vías de señalización y al incremento de ERO, lo cual podría derivar en la aparición de mutaciones, inestabilidad genómica y/o finalmente, en la muerte celular. Por otro lado, los resultados de nuestras investigaciones también aportan nuevas evidencias acerca de la acción del insecticida CPF como posible DE, sugiriendo la necesidad de revisar su uso, ya que podría actuar como un factor de riesgo ambiental para el cáncer de mama (Figura 5).

Figura 5. Resumen de los efectos que señalan al CPF como posible factor de riesgo ambiental para el cáncer de mama.de mama utilizando diferentes modelos experimentales tanto in vitro como in vivo.
Resulta fundamental señalar que muchos otros investigadores encontraron que el CPF es capaz de inducir muerte celular in vitro (Nakadai y col. 2006; Li y col. 2009). Sin embargo, los reportes que señalan que el plaguicida podría inducir proliferación o la viabilidad celular son muy escasos, probablemente porque muy pocas investigaciones fueron llevadas a cabo con concentraciones del plaguicida del orden nanomolar como en este caso.
A partir de nuestros resultados y los de otros investigadores concluimos que el cambio en la legislación que regula el uso de los plaguicidas debería resultar inminente. Puesto que muchos de estos compuestos modulan tanto el sistema neuronal y hormonal en el hombre y la mujer, con consecuencias inmediatas y a largo plazo sobre la salud de las personas, y muy probablemente de las próximas generaciones.
Bibliografía citada
1. Andersen H.R., Vinggard A.M., Rasmussen T.H, Gjermandsen I.M., Bonefeld-Jørgensen E.C. Effects of currently used pesticides in assays for estrogenicity, androgenicity, and aromatase activity in vitro. Toxicology and applied pharmacology. 2002;179:1-;12. [ Links ]
2. ANMAT. 2008. Disposición 2659/2008. [ Links ]
3. Bennett L.M., Davis B.J. Identification of mammary carcinogens in rodent bioassays. Environmental and Molecular Mutagenesis. 2002;39:150-;157. [ Links ]
4. Blair A., Kazerouni N. Reactive chemicals and cancer. Cancer causes & control. 1997;8:473-;490. [ Links ]
5. Brody J.G. Rudel R.A. Environmental pollutants and breast cancer. Environmental Health Perspectives. 2003;111:1007-;1019. [ Links ]
6. Clarke R.B., Sims A.H., Howell A. The origin of estrogen receptor α-positive and α-negative breast cancer. Hormonal Carcinogenesis V. 2008;617:79-;86.
7. De Coster S., Van Larebeke N. Endocrine-disrupting chemicals: associated disorders and mechanisms of action. Journal of environmental and public health. 2012;2012:713696. [ Links ]
8. Del Prado Lu J.L. Multipesticide residue assessment of agricultural soil and water in major farming areas in Benguet, Philippines. Archives of environmental contamination and toxicology. 2010;59:175-;181. [ Links ]
9. Grünfeld H.T., Bonefeld-Jorgensen E.C. Effect of in vitro estrogenic pesticides on human oestrogen receptor alpha and beta mRNA levels. Toxicology letters. 2004;151:467-;480. [ Links ]
10. Gupta S.C., Mishra M., Sharma A., Deepak Balaji T.G.R., Kumar R., Mishra R.K., Chowdhuri D.K. Chlorpyrifos induces apoptosis and DNA damage in Drosophila through generation of reactive oxygen species. Ecotoxicology and environmental safety. 2010;73:1415-;1423. [ Links ]
11. Howard M.D., Pope C.N. In vitro effects of chlorpyrifos, parathion, methyl parathion and their oxons on cardiac muscarinic receptor binding in neonatal and adult rats. Toxicology. 2002;170:1-;10. [ Links ]
12. Jaipieam S., Visuthismajarn P., Siriwong W., Borjan M., Robson M.G. Inhalation exposure of organophosphate pesticides by vegetable growers in the Bang-Rieng subdistrict in Thailand. Journal of environmental and public health. 2009;2009:452373. [ Links ]
13. Jergentz S., Mugni H., Bonetto C., Schulz R. xAssessment of insecticide contamination in runoff and stream water of small agricultural streams in the main soybean area of Argentina. Chemosphere. 2005;61:817-;826. [ Links ]
14. Lee W.J., Blair A., Hoppin J.A., Lubin J.H., Rusiecki J.A., Sandler D.P., Dosemeci, M., Alavanja, M.C.R. Cancer incidence among pesticide applicators exposed to chlorpyrifos in the Agricultural Health Study. Journal of the National Cancer Institute. 2004;96:1781-;1789. [ Links ]
15. Lee W.J., Colt J.S., Heineman E.F., McComb R., Weisenburger D.D., Lijinsky W., Ward M.H. Agricultural pesticide use and risk of glioma in Nebraska, United States. Occupational and environmental medicine. 2005;62:786-;792. [ Links ]
16. Lee W.J., Sandler D.P.,Blair A., Samanic C., Cross A.J., Alavanja M.C.R. Pesticide use and colorectal cancer risk in the Agricultural Health Study. Int J Cancer. 2007;121:339-;346. [ Links ]
17 Li Q., Kobayashi M., Kawada T. Chlorpyrifos induces apoptosis in human T cells. Toxicology. 2009;255:53-;57. [ Links ]
18. Loewy M., Kirs V., Carvajal G., Venturino A., Pechen de D'angelo M. Groundwater contamination by azinphos methyl in the northern Patagonic Region (Argentina). The Science of the total environment. 1999;225:211-;218. [ Links ]
19. Loewy R.M., Monza L.B., Kirs V.E., Savini M.C. Pesticide distribution in an agricultural environment in Argentina. Journal of Environmental Sciense and Health. 2011;46:662-;670. [ Links ]
20. Marino D., Ronco A. xCypermethrin and chlorpyrifos concentration levels in surface water bodies of the Pampa Ondulada, Argentina. Bulletin of environmental contamination and toxicology. 2011;75:820-;826. [ Links ]
21 Nakadai A., Li Q., Kawada T. Chlorpyrifos induces apoptosis in human monocyte cell line U937. Toxicology. 2006;224:202-;209. [ Links ]
22. Organización Mundial de la Salud. WHO specifications and evaluations for public health pesticides. Chlorpyrifos. 2009. [ Links ]
23. Qiao D., Seidler F.J., Slotkin T.A. Developmental neurotoxicity of chlorpyrifos modeled in vitro: comparative effects of metabolites and other cholinesterase inhibitors on DNA synthesis in PC12 and C6 cells. Environmental health perspectives. 2001;109:909-;913. [ Links ]
24. Querejeta G.A., Ramos L.M., Flores A.P., Hughes E.A., Zalts A., Montserrat J.M. Environmental pesticide distribution in horticultural and floricultural periurban production units. Chemosphere. 2012;87:566-;572. [ Links ]
25. Reynolds P., Hurley S.E., Gunier R.B., Yerabati S., Quach T., Hertz A. Residential Proximity to Agricultural Pesticide Use and Incidence of Breast Cancer in California, 1988-;1997. Environmental Health Perspectives. 2005;113:993-;1000. [ Links ]
26. Rush T., Liu X.Q., Hjelmhaug J., Lobner D. Mechanisms of chlorpyrifos and diazinon induced neurotoxicity in cortical culture. Neuroscience. 2010;166:899-;906. [ Links ]
27. Sanghi R., Pillai M.K.K., Jayalekshmi T.R., Nair A. Organochlorine and organophosphorus pesticide residues in breast milk from Bhopal, Madhya Pradesh, India. Human & Experimental Toxicology. 2003;22:73-;76. [ Links ]
28. Song X., Seidler F.J., Saleh J.L., Zhang J., Padilla S., Slotkin T.A. Cellular mechanisms for developmental toxicity of chlorpyrifos: targeting the adenylyl cyclase signaling cascade. Toxicology and applied pharmacology. 1997;145:158-;174. [ Links ]
29 Tan D.H., Peng S.Q., Wu Y.L., Wang Y.M., Lu C.F., Ding W., Wang, Q.X., Yang C.H. Chlorpyrifos induces delayed cytotoxicity after withdrawal in primary hippocampal neurons through extracellular signal-regulated kinase inhibition. Biological & pharmaceutical bulletin. 2009;32:1649-;1655. [ Links ]
30. Torres M. Mitogen-activated protein kinase pathways in redox signaling. Frontiers in Bioscience. 2003;8:369-;391. [ Links ]
31. Ventura C., Núñez M., Miret N., Martinel Lamas D., Randi A., Venturino A., Rivera E., Cocca C. Differential mechanisms of action are involved in chlorpyrifos effects in estrogen-dependent or -independent breast cancer cells exposed to low or high concentrations of the pesticide. Toxicology Letters. 2012;213:184-;193. [ Links ]
32. Ventura C., Ramos Nieto M.R., Bourguignon N., Lux-Lantos V., Cocca C., Núñez M. Clorpirifos: estudio de sus efectos como disruptor endócrino. Revista Medicina. 2014;74:271. [ Links ]
33. Ventura C., Ramos Nieto M.R., Bourguignon N., Lux-Lantos V., Rodriguez H., Cao G., Randi A., Cocca C., Núñez M. Pesticide chlorpyrifos acts as an endocrine disruptor in adult rats causing changes in mammary gland and hormonal balance. The Journal of Steroid Biochemistry and Molecular Biology. En prensa. [ Links ]
34. Ventura C., Venturino A., Miret N., Randi A., Rivera E., Núñez M., Cocca C. Chlorpyrifos inhibits cell proliferation through ERK1/2 phosphorylation in breast cancer cell lines. Chemosphere. 2015;120:343-;350. [ Links ]
35. Wu D., Pan W. GSK3: a multifaceted kinase in Wnt signaling. Trends Biochem Sci. 2011;35:161-;168. [ Links ]














