Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. vol.24 no.1 Ciudad Autónoma de Buenos Aires jul. 2016
ARTÍCULOS
Evaluación genotóxica de sedimentos de la cuenca Matanza-Riachuelo bajo la influence de distintos usos del suelo
Genotoxic evaluation of sludge from Matanza-Riachuelo basin under the influence of different uses of land
Biruk, Lucía Nadia1; Moretton, Juan1; Filippetto, Javier3; Etcheverry, Jimena3; Weigandt, Cristian2; Fabrizio de Iorio, Alicia2; Magdaleno, Anahí1*
1Cátedra de Higiene y Sanidad, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Junín 956 4° Piso (C1113AAC), Buenos Aires, Argentina.
2Cátedra de Química Analítica, Facultad de Agronomía, Universidad de Buenos Aires, Buenos Aires, Argentina.
3Instituto Nacional de Tecnología Industrial, Buenos Aires, Argentina.
Recibido: 9 de mayo de 2015
Aceptado: 19 de mayo de 2016
Resumen.
El Río Matanza-Riachuelo y sus afluentes atraviesan zonas con diferente grado de contaminación generada por las actividades agrícola-ganaderas, urbana e industrial. Los contaminantes que llegan al agua y son depositados en los sedimentos pueden ser liberados nuevamente al agua generando efectos tóxicos y/o genotóxicos sobre los organismos acuáticos. El objetivo de este trabajo fue analizar la genotoxicidad de muestras de sedimentos de la cuenca Matanza-Riachuelo obtenidas de zonas con diferentes usos del suelo. Se seleccionaron cuatro sitios de muestreo. Se utilizaron 2 métodos de extracción de contaminantes (agitación y sonicación), 2 solventes orgánicos (metanol y diclorometano) y 2 solventes inorgánicos (agua y solución ácida), obteniéndose un total de 5 extractos para cada muestra. Se realizaron mediciones de metales pesados e hidrocarburos aromáticos policíclicos (HAPs) mediante espectrofotometría de absorción atómica y CG/MS, respectivamente. La genotoxicidad se evaluó mediante el test de Ames con 2 cepas de Salmonella typhimurium (TA98 y TA100), con y sin fracción microsomal S9, y el test de Allium cepa. De los cuatro sitios estudiados, los sedimentos del Riachuelo mostraron mayores concentraciones de metales pesados y HAPs. Para el test de Ames, sólo los extractos obtenidos en diclorometano resultaron genotóxicos para la TA100 +S9 mix. Tanto los extractos inorgánicos como los orgánicos fueron citotóxicos y genotóxicos para A. cepa. Se observó una correlación negativa entre algunos compuestos HAPs y la frecuencia de micronúcleos, indicando la presencia de efectos antagónicos con otros compuestos genotóxicos. Los extractos con mayor efecto tóxico y genotóxico fueron los obtenidos con diclorometano y solución ácida. Este estudio mostró que los contaminantes orgánicos e inorgánicos extraídos de muestras de sedimento de la Cuenca Matanza-Riachuelo, con diferente grado de impacto, presentan un potencial riesgo tóxico y genotóxico para el ecosistema acuático.
Palabras clave: Test de Ames; Allium cepa; Genotoxicidad; Sedimentos.
Abstract.
The Matanza-Riachuelo River and its tributaries traverse areas with different degrees of contamination due to farming, urban and industrial activities. The pollutants entering the water are deposited in sediments, and can be released back into the water producing toxic and/or genotoxic effects on aquatic organisms. The aim of this study was to analyze the genotoxicity of sediment samples from the Matanza-Riachuelo Basin with different land uses. Four sampling sites according to the characteristics of land use were selected. Two methods of extraction (stirring and sonication), two organic solvents (methanol and dichloromethane) and two inorganic solvents (water and acid solution) were used, yielding a total of 5 extracts for each sample. Measurements of heavy metals and polycyclic aromatic hydrocarbons (PAHs) by atomic absorption spectrophotometry and GC/MS, respectively were performed. Genotoxicity was assessed using the Ames test with 2 strains of Salmonella typhimurium (TA98 and TA100) with and without S9 microsomal fraction, and the Allium cepa test. Taking into account the four sites, sediments from Riachuelo showed higher concentrations of heavy metals and PAHs. Only the dichloromethane extracts were genotoxic to the Ames test using the TA100 strain +S9 the mix. Both organic and inorganic extracts were cytotoxic and genotoxic to A. cepa. A negative correlation between some PAHs compounds and micronucleus frequency were observed, indicating the presence of antagonistic effects with other genotoxic compounds in samples. The extracts with high toxic and genotoxic effects were obtained with dichloromethane and acid solution. This study showed that organic and inorganic contaminants extracted from sediment samples from the Matanza-Riachuelo Basin, with varying degrees of impact, have potential toxic and genotoxic risk to the aquatic ecosystem.
Key words: Ames test; Allium cepa; Genotoxicity; Sediments.
Introducción
La cuenca del Matanza-Riachuelo abarca una de las zonas más pobladas e industrializadas de la Argentina. Comprende una superficie aproximada de 2250 km2, e incluye un total de 11 partidos de la Provincia de Buenos Aires y la Ciudad de Buenos Aires, con una población cercana a los 5 millones de habitantes. Dentro de dicha cuenca se realizan diferentes actividades lo que implica distintos usos del suelo. En la cuenca alta, la principal actividad es la agrícola-ganadera, con un incremento de las prácticas intensivas de la cría de ganado en establecimientos o áreas confinadas (Wyngaard y col. 2011). En las cuencas media y baja, las principales actividades son la urbana e industrial, con una importante presencia de basurales a cielo abierto en las márgenes de varios de sus afluentes y del curso principal del río (Magdaleno y col. 2008). Por lo tanto, los cursos de agua en toda la cuenca del Matanza-Riachuelo están potencialmente sujetos a diferentes tipos de contaminantes provenientes de la escorrentía de zonas agrícola-ganaderas, de efluentes provenientes de áreas urbanas e industriales y de lixiviados de los residuos sólidos domésticos. A esta problemática ambiental se suma la deficiente infraestructura sanitaria de las poblaciones asentadas en la ribera de la cuenca baja (Riachuelo), zona que fue caracterizada como una de las diez más contaminadas del mundo por la Cruz Verde de Suiza, en el año 2013 (Mendoza y col. 2015).
Los contaminantes que llegan a las aguas superficiales pueden sufrir procesos de adsorción a partículas en suspensión, y luego son depositados en los sedimentos (White y col., 1998). En consecuencia, los sedimentos constituyen una fuente de compuestos tóxicos, que se liberan a la columna de agua de forma continua a través de procesos de resuspensión y transferencia trófica (Minissi y col. 1998; Beyersmann y Hartwig 2008). Estos compuestos suelen estar presentes en el ambiente como mezclas complejas en el ambiente, cuyos efectos sobre los ecosistemas pueden ser evaluados mediante la utilización de bioensayos estandarizados de corto plazo (White 2002). Sin embargo, muchos contaminantes presentes en los sedimentos se encuentran a menudo por debajo de los niveles capaces de causar efectos sobre los organismos utilizados en esos bioensayos. De esta manera, efectuar una preconcentración de los contaminantes orgánicos e inorgánicos en muestras ambientales, a través del uso de solventes de extracción, mejora la capacidad de detectar los efectos potenciales de estos químicos (Chen y White, 2004; Di Giorgio y col., 2011; Cappi da Costa y col. 2012; De Souza Pohren y col., 2012). El uso de estas técnicas, en combinación con la utilización de bioensayos de pequeña escala, constituye una herramienta útil en el estudio de los riesgos de contaminantes en los ecosistemas (Klamer y col. 2005). La elección del solvente y método de extracción dependen de las propiedades físico-químicas de los sedimentos contaminados así como de los compuestos que se deseen extraer.
Uno de los ensayos más ampliamente utilizados para evaluar la mutagenicidad de sustancias puras y muestras ambientales es el de Ames (Ducatti y Vargas 2003; Ohe y col. 2004; White y Claxton 2004; Horn y Vargas 2008; Vargas y col. 2008; Magdaleno y col. 2012). Este ensayo utiliza varias cepas de Salmonella typhimurium con mutaciones en el operón de la histidina, que dejan a la bacteria incapaz de sintetizar este aminoácido y, por lo tanto, incapaz de crecer y formar colonias en su ausencia. Nuevas mutaciones en los sitios de estas mutaciones preexistentes, o cerca de dichos genes, pueden restaurar la función genética y permitir a las células sintetizar histidina, crecer en su ausencia y formar colonias denominadas revertantes. Esta reversión suele darse de manera espontánea y la cantidad de colonias revertantes es característica de cada cepa (Maron y Ames 1983). En los mamíferos, algunos agentes carcinogénicos pueden ser biológicamente inactivos a menos que sean metabolizados a sus formas activas. Por ello, se incluye en este ensayo, un sistema de activación metabólica exógeno (enzimas del sistema citocromo P450) proveniente de un homogenato de hígado de rata (Ames y col. 1973).
Otros excelentes modelos genéticos para evaluar la presencia de contaminantes ambientales, lo constituyen las plantas superiores, no sólo debido a su elevada sensibilidad para detectar mutágenos, sino porque ofrecen la posibilidad de evaluar varios tipos de efecto, desde mutaciones puntuales a algunas aberraciones cromosómicas en células de diferentes órganos o tejidos, como hojas, raíces y polen (Grant 1994). Entre dichos modelos, la especie Allium cepa es reconocida como uno de los mejores sistemas de prueba debido a su fácil manejo y bajo costo, su buena correlación con otros sistemas de prueba, así como por tener cromosomas de gran tamaño (fácilmente visibles al microscopio óptico) y en un número reducido (2 n=16). Otra ventaja importante radica en la presencia de un sistema de oxidasas, esencial para la evaluación de promutágenos (Fiskesjö 1985; Fatima y Ahmad 2006; Leme y Marin-Morales 2009).
El objetivo de este trabajo fue analizar la genotoxicidad de muestras de sedimento de la cuenca Matanza-Riachuelo obtenidas de zonas con diferentes usos del suelo, mediante la obtención de extractos y la aplicación de dos modelos biológicos, los ensayos de Ames y de A. cepa, correlacionando la presencia de contaminantes orgánicos e inorgánicos en dichos extractos con los resultados obtenidos.
Materiales y métodos
Sitios de muestreo
Las muestras de sedimento se tomaron en cuatro sitios de muestreo localizados en zonas de la cuenca con diferente uso del suelo y grado de contaminación (Figura 1).

Figura 1. Mapa de la cuenca Matanza-Riachuelo indicando los sitios de muestreo.
El sitio S1, sobre el Arroyo Morales a unos 8,3 km de su cabecera y a 100 metros aguas abajo de un "feedlot"; el sitio S2, sobre el Arroyo Morales a unos 13,5 km de su cabecera, ambos sitios en el Partido de Las Heras, con una densidad poblacional aproximada de 20 habitantes por km2. El sitio S3, sobre el cauce principal del río Matanza, en su cruce con la Ruta Nacional N° 3, a 41 km de su cabecera, en el Partido de Virrey del Pino, con una densidad poblacional aproximada de 1.500 habitantes por km2. El sitio S4, en el Riachuelo, a 79,5 km de su cabecera, en el Municipio de Avellaneda, con una densidad poblacional aproximada de 8.500 habitantes por km2. La principal actividad económica desarrollada en el sitio S1 es la agricultura extensiva (principalmente soja, maíz y girasol) y la ganadería intensiva en "feedlots" o corrales de engorde de ganado bovino, porcino y aves. El sitio S2 se caracteriza por una mediana actividad urbana e industrial. En el sitio S3, la principal actividad es la agricultura extensiva, y el sitio S4 se caracteriza por la mayor actividad urbana e industrial de toda la cuenca.
Recolección y procesamiento de las muestras
Las muestras de sedimento se colectaron en los meses de diciembre de 2009 y marzo de 2010. Se tomaron entre 0,5 y 1 kg de sedimento superficial a 20 cm de profundidad, en las márgenes del río. Las muestras se transportaron en frío dentro de bolsas plásticas protegidas de la luz. En el laboratorio, los sedimentos se congelaron a -20°C y posteriormente se lioflizaron, se molieron mecánicamente y se tamizaron a través de un tamiz de acero de 2 mm de diámetro de poro. Las muestras procesadas se guardaron en oscuridad hasta la extracción de los compuestos químicos orgánicos e inorgánicos.
Obtención de los extractos
A partir de cada muestra de sedimento previamente procesada se obtuvieron tres extractos inorgánicos (E1, E2 y E3) y dos extractos orgánicos (E4 y E5), según Rodrigues da Silva Júnior y col. (2009) y Cappi da Costa y col. (2012). Los extractos E1 se obtuvieron a partir de 25 g de sedimento y 50 mL de agua destilada (pH 5,5 ± 0,5), es decir una relación 1:2 gramos de sedimento: mL de solvente. Esta mezcla se sometió a agitación por un período de 24 hs, a 20 °C y una velocidad de 100 rpm. Posteriormente, la mezcla se centrifugó a 13.000 g durante 15 min a 4 °C, obteniéndose un sobrenadante que se filtró a través de una membrana de acetato de celulosa de 0,22 µm. Se separaron alícuotas de 10 mL que se guardaron a -20 °C. Para los extractos E2 se procedió de la misma manera pero utilizando una solución ácida (5,7 mL Ac. Acético más 64,3 mL NaOH 1 M en 1 L H2O destilada; pH 4,5 ± 0,2). Los extractos E3 se obtuvieron a partir 25 g de sedimento, 50 mL de solución ácida y dos ciclos sucesivos de sonicado (100 W) durante 10 min., seguidos por centrifugación a 13.000 xg por 15 min a 4 °C. En cada proceso de sonicado se utilizaron 25 mL de solución ácida. Los sobrenadantes de cada ciclo de extracción se mezclaron, filtraron y guardaron a -20 °C (relación 1:2 gramos de sedimento: mL de solvente). En los tres extractos inorgánicos se midió el pH.
Los extractos E4 y E5 se obtuvieron a partir de la misma metodología descripta para los extractos E3, pero utilizando diclorometano (DCM) y metanol, respectivamente, y un volumen total de solvente de 100 mL (relación 1:4 gramos de sedimento: mL de solvente). Del volumen final obtenido se separaron alícuotas de 10 mL de cada extracto para las determinaciones químicas de los contaminantes orgánicos. Se midió el volumen remanente y se llevó a Rotavap (40 °C) para obtener sequedad total. El residuo fue re-suspendido en dimetilsulfóxido (DMSO) (Chen y White 2004) en un volumen tal a fin de obtener una relación 1:10 volumen de DMSO: volumen de sobrenadante. De esta manera se concentró la muestra 10 veces. La solución obtenida se filtró a través de membrana de nylon de 0,22 µm y se guardó a -20 °C hasta el momento de su utilización.
Análisis químicos de los extractos
En los extractos inorgánicos se determinaron las concentraciones de metales pesados, particularmente zinc, cromo, plomo y cobre, que se encuentran en mayor concentración a lo largo de la Cuenca (Rendina y col. 2001). Las mismas se realizaron por medio del método de espectrofotometría de absorción atómica de llama (APHA, AWWA, WPCF, 2012), en un equipo Perkin Elmer 1100B (Perkin Elmer, Inc. Waltham, MA, USA). Los límites de cuantificación fueron: Zn (0,003 mg/L), Cr (0,003 mg/L), Pb (0,010 mg/L) y Cu (0,005 mg/L). En los extractos orgánicos se determinaron las concentraciones de 14 hidrocarburos aromáticos policíclicos (HAPs) incluidos en la lista de los 16 compuestos HAPs considerados prioritarios según la Agencia de Protección Ambiental de los Estados Unidos (USEPA). Las determinaciones analíticas de realizaron mediante cromatografía gaseosa y espectro-fotometría de masa en un equipo GC Agilent modelo 7890A, con "auto sampler" modelo 7693, acoplado a inert MSD modelo 5975C. Las condiciones de uso fueron las siguientes: gas helio, columna HP-5MS, longitud (30 m), diámetro interno (0,25 mm), temperaturas inicial y final (120 ºC-300 ºC), tiempo inicial y final (0 min–5 min), gradiente (5 ºC/min). Inyector: temperatura (300 ºC), flujo constante (1 mL/min), "Split": relación (5:1). Detector MSD: Fuente de MS (230 ºC), MS Quad: 150 ºC, límites de detección (50–300 unidades de masa atómica).
Ensayo de Ames
Se utilizaron las cepas TA98 y TA100 de S. typhimurium, las cuales permiten determinar tanto la sustitución de pares de bases, como los corrimientos en el marco de lectura de la molécula de ADN, respectivamente. Se realizó el ensayo de incorporación en placa luego de una pre-incubación de 30 minutos a 37 ºC, de la muestra (0,1 mL) en contacto con cada cepa (una cantidad de entre 107 y 108 células/mL), en presencia de 0,5 mL de solución reguladora de fosfato, y paralelamente con el agregado de 0,5 mL de fracción microsomal (mezcla S9). El contenido de los tubos así preparados se mezcló y volcó inmediatamente en placas de Petri que contenían sobre la superficie 15 mL de medio mínimo suplementado con glucosa y sales de Vogel-Bonner (Mortelmans y Zeiger 2000). Se utilizó agua destilada estéril y DMSO como controles negativos y 5 µg/placa de azida sódica (AS) (CAS Nº 26628-22-8) para la cepa TA100 y 10 µg/placa de 2-aminofuorene (2AF) (CAS Nº 153-78-6) para ambas cepas con el agregado de la fracción microsomal. El ensayo indica mutagenicidad cuando el número de colonias revertantes/placa en la muestra duplica al número de colonias revertantes/placa en el control (Maron y Ames 1983).
Ensayo de Allium cepa
Se utilizaron semillas de A. cepa variedad Valcatorce, libres de funguicidas y plaguicidas, ofrecidas gentilmente por el Instituto Nacional de Tecnología Agropecuaria (INTI), sede La Consulta, Provincia de Mendoza. Se colocaron 100 semillas en cajas de Petri plásticas estériles, conteniendo un papel de filtro de fibra de vidrio Whatman tipo GF/C embebido en 4 mL de cada extracto, y los respectivos controles: agua destilada (100 %), solución ácida (10 %) y DMSO (1 %). Se utilizó una solución de metil metansulfonato (MMS) (CAS Nº 66-27-3) como control positivo, en una concentración de 2x10-4 M. Se incubaron por 96 hs en cámara oscura y a temperatura controlada (20-22 °C). Luego de ese período, las semillas se fijaron en Carnoy (3:1 v/v alcohol etílico absoluto: ácido acético) por 24 hs, y se preservaron en alcohol etílico al 70 % v/v. Las observaciones microscópicas de las células meristemáticas de las raíces se realizaron a partir de la coloración de los cromosomas con orceina 2 % en ácido acético 45 %. Se observaron 5 preparados por cada extracto y/o controles, contabilizando aproximadamente un total de 5000 células y un mínimo de 200 anafases-telofases y 2000 interfases en cada uno. El análisis microscópico incluyó el índice mitótico (IM), la frecuencia de aberraciones cromosómicas (AC) en células en anafases y telofases, y la frecuencia de micronúcleos (MN) en células en interfase (Cappi da Costa y col. 2012; Magdaleno y col. 2014). Las AC contabilizadas fueron: puentes, fragmentos, cromosomas perdidos y cromosomas retrasados.
Análisis estadísticos
Se utilizó el análisis de Kruskal Wallis para evaluar las diferencias signifcativas entre los IM, las frecuencias de MN y AC en los extractos y sus respectivos controles. Se realizaron análisis de correlación entre los parámetros de genotoxicidad medidos (números de revertantes/placa, IM y frecuencias de AC y MN) y las determinaciones químicas de los extractos (concentraciones de metales pesados y HAPs) utilizando la matriz de correlación de Pearson (p < 0,05) Se utilizó el programa Infostats versión 2014 Estudiantil.
Resultados y discusión
Análisis químicos de los sedimentos
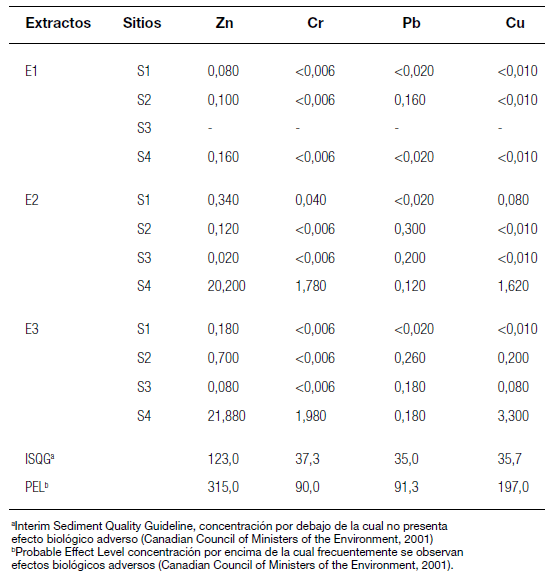
En todos los extractos inorgánicos se detectaron metales pesados, en mayor concentración en los extractos E2 y E3 (extractos ácidos) que en el extracto E1 (agua destilada) (Tabla 1). El metal más abundante, presente en todos los sitios y extractos, fue el Zn, con concentraciones máximas equivalentes a 20,20 y 21,88 mg/Kg de sedimento seco en los extractos ácidos y en el sitio S4. Los rangos de concentración de Cr, Pb y Cu, extraídos en solución ácida, fueron de 0,04-1,98; 0,12-0,30 y 0,08-3,3 mg/Kg equivalentes de sedimento seco, respectivamente. Estas concentraciones fueron de entre dos y tres órdenes de magnitud menores a los valores de metales totales reportados por ACUMAR (2012) en los sedimentos de la cuenca: Cr: 24,0-2922,3 mg/Kg; Pb: 24,1-526,6 mg/Kg y Cu: 20,5-597,0 mg/Kg de sedimento seco. Al comparar las concentraciones de metales pesados de los extractos con los niveles guía propuestos por la norma canadiense sobre la calidad de sedimentos (Canadian Council of Ministers of the Environment 2001), se observó que en ningún caso superaron dichos límites (Tabla 1).
Tabla 1. Concentración de metales pesados (mg/Kg equivalentes de sedimento seco) en los extractos acuosos y ácidos de las muestras de sedimento del Matanza-Riachuelo.
Los extractos orgánicos presentaron altos niveles de HAPs teniendo en cuenta los valores guía de la norma canadiense (Tabla 2). Muchos de los compuestos analizados en los extractos superaron el Interim Sediment Quality Guideline (ISQG), que indica la concentración por debajo de la cual no se presenta efecto biológico adverso, así como el Probable Effect Level (PEL), que indica la concentración por encima de la cual frecuentemente se observan efectos biológicos adversos. Los compuestos que superaron los valores PEL fueron: fuoreno y antraceno en S1 y S3, pireno y criseno en S4, para los extractos E4, y antraceno en S2, benzo(a)antraceno y benzo(a)pireno en S4, para los E5. Muchos otros compuestos se encontraron en concentraciones no detectables en ambos extractos. Según De Souza Pohren y col. (2012), existen fuertes interacciones entre HAPs y la matriz del suelo, lo que podría resultar en bajas concentraciones en los extractos obtenidos. Este efecto podría producirse en los sedimentos del Matanza-Riachuelo. Contrariamente a los resultados obtenidos en el presente trabajo, los informes de ACUMAR (2012) muestran la ausencia de compuestos HAPs en los sedimentos de la cuenca, a excepción del benzo(k)fuoranteno en unos pocos sitios y en un rango de 0,025-0,193 mg/Kg de sedimento seco. Estas diferencias podrían sugerir que los métodos de extracción utilizados en este trabajo resultarían más apropiados para la obtención de estos compuestos a partir de los sedimentos del Matanza-Riachuelo.
Tabla 2. Concentración de catorce hidrocarburos policíclicos aromáticos (mg/Kg equivalentes de sedimento) en los extractos E4 (diclorometano) y E5 (metanol) de las muestras de sedimento del Matanza-Riachuelo.
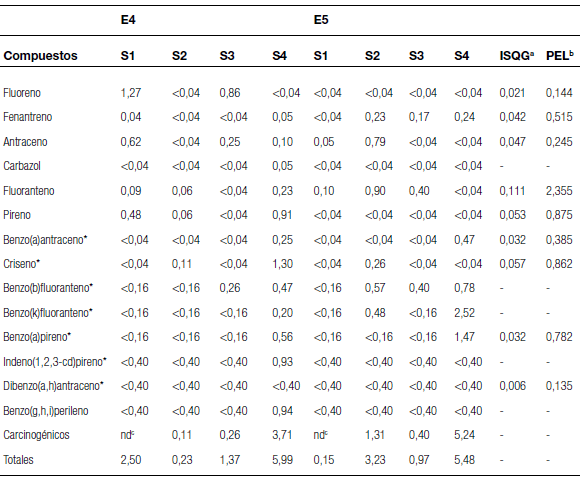

De los cuatro sitios analizados, El Riachuelo (S4) mostró las mayores concentraciones de HAPs en el sedimento, alcanzando además, los mayores niveles de HAPs carcinogénicos y totales: 3,71 y 5,99 mg/Kg en el extracto E4, y 5,24 y 5,48 mg/Kg en el extracto E5, respectivamente (Tabla 2). Al tener en cuenta la cantidad de compuestos extraídos en este sitio, se observó que el DCM extrajo una mayor cantidad de HAPs (11 de los 14 evaluados) con respecto al metanol, que sólo extrajo 5 compuestos. Sin embargo, las concentraciones de los 5 compuestos extraídos con metanol fueron mayores que las obtenidas con DCM (Tabla 2). En el sitio S2, ubicado en el arroyo Morales (sitio con características de impacto urbano e industrial), las concentraciones de HAPs carcinogénicos y totales fueron mayores en el extracto E5 que en el extracto E4, a diferencia de lo observado en el Riachuelo. Esas concentraciones fueron de 1,31 y 3,23 mg/Kg y 0,11 y 0,23 mg/Kg equivalentes de sedimento seco, respectivamente (Tabla 2). En los sitios S1 y S3, donde no hay actividad urbana e industrial, las concentraciones de HAPs carcinogénicos y totales fueron mayores que en S2 en los extractos E4, pero menores que en S2 en los extractos E5. Estas diferencias se debieron al tipo de solvente utilizado. El DCM extrajo una mayor cantidad total de HAPs en todos los sitios, excepto en S2, mientras que el metanol extrajo una mayor cantidad de los HAPs carcinogénicos. Dados estos resultados, resulta difícil poder establecer una mayor o menor eficacia de extracción con uno u otro de los solventes empleados.
Ensayo de Ames
El número de colonias revertantes en cada uno de los extractos y en los controles puede observarse en la Tabla 3.
Tabla 3. Análisis de mutagenicidad de Salmonella/microsomas en ausencia (-S9) y presencia (+S9) de activación metabólica (media ± desvío estándar) en los extractos de muestras de sedimento del Matanza-Riachuelo.

Ninguno de los extractos inorgánicos resultó genotóxico. Esto puede deberse a que los metales pesados analizados (Zn, Pb y Cu) no presentan mutagenicidad para S. typhimurium (Codina y col. 1995), o se encuentran en concentraciones mucho más bajas a las mutagénicas, tal como es el caso del Cr. Según López y col. (1999), el cromo hexavalente, como dicromato de potasio, es mutagénico a concentraciones de 20 μg/placa, mientras que concentraciones de 30 μg/placa resultan tóxicas para S. typhimurium. Teniendo en cuenta la cantidad de muestra ensayada (0,1 mL) y las condiciones de ensayo, las concentraciones de Cr fueron inferiores (0,002 y 0,099 μg/placa) a las reportadas como genotóxicas, lo cual explicaría la ausencia de genotoxicidad observada en las cepas TA98 y TA100 en los extractos inorgánicos.
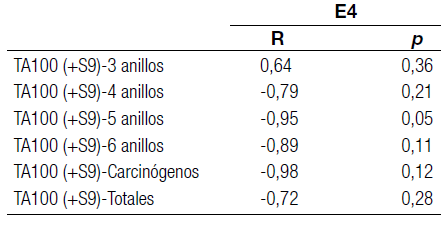
Solamente los extractos orgánicos E4 resultaron mutagénicos para la TA100 +S9 mix en los cuatro sitios (Tabla 3). Teniendo en cuenta las concentraciones de los compuestos HAPs obtenidas en los extractos E4, solamente el benzo(a)antraceno y el benzo(a)pireno superaron los valores de ISQG y PEL en el sitio S4 (Tabla 2). Sin embargo, la respuesta mutagénica fue similar en todos los sitios para esos extractos. Por otra parte, en los extractos E5, en los cuales no se observó una respuesta mutagénica, también se encontraron concentraciones de HAPs que superaron los valores guía (fuoreno y antraceno en S1, pireno y criseno en S2, fuoreno y antraceno en S3, fenantreno, antraceno, fuoranteno, pireno, benzo(a)antraceno, criseno y benzo(a)pireno en S4 (Tabla 2). Según el análisis de correlación, los compuestos HAPs (agrupados en 3, 4, 5 y 6 anillos, los carcinogénicos y los totales) presentes en los extractos E4 no estuvieron significativamente correlacionados con el número de colonias revertantes/placa obtenidas para la TA100 +S9 mix (Tabla 4). Estos resultados podrían estar indicando posibles efectos sinérgicos y/o antagónicos entre los compuestos HAPs o entre otros compuestos no analizados en este estudio.
Dentro de la lista de los 16 compuestos HAPs considerados prioritarios por la EPA, sólo 8 son carcinogénicos (IARC, 2011) y requieren la presencia de algún sistema de activación para que los metabolitos resultantes muestren su efecto (Watanabe y col. 2005; Courty y col. 2008; Watanabe y col. 2008). Varios autores han reportado efectos mutagénicos de HAPs para las dos cepas TA98 y TA100 con el agregado de la fracción microsomal (Chen y White 2004; Cappi da Costa y col. 2012; de Souza Pohren y col. 2012). Los HAPs son capaces de actuar a nivel del genoma produciendo tanto corrimientos del marco de lectura, como sustitución de pares de bases. Los resultados obtenidos en el presente trabajo sólo mostraron respuesta mutagénica únicamente con la cepa TA100, lo cual indicaría la presencia de mutágenos cuyo mecanismo de acción es la sustitución de pares de bases.
Tabla 4. Correlaciones entre las concentraciones de HAPs agrupadas por número de anillos, carcinogénicos y totales, y el número de colonias revertantes/placa para la cepa TA100 +S9 y los extractos E4s. R=coeficiente de correlación de Pearson, p=nivel de significancia (<0,05).
Ensayo de A. cepa
Los extractos acuosos y ácidos mostraron citotoxicidad, debido a que los IM fueron significativamente más altos (entre 49,74 ± 3,14 y 60,14 ± 6,79, y entre 55,50 ± 6,07 y 66,88 ± 11,35, respectivamente) que sus respectivos controles (39,77 ± 4,41 y 45,09 ± 7,89, respectivamente) (Tabla 5).
De acuerdo con Leme y Marin-Morales (2009), los altos IM son el resultado de un incremento en la división celular, que puede producir una proliferación celular desordenada e incluso la formación de tumores en los tejidos. Este mismo efecto también se observó en las semillas expuestas al mutágeno MMS. Todos los extractos inorgánicos resultaron genotóxicos para A. cepa, tanto en las frecuencias de AC como en las frecuencias de MN (Tabla 5). Los extractos E2 y E3 mostraron generalmente mayores frecuencias de AC y MN que los E1. Al comparar los dos métodos de extracción con la solución ácida, pudo observarse que los extractos E2 (en "shaker") mostraron mayor genotoxicidad con respecto a los E3 (sonicados). Las frecuencias de AC en el primer caso oscilaron entre 7,77 ± 7,53 y 9,33 ± 9,99, y en el segundo, entre 3,17 ± 4,81 y 5,06 ± 4,24, y las frecuencias de MN oscilaron entre 1,71 ± 1,03 y 4,19 ± 2,55 en el primer caso, y entre 1,05 ± 0,39 y 2,71 ± 1,52 en el segundo (Tabla 5). Teniendo en cuenta las frecuencias de AC, los sitios S3 y S4 mostraron mayor genotoxicidad que los sitios S1 y S2 en los tres extractos inorgánicos. Sin embargo, solamente en el sitio S4, las concentraciones de metales pesados fueron mayores que en los otros sitios (Tabla 1). Según el análisis estadístico, no hubo una correlación significativa entre las concentraciones de metales pesados y los diferentes parámetros de citotoxicidad y genotoxicidad (Tabla 6).
Tabla 5. Índice Mitótico (IM), y frecuencia de aberraciones cromosómicas (AC) y micronúcleos (MN) en 5000 células analizadas (media ± desvío estándar) de células meristemáticas de Allium cepa después de la exposición a los extractos de muestras de sedimento del Matanza-Riachuelo.
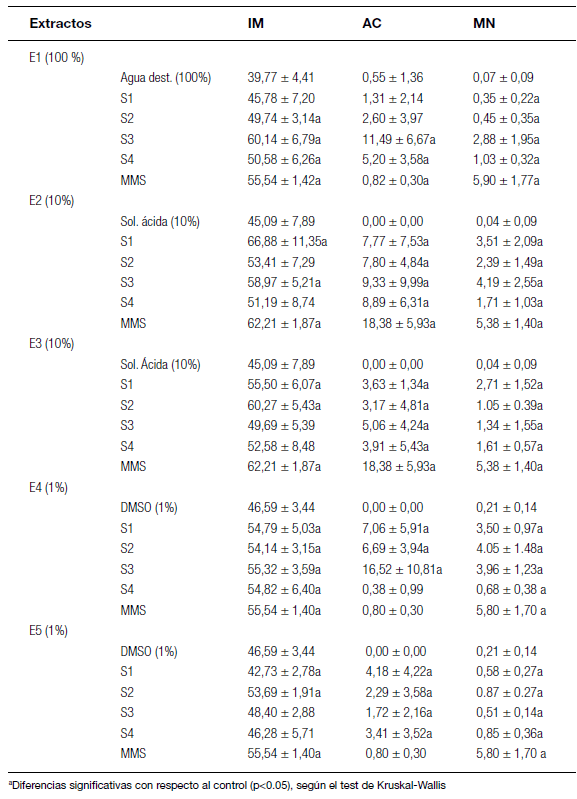
Tabla 6. Correlaciones entre los IM y los parámetros de genotoxicidad (frecuencias de AC y MN) medidos en A. cepa, y las concentraciones de metales pesados determinadas en los extractos inorgánicos utilizando la matriz de correlación de Pearson (p<0,05)
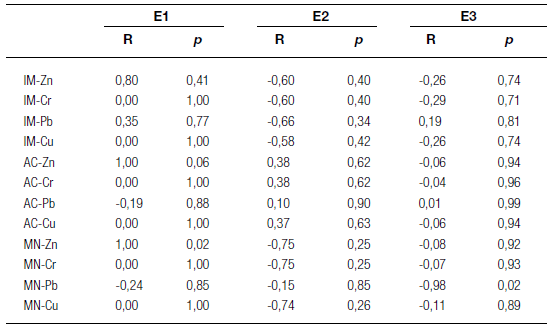
De este modo, los resultados observados podrían deberse a la presencia de otros elementos tóxicos y genotóxicos no considerados en este trabajo, así como a los efectos sinérgicos producidos por los metales y otros posibles compuestos presentes en los extractos. Si bien los metales analizados Zn, Cr, Pb y Cu podrían producir rupturas en los cromosomas, retrasos y puentes, y aumentos en las frecuencias de MN (Borboa y De La Torre 1996; Inceer y col. 2000; Matsumoto y col. 2006), otros metales no analizados en este trabajo, tales como Hg, Cd y Ni podrían también inducir AC con riesgos de aneuploidías (Fiskesjö 1988; Borboa y De La Torre 1996). Según ACUMAR (2012), los metales Ni y Hg se encuentran en elevadas concentraciones en los sedimentos de la cuenca (Ni: 21,7-99,7 mg/Kg y Hg: 1,3-6,5 mg/Kg).
Los extractos orgánicos E4 mostraron citotoxicidad en todos los sitios, en los que los IM fueron más altos (IM entre 54,79 ± 5,03 y 55,32 ± 3,59) que en el control DMSO (IM = 46,59 ± 3,44). Sólo dos de los extractos E5 fueron citotóxicos (S1= 42,73 ± 2,78 y S2 = 53,69 ± 1,91) (Tabla 5). En el primer caso se observó una significativa reducción en la división celular, lo que podría estar indicando la presencia de ciertos compuestos químicos capaces de inhibir el crecimiento y desarrollo normal de los tejidos expuestos (Leme y Marin-Morales, 2009). Las diferencias observadas en ambos tipos de extractos orgánicos podrían deberse a la utilización de distintos solventes de extracción. El DCM es un solvente muy poco polar, lo que favorecería la extracción de compuestos orgánicos no polares, tales como plaguicidas, HAPs y bifenilos policlorados (PCBs), mientras que el metanol es un solvente polar que permite extraer en mayor proporción los compuestos orgánicos relativamente más polares, tales como los pesticidas organofosforados. Según los datos obtenidos por ACUMAR (2012), los sedimentos de la cuenca Matanza-Riachuelo presentan pesticidas organoclorados, tales como hexaclorobenceno, los cuales podrían estar presentes en los extractos metanólicos.
Los extractos orgánicos E4 y E5 mostraron genotoxicidad en las cuatro estaciones, tanto en las frecuencias de AC como de MN (Tabla 5). Solamente en el extracto E4 del sitio S4 no se observaron diferencias estadísticamente significativas con respecto al control DMSO en las frecuencias de AC. Los extractos E4 (frecuencias AC = 6,69 ± 3,94 - 16,52 ± 10,81 y MN = 0,68 ± 0,38 - 4,05 ± 1,48) fueron más genotóxicos que los E5 (frecuencias AC = 1,72 ± 2,16 - 4,18 ± 4,22 y MN = 0,51 ± 0,14 - 0,87 ± 0,27). El análisis de correlación mostró que algunos HAPs (fuoranteno, benzo(a)antraceno, criseno, benzo(a)pireno, indeno(1,2,3-cd)pireno y benzo(g,h,i)perileno) estuvieron negativamente correlacionados con las frecuencias de MN para los E4 (Tabla 7).
Tabla 7. Correlaciones entre los IM y los parámetros de genotoxicidad (frecuencias de AC y MN) medidos en A. cepa, y las concentraciones de HAPs determinadas en los extractos orgánicos utilizando la matriz de correlación de Pearson (p<0,05).
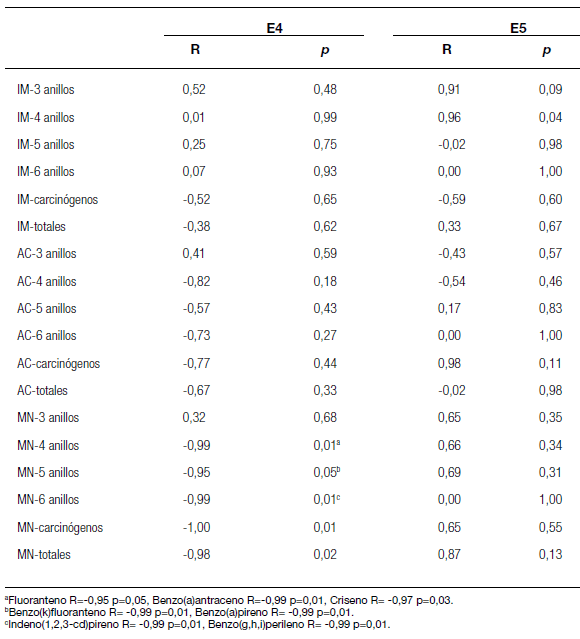
Estas correlaciones negativas estarían indicando algún tipo de efecto antagónico entre esos compuestos. Si bien existen pocos estudios acerca de los efectos sinérgicos y/o antagónicos sobre la mutagenicidad de los HAPs cuando se encuentran en mezclas, Cherng y col. (1996) reportaron efectos antagónicos del 1-nitropireno sobre la mutagenicidad cuando dicho compuesto se encuentra en mezclas binarias con otros compuestos HAPs, tales como coroneno, benzo(g,h,i) perileno, benzo(e)pireno, dibenzo(a,h)pireno, benzo(a)pireno, pireno, naftaleno y criseno.
Varios autores mostraron que el ensayo de A. cepa es sensible a la presencia de HAPs en muestras ambientales, tales como efluentes industriales (Odeigah y col. 1997), aguas superficiales de ríos contaminados por hidrocarburos del petróleo (Leme y Marin-Morales 2008) y mezclas complejas de hidrocarburos (Leme y col. 2008). Estos autores sugieren que la mutagenicidad observada y los posibles riesgos asociados en muestras de suelo, no pueden ser explicados solamente a las mediciones de HAPs. Por lo cual se puede considerar que tanto la citotoxicidad y la genotoxicidad observados en este ensayo se deben tanto a la presencia de HAPs como a otros compuestos orgánicos que podrían estar presentes en los extractos, así como a las interacciones sinérgicas y/o antagónicas que podrían producirse entre los componentes de la mezcla compleja.
Conclusiones
En el presente trabajo se analizó la genotoxicidad en muestras de sedimentos de la cuenca Matanza-Riachuelo a través de la obtención de cinco extractos (tres inorgánicos y dos orgánicos) y la utilización de dos ensayos (Ames y A. cepa). Las mayores concentraciones de metales pesados se encontraron en los sitios S4 (Zn, Cr y Cu) y S2 (Pb), mientras que las mayores concentraciones de HAPs se obtuvieron en S4. La solución ácida fue más efectiva en la extracción de metales pesados que el agua destilada, y el DCM fue más efectivo en la extracción de mayor cantidad de compuestos HAPs que el metanol, pero este último extrajo compuestos en mayor concentración. Esto sugiere la conveniencia de utilizar solución ácida para la extracción de contaminantes inorgánicos y una mezcla de DCM y metanol para la extracción de contaminantes orgánicos. Si bien el Riachuelo (cuenca baja) fue el sitio que mostró mayor contaminación, no pudo observarse una clara relación entre los diferentes usos del suelo y los niveles de contaminantes en los otros tres sitios. De los dos ensayos utilizados, el ensayo con A. cepa fue más sensible en la detección de genotoxicidad que el de Ames. Según el ensayo de A. cepa, los extractos ácidos obtenidos con el método de agitación mostraron mayor genotoxicidad que los extractos ácidos obtenidos por sonicación. Asimismo, los extractos en DCM fueron más genotóxicos que la extracción con metanol para los dos bioensayos utilizados. Una correlación negativa entre fuoranteno, benzo(a)antraceno, criseno, benzo(a) pireno, indeno(1,2,3-cd)pireno y benzo(g,h,i) perileno y la frecuencia de MN podría indicar la presencia de efectos antagónicos con otros compuestos genotóxicos. Independientemente del uso del suelo, todos los sitios estudiados mostraron un potencial riesgo genotóxico para el ecosistema acuático.
Agradecimientos
Este trabajo fue realizado con el apoyo de la Universidad de Buenos Aires, UBACyT N° 20020130100601BA. Los autores también agradecen a La Consulta, INTA de la Provincia de Mendoza, por la donación de semillas de Allium cepa, y a la Srta. Amalia González por el diseño del mapa de la cuenca Matanza-Riachuelo
Bibliografía citada
1. American Public Health Association, American Water Works Association, Water Environment Federation (APHA-AWWA-WPCF). Standard Methods for the examination of water and wastewater. 22nd Edition. USA. 2012. [ Links ]
2. Ames B.N., Durston W.E., Yamasaki E., Lee F.D. Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection. Proc Natl Acad Sci. USA 1973;70:2281-2285. [ Links ]
3. Autoridad de la Cuenca Matanza-Riachuelo (ACUMAR). Cuenca Matanza Riachuelo: Estado del agua superficial, subterránea y calidad del aire. [en línea]. [consulta febrero 2015]; 2012:[21 p.] Disponible en: http://www.acumar.gov.ar/Informes/Control/CalAmb/Julio2012/CDCA_ACUMAR_ INFO_INSTITUCIONAL _JULIO_2012.pdf. [ Links ]
4. Beyersmann D., Hartwig A. Carcinogenic metal compounds: recent insight into molecular and celular mechanisms. Arch Toxicol. 2008;82:493-512. [ Links ]
5. Borboa L., De La Torre C. The genotoxicity of Zn(II) and Cd(II) in Allium cepa root meristematic cells. New Phytol. 1996;134:481-486. [ Links ]
6. Canadian Council of Ministers of the Environment. Canadian sediment quality guidelines for the protection of aquatic life: Introduction. Updated. In: Canadian environmental quality guidelines, 1999, Canadian Council of Ministers of the Environment, Winnipeg. 2001. [ Links ]
7. Cappi da Costa T., Tagliari de Brito K.C,, Vaz Rocha J.A., Leal K.A., Kolowski Rodrigues M.L., Gomes Minella J.P., Matsumoto S.T., Vargas V.M.F. Runoff. Of Genotoxic Compounds In River Basin Sediment Under The Influence Of Contaminated Soils. Ecotoxicol Environ Saf. 2012;75(1):63-72. [ Links ]
8. Chen G., White P.A. The mutagenic hazards of aquatic sediments: a review. Mutat Res. 2004;567:151-225. [ Links ]
9. Cherng S.H., Lin S.T., Lee H. Modulatory effects of polycyclic aromatic hydrocarbons on the mutagenicity of 1-nitropyrene: a structure-activity relationship study. Mutat Res. 1996;367:177-185. [ Links ]
10. Codina J.C., Pérez-Torrente C., Pérez-García A., Cazorla F.M., de Vicente A. Comparison of microbial tests for the detection of heavy metal genotoxicity. Arch Environ Contam Toxicol. 1995;29(2):260-5. [ Links ]
11. Courty B., Curieux F.L., Belkessam L., Laboudigue A., Marzin D. Mutagenic potency in Salmonella typhimurium o forganic extracts of soil samples originating from urban, suburban, agricultural, forest and natural areas. Mutat Res. 2008;653:1–5.
12. de Souza Pohren R., Vaz Rocha J.A., Leal K.A., Ferrão Vargas V.M. Soil mutagenicity as a strategy to evaluate environmental and health risks in a contaminated area. Environ Internat. 2012;44:40-52. [ Links ]
13. Di Giorgio C., Malleret L., Gueydon-Morin C., Rigaud S., De Méo M. Comparison of two extraction procedures for the assessment of sediment genotoxicity: Implication of polar organic compounds. Mutat Res. 2011;725:1-12. [ Links ]
14. Ducatti A., Vargas V.M.F. Mutagenic activity of airborne particulate matter as an indicative measure of atmospheric pollution. Mutat Res. 2003:540:67-77. [ Links ]
15. Fatima R. A., Ahmad M. Genotoxicity of industrial wastewaters obtained from two different pollution sources in norttherm India: a comparison of three bioassays. Mutat Res. 2006;609:81-91. [ Links ]
16. Fiskesjö G. The Allium test – An alternative in environmental-studies – The relative toxicity of metalions. Mutat Res. 1988;197:243-260.
17. Fiskesjö G. The Allium test as standard environ-mental monitoring. Hereditas. 1985;102:99-112. [ Links ]
18. Grant W.F. The present status of higher plant bioassays for detection of environmental mutagens. Mutat Res. 1994;310:175-185. [ Links ]
19. Horn R., Vargas V.M.F. Mutagenicity and antimutagenicity of teas used in popular medicine in the Salmonella/microsome assay. Toxicol In Vitro. 2008;22:1143-1149. [ Links ]
20. Inceer H., Beyazoglu O., Ergul H.A. Cytogenetic effects of wastes of copper mine on root tip cells of Allium cepa L. Pak. J Biol Sci. 2000;3:376–377.
21. International Agency for Research on Cancer (IARC) Monographs, Supplement. [en línea]. 2011. [consulta febrero 2015]. Disponible en: http://monographs.iarc.fr/ENG/Classification/index.php. [ Links ]
22. Klamer H.J.C., Leonards P.E.G., Lamoree M.H., Villerius L.A., Kerman J.E., Bakker J.F. A chemical and toxicological profile of Dutch North Sea surface sediments. Chemosphere. 2005;58:1579-1587. [ Links ]
23. Leme D.M. y Marin-Morales M.A. Allium cepa test in environmental monitoring: a review on its application. Mutat Res. 2009;682:71-81. [ Links ]
24. Leme D.M., Angelis D.F., Martin-Morales M.A. Action mechanisms of petroleum hydrocarbons present in waters impacted by an oil spill on the genetic material of Allium cepa root cells, Aquat Toxicol. 2008;88:214-219. [ Links ]
25. López L.C., Bassi M.D., Moretton J. Infuence of river water in the detection of Cr (VI) mutagenicity by Ames Test. Bull Enviorn Contam Toxicol. 1998;63:438-443. [ Links ]
26. Magdaleno A., Juárez A.B., Dragani V., Saenz M.E., Paz M., Moretton J. Ecotoxicological and Genotoxic Evaluation of Buenos Aires City (Argentina) Hospital Wastewater. J Toxicol. 2014; Art.ID 24846:11-10. doi:10.1155/2014/248461. [ Links ]
27. Magdaleno A., Juárez A.B., Paz M., Tornello C., Núñez L., Moretton J. Evaluación ecotóxica y genotóxica de aguas residuales hospitalarias. Acta Toxicol. 2012;20(1):14-24. [ Links ]
28. Magdaleno A., Mendelson A., Fabrizio de Iorio A., Rendina A., Moretton J. Genotoxicity of leachates from highly polluted lowland river sediments destined for disposal in landfll. Waste Manage. 2008;28:2134-2139. [ Links ]
29. Maron D.M., Ames B.N. Revised methods for the Salmonella mutagenicity test. Mutat Res. 1983;113:173-215. [ Links ]
30. Matsumoto S.T., Mantovani M.S., Malagutti M.I.A., Dias A.L., Fonseca I.C., Marin-Morales M.A. Genotoxicity and mutagenicity of water contaminated with tannery effluents, as evaluated by the micronucleus test and comet assay using the fish Oreochromis niloticus and chromosome aberrations in onion root-tips. Genet Mol. 2006;29:148-158. [ Links ]
31. Mendoza R.E., García I.V., de Cabo L., Weigandt C.F., Fabrizio de Iorio A. The interaction of heavy metals and nutrients present in soil and native plants with arbuscular mycorrhizae on the riverside in the Matanza-Riachuelo River Basin (Argentina). Sci Total Environ. 2015;505:55-564. [ Links ]
32. Minissi S., Caccese D., Passafume F. , Grella A., Eleonora C., Rizzoni M. Mutagenicity (micronucleus test in Vicia faba root tips), polycyclic aromatic hydrocarbons and heavy metal content of sediments collected in Tiber river and its tributaries within the urban area of Rome. Mutat Res. 1998;420:77-84. [ Links ]
33. Mortelmans K., Zeiger E. The Ames Salmonella/microsome mutagenicity assay. Mutat Res. 2000;455:29-60. [ Links ]
34. Odeigah P.G.C., Nurudeen O., Amund O.O. Genotoxicity of oil field wastewater in Nigeria, Hereditas. 1997;126:161-167. [ Links ]
35. Ohe T., Watanabe T., Wakabayashi K. Mutagens in surface waters: a review. Mutat Res. 2004;567:109-149. [ Links ]
36. Rendina A., Bargiela M., de Cabo L., Arreghini S., Fabricio de Iorio A. Formas geoquímicas de metales pesados en sedimentos del río Matanza y principales afluentes. Rev Mus Argentino Cienc Nat. 2001;3(1):33-39. [ Links ]
37. Rodrigues da Silva Júnior F.M., Vaz Rocha J.A., Ferrão Vargas V.M. Extraction parameters in the mutagenicity assay of soil samples. Sci Total Environ. 2009;407:6017-6023. [ Links ]
38. Vargas V.M.F., Magliavacca S.B., Horn R.C., Terra N.R. Comparative temporal ecotoxicological study in a river basin infuenced by petrochemical industries. Sci Total Environ. 2008;392:79-92. [ Links ]
39. Watanabe T., Hasei T., Takahashi T., Asanoma M., Murahashi T., Hirayama T. Detection of a novel mutagen, 3,6-dinitrobenzo[e]pyrene, as a major contaminant in surface soil in Osaka and Aichi Prefectures, Japan. Chem Res Toxicol. 2005;18:283-289. [ Links ]
40. Watanabe T., Takahashi K., Konishi E., Hoshino Y. , Hansei T., Asanoma M. Mutagenicity of surfaces oil from residential areas in Kyoto city, and identification of major mutagens. Mutat Res. 2008;649:201-212. [ Links ]
41. White P.A. The genotoxicity of priority polycyclic aromatic hydrocarbons in complex mixtures. Mutat Res. 2002;515:85-98. [ Links ]
42. White P.A., Claxton L.D. Mutagens in contaminated soil: a review. Mutat Res. 2004;567: 227-345. [ Links ]
43. White P.A., Rasmussen J.B., Blaise C. Genotoxic substances in the St. Lawrence system I: Industrial genotoxins sorbed to particulate matter in the St. Lawrence, St. Maurice, and Saguenay Rivers, Canada. Environ Toxicol Chem. 1998;17:286-303. [ Links ]
44. Wyngaard N., Picone L., Videla C., Zamuner E., Maceira N. Impact of feedlot on soil phosphorus concentration. J Envir Protect. 2011;2:280-286. doi:10.4236/jep.2011.23031 [ Links ]














