Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. vol.24 no.3 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULOS ORIGINALES
Efecto citoprotector de extractos de Eugenia jambolana y Psidium myrsinites DC. A. contra peroxidación lipídica inducida por hierro II
Citoprotective effect of Eugenia jambolana and Psidium myrsinites DC. A. against the lipid peroxidation induced by iron II
Leite, Nadghia F.1; Sobral-Souza, Celestina E.1, Matias, Edinardo F.F.1,2; Alencar, Liscássia B.B.1; Albuquerque, Rosimeire S.1; Morais-Braga, Maria F.B.1; Souza, Erlanio O.3; Coutinho, Henrique D.M.1*
1Laboratório de Microbiologia e Biologia Molecular, Universidade Regional do Cariri,URCA, Crato(CE), Brasil.Rua Cel. Antonio Luis 1161, Pimenta, 63105-000.Fone:+55(88)31021212. 2Faculdade de Ciências Aplicadas Dr. Leão Sampaio, Juazeiro do Norte (CE), Brasil. 3Laboratório de Pesquisas em Produtos Naturais, Universidade Regional do Cariri, Crato (CE), Brasil.
*hdmcoutinho@gmail.com
Recibido: 16 de enero de 2015
Aceptado: 14 de septiembre de 2016
Resumen.
La evaluación de la actividad antioxidante ha sido una cuestión relevante teniendo en cuenta su importancia para la salud humana. Estudios recientes muestran que el uso de plantas en forma de jugos o tés como fuentes de antioxidantes naturales, que se pueden utilizar como complemento para el tratamiento de diversas enfermedades. En este contexto, evaluado el potencial antioxidante in vitro, de extractos de Eugenia jambolana Lam y Psidium myrsinites DC. A. y cuantificar fenoles y flavonoides presentes en los extractos. La peroxidación lipídica ha sido evaluada por la técnica de TBARS (sustancias reactivas al ácido tiobarbitúrico). De acuerdo con los resultados, mostraron una mejor actividad antioxidante del extracto de psidium myrsinites DC. A. Para poner a prueba TBARS con fosfolípido de huevo extrae redujo los niveles basales en el proceso de peroxidación de lípidos, la CI50 del extracto etanolico de Euguenia jambolana (EEFEJ) mostró los mejores resultados, con un más bajo valor de la CI50 en comparación con el extracto hidroetanolico de Psidium mirsinites, demostrado ser más efectivo. Por lo tanto, a través de estas pruebas se puede ver que los extractos de las hojas de la especie, Eugenia jambolana Lam y Psidium myrsinites DC. A., la actividad antioxidante de exposiciones, sustancias fenólicas directamente relacionados producidos a partir de su metabolismo secundario.
Palabras clave: Eugenia jambolana; Psidium myrsinites DC. A.; Metales pesados; Antioxidante.
Abstract.
The evaluation of the antioxidant activity has been a relevant and important issue to human health. Recent studies show that the use of plants juices or teas as sources of natural antioxidants, which can be used as an adjuvant in the treatment of several diseases. In this context, was evaluated the in vitro antioxidant potential of the extracts of Psidium myrsinites DC. and Eugenia jambolana Lam. The total of phenols and flavonoids were quantified in the extracts. Lipid peroxidation was evaluated by the technique of TBARS (thiobarbituric acid reactive substances). According to the results, was showed a better antioxidant activity in the extract of Psidium myrsinites DC. A. In the TBARS assay with egg phospholipid the extracts reduced the basal levels in the process of lipid peroxidation and the IC50 of ethanol extract of Eugenia jambolana (EEFEJ) showed the best results with a lower value of IC50 compared with hydroethanol extract of Psidium mirsinites, demonstrating be more effective. Therefore, through these tests can be seen that extracts from the leaves of the species, Eugenia and Psidium jambolana Lam myrsinites DC. A., exhibit antioxidant activity, directly related phenolic substances produced from the secondary metabolism.
Keywords: Eugenia jambolana Lam; Psidium myrsinites DC. A.; Heavy metals; Antioxidant.
Introducción
La evaluación de la actividad antioxidante ha sido una cuestión relevante teniendo en cuenta su importancia para la salud humana. Estudios recientes muestran que el consumo de plantas en forma de jugos o tés como fuentes de antioxidantes naturales, que se pueden uti lizar como una ayuda para el tratamiento de diversas enfermedades (Silva y col. 2005).
Además de las enfermedades crónicas, el estrés oxidativo también puede desempeñar un papel en la hepatotoxicidad aguda de varios medicamentos, incluyendo el analgésico y antipirético paracetamol utilizado en todo el mundo (Reid y col. 2005). Los estudios han demostrado que el uso de compuestos polifenólicos encontrados en el té, frutas y verduras se asocia con un menor riesgo de dicha enfermedad (Hertog y col. 1993). Por consiguiente, existe interés en las plantas comestibles que contienen antioxidantes y en la promoción de la salud del uso de fitoquímicos como agentes terapéuticos potenciales (Vieira y col. 1999).
El malondialdehído (MDA) ha sido el foco de atención de la peroxidación de lípidos durante muchos años, ya que puede medirse libre, usando el ácido tiobarbitúrico (TBA). El MDA reacciona con TBA y forma un cromógeno rosa fluorescente cuya absorción se mide a λ de 532 nm (Thérond y col. 2000).
Las plantas medicinales tienen varios compuestos químicos con potencial antioxidante. Entre éstas, los compuestos fenólicos han recibido mucha atención, sobre todo porque tienen una comprobada acción de inhibición de la actividad de la peroxidación lipídica y la lipoxigenasa in vitro (Sousa y col. 2007; Sun y col. 2012).
Los antioxidantes son sustancias químicas que reaccionan con los radicales libres limitando de este modo los efectos adversos en el organismo. El cuerpo humano tiene la capacidad de producir ciertos antioxidantes endógenos, pero la mayoría de ellos provienen de los alimentos ingeridos (Borguini y Torres 2009).
La Eugenia jambolana Lam. (Myrtaceae), conocido como de oliva, se utiliza como un alimento y en la medicina tradicional como antimicrobiano (Holetz y col. 2002), y ha sido ampliamente estudiado por sus propiedades antioxidantes, el potencial hipoglucémico e hipotensor (Souza y col. 2004).
Psidium myrsinites DC. A., también conocida como guayaba, tiene uso médico, ya que mejora la cicatrización de heridas, y como alimentos, en la fabricación de jugos y jaleas. Se puede encontrar en los estados de Ceará, Bahia, Tocantins, Goiás, Mato Grosso, Maranhão, Piauí y el Distrito Federal. En su aceite esencial está presente una sustancia usada en la composición de perfumes, linalol (Medio Ambiente, Brasil 2009).
Este estudio tuvo como objetivo determinar el potencial antioxidante de los extractos in vitro por DPPH (difenil-picrilhidrazil) y TBARS (sustancias reactivas al ácido tiobarbitúrico), y cuantificar los fenoles y flavonoides presentes en los extractos.
Materiales y métodos
Fenoles
La cantidad de fenoles se determinó mediante la adición de 200 μl de solución de extractos (300, 100, 50 y 25 mg/ml en etanol 99,6 %) a 1 ml de reactivo de Folin-Ciocalteu (10 % v/v) y se agitó durante 1 minuto. A continuación, se añadieron 800 μL de carbonato de sodio 7,5 % y se homogeneizó durante 30 segundos. Después de 1 hora se midió la absorbancia en un espectrofotómetro a una longitud de onda de 765 nm. El blanco se determinó con todos los reactivos, pero el extracto se sustituyó por agua destilada. La prueba se realizó por triplicado. La media de tres lecturas se utilizó para determinar los fenoles expresados como mg equivalentes de ácido gálico/g de extracto, obteniéndose este valor mediante la interpolación de la curva patrón construida con ácido gálico estándar. La curva de calibración de ácido gálico se determinó usando diferentes concentraciones de esa sustancia (300, 100, 75, 25 y 10 mg/ml).
Flavonoides
Se prepararon soluciones de extracto (300, 200, 100 y 50 mg/ml) a los cuales se les adicionó 1 ml de cloruro de aluminio (AlCl3) en una concentración con 2 % peso/volumen. Paralelamente se realizó un blanco con agua destilada. Después de 30 minutos de incubación a temperatura ambiente, se midió en espectrofotómetro la absorbancia a 415 nm. La prueba se realizó por triplicado, se calculó el promedio para determinar la cantidad de flavonoides totales los cuales fueron expresados en miligramos de equivalentes de quercetina/ g de extracto. La curva de calibración de quercetina se determinó usando diferentes concentraciones de esa sustancia (400, 300, 200, 100, 50, 25 y 10 mg/ml) diluidos en etanol 99,6 %.
Actividad antioxidante
Se prepararon soluciones con diferentes concentraciones de cada extracto de Eugenia jambolana Lam. y Psidium myrsinites DC. A. (250, 125, 50, 25, 10 y 5 mg/ml) por triplicado. En un tubo se mezclaron 100 ml de la solución de extracto y 3,9 ml de 2,2-difenil-1-picrilo-hidrazila (DPPH) y se homogeneizaron en agitador, en oscuridad. En el blanco, la muestra fue reemplazada con 100 ml de metanol. Las lecturas fueron tomadas con una longitud de onda de 520 nm y se repitieron cada minuto has ta que se observó estabilización de la lectura. La curva estándar se determinó mediante la realización de la medición en la misma longitud de onda (520 nm), pero con las soluciones de DPPH a diferentes concentraciones (10 μM, 20 μM, 30 μM, 40 μM, 50 μM y 60 μM) (Sánchez- Moreno y col. 1998; Rufino y col. 2007)
TBARS
La peroxidacion de los fosfolípidos por TBARS se determinó usando el método de Ohkawa y col. (1979) con modificaciones. Una solución de yema de huevo fue mezclada con una solución de hexano-isopropanol (3:2). Esta solución se filtró y en Rotavapor se concentró hasta obtener un residuo sólido. Se tomaron 0,05 g del residuo y se adicionaron para solubilizarlo 10 ml de agua Milli-Q. Para pre-incubación de 100 μl se utilizó fosfolípido, 50 ml de extracto a concentraciones de 100, 40, 10, 4 μg/ml con un volumen adecuado de agua desionizada. Las muestras se repitieron mediante la adición de 14 μl de Fe (60 μM) y se incubaron a 37 °C durante 1 h. Después de la preincubación se añadió 500 μl de ácido acético y 500 μl de TBA (ácido tiobarbitúrico) 0,6 % y se incubó durante 1 hora a una temperatura de 100 °C. A los tubos se añadieron 2 ml de n-butanol y la mezcla se centrifugó. El sobrenadante se retiró y se midió la absorbancia a 532 nm en un espectrofotómetro. Para la curva de MDA se utilizaron (malondialdehído) 500 μl de ácido acético, 500 μl de TBA (0,6 %), cantidades adecuadas de MDA para obtener concentraciones crecientes de MDA y de agua destilada para completar un volumen de 1,5 ml. El ensayo se realizó por triplicado y se repitió dos veces.
Evaluación del potencial de extracto etanólico de Eugenia jambolana (EEFEJ) y Extracto hidroetanólico de Psidium myrsinites (EHFPM) como citoprotector contra los metales pesados
Según Coutinho y col. (2008) modificado, las concentraciones inhibitorias mínimas (CIM) de EEFEJ y EHFPM se determinaron por el ensayo de microdilución usando suspensiones de 105 UFC/ml en solución salina y los extractos de la concentración inicial de 1024 μg/ml. La MIC se definió como la concentración más baja a la que no se observó crecimiento. Para evaluar el efecto protector EEFEJ y EHFPM a metales pesados, se ha realizado mediante una modulación de concentraciones subinhibitorias de los extractos, suspensiones de 105 UFC/ml de Escherichia coli ATCC 11105 y Candida albicans 62 en medio M9 Tris con 2 % de glucosa y una concentración de sulfato de hierro II que va desde 100 mM a 0,0488 mM. Las placas de microdilución se incubaron durante 48 horas a 37 °C. La concentración bactericida mínima (CBM) y la concentración fungicida mínima (MFC) se determinó como la menor concentración capaz de eliminar todos los microorganismos.
Resultados y discusión
Los resultados de la Tabla 1 muestran que la cantidad de compuestos fenólicos en los extractos de las plantas fue de 322,96 mg/g y 557,16 mg/g para EEFEJ y EHFPM, respectivamente. La cantidad de flavonoide fue mayor en el extracto de Eugenia jambolana Lam.
Tabla 1. Concentraciones totales de fenoles y los flavonóides en EEFEJ Y EHFPM

La actividad antioxidante se midió con el método de DPPH y el resultado se expresó como valor de EC50 siendo de 96,81 mg/ml y 7,52 mg/ml, para Eugenia jambolona Lam. y para Psidium myrsinites DC. A., respectivamente (Tabla 2). Cuanto menor sea el valor de EC50, mayor es el poder antioxidante. Por lo tanto, la EHFPM muestra a ser más eficaz como antioxidante en relación a EEFPJ, lo cual podría estar relacionado con la alta presencia de compuestos fenólicos. Iha y col. (2008), muestra en su trabajo que la especie Psidium guajava L. presenta una actividad antioxidante considerable cuando se compara con las sustancias ensayadas como estándar. Cuando P. guajava obtiene una CE50 de 0,15 mg/g y comparando el resultado de este trabajo, la especie P. guajava tiene una mejor actividad antioxidante que P. myrsinites.
Tabla 2. Valores de actividad y valores antioxidante y CL50 CE50 DE EEFEJ Y EHFPM
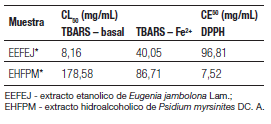
La CL50 se calculó a partir de datos obtenidos a partir de pruebas de la peroxidación lipídica (TBARS). EEFEJ mostró el mejor resultado, reduciendo la peroxidación lipídica inducida en el ensayo (Tabla 2; Figura 1).
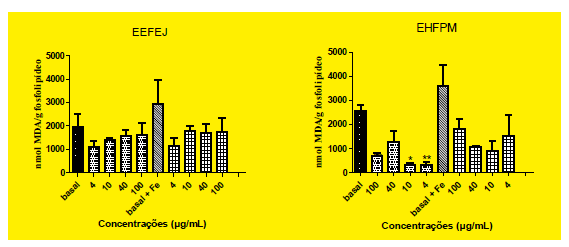
Figura 1. Propiedades antioxidantes de EEFEJ Y EHFPM. La peroxidación lipídica (TBARS producción) en fosfolípidos de huevo se determinó en ausencia o presencia de Fe2+ (10 mM). Los valores se expresan como media ± SEM de 2 experimentos independientes realizados por triplicado. *p <0,05 vs Fe2+ inducida, **p <0,01 vs Fe2+ inducida. EEFEJ - extracto etanolico de Eugenia jambolona Lam.; EHFPM – extracto hidroalcoholico de Psidium myrsinites DC. A.
Este ensayo reveló una inhibición del proceso de peroxidación lipídica con fosfolípidos de huevo. Esta reducción fue considerada más significativo para EHFPM, demostrando concentraciones de mayor importancia que las de EEFEL (respectivamente 4 μg/ml y 10 μg/ml).
La gran cantidad de compuestos fenólicos puede explicar el efecto antioxidante de EHFPM ya que la actividad antioxidante de los compuestos fenólicos es por la inhibición de la peroxidación lipídica. Esta actividad es dependiente de la estructura de las moléculas, así como el número y la posición del grupo hidroxilo. Los compuestos fenólicos (sobre todo flavonoides) son capaces de alterar la cinética de la peroxidación mediante la alteración de la organización de los compuestos lipídicos. Ellos son estabilizados por las membranas por disminución de la fluidez evitando la difusión de los radicales libres y restringiendo la reacción de peroxidación (Michalak 2006). Un estudio realizado por Mazzanti (2003) indica que no hay efecto antiperoxidativo en el extracto de corteza de Syzygium cumini (Eugenia jambolana Lam.).
El hierro es el segundo metal más abundante, pero sin embargo tiene una baja solubilidad en entornos aeróbicas a pH fisiológico y en la célula (Crichton 1991). Por lo tanto, este elemento es por lo general el límite de disponibilidad de diferentes procesos metabólicos celulares, que luego se retira de la atmósfera y se almacena en proteínas para evitar deficiencias que pueden conducir a la muerte celular (Brickman y Armstrong 1995).
Conclusión
Se evaluó la actividad antioxidante de los extractos de Eugenia jambolana y Psidium myrsinites, junto con su contenido de fenoles y flavonoides. En las pruebas de la captura de radicales libres DPPH se observó una mejor actividad antioxidante en EHFPM que está relacionado con el alto contenido de compuestos fenólicos. Para probar TBARS con fosfolípido de huevo los extractos redujeron los niveles basales en el proceso de peroxidación de lípidos, y cuando fue inducido por el Fe2+ EHFPM fue más eficiente. El extracto de E. jambolana Lam. mostró una CL50 con un valor más bajo. Por lo tanto, a través de estas pruebas se puede ver que los extractos de las hojas de E. jambolana Lam y Psidium myrsinites DC. A. mostraron actividad antioxidante, y podría estar relacionado con las sustancias fenólicas producidas a partir de su metabolismo secundario. Los extractos también no mostraron ningún potencial citoprotector contra el hierro II.
Bibliografía citada
1. Ambiente Brasil, Pesquisa da UnB descobre componente de perfume em planta do cerrado. 2009. [consultado 6 de abril 2012]. Disponible en http://noticias.ambientebrasil.com.br/clipping/2009/03/09/44154-pesquisa-daunb-descobre-componente-de-perfume-em-planta-do-cerrado.html. [ Links ]
2. Borguini R.G., Torres E.F.S. Tomatoes and tomato products as dietary sources of antioxidants. Food Rev Int. 2009; 25: 313-325. [ Links ]
3. Brickman T.J., Armstrong S.K., Bortella pertussis fur gene restores iron repressibility of siderophore and protein expression to dere gulated Bortella bronchiseptica mutants. J Bacteriol. 1995;177:268-270. [ Links ]
4. Coutinho H.D.M., Costa J.G.M., Lima E.O., Falcão-Silva V.S., Siqueira-Júnior J.P. Enhancement of the Antibiotic Activity against a Multiresistant Escherichia coli by Mentha arvensis L. and Chlorpromazine. Chemotherapy. 2008;54:328–330.
5. Crichton R.R. Inorganic biochemistry of iron metabolism. West Sussex: Ellis Horwood; 1991. [ Links ]
6. Hertog M.G.L., Hollman P.C.H., Van P.B. Content of potentially anticarcinogenic flavonoids of tea infusions, wines and fruit juices. J Agr Food Chem. 1993;41:1242-1246. [ Links ]
7. Holetz F.B., Pessini,G.L., Sanches N.R., Cortez D.A., Nakamura C.V., Filho B.P. Screening of some plants used in the Brazilian folk medicine for the treatment of infectious diseases. Mem Inst Oswaldo Cruz. 1997;97:1027–1031.
8. Iha S.M., Migliato K.F., Vellosa J.C.R., Sacramento L.V.S., Pietro R.C.L.R., Isaac V.L.B., Brunetti I.L., Corrêa M.A., Salgado H.R.N. Estudo fitoquímico de goiaba (Psidium guajavaL.) com potencial antioxidante para o desenvolvimento de formulação fitocosmética. Rev Bras Farmacogn. 2008;18:387-393. [ Links ]
9. Mazzanti C.M., Schossler D.R., Filappi A., Prestes D., Balz D., Miron V., Morsch A., Schetinger M.R.C., Morsch V.M. Cecim M. Extrato da casca de Syzygium cumini no controle da glicemia e estresse oxidativo de ratos normais e diabéticos. Ciênc Rural. 2003;33:1061-1065. [ Links ]
10. Michalak, A. Phenolic compounds and their antioxidant activity in plants growing under heavy metal stress. Pol J Environ Stud. 2006; 15:523-530. [ Links ]
11. Ohkawa H., Ohishi H., Yagi K. Assay for lipid peroxyde in animal tissues by thiobarbituric acid reaction. Analytical Biochem. 1979;95:351-358. [ Links ]
12. Reid A.B., Kurten R.C., McCullough S.S., Brock R.W., Hinson J.A. Mechanism of acetaminophen- induced hepatotoxicity: Role of oxidative stress and mitochondrial permeability transition in freshly isolated mouse hepatocytes. J Pharmacol Ther Exp. 2006;312:509–516.
13. Rufino M., Alves R., Brito E., Morais S., Sampaio C., Jimezes-Perez J., Saura-Calixto F. Metodologia Científica: Determinação da Atividade Antioxidante Total em Frutas pela Captura do Radical Livre DPPH. Fortaleza: Embrapa Agroindústria Tropical; 2007. [ Links ]
14. Sanchez-Moreno J.A., Larrauri F., Saura-Calixto F. A procedure to meausure the antiradical efficiency of polyphenols. J Sci Food Agr. 1998;76:270–276.
15. Silva C.G., Herdeiro R.S., Mathias C.J., Panek A.D., Silveira C.S., Rodrigues V.P., Rennó M.N., Falcão D.Q., Cerqueira D.M., Minto A.B.M., Nogueira F.L.P., Quaresma C.H., Silva J.F.M., Menezes F.S., Eleutherio E.C.A. Evalution of antioxidant activity of Brazilian plants. Pharmacological Res. 2005;52:229-233. [ Links ]
16. Sousa C.M.M., Silva H.S., Vieira-Jr. G.M., Ayres M.C.C., Costa C.L.S., Araújo D.S., Cavalcante L.C.D., Barros E.D.S., Araújo P.B.M., Brandão M.S., Chaves M.H. Fenóis totais e atividade antioxidante de cinco plantas medicinais. Quím Nova. 2007;30:351-355. [ Links ]
17. Sun J., Shao-Fang L., Chu-Shu Z., Li-Na Y., Jie B., Feng Z., Qing-Liy. Chemical composition and antioxidant activities of Brussonetia papyfera fruits. Plos One. 2012;7:1-8. [ Links ]
18. Thérond P., Bonnefont-Rousselot D., Davit- Spraul A., Conti M., Legrand A. Biomarkers of oxidative stress: an analytical approach. Curr Opin Clin Nutr Metab Care. 2000;3:373-384. [ Links ]
19. Vieira R.F. Conservation of medicinal and aromatic plants in Brazil. In: Perspective in new crops and new uses. Janick J. (ed). Alexandria: AHS press; 1999. [ Links ]














