Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta toxicológica argentina
versión On-line ISSN 1851-3743
Acta toxicol. argent. vol.26 no.1 Ciudad Autónoma de Buenos Aires mayo 2018
ARTÍCULOS ORIGINALES
Validación de un método para la determinación del ácido 3-fenoxibenzoico en orina por QuEChERS, microextracción líquido-líquido dispersiva y cromatografía líquida de alta resolución-arreglo de diodos
Validation of a method for the determination of 3-phenoxybenzoic acid in urine using QuEChERS, microextraction liquid-liquid dispersive and high-performance liquid chromatography-diode array
Herrero, Florencia; Rodríguez, María Soledad; Cañas, Ana Irene; Lucero, Patricia Antonia
Unidad Agroquímicos. Centro de Excelencia en Productos y Procesos de Córdoba (CEPROCOR). Ministerio de Ciencia y Tecnología de Córdoba.
Recibido: 9 de enero de 2018
Aceptado: 10 de mayo de 2018
Resumen
Los piretroides son insecticidas ampliamente usados no sólo en el ámbito agropecuario y doméstico sino también en salud pública. Una vez absorbidos, son rápidamente metabolizados a compuestos polares eliminados por vía renal. Uno de los metabolitos común a un gran número de piretroides es el ácido 3-fenoxibenzoico (3-PBA) el cual es utilizado como marcador de exposición. Se presenta en este trabajo, la validación de una metodología analítica para la determinación del 3-PBA utilizando QuEChERS acoplado a microextracción líquido-líquido dispersiva con tricloroetileno como disolvente extractivo y cromatografía líquida de alta resolución con detector de foto-arreglo de diodos. La validación se realizó con muestras aisladas de orina de voluntarios adultos de ambos sexos sin exposición conocida y orina sintética. El método resultó lineal en el intervalo 9 μg L-1–79 μg L-1; los límites de detección y cuantificación fueron de 3 μg L-1 y 9 μg L-1, respectivamente. No se observaron señales de interferentes a los tiempos de retención del 3-PBA y del ácido 2-fenoxibenzoico (2-PBA), estándar interno, en las muestras de orina blanco. Las señales cromatográficas en las muestras enriquecidas fueron espectralmente homogéneas. Las precisiones intradiarias (RSDr%) (n= 5) para 9 μg L-1 estuvieron comprendidas entre 9,3%-9,9% y para 27 μg L-1 entre 5,9%-10,6%. Las precisiciones interdiarias (RSDint%) (n=15) para los mismos niveles de concentración fueron de 11,8% y 9,1%, respectivamente. El rango de porcentajes de recuperación para 9 μg L-1 fue de 87%-119% y para 27 μg L-1 de 70%-91%. Se evaluó la estabilidad del analito en la muestra y en el extracto. El analito resultó estable a -20 °C durante 7 días en la muestra y durante 1 día en el extracto. Los valores de incertidumbre relativa e incertidumbre expandida fueron evaluados mediante la ecuación de Horwitz, los resultados obtenidos fueron para el nivel 9 μg L-1 de 33% y 65% y para el nivel 27 μg L-1 de 28% y 55%. La aplicabilidad del método validado fue evaluada con muestras reales de personas sin exposición laboral conocida, quienes declararon haber usado insecticidas piretroides. El método resultó sensible y selectivo.
Palabras clave: Validación; Ácido 3-fenoxibenzoico; Piretroides; Orina.
Abstract
Pyrethroid insecticides are used not only in the agricultural and domestic environment, but also in public health. Once absorbed, they are rapidly metabolized into polar compounds eliminated by the kidneys. One of the metabolites common to many pyrethroids is 3-phenoxybenzoic acid (3-PBA) which are used to evaluate exposure. We present in this paper the validation of an analytical methodology for the determination of 3-PBA using QuEChERS coupled to dispersive liquid-liquid microextraction with trichloroethylene as an extractive solvent and high-performance liquid chromatography with a photodiode array detector. Validation was carried out with isolated samples of urine from adult volunteers of both sexes without exposure and synthetic urine. The method was linear in the interval 9 μg L-1-79 μg L-1; the limit of detection and quantitation were 3 μg L-1 and 9 μg L-1, respectively. Interfering signals were not observed in the blank urine samples and the chromatographic signals in the enriched samples were spectrally homogeneous. The within-run precision (RSDr%) (n = 5) for 9 μg L-1 were between 9.3%-9.9% and for 27 μg L-1 between 5.9%-10.6%. The between–run precision (RSDint%) (n = 15) for the same concentration levels were 11.8% and 9.1%, respectively. The recovery for 9 μg L-1 ranged from 87%-119% and for 27 μg L-1 from 70%-91 %. The stability of the analyte was evaluated in the sample and in the extract. The analyte in the sample was stable at -20 °C for 7 days and in the extract was stable for 1 day. The values of relative uncertainty and expanded uncertainty obtained by the Horwitz equation were 33% and 65% for 9 μg L-1, and 28% and 55% for 27 μg L-1. The applicability of the validated method was evaluated with real samples of people without known occupational exposure, who declared having used pyrethroid insecticides. The method was sensitive and selective.
Keywords: Validation; 3-phenoxybenzoic acid; Pyrethroids; Urine.
Introducción
Los insecticidas piretroides se desarrollaron como análogos estructurales del insecticida natural piretrina, que se encuentra en las flores de Chrysanthemum cinerariaefolium (Fortes y col. 2013). Los piretroides son ampliamente utilizados para controlar las plagas de insectos en agricultura y salud pública debido a su relativa seguridad para los humanos y alta potencia insecticida (Tsuji y col. 2012).
Químicamente, los piretroides son ésteres del ácido vinil ciclopropan carboxílico y un alcohol ciclopentanona, que en la mayoría de los casos es el 3-fenoxibenciloalcohol (Wielgomas y col. 2013). La mayoría de los piretroides son moléculas quirales y existen como mezclas de enantiómeros (Saillenfait y col. 2015).
El modo de acción de los piretroides en mamíferos es el mismo que en insectos, la alteración de los canales de sodio dependientes de voltaje. Estos se unen a la subunidad α del canal de sodio y retrasan la activación, así como la velocidad de inactivación (cierre) de este canal, lo que lleva a un estado de hiperexcitabilidad y despolarización de la membrana neuronal (Costa y col. 2008). Además de la neurotoxicidad, los piretroides, producen efectos negativos en la reproducción de mamíferos, son inmunotóxicos y se ha informado que probablemente sean cancerígenos para los humanos (Trunnelle y col. 2014).
La población general se encuentra potencialmente expuesta a piretroides principalmente a través del consumo de alimentos, pero la exposición también podría ocurrir por inhalación y absorción dérmica, especialmente después del uso doméstico de estos plaguicidas (Fortin y col. 2008). Se ha reportado la exposición ocupacional de trabajadores en plantas de producción de formulados de plaguicidas y de aplicadores durante las operaciones de control de plagas (Saillenfait y col. 2015).
Una vez absorbidos, los piretroides son rápidamente metabolizados por escisión hidrolítica del enlace éster a compuestos polares y eliminados por vía renal. La presencia de metabolitos en la orina refleja exposición reciente. La fracción alcohol del grupo de piretroides que incluye permetrina, cipermetrina, deltametrina, fenvalerato, lambda-cialotrina, fenotrina, cifenotrina, fluvalinato y tralometrina se metaboliza a ácido 3-fenoxibenzoico (3-PBA) (Figura 1).

Figura 1. Hidrólisis de piretroides a ácido crisantémico y ácido 3-fenoxibenzoico (3-PBA).
Este ácido forma conjugados principalmente con ácido glucurónico para poder ser eliminado por orina (Bartosz y col. 2014). Este metabolito urinario es un biomarcador genérico y útil para evaluar exposición humana a piretroides (Chuang y col. 2011; Glorennec y col. 2017).
Schettgen y col. (2016), en un estudio piloto, analizaron muestras de orina de 38 personas de la población general para investigar posibles niveles basales de 8 biomarcadores de exposición a piretroides. Detectaron en todas las muestras cantidades cuantificables de 3-PBA, con un valor promedio de 0,22 μg L-1 siendo el valor máximo encontrado de 3,98 μg L-1. En otro trabajo, en el cual se analizaron 305 muestras de orina de niñas de entre 9 y 15 años, se detectaron en 270 muestras concentraciones de 3-PBA en el rango de 0,005 μg L-1 a 28,16 μg L-1 (Ye y col. 2017).
En Argentina no existen datos sobre niveles de biomarcadores de exposición a insecticidas piretroides. Por ello, sería conveniente contar con métodos analíticos para la determinación de 3-PBA y otros metabolitos de piretroides en orina suficientemente sensibles para evaluar la exposición a estas sustancias, dado su extendido uso.
Los biomarcadores de exposición a plaguicidas pueden estar presentes en la población general en concentraciones de pocos μg L-1, y en consecuencia su determinación requiere métodos analíticos sensibles y selectivos. Los métodos analíticos instrumentales desarrollados para determinar metabolitos de piretroides en orina se pueden dividir en: (a) métodos por cromatografía gaseosa, con detectores de captura de electrones o espectrometría de masas (Lin y col. 2011; Saito y col. 2014); (b) métodos por cromatografía líquida de alta resolu ción (HPLC), con detector de absorbancia uvvisible (Smith y col. 2002) o foto-arreglo de diodos (PDA) (Kumar y col. 2011; Wielgomas y col. 2013); y (c) ensayo por inmunoabsorción ligada a enzimas (ELISA) (Ahn y col. 2011; Chuang y col. 2011). Hoy en día, la cromatografía líquida- espectrometría de masas en tándem se ha convertido en la técnica analítica utilizada con mayor frecuencia para el biomonitoreo de plaguicidas en orina (Roca y col. 2014).
La preparación de la muestra es un paso clave del método analítico y se deben emplear procedimientos adecuados de extracción, limpieza del extracto y preconcentración. La técnica de extracción líquido-líquido (LLE) se ha utilizado en forma rutinaria durante muchos años, pero debido a que consume tiempo y demanda grandes cantidades de solvente, ha sido desplazada por técnicas miniaturizadas (Martínez Vidal y col. 2009; Boyd Barr y col. 2010; Tao y col. 2013). La microextracción líquido-líquido dispersiva (DLLME) permite la extracción y concentración simultánea de los analitos. Se fundamenta en el uso de un sistema ternario de solventes (la fase acuosa y una mezcla de dos solventes orgánicos) uno miscible con el agua, que funciona como agente dispersante, y otro inmiscible con agua y miscible con el agente dispersante, llamado agente extractante. Las 3 fases forman una emulsión, que incrementa al máximo la superficie de contacto entre ellas, favoreciendo así la rápida transición del analito entre la muestra y el extractante (Mudiam y col. 2014). Las principales ventajas de estas técnicas son simplicidad de operación, rapidez, bajo costo, fácil manejo, bajo consumo de solventes orgánicos, alta recuperación, alto factor de enriquecimiento y compatibilidad con cromatografía líquida y gaseosa (Bolzan y col. 2015).
La técnica QuEChERS (acrónimo inglés de Quick, Easy, Cheap, Effective, Rugged y Safe [rápido, fácil, económico, eficaz, sólido y seguro]) es muy flexible ya que puede ser modificada en función de las propiedades del analito, de la composición de la matriz y del equipamiento disponible. El procedimiento QuEChERS implica una extracción con acetonitrilo y una etapa de extracción/partición luego de la adición de una mezcla de sales (Lehotaya y col. 2010). Tradicionalmente es utilizada en la determinación de plaguicidas y sus metabolitos en alimentos, ya que resulta una técnica apropiada para la extracción y limpieza de matrices complejas y análisis simultáneo de múltiples analitos (Li y col. 2016). Esta técnica ha sido empleada para el análisis de biomarcadores de exposición a plaguicidas en orina humana (Roca y col. 2014).
El objetivo de este trabajo fue la validación de una metodología analítica usando QuEChERS, DLLME y HPLC con detector PDA para la determinación de 3-PBA en orina.
Materiales y métodos
Muestra biológica
Para la validación del método se colectaron muestras aisladas de orina de voluntarios adultos, de ambos sexos y sin exposición conocida laboral a insecticidas piretroides (orinas blanco, OB). Sin embargo, puesto que el principio activo de la mayoría de los insecticidas de uso doméstico es un piretroide o una mezcla de piretroides, fue difícil obtener muestras de orina blanco. Se hizo un procedimiento de selección para determinar que muestras de orina contenían concentraciones no detectables de 3-PBA. De 20 orinas analizadas se seleccionaron 6 que no tenían niveles detectables de 3-PBA para evaluar la selectividad. Por este motivo, para determinar algunos parámetros de la validación se utilizó una orina sintética (OS) preparada en el laboratorio (B´Hymer 2011; Ye y col. 2017).
Estándares y reactivos
Los estándares de 3-PBA y 2-PBA de pureza certificada (98%) fueron provistos por Sigma Aldrich. Para la preparación de la fase móvil y el tratamiento de las muestras se utilizaron los siguientes reactivos: acetonitrilo (Sintorgan, grado HPLC), ácido acético (Merck, EMSURE ®); tricloroetileno, cloruro de sodio y ácido clorhídrico (Cicarelli, grado Pro-análisis); tiras reactivas de orina (Wiener Lab.) y tiras de pH (Merck). Se empleó agua calidad HPLC obtenida mediante el sistema Milli-Q Plus®. Para la técnica de QuEChERS se utilizó para cada muestra: sulfato de magnesio anhidro (8 g) (Merck, ENSURE®), cloruro de sodio (2 g) (Cicarelli, pro-análisis), citrato de sodio (2,14 g) (Sigma-Aldrich, ACS®), citrato de sodio sesquihidratado (1 g) (Sigma Aldrich, Plus®).
Los reactivos necesarios para preparar un litro de orina sintética fueron: cloruro de potasio (3,80 g), cloruro de sodio (8,53 g), urea (24,5 g), sulfato de magnesio (1,03 g), fosfato de potasio (1,18 g), hidróxido de sodio (0,64 g), bicarbonato de sodio (0,47 g), todos marca Cicarelli, grado pro-análisis; ácido sulfúrico (0,496 g) (Merck, pro-análisis), ácido cítrico (1,03 g) (Sigma-Aldrich, ACS®), ácido ascórbico (0,34 g) (Sigma-Aldrich, BioXtra), crea tinina (1,40 g) (PUREST) y agua calidad HPLC (Milli-Q Plus®) (Gustafsson y Uzqueda 1978).
Equipamiento
Se empleó un Cromatógrafo Líquido Alliance 2690 Waters con detector de foto-arreglo de diodos (PDA) 996 Waters y sistema automático de registro de datos. El software utilizado para adquisición de los datos fue Empower 2 TM de Waters (Waters Corporation 2005). Se utilizaron balanzas analíticas Shimadzu- Modelo AUW220D-Legibilidad 0,01 mg y Shimadzu Libror AEG-220-Legibilidad 10 mg.
Preparación de las soluciones patrones
Las soluciones stock de 3-PBA y 2-PBA se prepararon pesando como mínimo 10 mg (legibilidad 0,01 mg) del estándar y llevando a volumen con metanol. A partir de estas soluciones se prepararon por dilución las soluciones intermedias y de trabajo. Todas las soluciones fueron conservadas en frascos de vidrio y se almacenaron a -20 °C hasta la fecha de vencimiento.
Análisis cromatográfico
El análisis cromatográfico se realizó a temperatura ambiente con una columna ZORBAX Eclipse® XDB-C18, (250 x 4,6 mm) 5-Micron (Agilent) y guarda columna XDB-C18 Guard (5 μm, 0,5 x 35 mm) (Agilent). Se empleó una fase móvil constituida por: 60% de solución acuosa de ácido acético al 1% y 40% de acetonitrilo acidificado al 1% con ácido acético, a un flujo de 1 mL min-1. El volumen de inyección fue 40 μL. Se hizo un barrido espectral entre 210-400 nm y se cuantificó a 230 nm. En estas condiciones los tiempos de retención (en minutos) fueron 13,4 para el 2-PBA (estándar interno) y 20,7 para el 3-PBA (Figura 2).

Figura 2. (A) Ejemplo del perfil cromatográfico de una muestra de control de calidad (MCC). (B) Espectro de absorbancia característico del 2-PBA (ácido 2-fenoxibenzoico). (C) Espectro de absorbancia característico del 3-PBA (ácido 3-fenoxibenzoico).
Tratamiento de las muestras
Se realizó el análisis físico-químico de las muestras de orina con tiras reactivas. Se adicionaron a 10 mL de cada muestra, cantidad suficiente del estándar interno (EI) en metanol para obtener una concentración final de 0,1 μg mL-1. Para liberar el 3-PBA de los conjugados, se procedió a una hidrólisis ácida añadiendo 1 mL de ácido clorhídrico concentrado y calentando en estufa a 90 °C durante 1 hora. Cada muestra se dejó enfriar a temperatura ambiente. Después de la hidrólisis, se realizaron las extracciones por el método QuEChERS con acetonitrilo para extraer el 3-PBA y el EI de las muestras. Una alícuota del extracto de acetonitrilo se usó para la DLLME como disolvente dispersivo y tricloroetileno como disolvente extractivo para aumentar el factor de enriquecimiento del procedimiento de extracción.
Brevemente, en un tubo de polipropileno de 50 mL se colocaron la orina hidrolizada junto con las sales de QuEChERS y 10 mL de acetonitrilo. Se agitaron vigorosamente por 1 minuto y se centrifugaron por 10 minutos a 3500 rpm. Se tomaron 9,5 mL de extracto de acetonitrilo y se le agregaron 20 mL de agua desionizada, 0,5 g de cloruro de sodio y 200 μL de ácido clorhídrico concentrado. A continuación, se adicionaron rápidamente con pipeta automática 1 mL de tricloroetileno, con posterior agitación en un agitador orbital durante 1 minuto y se centrifugaron 5 minutos a 3000 rpm. El extractante (tricloroetileno) fue separado y se llevó a sequedad con corriente de nitrógeno en baño de agua a 50 °C. Por último, el residuo se reconstituyó en 60 μL de fase móvil.
Validación
Los parámetros evaluados durante la validación fueron: linealidad, límite de detección, límite de cuantificación, selectividad, precisión, veracidad, arrastre (carry-over), estabilidad del analito en la muestra y en el extracto e incertidumbre.
Linealidad
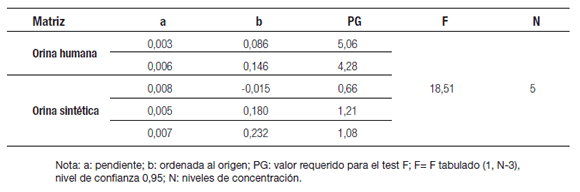
La linealidad fue evaluada analizando 5 estándares de calibración (EC) de concentraciones de 3-PBA en el rango de 9 μg L-1 a 79 μg L-1; una muestra blanco (muestra sin analito y sin EI) y una muestra cero (muestra con EI). Los EC se prepararon diariamente adicionando, a 40 mL de OB y OS, alícuotas de las soluciones de trabajo de 3-PBA y 2-PBA en metanol respectivamente. Cada nivel de concentración se realizó por duplicado. La curva de calibración se construyó graficando la relación de las alturas 3-PBA/2-PBA versus la concentración nominal del analito. Se realizó un análisis de regresión lineal de los datos, que proporcionó una pendiente y una ordenada al origen. La linealidad se evaluó empleando las propuestas de la ISO 8466-1 (International Standard Organization 1990): (1) la representación gráfica de los datos con la recta de regresión lineal calculada y (2) test estadístico: se calcula el valor PG requerido para la prueba F. Si PG ≤ F la función de calibración no lineal no da lugar a una mejora significativa del ajuste y por lo tanto la función de calibración es lineal. Se comparó la pendiente de las curvas de calibración generadas en orina humana y orina sintética por análisis de regresión lineal con variables auxiliares (Guerra Simones y col. 2007).
Límite de detección y límite de cuantificación El límite de detección (LD) se definió como la concentración más baja a la que se cumplen los criterios cualitativos (tiempo de retención y espectro UV-Visible) al menos en el 90% de casos. Se analizaron 5 muestras de control de calidad (MCC) en OS enriquecidas a la concentración del LD. El límite de cuantificación (LC) es el punto de menor concentración en la curva de calibrado en ambas matrices (Da Costa y Chasin 2004; EMA 2011).
Selectividad
Para la evaluación de posibles interferentes endógenos de la matriz, se analizaron 6 muestras de orina previamente seleccionadas y alícuotas de estas muestras enriquecidas con 3-PBA en el LC. Una señal se consideró interferente si es mayor que el 20% del LC del 3-PBA y mayor que el 5% del EI. Se determinó, además, la homogeneidad espectral de la señal del analito y el EI en las muestras enriquecidas a partir de las curvas de similitud y umbral de pureza (EMA 2011).
Arrastre (carry-over)
Se evaluó inyectando extractos de OB y OS después de un EC o MCC de concentración elevada. Las señales de los analitos en la muestra blanco no deben ser mayores que el 20% del LC del 3-PBA y el 5% del EI (EMA 2011).
Precisión
Se evaluó la precisión del método en términos de repetibilidad (precisión intradiaria) y precisión intermedia (precisión interdiaria) y fue expresada como el porcentaje de la Desviación Estándar Relativa (RSD%). Se utilizaron MCC en OS de 2 niveles de concentración: 9 μg L-1 y 27 μg L-1. Para la precisión intradiaria (RSDr%) se analizaron 5 réplicas por nivel de concentración. La precisión interdiaria (RSDint%) se evaluó analizando 5 réplicas de cada nivel en diferentes días y por diferentes analistas. El RSD% no debe exceder el 15%, excepto en el LC en el que es aceptable un RSD% de hasta 20% (EMA 2011).
Veracidad
La veracidad del método se evaluó mediante un ensayo de adición/recuperación. Las recuperaciones se calcularon a partir de los datos obtenidos durante la evaluacíón de la precisión. Las MCC se enriquecieron en forma independendiente de los EC utilizando soluciones preparadas por separado. Las MCC se cuantificaron con curva de calibración y las concentraciones obtenidas se compararon con el valor nominal. Los valores de recuperación aceptables se encuentran dentro del rango 70%-125% (AOAC 2002).
Estabilidad
Se evaluó la estabilidad del analito en MCC de concentración 27 μg L-1 en OB y OS durante 3 etapas relevantes del desarrollo de la metodología. Alícuotas de las MCC de OB se conservaron en las siguientes condiciones: 4 °C durante 10 días y -20 °C durante 60 días. Las muestras se analizaron por duplicado frente a curvas de calibración recientemente preparadas, y las concentraciones obtenidas se compararon con la concentración nominal.
Se evaluó estabilidad del analito frente a las condiciones de la hidrólisis en 6 alícuotas de MCC de OS. De las alícuotas, 3 se sometieron al proceso completo y en las 3 restantes se eliminó la hidrólisis.
La estabilidad del analito en el extracto con MCC de OB y OS se evaluó a -20 °C durante 24 y 48 horas.
Se realizó, para las muestras en las 3 condiciones, análisis de la varianza de una vía (ANAVA) con la prueba DGC de comparación de medias. Valores de p < 0,05 se consideraron significativos.
Estimación de la incertidumbre de la medición
La estimación de la incertidumbre de la medición (IM) es un parámetro asociado al resultado de la medición que caracteriza la dispersión de los valores que podrían atribuirse razonablemente al mensurado. Esta estimación se realizó utilizando la ecuación de Horwitz: [u′ = 21 - 0,5 log c]; donde u′ designa la desviación estándar relativa de la reproducibilidad y c la concentración del analito en μg L-1. La IM relativa expandida, U′ (al nivel de confianza del 95%) se calculó mediante: U′ = 2 u′. Los valores obtenidos a partir de la ecuación de Horwitz se consideraron como indicadores de la posible incertidumbre asociada con los resultados del ensayo debido a la falta de datos de apoyo (materiales de referencia, participación en interlaboratorios) (Codex Alimentarius, 2006).
Análisis de muestras reales
Para la verificación del método desarrollado, se procesaron 8 muestras de orinas de micción espontánea de 4 voluntarios, sin exposición laboral. Se recolectaron 4 muestras en el periodo diciembre-marzo, época de uso frecuente de insecticidas domésticos. Los voluntarios declararon haber usado productos insecticidas piretroides dentro de los 5 días anteriores a la toma de muestra. Muestras de las mismas personas fueron analizadas en época de temperaturas más bajas y menor uso de insecticidas domésticos, estación junio-agosto. Las muestras fueron analizadas en el mismo día de la recolección. La cuantificación del 3-PBA se realizó por el método de adición de estándares.
Análisis estadístico
El análisis estadístico de los datos se realizó con el software estadístico InfoStat versión 2016 (Di Rienzo y col. 2016).
Resultados y discusión
En humanos, el proceso de transformación de los piretroides produce metabolitos urinarios que son adecuados para el monitoreo biológico. La excreción es rápida, por lo que los niveles urinarios sólo reflejan una exposición reciente. Actualmente, para propósitos de biomonitoreo sólo se usa orina como material biológico para el estudio (Wielgomas y col. 2013). El 3-PBA es un metabolito común de cipermetrina, deltametrina, permetrina, cialotrina y fenvalerato y posiblemente otros insecticidas piretroides. Por lo tanto, la detección de este metabolito en la orina puede reflejar múltiples fuentes de exposición ambiental a diferentes insecticidas piretroides (Fortes y col. 2013).
Optimización de la metodología analítica
En general, la determinación de metabolitos de piretroides en orina comprende 3 etapas: (1) hidrólisis de los conjugados; (2) extracción del metabolito libre, concentración y derivatización y (3) detección y cuantificación (Ueyama y col. 2009). La hidrólisis de los conjugados puede realizarse por métodos enzimáticos (β-glucuronidasa, sulfatasa) o químicos (ácido clorhídrico o ácido sulfúrico y calor). Se decidió realizar una hidrólisis ácida (ácido clorhídrico / 90 °C / 1 h), también empleada por otros autores (Wang y col. 2007; Wielgomas y col. 2013; Schettgen y col. 2016). Toshima y col. (2015) compararon diferentes pretratamientos de la orina para el biomonitoreo de piretroides. Observaron un valor más bajo del metabolito en el análisis precedido por la desconjugación enzimática que en el precedido por hidrólisis ácida. Probablemente esto se deba a la presencia de otros conjugados no hidrolizados por glucuronidasas y sulfatasas.
Con la intención de obtener óptima sensibilidad se evaluaron distintas variantes de DLLME (con solvente orgánicos y líquidos iónicos), y método QuEChERS para extraer y concentrar el 3-PBA. Se encontró que el procedimiento QuEChERS simplificado propuesto por Roca y col. (2014) era apropiado para la extracción del 3-PBA de las muestras de orina. Sin embargo, no se alcanzó un LD adecuado para el biomonitoreo de la exposición a piretroides. Por ello, se decidió combinar QuEChERS y DLLME, de tal forma que el 3-PBA fue extraído de la orina por partición con acetonitrilo y luego concentrado en tricloroetileno por un procedimiento de microextracción dispersiva. Esta estrategia ha sido empleada por otros autores para de terminar residuos de plaguicidas en alimentos (Ravelo-Pérez y col. 2009, Melo y col. 2012).
Durante el proceso de optimización de la separación cromatográfica fueron probados diferentes fases móviles, gradientes, flujos, fases estacionarias de columna, etc., para lograr una buena separación y definición de los picos del 3-PBA y del 2-PBA. Finalmente, se seleccionaron las condiciones presentadas en materiales y métodos.
Se cuantificó con estándar interno contra patrones en matriz (unipuntual o multipuntual) o por adición de estándar (EMA, 2011).
Validación intralaboratorio
Linealidad
En el curso de la validación se realizaron 5 curvas de calibración. No se observaron desviaciones de la linealidad en la representación gráfica de los datos de la calibración (Figura 3). Comparando el valor calculado de PG con el valor tabulado de la distribución de Fisher- Snedecor, F (1, N-3 grados de libertad, nivel de confianza 0,95), resultó PG < F en todos los casos y por lo tanto el modelo lineal fue adecuado para modelar los datos de calibración en el intervalo de 9 μg L-1 a 79 μg L-1 (Tabla 1). Sin embargo, se observaron diferencias estadísticamente significativas (p < 0,05) en las pendientes de las curvas, especialmente entre curvas realizadas con OB. Esta diferencia refleja la naturaleza variable de la matriz orina. Debido a que no es posible conservar inalteradas las muestras de orina por mucho tiempo, las curvas se realizaron con OB frescas de distintos voluntarios.

Figura 3. Ejemplos de curvas de calibración de 3-PBA (ácido 3-fenoxibenzoico) en orina humana (A) y orina sintética (B) en el rango 9 μg L-1 - 79 μg L-1.
Tabla 1. Datos de las curvas de calibración del 3-PBA (ácido 3-fenoxibenzoico) en orina humana y orina sintética en el rango 9 μg L-1 - 79 μg L-1.
Límite de detección y límite de cuantificación
El LC corresponde al punto más bajo de la curva de calibración: 9 μg L-1 (ver Precisión y Veracidad). La concentración más baja que generó una señal cromatográfica en todas las MCC y el espectro de absorción característico de los analitos fue 3 μg L-1, considerado LD. Tal como han informado otros autores se detectó la presencia de 3-PBA en la mayoría de las muestras de orina analizadas (Wei y col. 2012; Le Grand y col. 2012; Morgan y col. 2016). Por esta razón, el LD se determinó empleando MCC preparadas con OS. B´Hymer (2011) empleó orinas sintéticas durante la validación de un método analítico para determinar metabolitos de tolueno y benceno en orina. Garí y col. (2018) usaron orinas sintéticas para determinar el LD y la selectividad del método analítico desarrollado para determinar 3-PBA. A diferencia de B´Hymer (2011) y Garí y col. (2018) que utilizaron orinas sintéticas comerciales, en nuestro trabajo empleamos orinas sintéticas preparadas en el laboratorio siguiendo el protocolo propuesto por Gustafsson y Uzqued (1978). El LD obtenido es comparable al informado por Wielgomas Bartosz y col. (2014). Estos autores desarrollaron un método que combina microextracción soportada por fibra hueca y HPLC-DAD para determinar 3-PBA en orina y reportaron un LD de 15 μg L-1. Cabe destacar que los métodos analíticos que emplean cromatografía acoplada a espectrometría de masas (CG-MS o HPLC-MSMS) permiten alcanzar LD más bajos. Ueyama y col. (2009) informan un LD de 0,02 μg L-1 con un método que mide 3-PBA por CG-MS.
Si bien no hay datos publicados sobre los niveles de exposición a insecticidas piretroides en Argentina los valores informados para otras poblaciones indican que los LD y LC del método validado son adecuados para el biomonitoreo de la exposición a piretroides. Por ejemplo, las concentraciones urinarias de 3-PBA en trabajadores textiles del este de China estuvieron en el rango de 0,17 μg L-1–261 μg L-1 (Lu y col. 2013). En un estudio realizado en USA que evaluó la exposición a piretroides de las familias de trabadores rurales se detectó 3-PBA en el 80% de las 250 muestras de orina analizadas en un rango de 0,3 μg L-1–13 μg L-1 (Trunnelle y col. 2014).
Selectividad
No se observaron señales de interferentes en las OB, en los tiempos de retención del analito y del EI. En las muestras enriquecidas las señales del 3-PBA y 2-PBA resultaron espectralmente homogéneas, es decir la curva de similitud estuvo siempre por debajo de la curva del umbral de pureza tal como se muestra en la Figura 4.
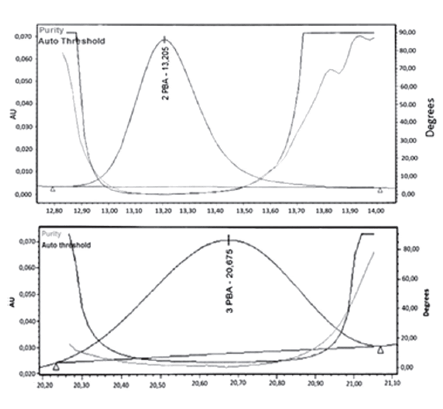
Figura 4. Curvas de similitud y umbral de pureza de muestras enriquecidas.
Arrastre (carry-over)
No se observaron señales en los tiempos de retención de los analitos en la OB inyectada después de un EC de 133 μg L-1 y 100 μg L-1 para el 3-PBA y el EI respectivamente.
Precisión y veracidad
Los resultados para la precisión y veracidad se presentan en la Tabla 2. Los datos muestran que el método cumple con los criterios de aceptación.
Tabla 2. Valores de reproducibilidad, precisión intermedia y recuperación del método.

Estabilidad
Como se muestra en la Figura 5 los resultados para las muestras conservadas a -20 °C no mostraron diferencias estadísticamente significativas entre los grupos de datos hasta el día 7. Las muestras conservadas a 4 °C se analizaron sólo durante 4 días ya que a partir del día 1 se observaron diferencias estadísticamente significativas. Por lo tanto, las muestras de orina para la determinación del 3-PBA pueden conservarse hasta 7 días a -20 °C sin conservantes. Estos resultados difieren de los informados por Leng y Gries (2005) que conservaron las muestras de orina durante un año a -20 °C. En cambio, Yoshida, (2017) reporta que las muestras de orina pueden ser conservadas durante un mes a -20 °C.

Figura 5. Estabilidad del 3-PBA (ácido 3-fenoxibenzoico) en muestras de orina a -20 °C (A) y 4 °C (B). Letras distintas indican diferencias estadísticamente significativas entre medias (p < 0,05) mientras que la línea vertical muestra la desviación estándar.
No se observaron diferencias estadísticamente significativas en la concentración de 3-PBA en las MCC con y sin hidrólisis. Esto nos permite sugerir que los patrones del analito no sufren modificaciones durante la hidrólisis ácida. Estos resultados concuerdan con los obtenidos por Aprea y col. (1997).
Los resultados de los extractos procedentes de OB y OS conservados a -20 °C no mostraron diferencias estadísticamente significativas hasta las 24 horas en la OB y hasta las 48 horas en la OS.
Complementariamente se evaluó en OB la interrupción por 24 horas de la técnica en 2 etapas del proceso: luego de la hidrólisis y luego de la extracción con QuEChERS. El proceso puede ser interrumpido luego de la hidrólisis, conservando la muestra por 24 horas a 4 °C ya que no se observaron diferencias estadísticamente significativas. Por el contrario, la interrupción luego de la extracción con acetonitrilo produjo diferencias estadísticamente significativas en los resultados, esto sugiere que el proceso de extracción y limpieza sólo puede ser detenido luego de la hidrólisis sin alterar los resultados.
Estimación de la incertidumbre de la medición
La estimación de la IM se realizó en dos niveles de concentración: 9 μg L-1 y 27 μg L-1. Los valores de u´ y U´ obtenidos fueron; 33% y 65% para el nivel 9 μg L-1 y 28% y 55% para el nivel 27 μg L-1, respectivamente. Borello y col. (2017) estimaron la incertidumbre de un método para medir 2,4-D en orina por este mismo procedimiento.
Análisis de muestras reales
En el grupo de muestras analizadas en época de uso frecuente de insecticidas domésticos se detectó 3-PBA en 3 de 4 muestras en el rango de 3 μg L-1-16 μg L-1. En las muestras analizadas en época de temperaturas más bajas y menor uso de insecticidas domésticos, no se detectó la presencia del metabolito en ninguna muestra. Estos datos sugieren que la frecuencia de uso de plaguicidas asociado a la época del año podría influir en la presencia del 3-PBA en orina. Otros autores observaron variaciones de los metabolitos urinarios asociadas a las estaciones; así, Attfield y col. (2014) informaron que las mediciones repetidas de metabolitos urinarios de piretroides en niños exhibieron una mayor variabilidad interpersonal que intrapersonal en verano e invierno. En otro estudio similar se detectaron los valores más altos de metabolitos de piretroides en las muestras tomadas en invierno y otoño (Lu y col. 2009).
Conclusión
El método analítico propuesto, en el que se combinaron las técnicas de extracción y concentración QuEChERS, DLLME y detección HPLC-PDA, resultó adecuado para la cuantificación del metabolito 3-PBA en orina. Esta metodología permitió obtener límites de detección y cuantificación aceptables, muy buena reproducibilidad, recuperación y selectividad óptima. Es lineal, preciso y exacto en el intervalo de concentración evaluado cumpliendo con los criterios de aceptación establecidos para estos parámetros. Como posible mejora al método se plantea estimar nuevamente la estabilidad del analito en la muestra aplicando conservantes y menores temperaturas.
Se detectaron concentraciones de 3-PBA en muestras reales de voluntarios sin exposición laboral, estos hallazgos ponen en evidencia la posible relación entre la frecuencia de uso según la época del año y la exposición a estos plaguicidas, asimismo, este dato confirma la utilidad del método tanto para biomonitoreo laboral como doméstico.
Bibliografía citada
1. Ahn K.C., Gee S.J., Kim H.J., Aronov P.A., Vega H., Krieger R.I., Hammock B.D. Immunochemical analysis of 3-phenoxybenzoic acid, a biomarker of forestry worker exposure to pyrethroid insecticides. Anal Bioanal Chem. 2011;401(4):1285–1293.
2. Aprea C., Stridori A., Sciarra G. Analytical method for the determination of urinary 3-phenoxybenzoic acid in subjects occupationally exposed to pyrethroid insecticides. Journal of Chromatography B: Biomedical Sciences and Applications. 1997;695(2):227-236. [ Links ]
3. Association of Official Analytical Chemists (AOAC). Guidelines for single laboratory validation of chemical methods for dietary supplements and botanicals. AOAC Int. 2002;1219:1–38.
4. Attfield K.R., Hughes M.D., Spengler J.D., Lu C. Within-and between-child variation in repeated urinary pesticide metabolite measurements over a 1-year period. Environmental Health Perspectives. 2014;122(2): 201-206. [ Links ]
5. Bartosz W., Marcin W., Wojciech C. Development of hollow fiber-supported liquid-phase microextraction and HPLC-DAD method for the determination of pyrethroid metabolites in human and rat urine. Biomed Chromatogr. 2014;28(5):708–16.
6. B'Hymer C. Validation of an HPLC-MS-MS method for the determination of urinary S-benzylmercapturic acid and S-phenylmercapturic acid. J Chromatogr Sci. 2011;49(7):547–53.
7. Bolzan C.M., Caldas S.S., Guimarães B.S., Primel E.G. Dispersive liquid-liquid microextraction with liquid chromatography-tandem mass spectrometry for the determination of triazine, neonicotinoid, triazole and imidazolinone pesticides in mineral water samples. J Braz Chem Soc. 2015;26(9):1902–1913.
8. Borello J.S., Cañas A. I., Lucero P.A. Validación de la metodología analítica basada en microextracción dispersiva líquido-líquido combinada con cromatografía líquida para la determinación del ácido diclorofenoxiacético en orina. Toxicología. 2017; 34:130-135. [ Links ]
9. Boyd Barr D., Olsson A.O., Wong L.Y., Udunka S., Baker S.E., Whitehead R.D., Magsumbol M. S., Williams B. L., Needham L. L. Urinary concentrations of metabolites of pyrethroid insecticides in the general u.s. population: National health and nutrition examination survey 1999-2002. Environ Health Perspect. 2010;118(6):742–748.
10. Chuang J.C., Van Emon J.M., Trejo R.M., Durnford J. Biological monitoring of 3-phenoxybenzoic acid in urine by an enzyme-linked immunosorbent assay. Talanta. 2011;83(5):1317–1323.
11. Costa L.G., Giordano G., Guizzetti M., Vitalone A. Neurotoxicity of pesticides: a brief review. Front Biosci. 2008;13:1240–1249.
12. Da Costa J.L., Chasin da Matta A.A. Determination of MDMA, MDEA and MDA in urine by high performance liquid chromatography with fluorescence detection. J Chromatogr B . 2004;811(1):41–45.
13. Di Rienzo J.A., Casanoves F., Balzarini M.G., Gonzalez L., Tablada M., Robledo C.W. InfoStatversión. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. 2016. [consulta 26 de julio 2017]. Disponible en: http://www.infostat.com.ar [ Links ]
14. Fortes C., Mastroeni S., Pilla M.A., Antonelli G., Lunghini L., Aprea C. The relation between dietary habits and urinary levels of 3-phenoxybenzoic acid, a pyrethroid metabolite. Food Chem Toxicol. 2013;52(2):91–96.
15. Fortin M.C., Bouchard M., Carrier G., Dumas P. Biological monitoring of exposure to pyrethrins and pyrethroids in a metropolitan population of the Province of Quebec, Canada. Environ Res. 2008;107(3):343–350.
16. Garí M., González-Quinteiro Y., Bravo N., Grimalt J.O. Analysis of metabolites of organophosphate and pyrethroid pesticides in human urine from urban and agricultural populations (Catalonia and Galicia). Science of the Total Environment. 2018;622:526-533. [ Links ]
17. Glorennec P., Serrano T., Fravallo M., Warembourg C., Monfort C., Cordier S., Viel J.- F., Le Gléau F., Le Bot B.; Chevrier C. Determinants of children's exposure to pyrethroid insecticides in western France. Environ Int. 2017;104:76–82.
18. Guerra Simones N., Vale CaedosoV., Ferrerira E., Benoliel, M.J., Almeida C.M. Experimental and statistical validation of SPMEGC- MS analysis of phenol and chlorophenols in raw and treated water. Chemosphere. 2007;68(3):501–510.
19. Guideline on bioanalytical method validation (EMA). EMEA, Comm Med Prod Hum Use. 2011;44:1–23.
20.Gustafsson J.B.C., Uzqueda B.H.R. The influence of citrate and phosphate on the Mancini single radial immunodiffusion technique and suggested improvements for the determination of urinary albumin. Clin Chim Acta. 1978;90(3):249–257.
21. Kumar B., Kumar S., Prakash D., Singh S.K., Mishra M., Jain P.K., Gaur R., Goel G., Sharma C.S., Kamayotra J.S., Gautam S.P. Determination of pyrethroid insecticides by reversed phase high performance liquid chromatography- diode array detector (HPLC-DAD) with different types of column. Proc Indian Natn Sci Acad. 2011;77(1):51–55.
22. Le Grand R., Dulaurent S., Gaulier J.M., Saint-Marcoux F., Moesch C., Lachatre G.. Simultaneous determination of five synthetic pyrethroid metabolites in urine by liquid chromatography–tandem mass spectrometry: application to 39 persons without known exposure to pyrethroids. Toxicology Letters. 2012;210(2):248-253.
23. Lehotaya S.J., Ae Son K., Kwon H., Koesukwiwat U., Fu W., Mastovska K., Hohe E., Leepipatpiboon N. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables. J Chromatogr A. 2010;1217(16):2548–2560.
24. Leng G., Gries W. Simultaneous determination of pyrethroid and pyrethrin metabolites in human urine by gas chromatography–high resolution mass spectrometry. Journal of Chromatography B. 2005;814(2): 285-294.
25. Li W., Morgan M.K., Graham S.E., Starr J.M. Measurement of pyrethroids and their environmental degradation products in fresh fruits and vegetables using a modification of the quick easy cheap effective rugged safe (QuEChERS) method. Talanta. 2016;151:42–50.
26. Lin C.H., Yan C.T., Kumar P.V., Li H.P., Jen J.F. Determination of pyrethroid metabolites in human urine using liquid phase microextraction coupled in-syringe derivatization followed by gas chromatography/electron capture detection. Anal Bioanal Chem. 2011;401(3):927–37.
27. Lu C., Barr D.B., Pearson M.A., Walker L.A., Bravo R. The attribution of urban and suburban children's exposure to synthetic pyrethroid insecticides: a longitudinal assessment. Journal of Exposure Science and Environmental Epidemiology. 2009;19(1):69-78. [ Links ]
28. Lu D., Wang D., Feng C., Jin Y.E., Zhou Z., Wu C., Lin Y., Wang G. Urinary concentrations of metabolites of pyrethroid insecticides in textile workers, Eastern China. Environment international. 2013;60:137-144. [ Links ]
29. Martínez Vidal J.L., Plaza-Bolaños P., Romero- González R., Garrido Frenich A. Determination of pesticide transformation products: A review of extraction and detection methods. J Chromatogr A. 2009;1216(40):6767–88.
30. Melo A., Cunha S.C., Mansilha C., Aguiar A., Pinho O., Ferreira I. M. Monitoring pesticide residues in greenhouse tomato by combining acetonitrile-based extraction with dispersive liquid–liquid microextraction followed by gaschromatography– mass spectrometry. Food chemistry. 2012;135(3):1071-1077.
31. Morgan M., Jones P., Sobus J., Boyd Barr D. Predictors of Urinary 3-Phenoxybenzoic Acid Levels in 50 North Carolina Adults. International journal of environmental research and public health. 2016;13(11):1172-1180. [ Links ]
32. Mudiam M.K.R., Chauhan A., Jain R., Dhuriya Y.K., Saxena P.N., Khanna V.K. Molecularly imprinted polymer coupled with dispersive liquidliquid microextraction and injector port silylation: a novel approach for the determination of 3-phenoxybenzoic acid in complex biological samples using gas chromatography-tandem mass spectromety. J Chromatogr B. 2014;945:23–30.
33. Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO). [en línea.]. Directrices sobre la estimación de la incertidumbre de los resultados (CAC/GL 59-2006). [consulta: 5 de septiembre de 2017]. Disponible en: www.fao.org/input/download/standards/10692/cxg_059s.pdf. [ Links ]
34. Ravelo-Pérez L.M., Hernández-Borges J., Asensio-Ramos M., Rodríguez-Delgado M.Á.Ionic liquid based dispersive liquid–liquid microextraction for the extraction of pesticides from bananas. Journal of Chromatography A. 2009;1216(43):7336-7345.
35. Roca M., Leon N., Pastor A., Yusà V. Comprehensive analytical strategy for biomonitoring of pesticides in urine by liquid chromatographyorbitrap high resolution mass spectrometry. J Chromatogr A. 2014;1374:66–76.
36. Saillenfait A.M., Ndiaye D., Sabaté J.P. Pyrethroids: Exposure and health effects - An update. Int J Hyg Environ Health. 2015;218(3):281–292.
37. Saito S., Ueyama J., Kondo T., Saito I., Shibata E., Gotoh M., Nomura H., Wakusawa S., Nakai K., Kamijima M. A non-invasive biomonitoring method for assessing levels of urinary pyrethroid metabolites in diapered children by gas chromatography-mass spectrometry. J Expo Sci Environ Epidemiol. 2014;24(2):200–207.
38. Schettgen T., Dewes P., Kraus T. A method for the simultaneous quantification of eight metabolites of synthetic pyrethroids in urine of the general population using gas chromatography- tandem mass spectrometry. Anal Bioanal Chem. 2016;408(20):5467–5478.
39. Smith P.A., Thompson M.J., Edwards J.W. Estimating occupational exposure to the pyrethroid termiticide bifenthrin by measuring metabolites in urine. Journal of Chromatography B. 2002;778(1-2):113-120. [ Links ]
40. Tao L., Chen M., Collins E., Chensheng L. Simultaneous quantitation of seven pyrethroid metabolites in human urine by capillary gas chromatography– mass spectrometry. J Sep Sci. 2013;36(4):773–80
41. Toshima H., Yoshinaga J., Shiraishi H., Ito Y., Kamijima M., Ueyama J. Comparison of different urine pretreatments for biological monitoring of pyrethroid insecticides. Journal of analytical toxicology. 2015;39(2):133-136. [ Links ]
42. Trunnelle K.J., Bennett D.H., Ahn K.C., Schenker M.B., Tancredi D.J., Gee S.J., Stoecklin-Marois M.T., Hammock B.D. Concentrations of the urinary pyrethroid metabolite 3-phenoxybenzoic acid in farm worker families in the MICASA study. Environ Res. 2014;131:153–159.
43. Tsuji R., Yamada T., Kawamura S. Mammal Toxicolgy of Synthetic Pyrethroides. Top Curr Chem. 2012;314: 83–112.
44. Ueyama J., Kimata A., Kamijima M., Hamajima N., Ito Y., Suzuki K., Inoue T., Yamamoto K., Takagi K., Saito I., Miyamoto K., Hasegawa T., Kondo T. Urinary excretion of 3-phenoxybenzoic acid in middle-aged and elderly general population of Japan. Environmental research. 2009;109(2):175-180. [ Links ]
45. Wang D., Kamijima M., Imai R., Suzuki T., Kameda Y., Asai K., Okamura A., Naito H., Ueyama Y., Saito I., Nakajima T., Goto M., Shibata E., Kondo T.,Takagi K.,Takagi K., Wakusawa S.. Biological monitoring of pyrethroid exposure of pest control workers in Japan. Journal of occupational health. 2007;49(6):509-514. [ Links ]
46. Wei B., Mohan K.R., Weisel C.P. Exposure of flight attendants to pyrethroid insecticides on commercial flights: urinary metabolite levels and implications. International journal of hygiene and environmental health. 2012;215(4):465-473. [ Links ]
47. Wielgomas B.W., Marcin W., Wojciech C. Development of hollow fiber-supported liquidphase microextraction and HPLC-DAD method for the determination of pyrethroid metabolites in human and rat urine. Biomedical Chromatography. 2014; 28(5):708-716. [ Links ]
48. Wielgomas B., Nahorski W., Czarnowski W. Urinary concentrations of pyrethroid metabolites in the convenience sample of an urban population of Northern Poland. Int J Hyg Environ Health. 2013;216(3):295–300.
49. Yoshida T. Analytical Method for Pyrethroid Metabolites in Urine of the Non-Occupationally Exposed Population by Gas Chromatography/ Mass Spectrometry. Journal of chromatographic science. 2017;55(9): 873-881. [ Links ]
50. Ye X., Pan W., Zhao Y., Zhao S., Zhu Y., Liu W., Lui j. Association of pyrethroids exposure with onset of puberty in Chinese. Environ Pollut.2017;227:606–612.














