Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta toxicológica argentina
On-line version ISSN 1851-3743
Acta toxicol. argent. vol.26 no.2 Ciudad Autónoma de Buenos Aires Sept. 2018
ARTÍCULOS ORIGINALES
Avaliação da atividade da enzima glutationa-s-transferase da minhoca Eisenia foetida exposta à ivermectina
Evaluation of glutatione-s-transferase enzyme activity of the earthworm Eisenia foetida exposed to ivermectin
Moreira Tuerlinckx, Sandro1*; Hahn Delfim, Daniel2; Kalil Huber, Ana Cláudia3; Araújo Gamboa Morselli, Tânia Beatriz4
1Centro de Ciências da Saúde, Universidade da Região da Campanha, Tupy Silveira nº2099, Bagé/RS/Brasil.
2Universidade da Região da Campanha.
3Centro de Ciências Exatas e Ambientais, Universidade da Região da Campanha, Bagé- RS.
4Faculdade de Agronomia Eliseu Maciel, FAEM/UFPel, Pelotas/RS/Brasil.
Recibido: 10 de septiembre de 2018
Aceptado: 19 de septiembre de 2018
Resumo
Muitos tipos de drogas são usados na medicina veterinária para controlar e melhorar a saúde animal através de tratamentos terapêuticos e profiláticos. A desvantagem desta prática é que os produtos farmacêuticos e seus metabólitos são liberados no ambiente e podem influenciar a fauna do solo através da excreção do esterco ou pela posterior aplicação ao campo agrÍcola. As avermectinas são vastamente utilizadas na medicina veterinária e na agricultura. Estudos anteriores demonstraram que a ivermectina (IVM), um parasiticida amplamente utilizado, é muito tóxico para diversas espécies de invertebrados não-alvo. Tendo em vista que a IVM é pouco metabolizada, excretada de forma relativamente inalterada e pela escassez de dados sobre a toxicidade aos invertebrados do solo, foram investigados, neste estudo, os efeitos agudos e crônicos deste parasiticida sobre a glutationa-s -transferase (GST) da oligoqueta Eisenia foetida. As minhocas Eisenia foetida foram expostas à concentrações de IVM a 0, 1, 5, 10, 50 e 100 mg kg-1, e as amostras foram tomadas nos dias 7, 14 e 28 para determinação da atividade da GST. Os resultados mostraram que a duração da exposição alterou significativamente os efeitos do parasiticida investigado sobre a atividade de GST. Especificamente, após uma redução inicial, o prolongamento da exposição causou a indução da atividade da GST. Com o aumento da concentração de IVM, as atividades da GST foram inibidas significativamente após 7 dias de exposição. Em particular, o efeito inibitório foi significativo nas concentrações mais elevadas de tratamento (10, 50 e 100 mg kg-1). Por outro lado, aos 14 e 28 dias foram observadas induções na atividade da enzima. A atividade da GST pode ser considerada como parâmetro sensÍvel para avaliar a toxicidade da ivermectina para minhocas.
Palavras-chave: Avermectinas; Marcador bioquÍmico; Toxicidade; Minhocas.
Abstract
Many types of drugs are used in veterinary medicine to control and improve animal health through therapeutic and prophylactic treatments. The disadvantage of this practice is that pharmaceuticals and their metabolites are released into the environment and may influence soil fauna through manure excretion and subsequent application to agricultural field. The avermectins are extensively and increasingly used in veterinary medicine and agriculture. Previous studies have shown that ivermectin (IVM), a widely used parasiticide, is very toxic to many non-target invertebrate species. In view of the little metabolism and most of the ivermectin dose given to the animal is excreted, relatively unaltered, primarily in the feces and the scarcity of data on toxicity to soil invertebrates, acute and chronic effects of the parasiticide on the glutatione-s-transferase (GST) of the oligochaete Eisenia foetida were investigated. Earthworms of Eisenia foetida were exposed to IVM at 0, 1, 5, 10, 50 and 100 mg kg-1 concentrations; samples were taken at days 7, 14, and 28 exposure for determination of GST activities. The results showed that duration of the exposure significantly changed the effects of the investigated parasiticide on the GST activity. Namely, after the initial decrease, the prolongation of exposure caused the induction of the GST activity. With increasing IVM concentration, GST activities were inhibited significantly after 7 days of the exposure. In particular, the inhibition effect was significant at the higher treatment levels (10, 50 and 100 mg kg-1). On the other hand, at 14 and 28 days were observed inductions of enzyme activity. GST activity can be regarded as sensitive parameter for evaluating the toxicity of ivermectin to earthworms.
Keywords: Avermectins; Biochemical marker; Toxicity; Earthworms.
Introdução
Substâncias farmacologicamente ativas são amplamente utilizadas na medicina humana e veterinária, para o diagnóstico, tratamento e prevenção de várias doenças (DÍaz-Cruz et al. 2003; Sarmah et al. 2006), entretanto, atualmente, são considerados importantes poluentes orgânicos emergentes, tanto em ambientes terrestres como aquáticos (Carlsson et al. 2006; Morley, 2009; Lin et al. 2010; Horvat et al. 2012; Iglesias et al. 2012; Nie et al. 2013).
Embora estes fármacos sejam produzidos para alvos especÍficos, quando introduzidos no meio ambiente, eles podem agir sobre organismos não-alvo (Fent et al. 2006; Rombke et al. 2007), principalmente, devido ao fato destas substâncias e seus metabólitos manterem atividade e persistirem no ambiente (Zhou et al. 2007; Kwon-Rae et al. 2011).
De acordo com a orientação atual sobre a avaliação de risco ambiental na União Europeia, os medicamentos veterinários são uma ameaça para os organismos do solo e devem ser avaliados através de dados experimentais sobre o seus destinos e potenciais efeitos adversos (RÖmbke et al. 2010; Torre et al. 2012).
Medicamentos veterinários e seus metabólitos são eliminados principalmente pelas fezes ou urina dos animais tratados e podem ser potencialmente perigosos para espécies não-alvo como a fauna que habita tanto o solo como os estercos de origem animal (Sommer y Bibby 2002). Neste sentido, os efeitos de antiparasitários de uso veterinário frente a organismos que habitam estercos estão bem documentados (Sommer et al. 1992; Holter et al. 1993; Jensen et al. 2003).
A ivermectina (IVM) é um princÍpio ativo pertencente à classe das avermectinas, que são substâncias semi-sintéticas derivadas do microorganismo de solo Streptomyces avermitilis, possuindo atividade inseticida, acaricida e anti- helmÍntica, fazendo parte do grupo quÍmico chamado de macrolactonas ou lactonas macrocÍclicas (Shoop et al. 1995).
A eficácia das avermectinas está relacionada ao seu mecanismo de ação, interagindo com os canais cloreto dependentes de glutamato em invertebrados. O parasiticida impede o fechamento desses canais, aumentando a permeabilidade aos Íons Cl-, que gera hiperpolarização e transmissão neuronal reduzida, resultando em paralisia e morte dos parasitas. Além disso, também inibem os canais de cloro ligados ao ácido g-aminobutÍrico (GABA), que ocorrem no sistema nervoso periférico de invertebrados e no sistema nervoso central dos vertebrados (Forrester et al. 2003; Omura 2008).
Devido ao seu largo espectro de atividade, alta eficiência e elevada margem de segurança, a ivermectina é um fármaco amplamente utilizado (Shoop et al. 1995; Omura 2008), no entanto, o uso indiscriminado deste produto pode originar consequências danosas ao meio ambiente (Herd 1995).
A caracterÍstica da ivermectina de forte adsorção ao solo e a matéria orgânica (Halley et al. 1989; Krogh et al. 2008), produz um baixo potencial de dessorção (Krogh et al. 2008) e, consequentemente, um baixo potencial de lixiviação (Halley et al. 1989; Oppel et al. 2004), devido a isso, segundo Mougin et al. (2003) este fármaco se dissipa lentamente.
Essas propriedades fÍsico-quÍmicas fazem com que a ivermectina seja muito persistente em fezes bovinas, mesmo quando expostas às condições ambientais (Sommer y Steffansen 1993; Suarez et al. 2003; Fernandez et al. 2009), apresentando concentrações relativamente constantes durante um perÍodo de até 60 dias (Iglesias et al. 2006).
Desta forma, os resÍduos medicamentosos dos endectocidas desta classe ou seus metabólitos em fezes de bovinos ocasionam efeitos adversos em alguns organismos que habitam o esterco e invertebrados não-alvo que vivem no solo (Lumaret y Errouissi 2002; Suarez 2002).
Tem-se demonstrado que os insetos detritÍvoros e os coleópteros coprófagos são os principais organismos afetados pela presença de resÍduos de lactonas macrocÍclicas nos estercos (Errouissi et al. 2001; Suarez 2002; Iglesias et al. 2006; Suarez et al. 2009, Iglesias et al. 2011), entretanto não há consenso na literatura cientÍfica em relação aos efeitos adversos e toxicidade das avermectinas sobre a atividade de minhocas (Madsen et al. 1990; Sommer et al. 1992; Wratten et al. 1993; Svendsen et al. 2003).
Entre os organismos pertencentes à comunidade dos decompositores, as minhocas são um dos componentes mais importantes, contribuindo significativamente para a decomposição da matéria orgânica, ciclagem de nutrientes e formação do solo (Lavelle et al. 2007). No entanto, são altamente afetadas pela contaminação do solo; seu modo de alimentação e elevada relação superfÍcie/volume facilita a assimilação e a rápida distribuição de substâncias tóxicas para os seus tecidos (Nadeau et al. 2001). Dentro deste contexto, as minhocas têm sido utilizadas como um organismo modelo para a avaliação de risco dos ecossistemas terrestres (Ratte et al. 2003).
Desde 1984, minhocas da espécie Eisenia foetida são preconizadas por organizações de padronização de testes para uso em ensaios de ecotoxicologia terrestre (OECD 1984; ISO 1998), porque elas podem ser facilmente cultivadas em laboratório e são sensÍveis a uma vasta gama de produtos tóxicos (Lowe y Butt 2007).
O uso excessivo e indiscriminado de lactonas macrocÍclicas resulta em resÍduos de avermectinas e consequente poluição ambiental (Lumaret y Errouissi 2002; Suarez 2002; Floate et al. 2005).
Quantidades crescentes desses tipos de produtos quÍmicos sintéticos no ambiente exigem o desenvolvimento de biomarcadores para avaliar e monitorar os seus efeitos, que tradicionalmente eram apenas identificados pelos parâmetros de mortalidade e os danos à reprodução e crescimento dos organismos. Biomarcadores bioquÍmicos são cada vez mais utilizados nas avaliações dos riscos ecológicos dos ecossistemas aquáticos e terrestres (Rizwan-ul -Haq et al. 2012).
Neste sentido, as enzimas de detoxificação são largamente utilizadas para detectar toxicidade em diferentes ambientes. Entre estas enzimas, a glutationa-s-transferase (GST) desempenha um papel fundamental na desintoxicação de uma ampla gama de compostos (Bainy et al. 2000; Frova 2006; Aly y Schroder 2008).
As glutationa-S-transferases (Mannervik y Danielson 1988) (GST, EC 2.5.1.18) são membros de uma superfamÍlia de proteÍnas diméricas multifuncionais envolvidas na detoxificação celular de compostos citotóxicos e genotóxicos e na prevenção de danos oxidativos aos tecidos (Mannervik et al. 1992; Armstrong 1997). Seu mecanismo catalÍtico é promover a adição nucleofÍlica do peptÍdeo glutationa (GSH-Glu- Cis-Gli) a uma extensa variedade de eletrófilos hidrofóbicos endógenos e exógenos, formando produtos conjugados que são mais polares e mais facilmente excretados do que os seus correspondentes precursores (Lannutti et al. 2012). Estudos comparando a sequência de aminoácidos confirmam que as classes de GSTs existem numa gama surpreendentemente ampla de organismos (Sheehan et al. 2001). Em mamÍferos, por exemplo, as GSTs são principalmente citosólicas, com estrutura proteica homodimérica e classificadas em oito classes distintas: α, µ, p , ?, s, ?, ? and ? (Sheehan et al. 2001; Lannutti et al. 2012). Enquanto que, em minhocas da espécie Eisenia foetida, Bogeraas et al. (1996) e Rizwan-ul-Haq et al. (2012) caracterizaram a enzima glutationa-S-transferase e identificaram como pertencente a classe Pi (p). Pesquisas relacionadas à elucidação de processos detoxificantes e respostas adaptativas de proteÍnas como a GST podem ser úteis para uma melhor compreensão da toxicidade em organismos expostos a substâncias quÍmicas (Otitoju y Onwurah 2007). Dentro deste contexto, estudos demonstraram a aplicabilidade das enzimas GSTs como biomarcadores bioquÍmicos em minhocas contra diferentes classes de poluentes ambientais (Booth et al. 2000; Lukkari et al. 2004; Velki y Hackenberger 2013). Saint-Denis et al. (1998) demonstraram que essas oligoquetas são metabolicamente bem equipadas para responderem à presença de substâncias quÍmicas, principalmente devido a existência de atividade substancial da GST. Neste sentido, Lacourse et al. (2009) sugeriram esta enzima como potencial candidata a biomarcador molecular em estudos de poluição ambiental.
Pesquisas recentes têm demonstrado alterações na atividade da GST em minhocas após exposição a solos contaminados por metais, herbicidas, inseticidas e outros diversos agentes quÍmicos (Booth et al. 2000; Saint-Denis et al. 2001; Lukkari et al. 2004; Xiao et al. 2006; Aly y Schroder 2008; Maity et al. 2008; Xie et al. 2011; Rizwan-ul-Haq et al. 2012), mas pouco tem sido relatado em relação a esta enzima como biomarcador frente à lactonas macrocÍclicas. O objetivo do presente estudo foi examinar os efeitos agudos e crônicos da ivermectina (IVM), um importante membro da classe das lactonas macrocÍclicas, sobre a enzima glutationa-Stransferase em minhocas da espécie Eisenia foetida.
Materiais e métodos
Substâncias quÍmicas
Para os testes, a substância padrão de ivermectina (22,23 dihidroavermectina-B1, pureza, > 98%), glutationa reduzida (GSH) e 1-cloro -2,4-dinitrobenzeno (CDNB) foram adquiridos da indústria quÍmica Sigma-Aldrich Co. (St. Louis, MO, USA). Todos os outros reagentes quÍmicos foram de grau laboratorial padrão.
Organismo teste
Minhocas do gênero Eisenia da espécie foetida (Lumbricidae, Annelida) foram obtidas a partir do Minhocário da UFPel - Pelotas/RS e posteriormente multiplicadas e mantidas no minhocário da URCAMP/Bagé-RS de acordo com as condições descritas por (Morselli 2009). Posteriormente, foram selecionadas 50 minhocas adultas e com clitelo desenvolvido para dar inÍcio a uma colônia mantida em esterco bovino e sob condições padronizadas de temperatura (20º ± 1ºC), fotoperÍodo (12:12 h: ciclo claro-escuro) e umidade (75%) em câmara climatizada. As minhocas utilizadas nos experimentos foram adultas com clitelo desenvolvido e obtidas a partir da colônia padronizada, com pelo menos três meses de idade, mas não mais que um ano, com pesos individuais variando entre 350 e 550 mg. Então, estas foram retiradas do substrato de manutenção 24 h antes do inÍcio dos testes, selecionadas e armazenadas em placas de Petri sobre papel filtro úmido no Laboratório de BioquÍmica e Toxicologia Animal - CCR/URCAMP-Bagé, RS, sob temperatura de 20 ± 1 ºC com luz 12:12 h: ciclo claro-escuro, para esvaziamento do conteúdo intestinal.
Procedimento experimental
Foi utilizado esterco bovino como substrato teste neste estudo, oriundo dos mesmos animais e do mesmo local do esterco usado para a manutenção, livre de resÍduos de produtos veterinários.
Para o experimento foram selecionadas concentrações de IVM (1 mg kg-1, 5 mg kg-1 e 10 mg kg-1) ambientalmente relevantes com base em estudos anteriores Halley et al. (1989); Sommer y Steffansen (1993); Herd et al. (1996) e Iglesias et al. (2006) assim como, concentrações subletais (50 mg kg-1 e 100 mg kg-1) determinadas em trabalhos desenvolvidos por Halley et al. (1989); Gunn y Sadd (1994); Sun et al. (2005) e Wang et al. (2012).
Desta forma, as minhocas foram divididas aleatoriamente em seis grupos, com quatro repetições: (1) controle: 0 mg kg-1, (2) ivermectina (IVM): 1 mg kg-1, (3), 5 mg kg-1 (4), 10 mg kg-1 (5), 50 mg kg-1 e (6) 100 mg kg-1.
A substância quÍmica teste (ivermectina [IVM]) foi dissolvida em acetona e em seguida, misturada ao esterco para alcançar as concentrações nominais nos tratamentos a serem efetuados com base na massa seca do substrato. água destilada foi adicionada à mistura, para atingir 75% da massa. Os substratos depois de serem misturados com a substância quÍmica foram colocados em gabinete ventilado, para permitir a evaporação da acetona residual e posteriormente transferidos para recipientes plásticos. água foi adicionada para compensar a massa perdida, devido à evaporação de acetona e, em seguida dez minhocas foram introduzidas em cada recipiente. Este teste segue as recomendações preconizadas por Gao et al. (2007).
Para evitar que as minhocas escapem e que ocorra presença de organismos indesejados, os recipientes foram fechados com tampas perfuradas que permitem também uma adequada ventilação.
Os recipientes teste foram de poliestireno com uma base de 110 a 155 mm e com altura de 60 mm, mantidos sob temperatura de 20 ± 2ºC com luz 12:12 h: ciclo claro-escuro Laboratório de BioquÍmica e Toxicologia Animal - CCR/ URCAMP-Bagé, RS.
O teste de toxicidade para avaliar os efeitos sobre a enzima glutationa-S-transferase de Eisenia foetida foi conduzido durante um perÍodo de 7, 14 e 28 dias de exposição de acordo com as recomendações de OECD (1984).
Avaliação da enzima gst em Eisenia foetida
Preparo das amostras
As minhocas foram retiradas dos recipientes ao término de cada perÍodo experimental, lavadas com água deionizada e antes das análises bioquÍmicas foram incubadas sem alimentação por vinte e quatro horas em papel de filtro Whatman nº 1 umedecido, à temperatura ambiente para esvaziar seu conteúdo do trato digestório (Reinecke y Reinecke 2007).
As oligoquetas inteiras, após o esvaziamento digestório foram congeladas em nitrogênio lÍquido e em seguida armazenadas à - 20ºC até a análise (não superior a uma semana) no Laboratório de BioquÍmica e Toxicologia Animal (CCR/URCAMP-Bagé/RS).
Os organismos teste foram homogeneizados em tampão Tris-HCl (0,1 M, pH 7,6) em quatro partes (4:1 peso:volume), contendo fluoreto de fenilmetilsulfonil (PMSF; 0,1 mM) em um homogeneizador de tecidos Heidolph a 6.000 rpm. Em seguida, o homogeneizado foi centrifugado a 9.000g por 30 min em uma centrÍfuga Coleman modelo 90-1, resultando em um sobrenadante (S1) que foi utilizado para a medida da atividade enzimática da GST. Todos os preparos teciduais foram realizados a 4ºC.
Descrição do método enzimático
A atividade da enzima glutationa-S-transferase (GST) foi medida usando o método preconizado por Habig et al. (1974) com CDNB como substrato para a medição espectrofotométrica em 340 nm à 25º C, utilizando o analisador bioquÍmico semiautomático TP Analyzer - Thermoplate. O ensaio foi realizado com a adição sucessiva de 960 µL de tampão Tris (0,1 mol L-1, pH 7), 10 µL de CDNB (100 mmol L-1), 10 µL de glutationa (GSH, 100 mmol L-1) e 20 µL do sobrenadante de minhoca. A reação foi iniciada pela adição de GSH.
Uma unidade da GST foi calculada como µmol de CDNB conjugado por mg de proteÍna (U mg-1 proteÍna), usando o coeficiente de extinção molar de 9,6 mM-1 cm-1. Para o cálculo da atividade enzimática, foi utilizado a variação da absorbância por minuto 1 (? ABS/minuto) durante 60 segundos conforme Habig et al. (1974), desta forma, a atividade enzimática foi expressa em mmol mg-1 proteÍna minuto-1.
O conteúdo de proteÍnas totais para o extrato enzimático foi mensurado pelo método de Biureto por meio de um kit diagnóstico (Labtest - Lagoa Santa, MG/Brasil). Todas as determinações foram realizadas em triplicata.
Análise estatÍstica
Todos os resultados são apresentados como a média ± desvio padrão (DP). Os dados foram submetidos primeiramente ao teste de normalidade e homogeneidade das variâncias (Teste de Levene), como pressuposto para a realização do teste de ANOVA de uma via entre os grupos testados, seguidos de comparações post-hoc (teste de Duncan em dois nÍveis de significância: P < 0,05 e P < 0,01) para indicar a diferença entre grupos tratados em relação ao grupo controle.
Todas as análises estatÍsticas foram realizadas utilizando-se o software IBM SPSS 20 e os dados plotados por intermédio do software SigmaPlot 10.0.
Resultados
Conforme observado na Figura 1, aos sete dias de exposição à ivermectina detectou-se diferenças (ANOVA, F = 9.39) entre os grupos testados. Foi verificado um pequeno aumento na atividade da glutationa-s-transferase (GST) nas concentrações de 1 e 5 mg kg-1, embora não seja estatisticamente diferente do controle. Na concentração de 10 mg kg-1 pode-se observar que houve uma redução significativa (P < 0,05) na atividade da GST, enquanto nas concentrações de 50 e 100 mg kg-1, foi verificado uma maior redução (P < 0,01) na atividade da GST em relação ao grupo controle.

Figura 1. Atividade da enzima glutationa-S-transferase de Eisenia foetida exposta a diferentes concentrações de ivermectina durante sete dias. Os resultados são expressos como média ± desvio padrão. * Difere significativamente do controle (P < 0,05); ** Difere significativamente do controle (P < 0,01).
Aos catorze dias de exposição à ivermectina, diferenças (ANOVA, F = 4.80) entre os grupos também foram detectadas, houve um aumento (P < 0,01) na atividade da enzima glutationa -s-transferase na concentração de 50 mg kg-1, enquanto que nas demais concentrações não foram verificadas diferenças estatÍsticas em relação ao grupo controle (Figura 2).
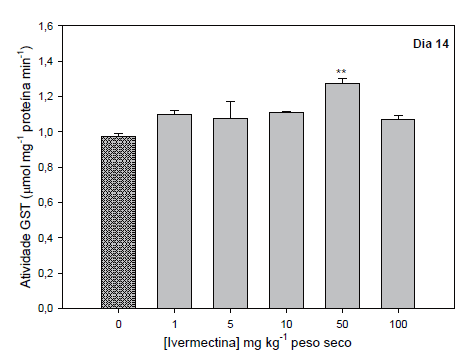
Figura 2. Atividade da enzima glutationa-S-transferase de Eisenia foetida exposta a diferentes concentrações de ivermectina durante catorze dias. Os resultados são expressos como média ± desvio padrão. ** Difere significativamente do controle (P < 0,01).
Foi observado que aos vinte e oito dias de exposição à ivermectina diferenças (ANOVA, F = 7.05) entre os grupos, devido a um aumento (P < 0,01) da atividade da enzima glutiona-stransferase, nas concentrações de 50 mg kg-1 e 100 mg kg-1, em quanto que nas demais concentrações (1 mg kg-1, 5 mg kg-1 e 10 mg kg-1) estatisticamente não houveram diferenças em relação ao grupo controle, conforme observado na figura 3.

Figura 3. Atividade da enzima glutationa-S-transferase de Eisenia foetida exposta a diferentes concentrações de ivermectina durante vinte e oito dias. Os resultados são expressos como média ± desvio padrão. ** Difere significativamente do controle (P < 0,01).
Discussão
Durante este estudo, foi verificado que aos sete dias de exposição à ivermectina houve uma redução significativa na atividade da GST de Eisenia foetida nas concentrações de 10 mg kg-1 a 100 mg kg-1, enquanto que nas concentrações mais baixas não foi observado alteração em relação ao grupo controle. Esta inibição evidenciada na atividade da GST pode ser atribuÍda ao estresse tóxico ocasionado pela ivermectina sobre a Eisenia foetida.
De acordo com Halley et al. (1989) o nÍvel de avermectinas excretado nas fezes varia conforme o tipo de animal, doses administradas e formas de aplicação, podendo alcançar concentrações de até 18.5 ± 7.4 mg kg-1 (Herd et al.1996).
Embora tenha sido demonstrado em alguns estudos que os efeitos da ivermectina em minhocas sejam improváveis em concentrações ambientalmente relevantes (Svendsen et al. 2003; Kaneda et al. 2006), os resultados obtidos neste trabalho mostram que a atividade da GST é inibida nestes organismos dentro das condições de ensaio utilizadas.
A diminuição da atividade desta enzima pode ser atribuÍda ao acúmulo de conjugados de GSH, possivelmente pela inibição seletiva da expressão gênica da GST como demonstrado por Srivastava et al. (1999). Somando-se a isso, o estresse oxidativo gerado pelo excesso de radicais livres ocasionado pela exposição a produtos quÍmicos também pode ajudar a explicar este fato (Xie et al. 2001; Xue et al. 2009).
Entre os sistemas endógenos de detoxificação, a GST possui um papel crÍtico na proteção contra eletrófilos e produtos do estresse oxidativo, por catalisar a conjugação da GSH com uma ampla variedade de compostos, desta forma a inibição da enzima resulta em menor proteção celular, menor metabolização de xenobióticos e aumento na suscetibilidade ao estresse oxidativo (Sheehan et al. 2001).
Têm-se demonstrado em outras pesquisas que a atividade da GST de Eisenia foetida também pode ser reduzida durante a exposição a altas concentrações de substâncias como o decabromodifenil éter (Xie et al. 2011) e tetrabromobisfenol A (Xue et al. 2009).
Por outro lado, Lin et al. (2010) mostraram que a atividade da GST de E. foetida foi estimulada após uma exposição de dois dias ao triclosan com a dose de 300 mg kg-1, no entanto, o efeito prolongado deste produto resultou em inibição da enzima.
Há escassez de dados na literatura em relação aos efeitos de lactonas macrocÍclicas sobre a GST de Eisenia foetida, entretanto trabalhos conduzidos em outras espécies revelam que a exposição à concentrações crescentes (100 e 300 mg kg-1 solo) de abamectina diminui a atividade da GST de Porcellio scaber (Kolar et al. 2010), enquanto que Jr. Vaz et al. (2004) não observaram alteração na GST de Boophilus microplus frente à ivermectina.
Neste estudo, foi observado que aos catorze dias de exposição à IVM houve flutuações na atividade da enzima glutationa-S-transferase, com elevação registrada de 1,27 ± 0,05 mmol mg-1 proteÍna minuto-1 na concentração de 50 mg kg-1, enquanto que nas demais concentrações não houveram diferenças em relação ao grupo controle (0,97 ± 0,039 mmol mg-1 proteÍna minuto-1).
As exposições a fatores de estresse ambiental podem regular vários genes, estimulando ou inibindo a expressão gênica de proteÍnas relacionadas a funções de proteção celular (Rizwan- ul-Haq et al. 2012). Desta forma, o contato com a ivermectina durante 14 dias poderia desencadear o estÍmulo de genes responsáveis pela sÍntese da enzima GST, explicando o fato do aumento da atividade neste perÍodo.
Ao contrário da redução na atividade da GST observada aos sete dias de exposição à IVM, aos vinte oito dias de tratamento os resultados mostram claramente valores elevados na atividade enzimática em resposta às concentrações de 50 mg kg-1 e 100 mg kg-1 (1,29 ± 0,06 e 1,36 ± 0,19 mmol mg-1 proteÍna minuto-1, respectivamente) em relação ao controle com atividade 1,03 ± 0,08 unidades de GST mg-1 proteÍnas.
Dados semelhantes foram observados por Rizwan- ul-haq et al. (2012) que relataram indução da GST de Eisenia foetida expostas à elevadas concentrações de roxarsona e ácido arsenÍlico. Da mesma forma, em estudos in vitro conduzidos por El-Shenawy (2010) houve aumento na atividade da GST em hepatócitos de ratos expostos à abamectina. Também foi demonstrado que a substância decabromodifenil éter induz a atividade da GST, embora somente em baixas concentrações (Xie et al. 2011).
A indução da GST é um processo fundamental na proteção celular contra uma variedade de substâncias tóxicas pró-oxidantes (Otitoju y Onwurah 2007). Além disso, promove uma melhor detoxificação dos xenobióticos através da formação de um complexo com a GSH (El- Shenawy 2010).
O aumento na atividade da GST aos 28 dias de exposição observado neste estudo, pode ser devido a uma resposta adaptativa da Eisenia foetida frente à ivermectina, como demonstrado por (El-Shenawy 2010), que relataram em hepatócitos de ratos a adaptação a vários inseticidas pela indução da GST.
Respostas adaptativas a substâncias quÍmicas estão relacionadas com um incremento na expressão gênica da GST, como verificado por Nadeau et al. (2001) após a exposição de Eisenia foetida a metais e a compostos como a roxarsona e ao ácido arsanÍlico (Rizwan-ul-Haq et al. 2012).
Conclusão
Neste trabalho, foi observado que a ivermectina em altas concentrações (10 mg kg-1, 50 mg kg-1 e 100 mg kg-1) reduz a atividade da GST de Eisenia foetida aos sete dias de exposição, possivelmente ocasionado pelo estresse tóxico. Entretanto, com o prolongamento da exposição (14 e 28 dias) houve uma indução da atividade enzimática, provavelmente resultante de uma adaptação metabólica neste organismo. Este estudo foi útil para compreender o papel da GST como um biomarcador potencial de exposição a substâncias contaminantes do solo como a ivermectina em Eisenia foetida, no entanto pesquisas adicionais necessitam ser realizadas para avaliar o efeito deste fármaco por intermédio de outros testes laboratoriais e de campo.
Agradecimentos
Ao Programa de Pós-Graduação em Sistemas de Produção AgrÍcola Familiar (PPG-SPAF/UFPEL-Pelotas/RS) e à Pró-Reitoria de Inovação, Pós-Graduação, Pesquisa e Extensão (PROIPPEX) da Universidade da Região da Campanha (URCAMP/Bagé-RS) pelo financiamento deste estudo.
Bibliografia citada
1. Aly M., Schroder P. Effect of herbicides on glutathione S-transferases in the earthworm, Eisenia fetida. Environ Sci Pollut Res Int. 2008;15:143-149. [ Links ]
2. Armstrong R.N. Structure, catalytic mechanism, and evolution of the glutathione transferases. Chem Res Toxicol. 1997;10:2-18. [ Links ]
3. Bainy A.C.D., Almeida E.A., Muller I.C., Ventura E.C., Medeiros I.D. Biochemical responses in farmed mussels Perna perna transplanted to contaminated sites on Santa Catarina Island, SC Brazil. Mar Environ Res. 2000;50:411-416. [ Links ]
4. Booth L.H., Heppelthwaite V., McGlinchy A. The effect of environmental parameters on growth, cholinesterase activity and glutathione Stransferase activity in the earthworm Apporectodea caliginosa. Biomarkers. 2000;5:46-55. [ Links ]
5. Carlsson C., Johansson A.K., Alvan G., Bergman K., Kuhler T. Are pharmaceuticals potent environmental pollutants? Part I: Environmental risk assessments of selected active pharmaceutical ingredients. Sci Total Environ. 2006;364:67- 87. [ Links ]
6. DÍaz-Cruz, M.S., López de Alda, M.J., Barceló D. Environmental behavior and analysis of veterinary and human drugs in soils, sediments and sludge. Trends Analyt Chem. 2003;22:340-351. [ Links ]
7. El-Shenawy N.S. Effects of insecticides fenitrothion, endosulfan and abamectin on antioxidante parameters of isolated rat hepatocytes. Toxicol In Vitro. 2010;24:1148-1157. [ Links ]
8. Errouissi F., Alvinerie M., Galtier P., Kerboeuf D., Lumaret J.P. The negative effects of the residues of ivermectin in cattle dung using a sustained-release bolus on Aphodius constans (Duft.) (Coleoptera: Aphodiidae). Vet Res. 2001;32:421-427. [ Links ]
9. Fent K., Weston A.A., Caminada D. Ecotoxicology of human pharmaceuticals. Aquat Toxicol. 2006;76:122-159. [ Links ]
10. Fernandez C., San Andres M., Porcel M.A., Rodriguez C., Alonso A., Tarazona J.V. Pharmacokinetic profile of ivermectin in cattle dung excretion, and its associated environmental hazard. Soil Sediment Contam. 2009;18:564-575. [ Links ]
11. Floate K.D., Wardhaugh K.G., Boxall A.B., Sherratt T.N. Fecal residues of veterinary parasiticides: nontarget effects in the pasture environment. Annu Rev Entomol. 2005;50:153-179. [ Links ]
12. Forrester S.G., Prichard R.K., Dent J.A., Beech R.N. Haemonchus contortus: HcGluCla expressed in Xenopus oocytes forms a glutamate- gated ion channel that is activated by ibotenate and the antiparasitic drug ivermectin. Mol Biochem Parasitol. 2003;129:115-121. [ Links ]
13. Frova C. Glutathione transferases in the genomics era: new insights and perspectives. Biomol Eng. 2006;149-169. [ Links ]
14. Gao Y., Sun Z., Liu Y., Sun X., Li Y., Bao Y., Wang G., Wang G. Effect of albendazole anthelmintics on the enzyme activities of different tissue regions in Eisenia fetida. Eur J Soil Biol. 2007;43:S246-S251. [ Links ]
15. Gunn A., Sadd J.W. The effect of ivermectin on the survival, behaviour and cocoon production of the earthworm Eisenia fetida. Pedobiologia. 1994;38:327-333. [ Links ]
16. Habig W.H., Pabst M.J., Jakoby W.B. Glutathione- S-transferase: the first enzymatic step in mercapturic acid formation. J Biol Chem. 1974;249(22):7130-7139. [ Links ]
17. Halley B.A., Jacob T.A., Lu A.Y. The environmental impact of the use of ivermectine: Environmental effects and fate. Chemosphere. 1989;18:1543-1563. [ Links ]
18. Herd R. Endectocidal drugs: Ecological Risks and Counter-Measures. Int J Parasitol. 1995;(25)8:875-885. [ Links ]
19. Herd R., Sams R.A., Ashcraft S.M. Persistence of ivermectin in plasma and faeces following treatment of cows with ivermectin sustained -release, pour-on or injectable formulations. Int J Parasitol. 1996;26:1087-1093. [ Links ]
20. Holter P., Sommer C., Gronvold J., Madsen M. Effects of ivermectin treatment on the attraction of dung beetles (Coleoptera, Scarabaeidae and Hydrophilidae) to cow pats. Bull Entomol Res. 1993;83:53-58. [ Links ]
21. Horvat A.J.M., Petrovic´ M., Babic´ S., Pavlovic´ D.M., Asperger D., Pelko S., Mance A.D., Kastelan- Macan M. Analysis, occurrence and fate of anthelmintics and their transformation products in the environment. Trends Analyt Chem. 2012;31:61-84. [ Links ]
22. Iglesias A., Nebot C., Miranda J.M., Vázquez B.I., Cepeda A. Detection and quantitative analysis of 21 veterinary drugs in river water using high-pressure liquid chromatography coupled to tandem mass spectrometry. Environ Sci Pollut Res Int. 2012;19(8):3235-49. [ Links ]
23. Iglesias L.E., Fusé L.A., Lifschitz A.L., RodrÍguez E.M., Sagüés M.F., Saumell C.A. Environmental monitoring of ivermectin excreted in spring climatic conditions by treated cattle on dung fauna and degradation of faeces on pasture. Parasitol Res. 2011;108:1185-1191. [ Links ]
24. Iglesias L.E., Saumell C.A., Fernandez A.S., Fuse L.A., Lifschitz A.L., Rodriguez E.M., Steffan P.E., Fiel, C.A. Environmental impact of ivermectin excreted by cattle treated in autumn on dung fauna and degradation of faeces on pasture. Parasitol Res. 2006;100:93-102. [ Links ]
25. International Standard Organization (ISO). Soil Quality: Effects of Pollutants on Earthworms (Eisenia fetida). Part II. Method for the Determination of Effects on Reproduction. ISO, Geneva. Standard Number No. 11268-2. 1998. [ Links ]
26. Jensen J., Krogh P.H., Sverdrup L.E. Effects of the antibacterial agents tiamulin, olanquindox and metronidazole and the anthelmintic ivermectin on the soil invertebrate species Folsomia metaria (Collembola) and Enchytraeus crypticus (Enchytraeidae). Chemosphere. 2003;50:437-443. [ Links ]
27. Jr Vaz I.S., Lermen T.T., Michelon A., Ferreira C.A.S., Freitas D.R.J., Termignoni C., Masuda A. Effect of acaricides on the activity of a Boophilus microplus glutathione S-transferase. Vet Parasitol. 2004;119:237-245. [ Links ]
28. Kaneda S., Yamashita N., Uchida T., Shimano S., Miyoshi N., Sasaki M., Enami Y. Effects of ivermectin in dung pats on earthworm (Megascolecidae) populations and pat degradation in Japanese grassland. Appl Soil Ecol. 2006;31:280-285. [ Links ]
29. Kolar L., Jemec A., Van Gestel C.A.M., Valant J., Hrzenjak R., Kozuh Erzen N., Zidar P. Toxicity of abamectin to the terrestrial isopod Porcellio scaber (Isopoda, Crustacea). Ecotoxicology. 2010;19:917-927. [ Links ]
30. Krogh K.A., Soeborg T., Brodin B., Halling- Sorensen B. Sorption and mobility of ivermectin in different soils. J Environ Qual. 2008;37:2202-2211. [ Links ]
31. Kwon-Rae K., Gary O., Soon-Ik K., Kyu-Ho S., Deog-bae L., Yong S.O. Occurrence and environmental fate of veterinary antibiotics in the terrestrial environment. Water Air Soil Pollut. 2011;214:163-174. [ Links ]
32. Lacourse E.J., Hernandez-Viadel M., Jefferies J.R., Svendsen C., Spurgeon D.J., Barrett J., Morgan A.J., Kille P., Brophy P.M. Glutathione transferase (GST) as a candidate molecular -based biomarker for soil toxin exposure in the earthworm Lumbricus rubellus. Environ Pollut. 2009;157:2459-2469. [ Links ]
33. Lannutti F., Marrone A., Nazzareno R.E. Binding of GSH conjugates to p-GST: A cross-docking approach. J Mol Graph Model. 2012;32:9-18.
34. Lavelle P., Barot S., Blouin M., Decaëns T., Jimenez J.J., Jouquet P. Earthworms as key actors in Self-organized soil systems. Cap. 5. In: Ecosystem Engineers, Elsevier, Inc. 2007. P. 77-106. [ Links ]
35. Lin D.S, Zhou Q., Xu Y., Chen C., Liu Y. Physiological and molecular responses of the earthworm (Eisenia fetida) to soil chlortetracycline contamination. Environ Pollut. 2012;171:46-51. [ Links ]
36. Lin D.S., Zhou Q.X., Xie X.J., Liu Y. Potential biochemical and genetic toxicity of triclosan as an emerging pollutant on earthworms (Eisenia fetida). Chemosphere. 2010;81:1328-1333. [ Links ]
37. Lowe C.N., Butt N.R. Earthworm culture, maintenance and species selection in chronic ecotoxicological studies: A critical review. Eur J Soil Biol. 2007;43:281-288. [ Links ]
38. Lukkari T., Taavitsainen M., Soimasuo M., Oikari A., Haimi J. Biomarker responses of the earthworm Aporrectodea tuberculata to copper and zinc exposure, differences between populations with and without earlier metal exposure. Environ Pollut. 2004;129:377-386. [ Links ]
39. Lumaret J.P., Errouissi F. Use of anthelmintics in herbivores and evaluation of risks for the non-target fauna of pastures. Vet Res. 2002;33:547-562. [ Links ]
40. Maity S., Roy S., Chaudhury S., Bhattacharya S. Antioxidant responses of the earthworm Lampito mauritii exposed to Pb and Zn contaminated soil. Environ Pollut. 2008;151:1-7. [ Links ]
41. Mannervik B., Awasthi Y.C., Board P.G., Hayes J.D., Di Ilio C., Ketterer B., Listowsky L., Morgenstern R., Muramatsu M., Pearson W.R., Pickett C.B., Sato K., Widersten M., Wolf C.R. Nomenclature for human glutathione transferases. Biochem J. 1992;282:305-306. [ Links ]
42. Mannervik B., Danielson U.H. Glutathione transferases-structure and catalytic activity. CRC Crit Rev Biochem. 1988;23:283-337. [ Links ]
43. Morley N. Environmental risk and toxicology of human and veterinary waste pharmaceutical exposure to wild aquatic hosteparasite relationships. Environ Toxicol Pharmacol. 2009;27:161-175. [ Links ]
44. Morselli, T.B.G.A. Minhocultura. Pelotas RS: UFPEL. 2009. [ Links ]
45. Mougin C., Kollmann A., Dubroca J., Ducrot P.H., Alvinerie M., Galtier P. Fate of the veterinary medicine ivermectin in soil. Environ Chem Lett . 2003;1:131-134. [ Links ]
46. Nadeau D., Corneau S., Plante I., Morrow G., Tanguay R.M. Evaluation for Hsp70 as a biomarker of effect of pollutants on the earthworm Lumbricus terrestris. Cell Stress Chaperones. 2001;6:153-163. [ Links ]
47. Nie X.P., Liu B.Y., Yu H.J., Liu W.Q., Yang Y.F. Toxic effects of erythromycin, ciprofloxacin and sulfamethoxazole exposure to the antioxidant system in Pseudokirchneriella subcapitata. Environ Pollut. 2013;172:23-32. [ Links ]
48. Omura S. Ivermectin: 25 years and still going strong. Int J Antimicrob Agents. 2008;31:91-98. [ Links ]
49. Oppel J., Broll G., Loffler D., Meller M., Rombke J., Ternes T., Leaching behaviour of pharmaceuticals in soil-testing systems: a part of an environmental risk assessment for groundwater protection. Sci Total Environ. 2004;328:265-272. [ Links ]
50. Organization for Economic Cooperation and Development (OECD). Guidelines for Testing of Chemicals, Earthworm, Acute Toxicity Tests (Filter Paper Test and Artificial Soil Test), vol. 207. Paris. 1984. [ Links ]
51. Otitoju O., Onwurah I.N.E. Glutathione Stransferase (GST) activity as a biomarker in ecological risk assessment of pesticide contaminated environment. Afr J Biotechnol. 2007;6:455-1459. [ Links ]
52. Ratte H.T, Hammers-Wirtz M., Cleuvers M. Ecotoxicity testing. Cap. 7. In: Markert B.A., Breure A.M., Zechmeister H.G. Eds. Bioindicators and biomonitors. Elsevier Science Ltd,; 2003. P. 221-256. [ Links ]
53. Reinecke S.A., Reinecke A.J. Biomarker response and biomass change of earth-worms exposed to chlorpyrifos in microcosms. Ecotoxicol Environ Saf. 2007;66:92-101. [ Links ]
54. Rizwan-Ul-Haq M., Zhenling Z., Yongxue S., Wenguang X. Evaluation of glutathione s-transferase as toxicity indicator for roxarsone and arsanilic acid in Eisenia fetida. J Appl Toxicol. 2012;32:731-738. [ Links ]
55. RÖmbke J., Hempel H., Scheffczyk A., Schallnaß H.J., Alvinerie M., Lumaret J.P. Environmental risk assessment of veterinary pharmaceuticals: Development of a standard laboratory test with the dung beetle Aphodius constans. Chemosphere. 2007;70:57-64. [ Links ]
56. RÖmbke J., Krogh K.A., Moser T., Scheffczyk A., Liebig M. Effects of the veterinary pharmaceutical ivermectin on soil invertebrates in laboratory tests. Arch Environ Contam Toxicol. 2010;58:332-340. [ Links ]
57. Saint-Denis M., Labrot F., Narbonne J.F., Ribera D. Glutathione, glutathione related enzymes and catalase activities in the earthworms Eisenia fetida andrei. Arch Environ Contam Toxicol. 1998;35:602-614. [ Links ]
58. Saint-Denis M., Narbonne J.F., Arnaud C., Ribera D. Biochemical responses of the earthworm Eisenia fetida andrei exposed to contaminated artificial soil, effects of lead acetate. Soil Biol Biochem. 2001;33:395-404. [ Links ]
59. Sarmah A.K., Meyer M.T., Boxall A.B.A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment. Chemosphere. 2006;65:725-759. [ Links ]
60. Sheehan D., Meade G., Foley V.W., Dowd C.A. Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily. Biochem J. 2001;360:1-16. [ Links ]
61. Shoop W.L., Mrozik H., Fisher M.H. Structure and activity of avermectins and milbemycins in animal health. Vet Parasitol. 1995;59:139-156. [ Links ]
62. Sommer C., Bibby B.M. The influence of veterinary medicines on the decomposition of dung organic matter in soil. Eur J Soil Biol. 2002;38:155-159. [ Links ]
63. Sommer C., Steffansen B. Changes with time after treatment in the concentrations of ivermectin in fresh cow dung and in cow pats aged in the field. Vet Parasitol. 1993;48:67-73. [ Links ]
64. Sommer C., Steffansen B., Nielsen B.O., Jensen V., Jespersen K.M.V., Springborg J.B., Nansen P. Ivermectin excreted in cattle dung after subcutaneous injection or pouron treatment-- concentrations and impact on dung fauna. Bull Entomol Res. 1992;82:257-264. [ Links ]
65. Srivastava S.K., Singhal S.S., Hu X., Awasthi Y.C., Zimniak P., Singh SV. Differential catalytic efficiency of allelic variants of human glutathione S-transferase Pi in catalyzing the glutathione conjugation of thiotepa. Arch Biochem Biophys. 1999;366:89-94. [ Links ]
66. Suárez V.H. Helminthic control on grazing ruminants and environmental risks in South America. Vet Res. 2002;33:563-573. [ Links ]
67. Suárez V.H., Lifschitz A.L., Sallovitz J.M., Lanusse C.E. Effects of faecal residues of moxidectin and doramectin on the activity of arthropods in cattle dung. Ecotoxicol Environ Saf. 2009;72:1551-1558. [ Links ]
68. Suárez V.H., Lifschitz A.L., Sallovitz J.M., Lanusse C.E. Effects of ivermectin and doramectin faecal residues on the invertebrate colonization of cattle dung. J Appl Entomol. 2003;127:481-488. [ Links ]
69. Sun Y., Diao X., Zhang Q., Shen J. Bioaccumulation and elimination of avermectin B1a in the earthworms (Eisenia fetida). Chemosphere. 2005;60:699-704. [ Links ]
70. Svendsen T.S., Grønvold J., Holter P., Sommer C. Field effects of ivermectin and fenbendazole on earthworm populations and the disappearance of dung pats from bolus-treated cattle. Appl Soil Ecol. 2003;24:207-218. [ Links ]
71. Torre A.D.L., Iglesias I., Carballo M., Ramirez P., Munoz M.J. An approach for mapping the vulnerability of European Union soils to antibiotic contamination. Sci Total Environ. 2012;414:672-679. [ Links ]
72. Velki M., Hackenberger B.K. Biomarker responses in earthworm Eisenia andrei exposed to pirimiphos-methyl and deltamethrin using different toxicity tests. Chemosphere. 2013;90:1216-1226. [ Links ]
73. Wang Y., Cang T., Zhao X., Yu R., Chen L., Wu C., Wang Q. Comparative acute toxicity of twentyfour insecticides to earthworm, Eisenia fetida. Ecotoxicol Environ Saf. 2012;79:122-128. [ Links ]
74. Wratten S.D., Mead-Briggs M., Gettinby G., Ericsson G., Baggott D.G. An evaluation of the potential effects of ivermectin on the decomposition of cattle dung pats. Vet Rec. [ Links ]














