Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta toxicológica argentina
On-line version ISSN 1851-3743
Acta toxicol. argent. vol.27 no.3 Ciudad Autónoma de Buenos Aires Dec. 2019
REPORTE DE CASOS
Tratamiento tardío de la intoxicación por paraquat en pacientes pediátricos. Reporte de dos casos
Late treatment of paraquat poisoning in pediatric patients. Report of two cases
Ramos-Gutiérrez, Ruth Yesica1*; Real-Ornelas, Gabriel Alejandro2; González Ruiz, Héctor Andrés1; Lona-Reyes, Juan Carlos1; Acuña-Chávez, Nancy1; Barriga-Marín, Javier Alvaro1
1Hospital Civil Nuevo de Guadalajara Dr. Juan I Menchaca Salvador Quevedo y Zubieta No. 750 C.P. 44340, Guadalajara, Jalisco, México. 2CIMATOX, S.A.S. de C.V. Centro Integral de Medicina Ambiental y Toxicología María Reyes 2.C.P. 44820, Guadalajara, Jalisco, México.
Recibido: 4 de agosto de 2019
Aceptado: 30 de diciembre de 2019
Resumen
El paraquat (PQ) pertenece al grupo de herbicidas de los bipiridilos. Su presentación es en forma líquida o en granulado, usándose con una concentración al 5 %, para uso en jardinería y al 20 % para uso agrícola. En la intoxicación en humanos el órgano blanco es el pulmón. Los pacientes desarrollan insuficiencia respiratoria que puede explicarse por una inicial actividad que involucra un gran estrés oxidativo, con presencia de radicales libres de oxígeno y peroxidación lipídica, con sus consecuentes daños, además de infiltración por polimorfonucleares que con su reacción de liberación empeoran la neumonitis. Puede haber mejoría de la neumonitis y el daño en algunos órganos, pero pronto la aparición de fibrosis pulmonar lleva a falta de respuesta a la administración de oxígeno y a la muerte por insuficiencia respiratoria en algunos días a semanas. De acuerdo con la cantidad ingerida varía la evolución de la severidad del cuadro clínico. Se presentan dos pacientes pediátricos con intoxicación por PQ, a quienes se les inició tratamiento inmunosupresor después de 48 horas de la exposición. Uno de los pacientes se intoxicó de manera no intencional y otro por suicidio. Los dos pacientes recibieron tratamiento similar, sin embargo, el paciente con intención suicida falleció días después de la exposición. Se hace una revisión de la literatura sobre el tratamiento administrado.
Palabras clave: Paciente pediátrico; Intoxicación con paraquat; Tratamiento inmunosupresor; México.
Abstract
Paraquat (PQ) belongs to the bipyridyls herbicides. Its presentation is liquid or granulated, being used at concentrations of 5 %, in gardening and 20 % in agricultural use. In human poisoning, the target organ is the lung. The patients develop respiratory insufficiency that can be explained by an initial activity that involves a great oxidative stress, with the presence of oxygen free radicals and lipid peroxidation, with its consequent damages, in addition to polymorphonuclear infiltration that with its liberation reaction worsen pneumonitis. There may be improvement of pneumonitis, but the appearance of pulmonary fibrosis will lead to a lack of response to the administration of oxygen and death due to respiratory failure in a few days to a few weeks. According to the amount ingested, the evolution of the severity of the clinical picture varies. We present two pediatric patients with PQ poisoning, who were started on immunosuppressant treatment after 48 hours of exposure. One of the patients was poisoned incidentally and the other one by suicide. The two patients received similar treatment, however, the patient with suicidal intention died days after the exposure. A review of the literature on the treatment offered is made.
Keywords: Children; Paraquat poisoning; Immunosuppressive treatment; México.
Introducción
El PQ pertenece al grupo de los herbicidas bipiridilos. Se le conoce como dicloruro de 1,1’ dimetil-4,4’ bipiridilo, Su fórmula química es C12H14Cl2N2. En México se le conoce como “Quema zacate”. Destruye las partes verdes de las plantas en presencia de la luz solar. Es hidrosoluble, actúa por contacto y es uno de los más tóxicos para el hombre y los animales. Produce daño multisistémico, con predominio en pulmones, riñones e hígado. El pulmón es el órgano blanco (Urdaneta-Carruyo y col. 2012).
La mortalidad varía dependiendo de la cantidad ingerida, el tiempo en que se inicie el tratamiento y la edad del paciente. La mortalidad se estima entre un 33 a 78 % (Kim y col. 2011)
La mayoría de los estudios que se han publicado tratan pacientes en etapas tempranas, inclusive, en algunos de los metaanálisis se excluyen a los pacientes que presentan tiempos de evolución prolongados (Agarwal y col. 2007). En otros estudios se hace énfasis en que la terapéutica inmunosupresora únicamente tiene efecto en las primeras horas. Aunado a esto, la mayoría de los reportes e investigaciones son realizados en países con alta incidencia de intoxicaciones por paraquat donde los profesionales de la salud se encuentran familiarizados con el diagnóstico y la aplicación de tratamiento oportuno. En México es una intoxicación poco conocida, lo que condiciona retraso en su diagnóstico y tratamiento y donde actualmente no se conoce su incidencia exacta.
El objetivo de esta comunicación es dar a conocer la evolución de dos pacientes pediátricos que ingirieron PQ y que recibieron tratamiento inmunosupresor después de 48 horas. Realizar una revisión de la literatura respecto al tratamiento de la intoxicación por este herbicida.
Caso clínico 1
Paciente masculino de 3 años y 9 meses, originario de Nayarit, ingirió una cantidad desconocida de PQ de manera no intencional. Los papás administraron por iniciativa propia jugo de limón y leche, posterior a lo cual presentó vómito. Al segundo día acude a un servicio de salud por presentar disfagia y lesiones causticas en labios, cavidad bucal y faringe. Niegan la presencia de hematemesis, melenas o hematoquecia. Se administró ketorolaco, dexametasona y penicilina. Se le realizó una endoscopía, en la que se menciona quemadura 2A en escala de Zargar en esófago. Al quinto día de la intoxicación fue derivado al Centro de Información y Atención Toxicológica del Hospital Civil de Guadalajara Dr. Juan I Menchaca (CIATJIM). Se inicia terapia a base de metilprednisolona a 30 mg/kg una vez al día durante tres días, y ciclofosfamida a 15 mg/kg por día dos días. Posterior a estas dosis, se brindó manejo con ciclofosfamida a 5 mg/kg seis días más y dexametasona a dosis de 1 mg/kg durante catorce días con retiro gradual.
Durante su estancia se midieron niveles de PQ en orina, resultando en 2 μg/ml al quinto día post ingesta (Figura 1). El paciente a su ingreso presentó lesión renal aguda con diversas alteraciones electrolíticas (Tabla 1), y leucopenia como efecto adverso de la terapia inmunosupresora. En el día 16 postingesta, (noveno día de tratamiento inmunosupresor) el paciente presentó deterioro hemodinámico con choque séptico debido a infección asociada a catéter central. Fue aislada de sus hemocultivos Serratia spp, y fue tratado con amikacina. La infección resolvió de manera adecuada. Durante su estancia no presentó datos clínicos de insuficiencia respiratoria, la radiografía se mantuvo sin infiltrados sugestivos de fibrosis (Figura 2). Fue egresado sin complicaciones.

Figura 1. Test positivo de dithionito de sodio en el paciente 1. Izquierda control negativo, derecha muestra al quinto día post ingesta.
Tabla 1. Secuencia de resultados de exámenes de laboratorio del paciente 1.


Figura 2. Radiografía de tórax del paciente 1 en el día 18 postingesta.
Caso 2
Paciente masculino de 11 años con ingesta de PQ por intento suicida. Manifestó vómitos 12 horas después, sus padres le dieron jugo de limón. Fue atendido en una clínica de primer nivel en las primeras horas post ingesta, donde se le administró un medicamento no especificado y se dio de alta. Al tercer día se derivó al CIATJIM, a su ingreso con presencia de vesículas y úlceras sangrantes en área bucal y faríngea, asimismo, se evidenciaron vómitos con hilos de sangre.
En este paciente no se realizó endoscopia por la sospecha de sangrado del tubo digestivo. Se inició manejo con ciclofosfamida a 15 mg/kg tres días, y a dosis de 5 mg/kg dos días más. Se administró metilprednisolona 1 g diario por cinco días, y posteriormente se continuó con dexametasona a dosis de 20 mg diarios.
Se midieron niveles de PQ en orina los días 3 y 4 post ingesta, encontrando 2 y 1 μg/ml respectivamente (Figura 3). El paciente desde el ingreso presentó lesión renal (Tabla 2). A su ingreso presentaba crépitos en campo pulmonar izquierdo. En el segundo día de hospitalización presentó insuficiencia respiratoria. (Figura 4). Como efecto adverso de la terapia inmunosupresora presentó leucopenia. Nueve días posteriores al ingreso comenzó con datos compatibles con choque séptico. Se iniciaron aminas vasopresoras y antibioticoterapia de amplio espectro. Se realizó un ecocardiograma en el que se encontró disfunción ventricular derecha e hipertensión pulmonar severa (80 mmHg), por lo que se administró levosimendán y sildenafil. Once días después del ingreso presentó paro cardiorrespiratorio que no revirtió a maniobras de reanimación cardiopulmonar.

Figura 3. Test positivo de dithionito de sodio en el paciente 2. Izquierda muestra tercer día post ingesta, centro control negativo, derecha muestra al cuarto día post ingesta.
Tabla 2. Secuencia de resultados de exámenes de laboratorio del paciente 2.
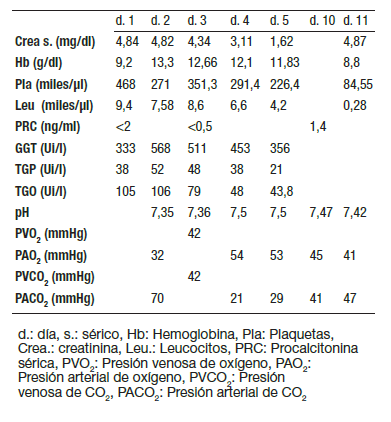

Figura 4. Radiografía de tórax del paciente 2 en el día 6 postingesta.
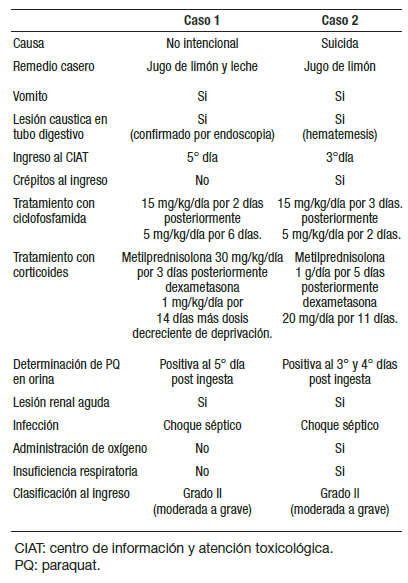
En la Tabla 3 se muestra un cuadro comparativo entre diferentes variables de interés de los casos clínicos presentados.
Tabla 3. Cuadro comparativo entre variables de interés del caso 1 y caso 2.
Discusión
El PQ es clasificado por OMS como un herbicida «moderadamente peligroso, clase II, la dosis tóxica en humanos para desarrollar un cuadro moderado a grave es de 20-40 mg/Kg, lo que equivale a entre 10 y 20 ml de la presentación al 20 % (Africano-López y Moreno-Villamizar 2015). En el caso de estos pacientes se desconoce la cantidad ingerida.
En un estudio realizado en la Guyana Francesa se describen las características clínicas entre los niños y los adultos, reportando que los niños habían ingerido una menor cantidad de PQ (48,8 mg/kg), mientras que en los adultos se reportó de 595,8 mg/kg (p=0,03), presentándose más muertes en el grupo de adultos 65 % versus 22 % en niños, p=0,004 (Elenga y col. 2018)
Duan y Wang (2016) describen que los menores de 10 años suelen ingerir el toxico de manera no intencional, mientras que los mayores de 10 años lo ingieren con fines suicidas (p<0,01)
Los dos pacientes recibieron remedios caseros y a ambos les provocaron el vómito. Se les ofreció tratamiento inmunosupresor en nuestra institución desde su ingreso hasta el desenlace de ambos casos. El paciente que falleció ingresó al segundo día de haber ingerido el PQ, y el paciente que sobrevivió ingresó al quinto día de ingerida la sustancia. Es importante conocer qué cantidad de PQ ingieren los pacientes, sin embargo, todo niño que ingiere este herbicida requiere ser hospitalizado iniciando tratamiento desde que se tiene el antecedente de exposición.
De acuerdo a las manifestaciones clínicas, la intoxicación por PQ se puede clasificar en: Leve (estadio I): cuando la ingestión del PQ se estima que es de 10 ml o menos, o la ingestión de < 20 mg/kg de peso; el paciente puede estar asintomático o tener síntomas leves, limitados al tubo digestivo superior como ulceraciones de la mucosa oral y diarrea. En este estadio, generalmente el paciente logra recuperarse sin secuelas importantes. Moderada a grave (estadio II): cuando la ingestión del PQ es aproximadamente de 10 a 20 ml o bien, es > 20 y < 40 mg/kg de peso. En este caso, el enfermo tiene lesiones cáusticas en el aparato digestivo como ulceraciones esofágicas o gástricas, además de daño hepático y/o renal (caracterizado por nefritis tubular aguda que origina falla renal) y fibrosis pulmonar. Usualmente la muerte de estos pacientes ocurre entre el quinto día y pocas semanas después. En casos severos (estadio III): con ingesta > 20 ml o > 40 mg/kg de peso, el paciente tiene en corto lapso (1-3 días), una falla multiorgánica o shock, que le conduce a la muerte.
En ambos casos se considera que por la evaluación clínica al ingreso correspondían a cuadro de moderado a grave (Urdaneta-Carruyo y col. 2012)
El diagnóstico se realiza con la evolución clínica y el antecedente de exposición. Existen diversas pruebas laboratoriales cuantitativas en suero y en orina con buen rendimiento analítico, como la cromatografía de líquidos de alta resolución, la espectrofotometría de derivadas y sistemas de inyección de flujo con detección espectrofotométrica, por mencionar algunos ejemplos, sin embargo, no son estudios disponibles en el contexto hospitalario de nuestro medio (Fuke y col.1992; Luna y col. 2008; Sun y Chen 2015).
Las pruebas cualitativas o semicuantitativas en orina, suero, contenido gástrico o residuos de líquidos sospechosos de haber sido ingeridos son de utilidad ya que no se necesitan laboratorios de alta complejidad para realizarlas. Una de las disponibles en presentación comercial como prueba rápida es el test de dithionito de sodio, cuyo principio se basa en la reducción del PQ en medio alcalino, lo que produce un catión de color azul, esta prueba tiene un límite de detección de 0,5 μg/ml (Ingale y col. 2015). El catión formado por esta reacción no es estable y la coloración desaparece en pocos minutos, por lo que otra opción es utilizar glucosa como agente reductor, esto ha mostrado buena concordancia con el test de dithionito y además se forma un complejo coloreado más estable. Dado que la intensidad del color depende de la concentración, puede hacerse una estimación semicuantitativa comparando visualmente con estándares de concentración conocida (Luna y col. 2007).
Aunque una prueba negativa no excluye el diagnostico, su negativización desde la ingesta tiene valor pronostico en la intoxicación ya que una persistencia de la reacción positiva después de las 34 horas es un predictor de mortalidad con una sensibilidad del 71,4 % y especificidad del 75,0 %, así mismo, se ha relacionado con lesión renal aguda y con posterior falla respiratoria (Seok y col. 2012).
En ambos pacientes se reportó positiva la prueba cualitativa de dithionito de sodio, en el que sobrevivió permaneció positiva después de los 3 días y en el otro paciente hasta el cuarto día post ingesta, con estimación semicuantitativa de 1 μg/ml.
La determinación de lactato en muestra arterial es otro predictor de mortalidad. Se publicó un meta análisis por Li y col. (2018) donde se menciona que un lactato arterial elevado se relaciona con una alta mortalidad presentando un OR 16,94 (IC 95 %= 7,96- 36,06), p<0,001, con una sensibilidad de 7 7 % y especificidad de 84 %.
No existe un esquema terapéutico internacionalmente aceptado. Se han utilizado medidas de descontaminación e inactivación gástrica como carbón activado y tierra de Fuller, en cuanto a tratamiento se han propuesto esquemas a base de corticoesteroides a distintas dosis, ciclofosfamida, deferoxamina, radiación, vitamina E, vitamina C, N-acetil cisteína, ambientes anóxicos, y terapias de eliminación extracorpóreas como hemodiálisis, hemofiltración continua venovenosa y hemoperfusión; con distintos grados de éxito. (Nasr-Isfahani y col. 2019)
Se recomienda hospitalizar al paciente considerándolo grave, aunque no presente síntomas. El lavado gástrico está indicado en las primeras dos horas de la ingestión. Se sugiere que se acompañe de tierra de Fuller (200 ml de suspensión al 30 % con agua) y debe continuarse con la administración de la suspensión cada 8 horas por 48 horas. En caso de no contar con ésta, se realiza el lavado gástrico con carbón activado a una dosis de 1 a 2 g/kg. Se ha encontrado que ambos compuestos tienen una actividad equiparable hacia el PQ. No se recomienda el lavado gástrico después de las 4 horas por el riesgo de hemorragia y perforación a los órganos lesionados (Hernández y col. 2008; Solís-Cundapí 2017). En los casos presentados el lavado gástrico y carbón activado no fueron administrados ya que ambos pacientes ingresaron después de 24 horas del antecedente de exposición.
Es importante evitar el uso de oxígeno para no favorecer la producción de óxidos y superóxidos propios de la toxicodinamia del PQ. (Africano-López y Moreno-Villamizar 2015). Se ha sugerido la administración de óxido nítrico, pero su eficacia no ha sido probada (Solís-Cundapí 2017). En el caso del paciente sobreviviente no se utilizó oxígeno suplementario durante toda la hospitalización. En el caso del paciente que falleció se requirió ventilación mecánica, en un inicio se mantuvo con concentraciones de oxígeno de 21 %, pero conforme se agravó la falla respiratoria se tuvo que incrementar el aporte. La literatura comenta que el oxígeno solo está indicado si el paciente presenta una presión arterial de oxígeno menor de 50 mmHg (Hernández y col. 2008). Es importante recordar al personal de salud el riesgo que implica la administración indiscriminada de oxígeno.
Para reducir la reacción inflamatoria se ha utilizado la ciclofosfamida, metilprednisolona y dexametasona. Existen estudios en donde se comparan diferentes dosis y formas de administración de la ciclofosfamida y los corticoesteroides, la mayoría en adultos. Un metaanálisis que se hizo de 1980 a 2006 en pacientes mayores de 19 años incluyó estudios que utilizaron ciclofosfamida en dosis desde 1,6 hasta 15 mg/kg al día, en intervalos desde dos días hasta cuatro semanas. Se utilizaron también corticoides, en algunos casos dexametasona en dosis desde 0,15 mg/kg hasta dosis de 10 mg cada 8 horas o metilprednisolona en dosis desde 15 mg/kg hasta 1 g diario. Se prolongó la terapia inmunosupresora con un segundo corticoide, o dosis menores del mismo utilizado en la primera fase del tratamiento. En uno de los estudios analizados, se utilizó terapia por bolos: si el paciente presentaba hipoxemia, se repetía tres dosis de metilprednisolona 1g IV cada 24 horas, y una dosis de 15 mg/kg de ciclofosfamida. En el metaanálisis se reporta un riesgo relativo para disminuir la mortalidad, de 0,55 (IC 95 %= 0,39-0,77) en estudios observacionales, y 0.6 (IC 95 %= 0,27-1,34) en estudios controlados randomizados (Agarwal y col. 2007).
En 2014 se volvieron a analizar los estudios controlados randomizados del metaanálisis previamente mencionado, y se agregó un nuevo ensayo. Se calculó un RR de 0,72 (IC 95 %= 0,59-0,89) para riesgo de mortalidad en pacientes que reciben terapia inmunosupresora dual (Li y col. 2014).
En otro metaanálisis del 2015, se encontró un RR de 0,71 (IC 95 %= 0,49-0,86) para mortalidad con uso de terapia de bolos de corticoides y ciclofosfamida con esquemas equiparables a los ya mencionados anteriormente. Se hizo un análisis de subgrupos, en donde resultó que no existía beneficio en la terapia de pulsos al ser aplicada en pacientes con intoxicación fulminante, pero sí en pacientes con intoxicación moderada a severa (45,1 % vs. 79,1%, RR 0,45; IC 95 %= 0,28 - 0,75, p= 0.002). Se encontró también que no existe influencia de la terapia inmunosupresora sobre la falla renal (He y col. 2015).
Por último, en un estudio de 2018 se evaluó la eficacia de realizar terapias cortas con corticoides vs terapias largas y se analizó la función pulmonar después de la estabilización del paciente. Los resultados muestran que la capacidad de difusión de monóxido de carbono, el volumen espiratorio forzado, y la capacidad vital forzada son mejores cuando se usa terapia larga en comparación con la terapia corta (Gao y col. 2018).
De esta manera, decidimos seguir un esquema que presentara uso de ciclofosfamida y metil prednisolona con bolos a dosis altas y continuar con dosis descendentes de otros corticoides.
Los pacientes intoxicados por PQ pueden evolucionar a falla renal aguda. No se tiene una clara compresión del mecanismo por el que causa lesión directa al riñón, sin embargo, se sabe que este químico puede acumularse dentro de las células tubulares renales, lo que lleva a ciclos de reducción y oxidación, generando especies reactivas de oxígeno y en última instancia daño de los túbulos proximales. Cheng-Hao Weng y col. (2017) realizaron un estudio para evaluar predictores de qué pacientes tienen riesgo de evolucionar a falla renal, encontrando por medio de análisis multivariado por regresión logística que la presencia de hepatitis (p < 0,001), una puntuación SIPP (Sistema Internacional de Puntuación Pronóstica) más alta (p= 0,026), PaO2 más alta al momento del ingreso (p= 0,014) y retardo en la llegada al hospital (p < 0,001) fueron factores predictivos de insuficiencia renal aguda.
Kim y col. (2011)evaluaron los niveles de ácido úrico como marcador para el daño renal en pacientes intoxicados por PQ. Encontraron que la mortalidad se incrementa en aquellos pacientes que presentaron niveles más elevados de ácido úrico, incrementando la mortalidad a 3.3 después de haber ajustado las variables para la edad, sexo y la cantidad de PQ estimada.
Rao y col. (2017) evaluaron el papel de la hemoperfusión en el tratamiento por la intoxicación por PQ. Compararon los pacientes que habían recibido solo lavado gástrico con tratamiento sintomático vs hemoperfusión con carbón activado. Posteriormente compararon el inicio de la terapia con hemoperfusión llamándole temprana si se inició en las primeras 6 horas de la intoxicación, y tardía si la recibieron después de las 6 horas. Se encontró que los pacientes que recibieron la terapia con hemoperfusión tuvieron un aumento en la supervivencia (57,1 % vs. 7,3 %, (p < 0.001). Si la hemoperfusión se realizaba dentro de las primeras 6 horas, la sobrevida mejoraba en un 93 %.
Un metaanálisis encontró efecto sobre la mortalidad usando la hemoperfusión sola comparado con terapias convencionales con una reducción de la razón de muerte (OR= 0,2, IC 95 %= 0,11-0,40, p < 0,0001); el efecto fue superior cuando se combinó hemoperfusión más terapia estándar versus solo hemoperfusión (OR= 1,24; IC 95 %= 1,05 –1,46, p= 0,01) (Nasr Isfahani y col. 2019). En los pacientes evaluados en nuestro reporte no se realizó la terapia con hemoperfusión por no contar con el recurso.
Conclusiones
La intoxicación por PQ es poco frecuente, debe sospecharse en pacientes con ingesta de agroquímicos que presentan lesiones causticas en cavidad oral o con lesión renal y acidosis metabólica sin otra causa que lo justifique. Las variables que van a intervenir en la severidad son la edad, la dosis y el tiempo de inicio del tratamiento. En los casos reportados se presentaron factores de mal pronóstico como lesión renal aguda y test de ditionito positivo, categorizados en grado II. La principal diferencia fue la intencionalidad. No existe un tratamiento estandarizado en pediatría, los autores recomiendan hemoperfusión en las primeras 6 horas y ciclofosfamida con corticoides para evitar la fibrosis pulmonar, el paciente 1 no la desarrolló, lo que sugiere que la terapia inmunosupresora puede ser útil aún después de transcurridos días desde la ingesta.
Bibliografía citada
1. Africano-Lopez H., Moreno Villamizar R. Intoxicación por paraquat. Perspectiva en urgencias 2015; 1(2):116-121. [ Links ]
2. Agarwal R., Srinivas R., Aggarwal A.N., Gupta D. Immunosuppressive therapy in lung injury due to paraquat poisoning: a meta-analysis. Singapore Med J. 2007;48(11):1000-5. [ Links ]
3. Duan Y., Wang Z. To explore the characteristics of fatality in children poisoned by paraquat-with analysis of 146 cases. Int J Artif Organs. 2016;39(2):51-5. [ Links ]
4. Elenga N., Merlin C., Le Guern R., Kom-Tchameni R., Ducrot Y.M., Pradier M., Ntab B., Dinh-Van K.A., Sobesky M., Mathieu D., Dueymes J.M., Egmann G., Kallel H., Mathieu-Nolf M. Clinical features and prognosis of paraquat poisoning in French Guiana: A review of 62 cases. Medicine 2018;97(15):e9621. [ Links ]
5. Fuke C., Ameno K., Ameno S., Kiriu T., Shinohara T., Sogo K., Ijiri I. A rapid, simultaneous determination of paraquat and diquat in serum and urine using second-derivative spectroscopy. J Anal Toxicol. 1992;16(4):214-216. [ Links ]
6. Gao J., Cao Z., Feng S., Song Y., Bai W., Zhao S., Zhang S., Li Y. Patients with mild paraquat poisoning treated with prolonged low-dose methylprednisolone have better lung function: A retrospective analysis. Medicine. 2018;97(16):e0430. [ Links ]
7. He F., Xu P., Zhang J., Zhang Q., Gu S., Liu Y., Wang J. Efficacy and safety of pulse immunosuppressive therapy with glucocorticoid and cyclophosphamide in patients with paraquat poisoning: A meta-analysis. International immunopharmacology. 2015;27(1):1–7.
8. Hernández J., Contreras-Zúñiga E., Zuluaga-Martínez S. Intoxicación por paraquat: descripción de un caso clínico. Acta Toxicol. Argent. 2008;16(1):5-8. [ Links ]
9. Ingale P.W., Shelke S.N., Sundharan S., Raul N.M. Importance of urine sodium dithionite test in paraquat poisoning: a case study. Int J Res Med Sci. 2015;3(1):310-311. [ Links ]
10. Kim J.Y., Gil H.W., Yang J.O., Lee E.Y., Hong S.Y. Serum uric acid level as a Marker for mortality and acute kidney injury in patients with acute paraquat intoxication. Nephrol Dial Transplant. 2011;26(6):1846-1852. [ Links ]
11. Li L.R., Sydenham E., Chaudhary B., Beecher D., You C. Glucocorticoid with cyclophosphamide for paraquat-induced lung fibrosis. Cochrane Database Syst Rev. 2014;(8):CD008084. [ Links ]
12. Li S., Zhao D., Li Y., Gao J., Feng S. Arterial lactate in predicting mortality after paraquat poisoning A meta-analysis. Medicine 2018; 97:34. [ Links ]
13. Luna J.R., Di Bernardo M.L., García M.Y., Yáñez C., Mejias R., Morales A., Rodríguez L., Ovalles F. Uso de glucosa como agente reductor en la determinación semicuantitativa de paraquat en orina. RETEL (Revista de Toxicología en Línea). 2007;(13):30-45. [ Links ]
14. Luna R.F., Di Bernardo M.L., García M.Y., Ovalles F., Calderón L. Determinación de paraquat en orina utilizando un sistema de inyección en flujo continuo. Acta Bioquím Clín Latinoam 2008;42(2):251-259. [ Links ]
15. Nasr Isfahani S., Farajzadegan Z., Sabzghabaee A.M., Rahimi A., Samasamshariat S., Eizadi-Mood N. Does hemoperfusion in combination with other treatments reduce the mortality of patients with paraquat poisoning more than hemoperfusion alone: A systematic review with meta-analysis. J Res Med Sci. 2019; 24: 2. [ Links ]
16. Seok S., Kim Y.H., Gil H.W., Song H.Y., Hong S.Y. The time between paraquat ingestion and a negative dithionite urine test in an independent risk factor for death and organ failure in acute paraquat intoxication. J Korean Med Sci. 2012;27(9):993-998. [ Links ]
17. Solís.Cundapí J.H. Intoxicación por gramoxone. Salud en Chiapas 2017;4:204-208. [ Links ]
18. Sun B., Chen Y. A simple and rapid method for detection of paraquat in human plasma by high-performance liquid chromatography. Int J Clin Exp Med. 2015; 8(10):17067-17071. [ Links ]
19. Urdaneta-Carruyo E., Urdaneta-Contreras A.V., Valero-Rivas J.A., Angulo-Bravo L.V., Parra-Sosa Y., Vargas-Cobos Y. Falla renal aguda por envenenamiento con paraquat. Rev Mex Pediatr. 2012;79(1):18-22. [ Links ]
20. Weng C.H., Chen H.H., Hu C.C., Huang W.H., Hsu, C.W., Fu J.F., Lin W.R., Wang I.K., Yen T.H. Predictors of acute kidney injury after paraquat intoxication. Oncotarget. 2017;8(31):51345–51354.














