Introducción
Las floraciones de algas nocivas (FAN) son fenómenos naturales causados por organismos fito-planctónicos microscópicos, que en condiciones ambientales favorables para su desarrollo, se multiplican y concentran produciendo efectos nocivos para los ecosistemas y la salud humana. El término FAN, no es una clasificación científica, sino socioeconómica, pues define cualquier proliferación de microalgas (independientemente de su concentración) que sea percibida como dañina para el hombre. Por lo tanto, una microalga de la misma especie puede resultar muy dañina en una parte del mundo y pasar totalmente inadvertida en otra si no afecta la salud de sus habitantes o a alguno de sus principales recursos pesqueros o naturales. De acuerdo con las especies de fitoplancton involucradas, los efectos nocivos pueden dividirse en dos grandes grupos. El primer grupo de fitoplancton no produce toxinas, pero causa efectos nocivos como la producción de metabolitos que afectan la calidad del ambiente o mortandad de organismos marinos por anoxia o daño físico a sus branquias (Hallegraeff 1995). El segundo grupo fitoplanctónico, más perjudicial, es el que produce potentes toxinas que pueden contaminar los alimentos de origen marino y poner en riesgo a la salud humana, ocasionando también la mortandad de organismos marinos por intoxicación. Los principales vectores de intoxicación humana son los moluscos filtradores bivalvos que pueden acumular y concentrar altas cantidades de toxina sin ser afectados. Como se mencionó, aunque la mayoría de estas toxinas tienen un origen fitoplanctónico, se bioacumulan principalmente dentro de los tejidos de moluscos bivalvos, esta es la razón por la cual se les conoce como "toxinas de moluscos". Además de los moluscos bivalvos pueden actuar como vectores de intoxicación gasterópodos marinos, crustáceos o asci-dias (ejemplo: piure) (Farabegoli et al. 2018). Los factores que aumentan el riesgo de exposición humana (Pulido 2016) incluyen: 1) toxinas que son inodoras, insípidas y no se desactivan al cocinar; 2) inexistencia de antídotos; 3) densa población humana en las regiones costeras, sumado a la recolección recreativa de mariscos; 4) globalización del comercio de alimentos y la falta o ineficiencia de un sistema de monitoreo en muchas regiones del mundo; 5) los eventos de FAN son en términos generales impredecibles, si bien tienden a seguir las variaciones estacionales, oceánicas y climáticas (Hallegraeff 1995; Pulido 2016).
Los eventos de intoxicación por mariscos se clasifican según los síntomas que generan en los seres humanos luego de su ingesta, aunque en estudios recientes se ha cuestionado esta clasificación y los últimos síndromes identificados siguen otro criterio más descriptivo basado en la estructura química de las toxinas involucradas (Paredes 2011; FAO/WHO 2016; Esteves et al. 2019). Las biotoxinas marinas se pueden clasificar según su solubilidad en hidrofílicas y lipofílicas. Las toxinas hidrofílicas incluyen a la Toxina Amnésica de Moluscos (TAM), la toxina paralizante de moluscos (TPM) y el envenenamiento por peces globo (Tetrodotoxinas). Las toxinas lipofílicas reguladas están asociadas con la intoxicación diarreica por mariscos (IDM) y la intoxicación por azaspirácido (IAZ), mientras que las toxinas no reguladas por peces ciguatera (CFP), las iminas cíclicas (IC) y la intoxicación neurotóxica por mariscos (INS) se consideran toxinas emergentes (Reguera et al. 2014). En nuestro país los eventos más problemáticos en términos de toxicidad y distribución geográfica son los ocasionados por los dinoflagelados del género Alexandnum, productor de Toxinas Paralizantes de Moluscos (TPM) (Montoya et al. 2018). Este grupo de toxinas fue el primero en ser detectado en el país en el año 1980 y desde entonces ha causado recurrentemente intoxicaciones severas, incluso letales. Es también el causante de la intoxicación más conocida y frecuente, por lo tanto, se ha generado un sistema de control y monitoreo eficiente.
Recientemente se han publicado revisiones sobre los organismos productores, la distribución y consecuencia de la presencia de TPM en el Mar Argentino (Krock et al. 2018; Montoya et al. 2018; Montoya 2019). Por lo tanto, esta revisión recopila los conocimientos recientes sobre los otros síndromes ocasionados por microalgas toxigénicas más desconocidos, cuyas especies fitoplanctónicas productoras ya han sido detectadas en nuestro país: la intoxicación amnésica por moluscos, la intoxicación diarreica por moluscos, la intoxicación por azaspirácido y por las toxinas iminas cíclicas (Tabla 1).
Monitoreo y control
El sistema de control y monitoreo de toxinas en Argentina surgió en el año 1980, luego de la intoxicación y muerte de dos pescadores por consumo de mejillones con TPM ocurrido en Península de Valdés (Elbusto et al. 1981; Carreto et al. 1986). El Servicio Nacional de Salud y Calidad Agroalimen-taria (SENASA) es el responsable del monitoreo y control (Resolución SAGPyA 829/06) y coordina esta tarea con los gobiernos provinciales y regionales para la clasificación y control de zonas de extracción y producción en cuanto a toxinas legisladas y límites para su consumo. Mientras que las normas sanitarias para la exportación de los moluscos de Argentina son basadas en el Reglamento de la Unión Europea (CE) N° 853/2004. En consecuencia, el nivel máximo de TPM no debe sobrepasar 800 pg STX eq/kg de tejido comes-tibie, si es superado, el área en la que se detecta la toxicidad se cierra a la cosecha hasta que los mariscos hayan sido evaluados como seguros nuevamente. Las principales especies de interés comercial susceptibles de actuar como vectores de intoxicación en la Argentina son los mejillones comunes (Mytilusplatensis), cholgas (Aulacomya afra), almejas (Ameghinomya antiqua), panopea (Panopea abbreviata), ostras (Ostrea puelchana), vieiras (Aequipecten tehuelchus, Zygochlamys pa-tagonica), navajas (Ensis macha, Solen tehuelchus) y los gasterópodos o caracoles marinos (Zidona dufresnei; Adelomelon beckii) (Montoya 2019). Tradicionalmente se ha utilizado el bioensayo en ratones (BR) para la detección de biotoxinas, que indica de manera rápida y segura la presencia de toxinas en moluscos bivalvos y otros productos pesqueros, sin embargo este método solo se considera adecuado para las TPM (FAO/WHO 2006; EFSA 2010). Nuevas metodologías de detección por medio de equipos de alta resolución como HPLC-MS dieron como resultado el descubrimiento de nuevos grupos de toxinas, cuya distribución mundial está actualmente bajo estudio (Paredes et al. 2011; FAO/WHO 2016). En la costa y plataforma marítima argentina en sucesivas etapas se han detectado especies de fitoplancton potencialmente productoras de nuevas toxinas lo que implica un desafío al monitoreo y control de los mariscos comerciales (Krock et al. 2018). El registro de nuevas toxinas pone en alerta a los sistemas de control en los lugares de producción de mariscos que en la actualidad no cuentan con la tecnología necesaria para su detección y control e implica un esfuerzo conjunto y la realización de trabajos multidisciplinarios.
Intoxicación Amnésica de Moluscos
La intoxicación amnésica de moluscos es causada por un potente neurotóxico: el ácido domoico (AD), también conocido como toxina amnésica de los moluscos (TAM). El primer evento de intoxicación humana por consumo de moluscos ocasionado por AD, ocurrió en 1987 en Prince Edward Island, Canadá, asociado al crecimiento extraordinario de una diatomea, Pseudo-nitzschia multiseries (Wright et al. 1989). El género de diatomeas marinas Pseudo-nitzschia tiene una amplia distribución en todo el mundo, y comprende 48 especies reconocidas; entre ellas al menos 23 han sido mencionados como posibles productores de AD (Bates et al. 2018). Esta neurotoxina se puede acumular en la red alimentaria marina, provocando la intoxicación amnésica de moluscos, un síndrome neurológico con efectos letales en aves marinas, mamíferos marinos y humanos (Geraci et al. 1989; Sierra Beltran et al. 1997; Lefebvre y Robertson 2010). El AD (Figura 1) es estructuralmente similar al ácido glutámico y actúa como agonista. Esta toxina se fija fuertemente en los receptores del glutamato presentes en el tejido cerebral de la región del hipocampo evitando un funcionamiento normal en las sinapsis, produciendo la apertura de canales de calcio, lo que lleva a la necrosis neuronal por el exceso de este ion (Tabla 1). Los síntomas de la intoxicación amnésica de moluscos aparecen aproximadamente a las 48 hs de la ingesta: náuseas, vómitos, dolor estomacal y diarrea, seguidos por confusión, mareos, desvanecimiento, somnolencia, letargia, coma, arritmias cardíacas y pérdida permanente de la memoria (Alvarez-Falconí 2009). Esta toxina, de acuerdo a la dosis, puede ser letal, no posee antídoto y el tratamiento es sintomático. Debido al riesgo de convulsiones, el vómito no debe ser inducido y en casos severos y si la ingestión es reciente, se recomienda el lavado gástrico. Aunque el programa de monitoreo actual parece eficaz para prevenir el envenenamiento agudo en los humanos, se desconocen los efectos debidos a la exposición de largo plazo a concentraciones bajas de AD. En esta línea, se ha caracterizado un síndrome de toxicosis crónica en leones marinos que ha llevado a evaluar los potenciales efectos de exposición crónica en humanos (Lefebvre y Robertson 2010). El mayor riesgo de exposición a AD para humanos y la vida silvestre marina proviene del consumo de organismos marinos que se alimentan por filtración, tales como mariscos y peces planctónicos (Kvitek et al. 2008). Los mejillones y los peces planctívoros como la anchoíta, tienen una rápida velocidad de acumulación y depuración de AD. Se demostró que acumulan en sincronía con las floraciones tóxicas de Pseudo-nitzschia con niveles de AD que decrecen a niveles indetectables dentro de una semana de finalizada la floración (Ferdin et al. 2002; Lefebvre y Robertson 2010). Contrariamente, algunos bivalvos como almejas y vieiras pueden retener AD en sus tejidos durante meses (Bogan et al. 2006).
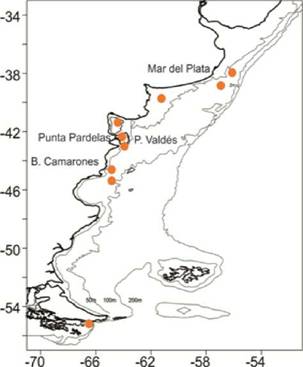
En Argentina no han ocurrido intoxicaciones humanas por TAM, aunque se han reportado nueve especies toxigénicas del género Pseudo-nitzschia (P australis, P. brasiliana, P. delicatissima, P. fraudulenta, P multiseries, P pseudodelicatissima, P pungens, P seriata, y P turgidula) (Almandoz et al. 2017). La presencia de AD se ha confirmado en algunos sectores del litoral argentino durante los últimos años, pero en general los registros son escasos (Figura 2). El primer registro de AD en Argentina fue en el año 2000, frente a Mar del Plata asociado a la diatomea Pseudo-nitzschia australis. En ese evento, el máximo contenido de AD (76,6 gg/g) se detectó en muestras de tejido de visceras de anchoíta (Engraulis anchoíta) mientras que en mejillones (Mytilus edulis pla-tensis) fue menor (7,7 gg/g) (Montoya et al. 2000; Negri et al. 2002). En el año 2005, se detectó AD en muestras de plancton de Punta Pardelas y Bahía Camarones (Figura 2) (Sastre et al. 2007) y más recientemente en muestras de plancton en distintos sectores de la plataforma (Krock et al. 2018). La detección de AD en las heces de la ballena franca austral Eubalaena australis (Wilson et al. 2016; D'Agostino et al. 2017) en la región de la Península Valdés (Figura 2), proporciona evidencia del riesgo no solo para los humanos sino también para la fauna marina.
Para proteger a los consumidores, la legislación argentina al igual que la internacional, establece un limite apto para el consumo de 20 mg AD/kg de tejido de molusco (FAO/WHO 2006). Cuando el nivel excede este limite se clausura la zona de producción y se prohíbe la extracción y comercialización. Tradicionalmente, el bioensayo en ratones se utilizaba para determinación de toxicidad en moluscos para el consumo humano. Sin embargo, este método es altamente insensible y no proporciona una estimación confiable, por lo tanto la legislación establece la utilización de métodos basados en HPLC (FAO/WHO 2006).
Toxinas lipofílicas de moluscos
Intoxicación diarreica de moluscos.
Inicialmente se incluyeron en el complejo de toxinas diarreicas de moluscos en minescula (TDM) a tres grupos de toxinas con diferentes estructuras moleculares (poliéter): el ácido okadaico (AO con sus congéneres, las dinofisistoxinas: DTXs), las pectenotoxinas (PTXs) y las yessotoxinas (YTXs) (Figura 3) (Reguera et al. 2014). Sin embargo, esta clasificación ha sido debatida, pues no todas producen diarreas por consumo. Históricamente, cuando el BR fue la única técnica disponible para la detección de biotoxinas marinas, todas las toxinas lipofílicas se consideraron como TDM porque a menudo ocurren en el mismo grupo de microplancton natural. Además, por su solubilidad en metanol son extraídas en forma conjunta y por lo tanto, se detectan juntas en los moluscos que se alimentan por filtración. Actualmente, está bien establecido que los tres grupos de toxinas tienen diferentes efectos biológicos y que solo el AO y sus congéneres son diarreogénicos (FAO/ WHO 2016). La intoxicación diarreica por mariscos (IDM) es causada por el consumo de mariscos que contienen ácido okadaico (AO) y sus análogos, las dinofisistoxinas (DTX-1, DTX-2, DTX-4, DTX-5 y DTX-3 por DTX-1, DTX-2, DTX-4, DTX-5 y el grupo DTX-3). Mientras que el AO, la DTX-2 y DTX-1 son producidos por dinoflagelados, el grupo DTX-3 incluye una amplia gama de derivados esterificados con ácidos grasos saturados e insaturados, productos de las transformaciones metabólicas que ocurren en los mariscos (Reguera etal. 2014). Este último grupo de análogos de AO poseen actividad tóxica después de la hidrólisis en el tracto gastrointestinal humano (Paredes et al. 2011). Los síntomas de intoxicación (Tabla 1) por toxinas diarreicas se caracterizan por diarrea, náuseas, vómitos y dolor abdominal, que comienza generalmente entre 3 a 12 horas luego de la ingestión del alimento contaminado (Dominguez et al. 2010). Además de estos efectos agudos, el AO podría tener algunos efectos crónicos por el consumo prolongado de mariscos contaminados. Se ha encontrado que estas toxinas son potentes promotores tumorales (Fujiki et al. 1999). Aunque las observaciones existentes de las poblaciones humanas no son concluyentes, hay evidencias epidemiológicas que asocian estas toxinas con cáncer digestivo (Suganuma et al. 1992, Cordier et al. 2000). Se demostró que AO y sus análogos son inhibidores potentes de la proteína serina / treonina fosfatasas 1 (PP1) y 2A (PP2A) (Fernández et al. 2002; Cruz et al. 2007). Se ha propuesto que AO puede inducir diarrea estimulando la fosforilación de aquellas proteínas que controlan la secreción de sodio de células intestinales o mediante la fosforilación de proteínas citoesqueléticas responsables del manejo de la permeabilidad de los solutos, perjudicando el balance de agua (Cohen et al. 1990). La fosforilación de estas fosfatasas también parece tener relación con el daño producido al ADN y la inestabilidad genómica en los procesos oncogénicos (Ten-Hage et al. 2000).
El primer informe clínico de una enfermedad gastrointestinal asociada con el consumo de mejillones cocidos provino de los Países Bajos en 1961, pero el agente causal no fue identificado hasta años después, cuando dinoflagelados del género Dinophysis fueron identificados como toxigéni-cos (Reguera et al. 2014). A nivel mundial, solo las áreas de producción de mariscos que han implementado monitoreo pueden diferenciar las IDM de las producidas por contaminación bacteriana o viral. Además, los niveles de TDM que no causan enfermedades gastrointestinales, pero se encuentran próximos o incluso muy por encima de los límites regulatorios, son ignorados si no se ha establecido un control de estas toxinas. Por estas razones, cualquier mapa de distribución mundial actual de TDM y brotes relacionados subestima la magnitud del problema (Reguera et al. 2014). Dos géneros de microalgas han sido identificadas como productores de toxinas diarreicas en Argentina: el dinoflagelado bentónico Prorocen-trum lima y varias especies de dinoflagelados del género Dinophysis: D. acuminata, D. caudata, D. fortii, D. norvegica, y D. tripos (Gayoso et al. 2002; Gracia Villalobos et al. 2015). La presencia de estas especies en aguas argentinas está asociada con el AO, las DTXs, PTX-2 y PTX-2sa (Krock et al. 2018). El primer brote de IDM en Argentina ocurrió en marzo de 1999, causado por mejillones cosechados en el Golfo de San José y en el Golfo Nuevo (Figura 4). Este evento fue causado por el dinoflagelado bentónico Prorocentrum lima que produjo DTXs (Gayoso et al. 2002). No se registraron nuevas intoxicaciones hasta el año 2010, en que se produce el primer registro de IDM después de consumo de mariscos asociado con la presencia de especies de Dinophysis (D. acuminata y D. caudata) en Villa Gesell, Buenos Aires (Sar et al. 2010). A mediados de enero de 2010, funcionarios municipales de Bromatología reportaron varios intoxicados, con náuseas y vómitos luego de consumir almejas, (Amarillodesma mactroides) y berberechos (Donax hanleyanus) colectados en las playas. El análisis de los tejidos de los moluscos demostró que estaban contaminados con perfiles complejos de toxinas OA, DTX-1, Acil-AO y Acil-DTX-1, mientras que las muestras de plancton durante el evento contenían AO, DTX-1 y PTX-2 (Montoya et al. 2012; Sar et al. 2010). Turner y Goya (2015) realizan un análisis de biotoxinas marinas lipofílicas en mariscos cosechados en Argentina entre1992 y 2012. Este estudio reveló la presencia de varias toxinas (AO, DTX-1, DTX-2, PTX-2 e YTX) en la plataforma bonaerense, en los golfos del norte de la Patagonia, el Golfo San Jorge y el Canal Beagle (Figura 4). En informes más recientes, se encontró PTX-2 en todo el Mar Argentino (Figura 4), asociado con varias especies de Dinophysis (Gracia Villalobos et al. 2015; Krock et al. 2015;Fabro et al. 2016) y PTX-2 asociada a D. tripos en el área norte (Fabro et al. 2016; Negri et al. 2019). En la actualidad AO, PTX y YTX pueden analizarse por métodos analíticos y de acuerdo con las directivas europeas están regulados individualmente aunque, los resultados de estudios sobre el efecto no tóxico de las PTX y las YTX en ratones mediante administración oral, han llevado a un grupo de expertos a recomendar la desregulación de estos dos grupos de toxinas (FAO/ WHO 2006). Se sabe relativamente poco acerca de los efectos de las PTX, casi todo el conocimiento toxicológico se ha obtenido de experimentos controlados in vitro e in vivo. PTX-2 no es tóxica en roedores cuando se administra por vía oral, incluso a dosis altas (Miles etal. 2004; FAO/WHO 2016), mientras que la toxicidad por inyección intraperitoneal (ip) es alta. Se han determinado las DL50 para PTX-1 y PTX-2 siendo éstas 250 y 200 pg/kg de peso corporal respectivamente (Tabla 1) (Munday 2008a). No hay informes de intoxicación humana por PTX. El síndrome IDM es una preocupación frecuente de las pesquerías de mariscos en pequeña escala en Argentina, porque puede causar el cierre prolongado de las áreas de captura y prohibiciones en la venta de mariscos de las áreas afectadas (Turner y Goya 2015). El monitoreo de toxinas lipófilicas se realiza actualmente en el país siguiendo el Procedimiento Operativo Estándar para la detección de toxinas lipofílicas por BR (Resolución SAGPyA 829/06). Sin embargo, por su pobre especificidad y por razones éticas, no se considera éste un método adecuado. Actualmente, en Argentina solo el BR se utiliza para el control de rutina de toxinas lipofílicas, y por lo tanto hay muy pocos datos disponibles sobre la identidad de las toxinas responsables. La legislación establece que el contenido total máximo permitido de toxina expresada como el análogo de referencia para AO, dinofisistoxinas y pectenotoxinas, es 160 gg de AO eq/kg y para yessotoxinas, es 3.75 mg YTX eq/kg (Resolución SAGPyA 829/06). Recientemente, la Unión Europea ha legislado sobre métodos de análisis reconocidos para la detección de biotoxinas lipofílicas, rechazando el BR y recomendando la utilización de técnicas HPLC-MS (FAO/WHO 2006; Dominguez et al. 2010; FAO/WHO 2016), sin embargo esta metodología no ha sido legislada ni es de uso corriente en los programas de monitoreo nacional.
Yessotoxinas
Históricamente, las yessotoxinas (YTX) se incluyeron en el síndrome de intoxicación diarreica (IDM), sin embargo los síntomas producidos por la ingestión de YTX en humanos son desconocidos, debido a que a la fecha no hay casos informados de intoxicación. Los estudios toxicológicos disponibles son ensayos basados en la administración oral e i.p. a ratones, observándose una alta toxicidad i.p. (Ogino et al. 1997). Los síntomas observados son disnea, saltos involuntarios, temblores, calambres (Tubaro et al. 2003). Por el contrario, la YTX no resultó letal para ratones luego de la administración oral de hasta 10 mg/ kg (Tubaro et al. 2003), ni se registraron daños en los órganos digestivos ni diarrea (Satake et al. 1997), solo se observaron alteraciones con-ductuales a dosis altas (Aune et al. 2007). Se ha registrado una alta variabilidad en la DL50 para intoxicación ip con valores que van desde los 80 pg/kg hasta los 750 pg/kg (FAO/WHO 2016).

Figura 3: Estructura química de las toxinas más importantes del grupo diarreicas para la región de estudio a) ácido okadaico y dinophysis toxinas 1, 2 y 3; b) pectenotoxina 2 y pectenotoxina 2 seco-ácido; c) Yessotoxina.
Las YTX al igual que las TDM son moléculas po-liéter, pero consisten casi por completo en anillos de éter condensado, por los que también se denominan toxinas "marco de escalera" (Figura 3) . En comparación con OA, DTX y PTX, tienen pesos moleculares más altos (> 1000 Da) y una gran variabilidad con más de 90 congéneres, lo que dificulta su identificación y cuantificación (Miles et al. 2004). Los tres dinoflagelados productores de YTX que se han registrado en aguas argentinas corresponden a los géneros Gonyaulax spinifera, Lingulodinium polyedra y Protoceratium reticulatum (Krock et al. 2018). Akselman et al. (2014) describen los perfiles YTX de dos aislados de P reticulatum del Golfo San Jorge, compuestos por > 95% de YTX y algunas variantes de ésta en cantidades menores. Dado que solo pueden ser detectados por métodos HPLC-MS, no hubo registros de YTX en mariscos hasta el año 2015 que se detectó en vieiras de las provincias de Buenos Aires (muestra correspondientes al año 2001) y Golfo San Jorge (muestra correspondientes al año 2007) (Figura 4) (Turner y Goya 2015).
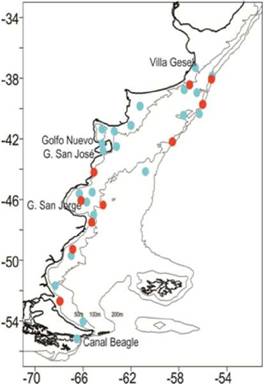
Figura 4: Distribución geográfica de los dinoflagelados tóxicos productores de toxinas diarreicas (Dinophysis) y de la presencia de ácido okadaico, dinophysis toxinas y pectenotoxinas en puntos celestes. En puntos rojos distribución de P reticulatum y yessotoxinas.
Azaspirácidos
La intoxicación azaspirácida por consumo de moluscos (IAZ) es la más recientemente descripta. El primer evento documentado ocurrió en los Países Bajos en 1995, cuando ocho personas se intoxicaron después del consumo de mejillones provenientes de Irlanda (McMahon y Silke 1996). En los años siguientes, se identificó AZA1 como el compuesto causante (Satake et al. 1998) y posteriormente se detectaron más variantes de AZA (Figura 5) en mariscos producidos por el dinoflagelado Azadinium (Ofuji et al. 1999). Los síntomas observados en humanos después del consumo de mariscos contaminados (Tabla 1) aparecen a las pocas horas e incluyen nauseas, vómitos y diarrea que persisten por 2 o 3 días observándose una recuperación total del paciente en los casos conocidos (McMahon y Silke 1996). No se conoce aún la existencia de efectos a largo plazo, aunque es posible que contribuyan a trastornos crónicos en el tracto gastrointestinal (Twiner et al. 2008, 2014). La intoxicación por AZA presenta una gran similitud con la intoxicación diarreica de moluscos y dada la desaparición rápida de los síntomas y la evolución favorable, es posible que a nivel mundial haya un sub registro de los casos de intoxicación.
Al igual que muchas toxinas de dinoflagelados, los azaspirácidos (AZA) son grandes anillos poliéter en el rango de masa 700 a 900 Da (Figura 5), reportándose hasta la fecha, más de 50 variantes de AZA. Se sabe que los azaspirácidos prevalentes en los mejillones son AZA1, AZA2 y AZA3 (Twiner et al. 2008, 2014; Furey et al. 2010). Desde su primer descubrimiento en mejillones irlandeses, el desarrollo de métodos HPLC-MS sensibles y selectivos ha resultado en el descubrimiento de AZA en otros países y en otras especies (Twiner et al. 2008, 2014). El mecanismo de acción de la toxina es desconocido, por lo que se requieren mayores estudios para poder dilucidarlo. Casi toda la información sobre la toxicología de esta toxina se ha obtenido al realizar experimentos in vitro e in vivo. Estudios en ratones a los que se les inyectó intraperitonealmente AZA mostraron la aparición de síntomas compatibles con intoxicación por neurotoxinas, con la aparición de dificultades respiratorias, espasmos, parálisis progresiva y muerte dentro de los 20-90 minutos (Satake et al. 1998), observándose una dosis letal mínima de 74 pg/kg de AZA1 (FAO/ WHO 2016). Se estudió también la toxicidad en ratones por vía oral, a una dosis 6 veces mayor a la dosis letal mínima, resultando en la supervivencia de todos los ratones testeados y sin la aparición de signos clínicos después de 24 hs (Ito et al. 1998). Ratones inyectados con la toxina que no sobrevivieron y fueron sometidos a autopsia, evidenciaron diversos signos de daño gastrointestinal, como acumulación de líquido en el íleon y necrosis de células epiteliales de las microvellosidades. Estos estudios indican que esta clase de toxina puede causar lesiones graves en los tejidos, especialmente en el intestino delgado, y la exposición crónica puede aumentar la probabilidad de desarrollo de enfermedades como la colitis ulcerativa, la enfermedad de Cro-hn, y tumores en el sistema digestivo (Twiner et al. 2008). Los estudios también muestran que la recuperación del tejido es muy lenta después de la exposición. Estas observaciones sugieren que los AZAs son más peligrosos que las otras clases conocidas de toxinas diarreicas de mariscos. En consecuencia, para proteger a los consumidores humanos es muy importante la evaluación adecuada y el control regulatorio de los mariscos y otras especies afectadas. La regulación actual de la Unión Europea solo incluye AZA1-3 (Furey et al. 2010; FAO/WHO 2016), ya que fueron los principales análogos identificados en los mejillones en 2001 cuando se formuló la primera regulación específica para toxinas y fijó el límite regulatorio actual de 160 gg equivalente AZA1/kg de carne de mariscos.
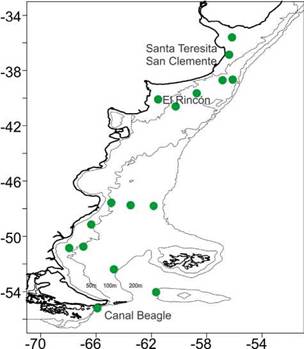
En Argentina, la primera documentación de la presencia del dinoflagelado Azadinium, fue reportada en plataforma bonaerense en el área de El Rincón (Figura 6), acompañado por una intensa marea roja que ocurrió en dos años consecutivos, 1990 y 1991 (Akselman et al. 2014). Varias especies de dinoflagelados de la familia Amphidomataceae, que causan IAZ, se han reportado en la Argentina: Amphidoma languida, Azadinium dexteroporum, Az. luciferelloides, Az. poporum, y Az. Spinosum (Krock et al. 2018). A pesar de este potencial de formación de elevadas concentraciones celulares y la alta diversidad de Amphidomataceae en el área, la producción de AZA es aún poco conocida. A. spinosum es el productor de AZA más importante en aguas europeas, sin embargo las cepas aisladas en el área de El Rincón, revelaron por primera vez la presencia de un ribotipo no toxigénico de esta especie (Tillmann et al. 2019). Por otra parte, en cultivo, varias cepas de Azadinium poporum aisladas en la plataforma bonaerense cerca del área de El Rincón producen AZA-2 y AZA-2-fosfato (Tillmann et al. 2016), mientras que no se detectó ningún derivado de AZA conocido para Amphidoma parvula aislada de la plataforma argentina (Tillmann et al. 2018). Solo trazas de AZA-2 fueron detectados en bivalvos: en almejas amarillas (Mesodesma mactroides) de Santa Teresita y en mejillín (Brachidontes rodriguezii) de San Clemente, Provincia de Buenos Aires (Figura 6), ambas muestras del año 2008 reportadas en 2015 (Turner y Goya 2015).
Iminas cíclicas
Las iminas cíclicas son consideradas toxinas emergentes, pues han sido recientemente detectadas por medio de equipos de alta complejidad (HPLC-MS), estando su distribución mundial actualmente bajo estudio (EFSA 2010; Stivala et al. 2015; Molgo et al. 2017). Sin embargo, hasta el momento no se han registrado intoxicaciones humanas por este tipo de toxinas en el mundo. Estas incluyen los siguientes subgrupos (Figura 7): espirólidos (SPX), gymnodiminas (GYM), pinnatoxinas (PnTX), pteriatoxinas (PtTX), prorocentrolides y espiro-prorocentriminas (EfSa 2010; Molgo et al. 2017; Stivala et al. 2015). Existe una mayor atención en las autoridades reguladoras de la Unión Europea por los tres primeros subgrupos, porque a diferencia de los tres últimos, aquellos ya se han detectado en Europa o hay pruebas sólidas que respaldan su presencia (EfSa 2010). Las GYM son producidas principalmente por el dinoflagelado Karenia selliformis y en menor medida,algunos análogos son producidos por Alexandrium peru-vianum y A. ostenfeldii (Van Wagoner et al. 2011; Miles et al. 2000). Las PnTX son producidas por un dinoflagelado recientemente descrito del nuevo género Vulcanodinium spp. (Rhodes et al. 2011). Dentro de este grupo, las toxinas más estudiadas son los SPX conocidos como “toxinas de rápida acción” por su rápido efecto letal en bioensayos en ratones (EFSA 2010). Son producidos por el dinoflagelado Alexandrium ostenfeldii, especie asociada también a la producción de las muy letales TPM, presentando una gran variabilidad en la producción de ambos grupos de toxinas de acuerdo a su localización geográfica (Cembella et al. 2000). La primera detección de SPX fue reportada en 1990, en moluscos bivalvos colectados en Nova Scotia, Canadá, cuando se observó un síndrome inusual en los ratones empleados para el bioensayo, con síntomas neurológicos y muerte rápida (Hu et al. 1996). En la actualidad existen registros de su presencia en mejillones y microalgas en varios lugares del mundo (citas en EFSA 2010). Según las estimaciones de exposición a SPX realizados por la Autoridad Europea de Seguridad Alimentaria estas toxinas suponen un riesgo bajo de intoxicación aguda para los consumidores, pero es recomendable su moni-toreo preventivo (EFSA 2010).
Aunque no hay información suficiente sobre la distribución geográfica de las iminas cíclicas, el hecho de que se hayan detectado en múltiples ocasiones en aguas europeas, en combinación con su toxicidad aguda antes mencionada en ratones después de la administración por inyección intraperitoneal, las ha posicionado al menos dentro de la UE, como un tema de investigación científica (Molgo et al. 2017). Poseen una toxicidad parenteral más potente que la oral. En ratones la toxicidad de SPX es ip: 40 gg/kg y oral: 1 mg/kg (EFSA 2010; FAO/WHO 2016). Las iminas cíclicas son neurotóxicas (Tabla 1), actuando posiblemente como antagonistas competitivos del receptor muscarínico de la acetilcolina en el sistema nervioso central (EFSA 2010; Munday et al. 2012). El conocimiento limitado sobre su absorción, distribución, metabolismo y excreción en animales y en humanos, sumado al hecho que no se registran intoxicaciones humanas por su consumo (Stirling y Survey 2001; Gueret et al. 2010), hace que aún no exista un criterio de legislación unificado para establecer los límites máximos permitidos para su concentración en mariscos. Tampoco se ha designado ningún método de referencia para su detección y cuantificación. En Nueva Zelanda, que fue el primer país en detectar la presencia de GYM en los mariscos, las autoridades reguladoras decidieron que los mariscos contaminados con GYM no representan un riesgo de intoxicación humana, ya que, según sus datos epidemiológicos, no hubo intoxicaciones después de consumir mariscos durante un incidente de contaminación (Stirling y Survey 2001; EFSA 2010). Además, en Rangaunu Harbour, Nueva Zelanda, donde se detectaron PnTX en ostras en concentraciones considerables, no se han observado efectos adversos para la salud en los consumidores (Munday 2008b).
En Argentina, la información sobre las especies que producen toxinas iminas cíclicas es muy escasa y siguiendo la tendencia de la Unión Europea no se encuentran en la lista de toxinas legisladas. Se demostró que cepas de A. ostenfeldii aisladas del Canal Beagle producen SPX y análogos (Almandoz et al. 2014). En moluscos, SPX-1ha sido detectado en concentraciones muy bajas a lo largo de toda la costa argentina, desde Buenos Aires hasta Tierra del Fuego (Turner y Goya 2015), lo que sugiere una amplia distribución de este dinoflagelado (Figura 8). Recientemente, se ha informado de A. ostenfeldii en aguas costeras y en la plataforma abierta del Mar Argentino asociada con la producción las mismas variantes de SPX producidas por los aislamientos del Canal Beagle (Fabro et al. 2017; Almandoz et al. 2014). A pesar de que los GYM están ampliamente distribuidos a nivel mundial, hasta la fecha solo se detectó la presencia de trazas de GYM en una oportunidad, en el agua del Golfo San Jorge (Figura 8) (Fabro et al. 2018).
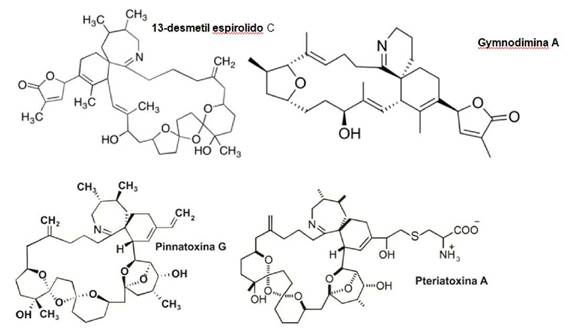
Figura 7: Estructura química de las principales iminas cíclicas, 13-desmetil espirolido C, Gymnodimina, Pinnatoxina G y Pteriatoxina A.

Tabla 1: Síntesis de la información sobre las toxinas marinas producidas por fitoplancton: síndromes, efectos para la salud humana, toxicidad y legislación. Referencias en el texto.
Comentarios finales
Las toxinas marinas y los efectos asociados a la salud humana son un problema de salud pública en todo el mundo. El objetivo de esta revisión es dar a conocer las nuevas toxinas halladas en el Mar Argentino y plantear los desafíos que implican no solo para el monitoreo y control, sino también dentro del sector sanitario. Una visión integral del riesgo para la salud humana de las toxinas marinas requiere una colaboración multidisciplinara: información epidemiológica, datos sobre el consumo, información detallada sobre los niveles de contaminación de los productos del mar, control de los alimentos importados y estrategias políticas de mitigación y ayuda a laboratorios regionales para el control de sus productos pesqueros y a los pescadores artesanales afectados. La herramienta clave de manejo es la prevención, a través de política, regulaciones y sistemas de monitoreo y control de cada grupo de toxinas. Es necesario profundizar los conocimientos locales de organismos productores de toxinas emergentes y el medio ambiente que favorece su síntesis, cuales son los posibles vectores de contaminación al hombre, la toxicología, efectos crónicos y sinér-gicos. Por otra parte, hay muy poca información sobre la transferencia trófica de estas toxinas dentro de los organismos marinos y como afectan a la biota. Es necesario mejorar la detección de toxinas no solo en los sectores de producción de mariscos, sino también los que permitan diagnósticos y una vigilancia más precisa de las intoxicaciones y la epidemiología. Ciertamente presentan un nuevo desafío, pues la detección y cuantificación solo puede realizarse por medio de métodos basados en HPLC- espectrometría de masas, lo cual dificulta el monitoreo en laboratorios regionales. Además, un desafío adicional es el desarrollo de tratamientos contra la acción fisiológica en humanos de estas biotoxinas. Estas toxinas, emergentes para la región, representan un riesgo potencial para la salud e inconvenientes socioeconómicos por el cierre de los sitios de explotación de moluscos. A través de estas mejoras, se anticipa que no solo se disminuirá el número de afectados, sino que se podrán realizar vedas más eficientes, asegurando un equilibrio que proteja tanto la salud pública como el desarrollo de la industria pesquera.












 uBio
uBio