Introducción
El consumo de alcohol constituye un grave problema de salud pública. La ingesta crónica fuerte de alcohol produce más de 200 enfermedades y lesiones, como enfermedades de transmisión sexual y no transmisibles (cardiopatías, neuropatías, diabetes, numerosos cánceres) (OMS 2014), incluyendo las patologías reproductivas (Canteros et al. 1995; Cebral et al. 1997; Cebral et al. 1998a; Cebral et al. 1998b; Cebral et al. 2011; Lee et al. 2010; Angelis et al. 2020).
Los efectos del consumo de alcohol sobre la función femenina son muy diversos, dependiendo de la ruta de administración, la dosis de etanol, el tiempo, la frecuencia y período de exposición y las variables individuales (peso, edad, sexo, genética). En la mujer el consumo crónico de alcohol interrumpe el ciclo menstrual, produce hiperpro-lactinemia, amenorrea, anovulación, disfunción de la fase lútea y patología ovárica (Schliep et al. 2015; Anwar et al. 2021). Se propuso que estas alteraciones son debidas a los efectos primarios del etanol sobre el eje hipotálamo-hipofisario, y/o a las acciones directas sobre el ovario a nivel folicular y esteroidogénesis (Mendelson y Mello 1988; Cebral et al. 1998a; Kline et al. 2016; Angelis et al. 2020). Previamente observamos, en ratas hembras inyectadas con etanol, una inhibición hipotalámica de LHRH (enzima liberadora de hormona luteinizante) en rata hembra (Canteros et al. 1995), lo que correlacionó con la restricción de la liberación de hormona luteinizante (LH) (La-paglia et al. 1997) y alteraciones en la liberación de FSH (hormona folículo estimulante) (Cruz et al. 2014). El consumo y abuso prolongado de alcohol impacta directamente sobre la fisiología ovárica (Dees et al. 2000; Brett y Cooper 2003; Kinney et al. 2006). Hakim et al. (1998) informaron que la tasa de concepción se redujo un 50% en un ciclo menstrual durante el cual las pacientes habían consumido alcohol (1-90 g por semana). El consumo de alcohol tanto moderado-alto (2 o más tragos por día) / aumenta significativamente el riesgo de infertilidad ovulatoria (Grodstein et al. 1994), disminuye el volumen ovárico, el número de folículos antrales, aumenta de la aparición de anomalías en el flujo menstrual y altera los niveles de FSH en sangre (Li et al. 2013). Sin embargo, aún son poco conocidos los efectos de la ingesta corta, semicrónica, de alcohol sobre la foliculo-génesis y desarrollo luteal. En particular, estudios a nivel del eje hipotálamo-hipófisis-ovario luego de la exposición crónica a alcohol durante la adolescencia sugirieron la interferencia del etanol con el funcionamiento de sistemas intraováricos relacionados con factores de crecimiento y an-giogénicos, tales como el factor de crecimiento tipo insulina 1 (IGF-1) y el óxido nítrico (NO) (incremento) (Dees et al. 2001). Sin embargo, defectos en la expresión de otros factores angiogénicos, como el factor de crecimiento endotelial (VEGF) en el ovario, luego del consumo de alcohol, no han sido abordados previamente.
El desarrollo vascular del ovario es fundamental para garantizar el aporte de nutrientes, gonado-trofinas, factores de crecimiento, oxígeno y precursores de esteroides, entre otras sustancias, necesarios para promover el crecimiento folicular y la formación del cuerpo lúteo (Stouffer et al. 2001; Li et al. 2020). Uno de los más importantes factores reguladores de la angiogénesis ovárica y del desarrollo del folículo y el cuerpo lúteo es el factor de crecimiento del endotelio vascular (VEGF) (Hoeben et al. 2004; Tamanini y De Am-brogi 2004; Abramovich et al. 2009). La familia VEGF comprende siete miembros (Neufeld et al. 1999), pero el VEGF-A juega el rol más relevante en la regulación de la angiogénesis en el ovario (McFee y Cupp 2013) actuando vía sus receptores (VEGFR-1/Flt-1, VEGFR-2/KDR/Flk-1 y VEGFR-3/ Flt-4) (Ortega et al. 1999), principalmente por KDR. VEGF media casi todas las respuestas celulares conocidas (proliferación, migración, supervivencia, aumento de la permeabilidad vascular, vaso-dilatación y reorganización del citoesqueleto en células endoteliales) (Kimura y Esumi 2003; Byrne et al. 2005; Caires et al. 2012). A su vez, VEGF es un agente antiapoptótico de células endoteliales (Gerber et al. 1998), y de células ováricas de ratón (Quintana et al. 2004). En ovarios murinos, VEGFA es expresado débilmente durante el desarrollo folicular temprano mientras que su expresión se incrementa en las células de la granulosa y en la teca durante la folículogénesis (Barboni et al. 2000; Celik-Ozenci et al. 2003; Greenaway et al. 2004). Los niveles de VEGF en el folículo y ooci-to son finamente regulados (McFee et al. 2009). Diversos estímulos, tales LH, FSH, citoquinas, ésteres de forbol, oncogenes, metales de transición, quelantes de hierro, NO e hipoxia modulan la expresión de VEGF (Christenson y Stouffer 1997; Jozkowicz et al. 2001; Li et al. 2020). Hasta la fecha, los efectos de la exposición de corta duración a alcohol, sobre la expresión de VEGF en el ovario y la relación con el desarrollo/calidad folicular, no fueron abordados.
Junto con los efectos directos de la exposición a alcohol sobre la función ovárica, resulta probable una acción adversa del etanol sobre el desarrollo y calidad oocitaria. El estudio morfológico de la gameta femenina, reflejo de su desarrollo génico-nuclear y citoplasmático (Cebral 2016), luego de la ingesta de alcohol, es imprescindible como pronóstico del desarrollo del embrión. Diversas anomalías oocitarias han correlacionado negativamente con la calidad embrionaria (Ebner et al. 2002; Gualdoni et al. 2021a) y alta tasa de aborto temprano (Kahraman et al. 2000). La exposición directa (in vitro) de los oocitos a diferentes concentraciones de etanol indujo anomalías cromosó-micas (aneuploidías) (Shiina et al. 1993; Kaufman 1997), mientras que nosotros demostramos que la ingesta crónica-prolongada de concentraciones moderadas a bajas, causa partenogénesis espontánea en los oocitos (Cebral et al. 1997; Cebral et al 1998a; Cebral et al. 1998b).
Dados los antecedentes mencionados, los objetivos del presente trabajo fueron analizar los efectos de la ingesta semi-crónica moderada de alcohol sobre el ciclo estral, el desarrollo folicular y formación del cuerpo lúteo y la expresión de VEGF ovárica, y la calidad morfológica-nuclear oocitaria en un modelo murino exocriado con ovulación espontánea e inducida.
Materiales y Métodos
Animales
Se utilizaron ratones hembras de la colonia CF-1 adultas (60 días, 28,5 ± 1,2 g), provenientes del Bioterio Central de la Facultad de Ciencias Exactas y Naturales (FCEN) de la Universidad de Buenos Aires (UBA), las que se mantuvieron en grupos de 2 a 3 por jaula, en condiciones controladas de luz y temperatura (25°C, 14-10 hs luz/oscuridad) y alimentados adlibitum con alimento comercial balanceado y agua corriente. Se utilizó un mínimo de 5 hembras para cada grupo experimental.
Diseño experimental
Los experimentos se desarrollaron siguiendo la Guía para el cuidado y uso de animales de laboratorio de los Institutos Nacionales de Salud (NIH) (publicación NIH 80-23 / 96) y del Comité Institucional de Ética en Uso y Cuidado Animal (CICUAL, protocolo n° 0057) de FCEN-UBA.
Las hembras murinas se trataron con etanol al 10 % m/v en el agua de bebida (hembras tratadas; HT) o agua sin etanol (hembras controles; HC) por 17 días. En ambos grupos, se analizó la ciclicidad diariamente. Al día 15 del tratamiento, un grupo de HC y HT se superovuló con inyección i.p. de 5 UI de eCG/hembra (Novormon, Syntex SA, Argentina) (13:00 h), y 48 h después con 5 UI de hCG (Sigma Aldrich, Saint Louis, MO, EE. UU.). Finalizado el periodo de tratamiento, las hembras controles y tratadas, superovuladas o no, se sacrificaron por dislocación cervical y se disecaron los ovarios, los oviductos y los oocitos.
Análisis del ciclo estral
Se determinó la regularidad del ciclo estral y la frecuencia del estro diariamente durante el período de tratamiento. Se extrajeron muestras de frotis de la mucosa vaginal (microscopía a 10x), y se calculó la proporción relativa de los tipos de células epiteliales y de leucocitos, para establecer el estado del ciclo estral (Caligioni 2010). Se calculó la frecuencia promedio de cada estado del ciclo en 15 días de tratamiento, la duración promedio de cada estado (en días), el porcentaje de hembras con alteraciones de la ciclicidad. Para esto último se consideró ciclo estral alterado o irregular siempre que un mismo estado se presentara más de tres días consecutivos en el mismo animal.
Recolección de oocitos
Luego de la superovulación, a las 16 hs post-hCG, en todos los grupos experimentales, se disecaron los oviductos en medio Krebs-Ringer (KRB) para extraer los complejos cúmulos-oocitarios (COCs) por punción de la ampolla oviductal. Luego, las células de la granulosa de los COCs se dispersaron por breve incubación en hialuronidasa 0,1 %/ KRB (Sigma-Aldrich) (Cebral et al. 1998a; Cebral et al. 1998b; Cebral et al. 2011). Posteriormente a lavados en KRB, los oocitos se recolectaron con solución de Krebs adicionado de albúmina sérica bovina (BSA) 0,3 %/PBS para ser evaluados en microscopio invertido con contraste de fase (Labomed). Luego del recuento del total y los tipos morfológicos, los oocitos se fijaron en paraformaldehido (PF) 2 %/PBS, por 10 minutos incubaron con Hoechst 33342 (0,5 mg/ml, Sigma-Aldrich) y lavados en PBS, para finalmente observarse la morfología nuclear bajo microscopio de fluorescencia Carl Zeiss equipado con cámara de video y programa para captura de imágenes.
Análisis morfológico externo y nuclear oocitario Para el análisis de la calidad morfológica, citoplas-mática y nuclear, de los oocitos se siguieron los criterios de clasificación previamente establecidos (Cebral 1998a; Cebral et al. 1998b; Cebral et al. 2011), basados en el aspecto del citoplasma del oocito, la apariencia de la zona pelúcida, el espacio perivitelino en relación con la ubicación del oocito, la presencia o no de fragmentos, la presencia del primero y/o segundo cuerpo polar. Brevemente, su clasificación morfológica externa fue: a) oocitos intactos: morfológicamente normales, con o sin primer cuerpo polar (I CP), con zona pelúcida (ZP) intacta, homogénea y lisa, oolema regular y un ooplasma homogéneo; b) oocitos fragmentados o necróticos: con vacuolización, fragmentos en espacio perivitelino (EPV), citoplasma fragmentado y/o con lisis citoplasmática; c) oocitos activados partenogenéticamente: con segundo cuerpo polar (II CP) o 2-células (clivaje inmediato); d) oocitos inmaduros: con ZP rugosa y cubierta de células de la granulosa adheridas. Los tipos de oocitarios según criterio morfológico núcleo-cromatínico (microscopio de fluorescencia), fue definida como sigue: a) oocitos intactos con metafase II normal (MII) (cromosomas condensados alineados en el ecuador del huso meiótico en la periferia del oocito), con o sin I CP; b) oocitos intactos con metafase II anormal: presencia de cromatina dispersa en el oolema o lindante a la placa metafásica; c) oocitos activados partenogenéticamente, incluyendo: c.1) oocitos sin metafase II (ausencia de cromatina condensa-da), c.2) oocitos activados sin II CP (en anafase/ telofase II) y oocitos con un pronúcleo (1 PN) o 2 PN (periféricos o central) (diploidizados), c.3) oocitos activados con II CP: en telofase II (cromatina condensada en periferia del citoplasma) o con 1 PN, c.4) oocitos de activación inmediata (2-células de clivaje inmediato).
En base al recuento de cada tipo de oocito se calculó la frecuencia respecto del total analizado en al menos 5 hembras / grupo.
Histología e histopatología ovárica Al día 17 de tratamiento, los ovarios extraídos de HC y HT con ovulación espontánea, en estado de estro o hembras superovuladas (16 hs post-hCG), se fijaron en PF 4% por 24 hs, se lavaron en PBS y deshidrataron en alcoholes (70 %, 80 %, 90 %, 10-20 minutos cada uno, y 2 pasajes de 100 %, 15 minutos cada uno) y en xilol, y luego se incluyeron en parafina (“Paraplast”) a 600C por 30 minutos cada baño. De los tacos obtenidos se realizaron cortes a 7 pm de espesor, seriados longitudinales al eje mayor del órgano, para luego ser teñidos con hematoxilina-eosina. Finalmente, los cortes fueron deshidratados por pasajes en alcohol y xilol, y montados con líquido de montaje DPX (Sigma-Aldrich). Se cuantificaron los folículos (primarios; preantrales; antrales y anormales/ atrésicos) y cuerpos lúteos en microscopio óptico convencional. Se calculó el promedio del número de folículos de cada categoría/hembra y el promedio de cuerpos lúteos/hembra para cada grupo experimental. La comparación entre grupos experimentales de los datos obtenidos se realizó comparando los datos de ovarios de hembras en la misma fase del ciclo estral.
Inmunohistoquímica
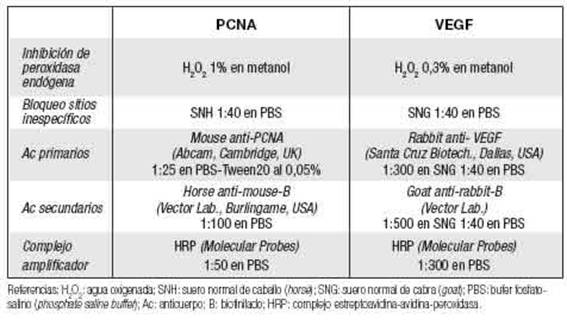
En cortes de parafina de los ovarios extraídos de HC y HT superovuladas o no (en estro), se determinó la tasa de proliferación de las células de la granulosa por inmunohistoquímica contra PCNA (proliferating cell nuclear antigen), y la inmunoex-presión ovárica de VEGF empleando protocolo previamente establecido en el laboratorio (Gualdoni et al. 2021b). Las condiciones específicas empleadas se detallan en Tabla I. Brevemente, los cortes fueron hidratados e inhibidos (bloqueo de peroxidasas endógenas) por 30 min a 4°C. Luego de lavados con PBS, se bloquearon los sitios inespecíficos de unión con sueros por 60 min a temperatura ambiente (TA). Los cortes se incubaron con el anticuerpo primario específico contra la molécula de interés, overnight a 4oC en cámara húmeda. En todos los portaobjetos se efectuaron controles negativos por omisión del anticuerpo primario. Al día siguiente, los cortes se lavaron con PBS y se incubaron con el anticuerpo secundario biotinilado correspondiente, por 60 min a TA. Luego, de lavados con PBS, se amplificó la señal por incubación con el complejo estreptoavidina-avidina-peroxidasa (HRP) por 60 min a TA. Los cortes fueron lavados y finalmente revelados con diaminobencidina (DAB) (DAB-kit, Cell Marque). Los cortes se contratiñeron con hematoxilina, se deshidrataron y se montaron con medio de montaje DPX.
Análisis de imágenes
En imágenes de microscopía (Cari Zeiss) a 40x se determinó el índice de proliferación de células de la granulosa cuantificando el número de células PCNA+ / tipo folículo en el total de ovarios analizados para las HC y HT en el grupo no inducido y superovulado. Para el análisis de la inmunoexpresión de VEGF en cortes de los ovarios, se observó la localización, la distribución y la intensidad relativa de la marca en los folículos, cuerpos lúteos y en la zona medular, en todos los grupos experimentales respecto de los controles.
Análisis estadístico
Los valores expresados como promedios ± DE (desvío estándar) fueron comparados contra el control mediante la prueba t de Student. Los resultados expresados en proporciones o frecuencias (%) fueron analizados con la prueba de Fisher. Para el análisis estadístico se utilizó el programa estadístico GraphPad Instat software Inc. v2.05a e Infostat. Un valor de p<0,05 fue considerado estadísticamente significativo.
Resultados
Efecto de la ingesta semi-crónica de alcohol en el ciclo estral
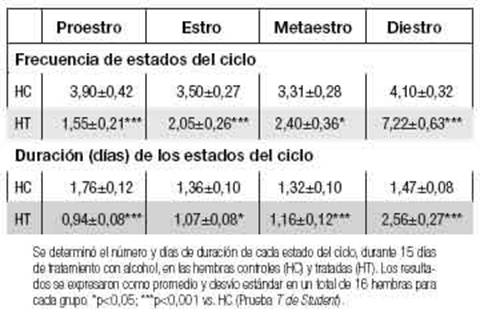
Se evaluaron probables diferencias en la frecuencia y duración de cada estado del ciclo estral durante el tratamiento en las HC y HT (Tabla II). El número promedio de proestro, estro y metaestro disminuyó significativamente mientras que el de diestro fue significativamente mayor en las HT comparado con el control (p<0,001; p<0,001, p<0,05 y p<0,001, respectivamente). La duración (número promedio de días) del proestro, estro y metaestro en el grupo HT se redujo significativamente vs el grupo HC (p<0,001; p<0,05 y p<0,001 respectivamente, tabla II). Por el contrario, la duración del diestro en las HT fue significativamente mayor con respecto a HC (p<0,001). Al finalizar el periodo de tratamiento, la frecuencia de hembras tratadas que se encontraron en estado de diestro aumentó significativamente vs HC (77,7% vs 16% respectivamente, p<0,001).
Calidad ovárica y desarrollo folicular luego del tratamiento con alcohol.
Efectos de la superovulación
Dadas las alteraciones en el ciclo estral de las hembras expuestas a etanol, se analizó la histo-patología ovárica. Los ovarios extraídos de las HT que finalizaron el tratamiento en estro (ovulación espontánea), presentaron líquido intersticial (edema) y mayor vascularización en el área medular comparando con los ovarios de HC (Fig. 1B vs A). El análisis cuantitativo de los tipos foliculares y cuerpos lúteos maduros mostró una reducción significativa del número de folículos primarios / preantrales, antrales y cuerpos lúteos en ovarios de HT vs HC (p<0,05; p<0,05; p<0,001 respectivamente); mientras que el número de folículos atrésicos aumentó significativamente en HT respecto del HC (p<0,05) (Fig. 1E).
Se determinó el número y días de duración de cada estado del ciclo, durante 15 días de tratamiento con alcohol, en las hembras controles (HC) y tratadas (HT). Los resultados se expresaron como promedio y desvío estándar en un total de 16 hembras para cada grupo. *p<0,05; ***p<0,001 vs, HC (Prueba Tde Student).
Dado que la gran mayoría de las HT finalizaron el periodo de tratamiento en diestro, y que el número de folículos y de cuerpos lúteos se redujo, el objetivo fue determinar si un protocolo de supe-rovulación podía restablecer la foliculogénesis y ovulación. En los cortes histológicos de ovarios de HT y HC superovuladas, se observó vascularización medular similar (Fig. 1B y D) mientras que el número de folículos y de cuerpos lúteos en ambos grupos experimentales no presentó diferencias significativas (Fig. 1F).
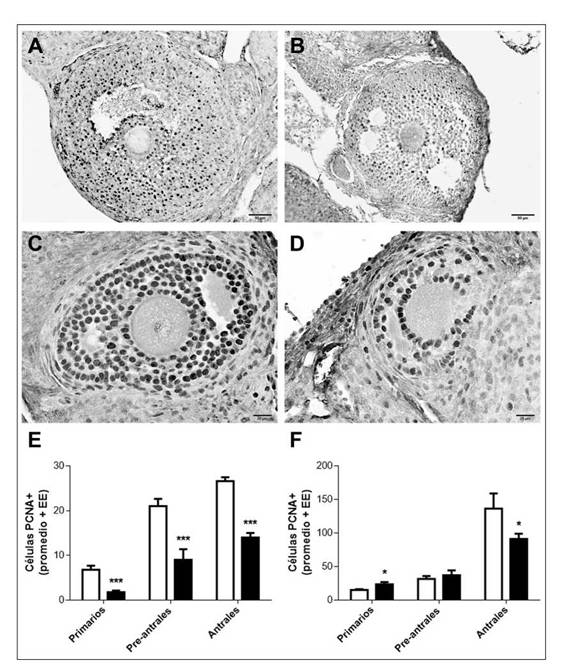
Un menor desarrollo folicular en los ovarios de las HT podría deberse a un déficit en la proliferación de las células de la granulosa, mientras que la su-perovulación restauraría dicho índice folicular. Se observó inmunomarcación PCNA-positiva en las células de la granulosa de folículos primarios, preantrales (dato no mostrado) y de folículos antrales de HC y HT con ovulación espontánea (en estro) y superovuladas (Fig. 2A-D). El número de células de la granulosa PCNA+ disminuyó significativamente en todos los tipos foliculares analizados en los ovarios de HT con ovulación espontánea comparando con los controles (p<0,001) (Fig. 2E). Sin embargo, en las HT superovuladas, sólo los folículos antrales presentaron una disminución del número de células PCNA+ respecto de los folículos de las HC (p<0,05) (Fig. 2F).
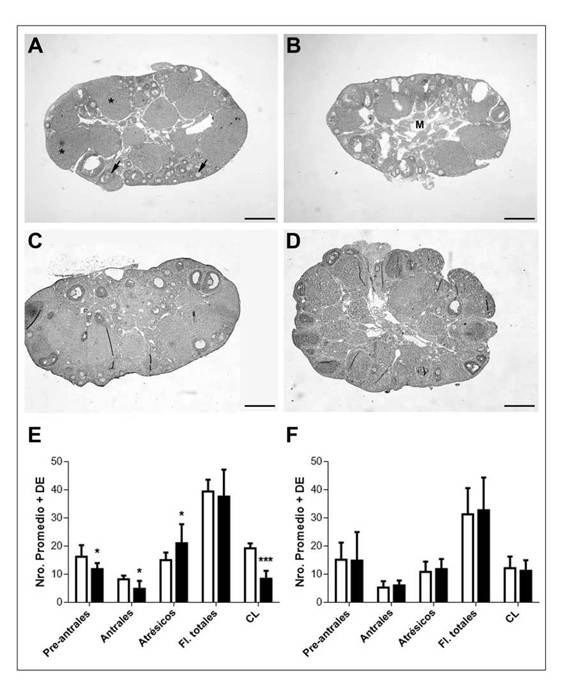
Figura 1: Calidad ovárica y desarrollo folicular luego del tratamiento semicrónico con alcohol. Efectos de la superovulación.
Micrografías representativas de ovarios (Hematoxilina-eosina) de hembras controles (HC) y tratadas (HT), con ovulación espontánea en estro (A, B) y superovuladas (C, D). Notar la menor cantidad de cuerpos lúteos (*), la mayor vascularización de la médula (M) ovárica y la escasa cantidad de folículos (flecha) de la corteza del ovario de las HT (B) respecto del ovario de las HC (A) con ovulación espontanea. Los ovarios de las HT superovuladas (C) presentan una histología similar a las HC (D). Aumento: 2,5x. E y F: promedio ± desvío estándar (DE) de folículos primarios y preantrales, antrales, anormales/atrésicos, folículos (Fl.) totales y cuerpos lúteos (CL) en los ovarios de HC (barras blancas) y HT (barras negras) con ovulación espontánea (E) y superovuladas (F). (n=5 hembras para cada grupo). * p<0,05; *** p<0,001 vs. HC (Prueba t de Student).
Evaluación de la proliferación de las células de la granulosa por inmunohistoquímica contra PCNA, en ovarios de hembras controles (HC) y tratadas (HT), inducidas o no con hCG. Micrografías representativas de cortes de ovarios mostrando folículos antrales de hembras con ovulación espontánea (A, B) y superovuladas (C, D). Notar la menor inmunomarcación de células foliculares PCNA-positivas en los cortes de las HT no inducidas (B) e inducidas (D) versus controles (A, C, respectivamente). Aumento:40x. Cuantificación de células de la granulosa PCNA-positivas (+) en folículos primarios, preantrales y antrales de ovarios de HC (barras blancas) y HT (barras negras) no inducidos (E) e inducidos (F). Los resultados se expresan como el promedio ± error estándar (EE) (n=5 hembras para cada grupo). * p<0,05; *** p<0,001 vs. HC (Prueba t de Student).
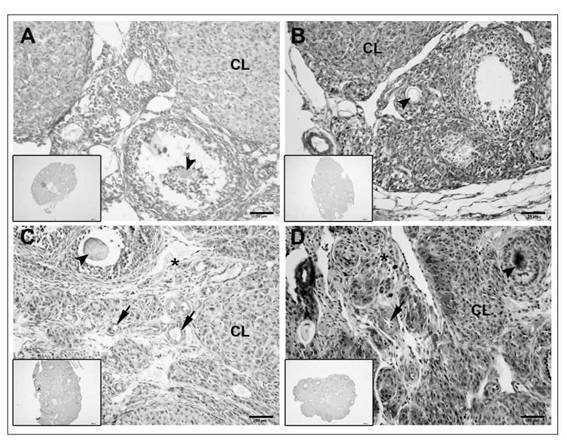
Figura 3: Inmunoexpresión de VEGF en hembras controles y tratadas con ovulación espontánea y superovuladas.
Microfotografías representativas de la inmunoexpresión de VEGF en cortes de ovarios de hembras controles (HC) y tratadas (HT) inducidas o no con hCG, mostrando folículos / oocitos (cabeza de flecha), cuerpos lúteos (CL), estroma medular (*) y vasos arteriales (flecha) de hembras con ovulación espontánea (A, B) y hembras superovuladas (C, D). Nótese la mayor inmunoreactividad de VEGF en las distintas estructuras ováricas de las HT no inducidas (B) e inducidas (D) versus sus controles (A, C, respectivamente). Aumento 40x. Inserto, control negativo de la inmunohistoquímica.
Niveles adecuados de expresión de VEGF son fundamentales para el desarrollo de una angio-génesis-vascularización ovárica y foliculogénesis normal, ya que VEGF es un fuerte promotor de la proliferación folicular y endotelial. VEGF se localizó en los folículos preantrales y antrales, cuerpos lúteos, estroma ovárico y vasos sanguíneos medulares de ovarios de HT y HC con ovulación espontánea o con superovulación (Fig. 3A-D). Sin embargo, la intensidad de la inmunomarcación fue mayor en los ovarios de las HT con ovulación espontánea y superovuladas (Fig. 3B y D) respecto sus controles (Fig. 3A y C).
Efectos de la ingesta semicrónica de alcohol sobre la calidad oocitaria
Para analizar los efectos de la ingesta semicrónica de alcohol sobre la calidad oocitaria, se indujo la ovulación con la aplicación de gonadotrofinas al cabo del tratamiento. En las hembras tratadas inducidas, se encontró una cantidad signi-^cativamente mayor de oocitos ovulados que el control (HC: 25,0 ± 8,6; HT: 44,0 ± 16,4, p<0,01). La proporción total de oocitos morfológicamente intactos, observados por microscopía de contraste de fase (Fig. 4A), no se alteró en las HT vs las HC (Fig. 4E). Sin embargo, la frecuencia de oocitos intactos con MII normal (Fig. 4C) disminuyó significativamente en HT respecto del control (p<0,001), mientras que la proporción de oocitos intactos, pero con MII anormal (Fig. 4D), aumentó significativamente comparando con las HC (p<0,001) (Fig. 4E).
Por otra parte, la proporción de oocitos activados partenogenéticamente, observados por microscopía de contraste de fase (Fig. 5E), aumentó significativamente en HT respecto del control (p<0,001) (Fig. 5H). Dentro de esta categoría, la proporción de oocitos sin II CP en anafase II (AII) o con 1 o 2 pronúcleos (Fig. 5B-D) aumentó significativamente en HT respecto del control (p<0,05, Fig.5H). La proporción de oocitos activados con expulsión de II CP, en telofase II (TII) (Fig. 5F), fue significativamente mayor en HT respecto al control (p<0,001, Fig.5H). Mientras que la proporción de oocitos con IICP y 1 PN (Fig. 5G) no mostró diferencias significativas entre los grupos (Fig.5H).
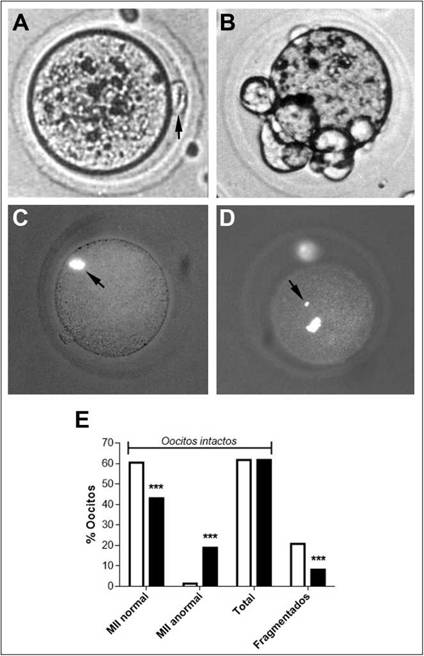
Figura 4: Calidad morfológica externa y nuclear de oocitos de hembras controles y tratadas superovuladas.
Se analizó la calidad oocitaria por microscopía de contraste de fase y fluorescencia {Hoescht 33342) en oocitos extraídos a las 16 hs post hCG de hembras controles (HC) y tratadas (HT) superovuladas. (A) Oocito intacto con morfología normal, con primer cuerpo polar (ICP) (flecha) en espacio perivitelino, (B) oocito fragmentado, (C) oocito intacto en metafase (M) II normal (flecha), (D) oocito intacto normal, pero con MII anormal (disrupción de placa metafásica localizada centralmente y con pérdida de cromatina) (flecha). Contraste de fase (A, B), tinción con Hoescht (C, D). Aumento: 40x. (E) Cuantificación de la frecuencia (%) de los tipos oocitarios según morfología externa (intactos y fragmentados) y nuclear (metafase) en HC y HT. *** p<0,001 vs control (Test de Fisher).
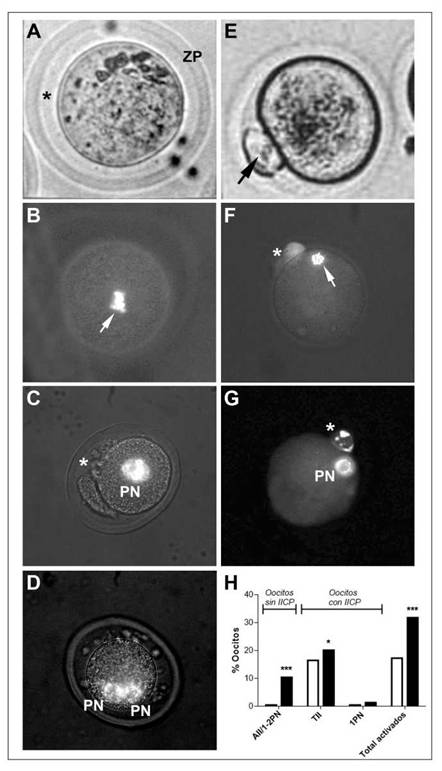
Figura 5: Frecuencia de oocitos activados partenogenéticamente luego del tratamiento semicrónico con alcohol en hembras superovuladas.
Se analizó la calidad oocitaria por microscopía de contraste de fase y fluorescencia (Hoescht 33342) en oocitos extraídos a las 16 hs post hCG de hembras controles (HC) y tratadas (HT) superovuladas. (A) Oocito intacto sin liberación de segundo cuerpo polar (IICP) (*: espacio perivitelino, ZP: zona pelúcida), (B) oocito intacto sin IICP + Metafase (M) II activada/Anafase (A) II, migrada al centro del oolema (flecha), (C) oocito anormal sin IICP, con fragmentos perivitelino (*) + 1 pronúcleo (PN) central, (D) oocito anormal sin IICP + 2PN, (E) oocito activado con liberación de IICP (flecha), (F) oocito con IICP (*) + AII/telofase II (flecha), (G) oocito con IICP (*) + 1PN. Contraste de fase (A, E), tinción con Hoescht (B, C, D, F, G). Aumento 40x. (H) Cuantificación de la frecuencia (%) de los tipos oocitarios activados partenogenéticamente en HC y HT * p<0,05; *** p<0,001, vs control (Test de Fisher).
Discusión
Históricamente, se reportó que el consumo femenino crónico de alcohol afecta negativamente el funcionamiento endócrino del eje hipotalámico-hipofisario-gonadal, produciendo efectos adversos en la tasa ovulatoria. Por primera vez, en el presente trabajo describimos el efecto nocivo de la ingesta femenina corta de alcohol en concentraciones moderadas a bajas, según el grado de alcoholemia producida (20-50 mg/dl), sobre la ciclicidad estral, la calidad ovárica y la gameta así como su respuesta a la superovulación con gonadotrofinas.
El tratamiento con alcohol al 10% por 15 días de hembras de ratón, provocó en el día 4-5to de tratamiento, alteraciones en la ciclicidad que se reflejaron en menor cantidad relativa y duración de los estados de proestro, estro y metaestro. El detenimiento del ciclo en diestro y/o prolongación de este estado se observó, al término del tratamiento, en la gran mayoría de las hembras tratadas, sugiriendo un efecto de anestro prolongado. Diversos trabajos han mostrado resultados similares, sin embargo, los periodos de exposición a alcohol fueron más prolongados. El tratamiento durante 5 semanas con una dieta líquida con 5 % de alcohol, disminuye significativamente la frecuencia del estro y proestro e incrementa la duración de las fases de diestro y metaestro (Sanchis et al. 1985). Ratas tratadas con 5 % de etanol en dieta líquida durante dos ciclos estrales completos fue suficiente para abolir completamente la ciclicidad, presentaron un persistente estado de diestro, disminución de LH y marcada disrupción de la estructura y función ovárica (Rettori et al. 1987; Emanuele et al. 2001). Mujeres no alcohólicas pero bebedoras sociales (consumidoras de bajas cantidades de alcohol), tuvieron interrupción del ciclo normal e infertilidad temporal, lo cual se asoció con una reducida o ausente secreción de LH (Mendelson y Mello 1988). Por estudios previos, los resultados obtenidos sugieren que las alteraciones en el ciclo estral están relacionadas con defectos en la síntesis/liberación hormonal a nivel del eje hipotálamo-hipófisis-ovario (H-H-O). En relación con ello, a nivel ovárico, demostramos que el tratamiento corto con alcohol produce un menor crecimiento y maduración folicular y por ende una reducción en la tasa de formación lútea. Más aún, la exposición a alcohol genera elevado índice de atresia folicular.
Dado que los resultados obtenidos sugieren efectos adversos del etanol sobre la regulación hormonal el eje H-H-O, hipotetizamos que la inducción con gonadotrofinas exógenas era capaz de restaurar la baja frecuencia de folículos antrales y cuerpos lúteos maduros luego del tratamiento. Esta hipótesis fue probada en las hembras tratadas, con la aplicación de la superovulación. De hecho, los folículos atrésicos tempranos pueden ser rescatados por la aplicación de gonadotrofinas exógenas (Hsueh et al. 1994). En otras especies (bovinos y porcinos) ya fue demostrado el efecto de las gonadotrofinas sobre la supervivencia folicular y el rescate de la atresia (Layman y Mc-Donough 2000), efecto que está mediado por una inhibición de la apoptosis de las células de la granulosa (Yang y Rajamahendran 2000; Asahara et al. 2003). El número cuerpos lúteos de las hembras tratadas luego de la superovulación también fue normalizado a los valores del control, mostrando la recuperación del desarrollo folicular y la ovulación luego de la exposición. Sin embargo, todos los tipos foliculares de los ovarios de las hembras expuestas a alcohol presentaron una reducción del crecimiento folicular, dado por el menor número de células de la granulosa en proliferación (PCNA+). De hecho, este resultado sugiere que la alta tasa de atresia en los ovarios de las hembras tratadas pudo deberse al cese de la mitosis folicular, como fue demostrado por otros (Crisp 1992; Hsueh et al. 1994). De manera similar, la exposición directa a etanol inhibió la proliferación de células de músculo esquelético in vitro (Garriga et al. 2000). Sin embargo, luego de la superovulación, si bien la tasa de proliferación de los folículos antrales de los ovarios de las hembras tratadas permaneció disminuida, contrariamente a lo esperado, la superovulación provocó un aumento en la tasa de proliferación de los folículos primarios, efecto que requiere mayor estudio.
La calidad del desarrollo folicular e índice proli-ferativo están íntimamente ligados con el rol de factores de crecimiento, como el VEGF. El impacto de la ingesta de alcohol a nivel del ovario se tradujo en un incremento de la expresión de VEGF en folículos preantrales y antrales, en cuerpos lúteos y en el estroma medular. Aunque se demostró que la inyección directa de VEGF en ovarios de ratón incrementa significativamente la densidad vascular y el número de folículos preovulatorios (Quintana et al. 2004), en nuestro modelo, la exposición a alcohol induciría una sobre-expresión ovárica de VEGF, por encima del nivel del control. En la rata, el ARNm de VEGF se expresa en las capas de la teca de los folículos preantrales y antrales pequeños, sugiriendo una acción paracrina de VEGF en dichas células con un rol en la dirección de la extensión de capilares hacia la periferia del folículo (Shweiki et al. 1993). Durante la foliculogénesis, los folículos destinados a ovularse presentan incremento de la expresión de VEGF (Kaczmarek et al. 2005). En ratón, VEGFA participa en la supervivencia de las células de la granulosa, a través de la estimulación de las mismas a producir hormonas esteroideas que promueven la viabilidad y progresión folicular (Sargent et al. 2015). Además, VEGF estaría involucrado en el proceso de formación del antro por aumento de la permeabilidad vascular. Sin embargo, los resultados obtenidos en nuestro modelo sugieren que los altos niveles de VEGF se relacionan con regulación negativa de la proliferación de la granulosa folicular luego de la exposición a alcohol, y por lo tanto con una disminución de la viabilidad folicular que lleva a atresia ovárica. Tal como fue demostrado por otros autores, el incremento de la expresión de VEGF ovárica está asociado con patología gonadal. Así, la elevada producción de VEGF se vinculó con anovulación en el síndrome de ovario poliquísti-co, en el síndrome de estimulación ovárica y en neoplasias ováricas benignas y malignas (Geva y Jaffe 2000). Más aún, se ha encontrado que la sobreexpresión de la isoforma VEGF165b en el ovario de ratón reduce la fertilidad al inhibir el desarrollo folicular (Qiu et al. 2012). De hecho, la administración de 5 UI de gonadotrofinas en las hembras tratadas tampoco revirtió el efecto del alcohol sobre el aumento de VEGF, el que permaneció elevado. Varios estudios sugirieron que LH y hCG incrementan la expresión y secreción de VEGF (Ravindranath et al. 1992; Neulen et al. 1995; Christenson y Stouffer 1997), que actúa de manera parácrina sobre su receptor KDR en las células epiteliales foliculares y endoteliales del ovario (Zimmermann et al. 2003).
Luego de la ingesta corta de alcohol y bajo estimulación ovárica con gonadotrofinas, se observó una mayor tasa ovulatoria. Considerando que el tratamiento con alcohol fue capaz de inhibir la foliculogénesis e incrementar la tasa de atresia, la aplicación de gonadotrofinas exógenas en las hembras tratadas podría llevar a la inducción de la maduración de folículos pequeños poco desarrollados y rescatar algunos atrésicos, produciendo de esta manera una mayor ovulación de folículos. Es por ello que pensamos que en las hembras tratadas la superovulación indujo aumento de anomalías oocitarias y menor frecuencia de fragmentados, efecto que en las hembras controles constituye un evento fisiológico normal ocasionado por la apoptosis oocitaria durante la atresia folicular.
La ingesta de alcohol afectó negativamente la calidad oocitaria, por lo que se observó una elevada frecuencia de oocitos con MII anormal, dada por pérdida de material genético y/o probablemente cromosomas rezagados en el oolema. Según trabajos previos, el etanol indujo anomalías cro-mosómicas (aneuploidías) en oocitos expuestos durante la meiosis I y II, donde se vieron husos multipolares asociados con alineamientos desorganizados de cromosomas (Balakier y Casper 1993). Varios estudios indicaron que el principal metabolito del etanol, el acetaldehído, interfiere con la integridad de los microtúbulos y la polimerización de la tubulina (Kaufman 1997). Es probable que aún la ingesta corta de alcohol en el presente modelo, induzca errores en la segregación cromosómica durante la meiosis, efectos adversos que estarían dados a nivel de alteraciones en la formación del huso meiótico.
Por otro lado, observamos que una alta cantidad de oocitos de las hembras tratadas salieron del arresto meiótico, proceso que, aunque puede ocurrir en baja frecuencia en forma espontánea en las hembras controles, fue inducido por el tratamiento con alcohol. La ingesta de alcohol produjo alta frecuencia de diploidización de la gameta (oocitos sin extrusión de II CP y en AII o con desarrollo de 1 o 2 pronúcleos), y de activación partenogenética haploide (oocitos con liberación de IICP y en telofase II). Estos resultados son coincidentes con trabajos propios previos, donde tratamientos crónicos con etanol al 5 y 10 % por 30 días en ratones híbridos y exocriados (CF1) producen un incremento del porcentaje de oocitos morfológicamente anormales y de activados partenogenéticamente, aunque en este caso, luego de la expulsión de IICP, se desarrolló un pronúcleo (Cebral et al. 1998a; Cebral et al. 1998b; Cebral et al. 1999; Cebral et al. 2011). En el presente estudio la activación diferencial de oocitos, con o sin extrusión del IICP y desarresto de la meiosis, podría ser explicada por el tipo mecanismo de activación gatillado por la exposición corta a alcohol. La activación oocitaria está dada por el incremento del Ca2+ intracelular libre que lleva a la reasunción meiótica (de Felici et al. 1991; Kline 1996). La exposición directa de oocitos a etanol induce un aumento de Ca2+ intracelular y con ello la extrusión completa del IICP (Cuthbertson 1983; Chatot et al. 1989). Por lo tanto, el tratamiento semicrónico de alcohol en el presente modelo murino exocriado, induce desarresto de la meiosis que, dependiendo del patrón de pulsos de calcio intracelular, lleva al desarrollo temprano de partenogénesis diploide y/o haploide sin formación de pronúcleo, evento más tardío de la progresión de la meiosis.
En resumen, la superovulación en hembras mu-rinas tratadas semicrónicamente con alcohol en el agua de bebida por 15 días, no restaura la calidad de la gameta, sino lo contrario, además de la persistencia de anomalías nucleares y activación partenogénetica oocitaria, la inducción de la ovulación incrementa la tasa de fragmentación de la gameta luego de la exposición a alcohol El presente trabajo, abre nuevos horizontes en la investigación de los efectos adversos del consumo de alcohol sobre la ovulación y la calidad gamética en edad reproductiva y su probable repercusión en la competencia y calidad del desarrollo embrionario temprano.
Agradecimientos. Los autores agradecen al Dr. Cristian So-barzo, del INBIOMED, Facultad de Medicina, Universidad de Buenos Aires, por facilitar la utilización y disposición de equipamiento de microscopía óptica y de fluorescencia (Cari Zeiss). El presente trabajo fue realizado con aportes de subsidios PIP-CONICET y de la Agencia de Ciencia y Técnica (PICT) (EC).












 uBio
uBio