Introducción
El botulismo del lactante (BL) es una entidad potencialmente grave que afecta a niños me nores de un año (Ministerio de Salud 2012) ocasionada por la ingesta de esporas de la bacteria del género Clostrídium y producción in situ de toxina botulínica (TB). Se caracteri za por un cuadro de parálisis fláccida aguda descendente, de instalación progresiva y se veridad variable. Afecta principalmente a niños entre las 2 y 24 semanas de vida (Ministerio de Salud 2012). La principal causa de muerte es la insuficiencia respiratoria, con requerimiento en casos graves de asistencia ventilatoria me cánica (AVM).
Nuestro país ocupa el segundo lugar con ma yor incidencia de BL luego de Estados Unidos (Jong y Fernández 2012), siendo ésta además la presentación clínica más frecuente de bo- tulismo en Argentina (Jong y Fernández 2012, Ministerio de Salud 2012).
La primera identificación de toxiinfección por botulismo en lactantes humanos a partir de la ingesta de esporas fue comunicada en Esta dos Unidos (EEUU) por Arnon et al. en 1977. En Argentina los primeros casos confirmados datan del año 1982 (Lentini et al. 1986), consti tuyendo desde 1999 un evento de notificación obligatoria inmediata por medio del Sistema Nacional de Vigilancia Epidemiológica (SNVE) (Ministerio de Salud 2012).
Si bien el manejo de esta entidad se basa prin cipalmente en el tratamiento de sostén, cuenta con tratamiento específico que consiste en la administración temprana, dentro de los 5 días desde inicio de los síntomas, de antitoxina botulínica (AtB). La misma se encuentra disponible en dos formas: derivada de suero humano o BabyBIG® y derivada de suero equino, en Argentina en forma bivalente A-B. Ésta última es utilizada para botulismo por heridas o alimentario sin indicación formal para BL, princi palmente por posibles reacciones de hipersensibilidad.
El objetivo del presente trabajo es exponer un caso clínico de BL grave con aislamiento de TB tipo A, tratado con antitoxina botulínica biva lente equina A-B (AtBE), más allá de los 5 días de evolución y presentar una revisión bibliográ fica sobre las indicaciones de AtBE en BL y su perfil de seguridad.
Caso clínico
Paciente femenina de 5 meses que es derivada al Hospital Interzonal de Agudos Especializado en Pediatría “Superiora Sor María Ludovica” de La Plata desde un hospital de menor complejidad del partido de Merlo, provincia de Buenos Aires, en su décimo día de internación. Ingresa con diagnóstico de encefalopatía en estudio en contexto de shock séptico sin aislamien to bacteriológico, con hipotonía generalizada asociada a estatus epiléptico y AVM. Precede a su hospitalización un cuadro de decaimiento, succión débil y rechazo parcial del alimento de 48 horas de evolución. Al momento de la re cepción en nuestra institución, por antecedentes, evolución y cuadro clínico, se sospecha BL. No surge de la anamnesis antecedente de ingesta de miel o medicina folclórica, pero se destaca que habita en una vivienda en cons trucción, sobre calle de tierra y haber estado días previos en una zona rural. A partir de esto se mantienen las medidas de cuidados críticos y se solicita identificación de TB en muestras de suero y materia fecal al centro de referencia ANLIS “Dr. Carlos Malbrán”, con confirmación de TB tipo A en materia fecal. Por cuadro de constipación de aproximadamente 12 días de evolución, se inicia tratamiento con enemas evacuantes. La paciente presenta catarsis positiva y mejoría clínica progresiva. A los 27 días de evolución se observa deterioro clínico, intensificándose la hipotonía muscular generalizada, persistiendo con requerimientos de AVM. Se replantea el tratamiento instaurado, identificándose en nuevas muestras de materia fecal y sangre la presencia de TB tipo A. Se decide, luego de una revisión bibliográfica, utilizar an titoxina botulínica A-B producida en el Instituto Biológico “Dr. Tomás Perón”, inmunoglobulina G purificada de origen equino, en el día 48 desde el inicio del cuadro. El procedimiento es bien tolerado por la paciente, sin presentar efectos adversos y con respuesta favorable. Se otorga el egreso hospitalario con traqueostomía y sonda nasogástrica para manejo de líquidos a los 166 días de iniciado el cuadro, con segui miento por servicios de toxicología, neurología, fonoaudiología y gastroenterología, sin compli caciones a 1 año de su seguimiento.

Tabla 1: Prevalencia de Botulismo del Lactante por Provincia. Período enero 2012 a diciembre 2021. CB: Conurbano Bonaerense, IP: Interior de la Provincia. (Ministerio de Salud de la República Argentina 014,2015,16, 2017, 2018, 2019, 2020, 2021)
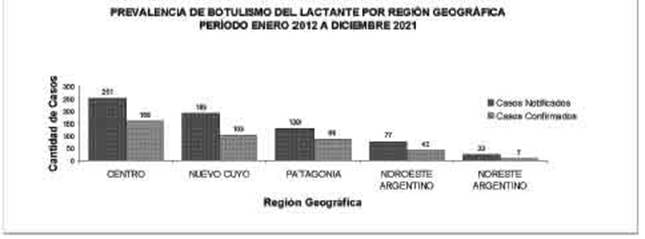
Tabla 2: Prevalencia de Botulismo del Lactante por Región Geográfica. Período enero 2012 a diciembre 2021. (Ministerio de salud de la República Argentina 2014, 2015, 2016, 2017, 2018, 2019, 2020, 2021)
Discusión
Según datos extraídos del Boletín Integrado de Vigilancia del período comprendido entre 2012 y 2021, en Argentina se registraron un total de 669 casos notificados (incluyendo casos sos pechosos, probables, confirmados y descarta dos) y 396 casos confirmados de BL. Las provincias con mayor prevalencia de casos confirmados en orden decreciente fueron: Ciudad Autónoma de Buenos Aires (C.A.B.A.), Mendo za, Córdoba, Río Negro y San Luis (Tabla 1). En el mismo período, las regiones geográficas con mayor frecuencia de casos confirmados fue ron: Centro, Cuyo y Patagonia (Tabla 2) (Minis terio de Salud de la República Argentina 2014, 2015, 2016, 2017, 2018, 2019, 2020 y 2021). En la Tabla 3 se expone la cantidad de habi tantes por provincia según el último el Censo Nacional de Población, Hogares y Viviendas (CNPHyV), realizado en el año 2010 (INDEC 2010). Se observa predominio franco de la provincia de Buenos Aires, que con la pobla ción del conurbano bonaerense y del interio
de la provincia posee el 39,8% del total de la población del país, seguido por las provincias de Córdoba con 8,25%, Santa Fe con 7,96%, C.A.B.A. con 7,2% y Mendoza con 4,33% ('Tabla 3). Basado en lo expuesto en las Tablas 1 y 3 se observa que las provincias de la región Centro, que poseen predominio de clima tem plado subhúmedo-húmedo, suman la mayor cantidad de casos, pero también concentran la mayor cantidad de habitantes con el 65,4% del total. En segundo lugar se encuentra la región de Nuevo Cuyo, con clima árido-semiárido, ventoso y escasas precipitaciones, que representa solo el 7,94% de la población total (IN DEC 2010).El agente involucrado en BL es Clostridium botulinum, un bacilo anaerobio gram positivo de distribución ubicua que se encuentra en los suelos, capaz de formar esporas. Estas estructuras resguardan el material genético, confiriéndole la capacidad de resistir a condi ciones ambientales adversas. Las mismas se hallan en el polvo ambiental pudiendo conta minar agua, alimentos y fómites (Ministerio de Salud 2012). Se considera que el ingreso del agente al organismo es por la vía oral, tanto por ingesta de alimentos como por la deglución de secreciones respiratorias contaminadas. Dentro de los alimentos involucrados con más frecuencia se destacan la miel, el jarabe de maíz y las hierbas medicinales, razón por la cual se desaconseja su administración a ni ños menores de un año (Martín de Santos et al. 2011). Se postula que los lactantes son es pecialmente susceptibles, por su pH gástrico mayor y la inmadurez tanto de su flora intestinal como de su sistema inmune (Ministerio de Salud 2012; Nelson et al. 2019). Existe controversia respecto al efecto protector de la lac tancia materna (LM). En pacientes con LM se describe mayor prevalencia de BL, pero con mayor edad al momento de la presentación, mientras que en pacientes alimentados con le che de fórmula se observa mayor prevalencia de cuadros graves (Ministerio de Salud 2012; Peruffo et al. 2014; Rosow y Strober 2015; Nelson et al. 2019). Debido a esto en 2015 Rosow y Strober sugirieron mantener la LM, aún en los pacientes que hayan presentado botulismo del lactante. En cuanto a condiciones geográficas, presentan mayor riesgo aquellos niños que habitan en zonas rurales, regiones áridas, ventosas, con bajas precipitaciones, baja humedad ambiental (Ministerio de Salud 2012) y cerca de sitios en construcción, por presencia de polvo aerolizado (Nelson et al. 2019).
Una vez dentro del intestino del lactante la espora encuentra condiciones favorables para su germinación y producción de TB, la cual, luego de alcanzar la circulación general, tiene tropismo específico por las terminales nerviosas colinérgicas periféricas. Compuesta por dos cadenas peptídicas, la TB ingresa a las células por unión a receptores específicos por medio de su cadena pesada. Luego, por medio de la liberación de su cadena liviana, generará des trucción y pérdida de función del complejo de proteínas de membrana presináptica denominadas SNARE (proteínas de fusión entre membranas, sensible a la N-etilmaleimida) involucradas en la exocitosis de acetilcolina (ACh), conduciendo al déficit del neurotransmisor en biofase (Arnon et al. 2001; Nelson et al. 2019). Este complejo incluye a las proteínas Sinap- tobrevina, SNAP25 (sinaptosoma asociado a proteína de 25 kDa) y Sintaxina. La unión al sitio diana es irreversible.
Se describen ocho serotipos de toxinas, nom bradas de la A a la H, que son producidas en diferente medida por distintas especies del género Clostrídium, siendo Clostrídium botu- linum capaz de producir los ocho serotipos. Diferentes serotipos de TB escinden diferen tes proteínas de la familia SNARE, lo que pro bablemente explique su espectro diverso de toxicidad (Nelson et al. 2019). Las TB tipo B, D, F y G escinden la Sinaptobrevina, los tipos A, C y E la SNAP-25 y la tipo C la Sintaxina (Cortés Monroy et al. 2014). Los serotipos más frecuentemente asociados al BL en Argentina son el A y B (Jong y Fernández 2012), dato fundamental al momento de utilizar sueros an titoxina botulínica específicos.
Este proceso resulta en una parálisis muscular flácida, progresiva, simétrica y descendente, precedida frecuentemente por constipación, afectación de pares craneales y musculatura proximal. En el BL se evidencia llanto débil, ptosis palpebral bilateral, pérdida de expre sión facial, pérdida del sostén cefálico, midria- sis y dificultad para deglutir y alimentarse. Se pueden observar signos de disfunción auto nómica como anhidrosis, xerostomía, enroje cimiento facial, retención urinaria, hipertensión o hipotensión arterial y arritmias cardíacas. Lo característico de esta patología es la hipotonía generalizada con hiporreflexia o arreflexia os- teotendinosa, por lo que puede observarse la “postura de rana” en miembros inferiores. Se presenta con diferentes niveles de gravedad, pudiendo sobrevenir la muerte secundaria a la parálisis de músculos respiratorios con insu ficiencia respiratoria en una primera etapa, o por complicaciones inherentes a los cuidados intensivos prolongados en una segunda eta pa (Griese et al. 2017). Se postula una relación entre las presentaciones fulminantes de BL y el Síndrome de Muerte Súbita del Lactante (Nelson et al. 2019).
Dentro de los principales diagnósticos diferen ciales del BL se plantea: sepsis, deshidrata- ción con alteraciones hidroelectrolíticas, Gui- llain-Barré variante Miller-Fisher y meningoen- cefalitis (Ministerio de Salud 2012). Debido a su baja incidencia es necesario un alto grado de sospecha clínica. Se propone como tría da patognomónica: constipación, hipotonía y abolición del reflejo fotomotor (Ministerio de Salud 2012).
El diagnóstico se basa en el cuadro clínico, antecedentes epidemiológicos y aislamiento de TB en suero o materia fecal. En el BL es más frecuente el aislamiento de TB en materia fecal, con bajo rescate en sangre. La prueba diagnóstica “gold estándar” es el método de bioensayo por inoculación intraperitoneal en ratón albino (Nelson et al. 2019). La misma consiste en la inoculación de suero o cultivo de materia fecal del paciente, en peritoneo de ratón y su observación durante el término de 24 a 48 horas. De ser positivo, se procede a la exposición de las mismas muestras a ra tones de iguales características, previamente expuestos a antitoxina botulínica específica, con el fin de identificar el serotipo de TB. Se trata de una prueba con alta sensibilidad, pero costosa, laboriosa y que no permite un diag nóstico rápido.
Respecto al tratamiento, la terapia de soporte es primordial, debiendo jerarquizar el acceso precoz a los cuidados intensivos, sobre todo cuando el paciente presenta compromiso de la mecánica ventilatoria. La mejoría en la ca lidad de la misma a lo largo de los años, se ha relacionado con mayor sobrevida de estos pacientes. Un cuidadoso monitoreo del estado respiratorio, utilizando parámetros como oximetría de pulso, presión de CO2 y presencia o ausencia de reflejo de protección de vía aérea o reflejo nauseoso, es esencial para determinar la necesidad de intubación orotraqueal. Se ha descrito que la posición de Trendelenburg invertida a 20-25° con soporte cervical podría ser beneficiosa, ya que disminuye el riesgo de aspiración mientras reduce la presión que ge neran las vísceras abdominales sobre el dia fragma, reduciendo el esfuerzo ventilatorio. Sin embargo, su aplicación clínica en pacien tes con compromiso de la función respiratoria no ha sido validado (Nelson et al. 2019). La kinesioterapia respiratoria y la rehabilitación física son fundamentales.
En cuanto a la alimentación, se recomienda instalar precozmente una sonda nasogástrica o nasoyeyunal y aportar leche materna como fuente nutricional de elección. No se recomienda de rutina el uso de alimentación parenteral, ya que aumentaría los riesgos de infecciones secundarias (Ministerio de Salud 2012).
La constipación suele ser un problema fre cuente. Se describe el uso inicial de enemas evacuantes, para disminuir la carga de esporas y obtener las muestras para diagnóstico, pudiendo luego continuar con ablandadores de heces y aumento del aporte de líquidos. Se reporta el uso de catárticos y enemas para eliminar la toxina del tracto gastrointestinal (Ministerio de Salud 2012; O’Horo et al. 2018), aunque se debate la utilidad de las enemas (Puig de Centorbi y Calleri de Milán 1984) y se recomienda evitar el uso de laxantes diferen tes a los ablandadores de heces (Ministerio de Salud 2012). Es de suma importancia el mane jo cuidadoso de las excretas, ya que estos pa cientes pueden eliminar esporas y toxinas en las heces hasta 4 meses después de iniciados los síntomas (Ministerio de Salud 2012).
No se recomienda el uso de antibióticos de forma rutinaria, debiendo ser considerados sólo en caso de infecciones sobreagregadas. Se recomienda la profilaxis para trombosis venosa profunda y el monitoreo continuo de la función cardíaca, debido a la posibilidad de disfunción autonómica (Nelson et al. 2019).
El tratamiento específico del BL es la administración temprana de AtB, ya que la misma neutraliza la TB libre en plasma previo a su internalización. A las medidas de sostén junto con el uso de la AtB se les atribuye, según estadísticas de EEUU, la reducción de la mortalidad de más del 60% a principios del siglo XX, a menos del 5% en la actualidad (O’Horo et al. 2018).
En el año 2003 la FDA aprobó en EEUU la AtB humana BabyBIG®, que demostró en un ensayo clínico randomizado una reducción significativa en la duración de AVM y de nutrición parenteral o enteral, de la estadía hospitalaria, del tiempo de requerimientos de cuidados intensivos y del costo de hospitalización frente a placebo, sin causar efectos adversos (EA) serios (Nelson et al. 2019), con una vida media de 28 días (Ministerio de Salud 2012; Rosow y Strober 2015). Si bien se trata de una medida terapéutica efectiva, resulta de alto costo (Jang et al. 2020) y al momento de la elaboración de este trabajo no se encuentra dispo nible en muchos países, incluida la Argentina. Respecto a la AtBE, existe experiencia limitada en su utilización para BL (Ministerio de Salud 2012). Es utilizada ampliamente en pacientes adultos, pero no cuenta con indicación formal para el BL. La contraindicación de muchos autores en este sentido, se basa en la aparición de EA en series de pacientes adultos con bo- tulismo alimentario expuestos a AtBE (Black y Gunn 1980; Tacket et al. 1984), la sensibilización potencial de por vida a las proteínas equi nas (Arnon et al. 2006; Rosow y Strober 2015) y la posibilidad descrita en trabajos antiguos, de que las reacciones anafilácticas frente a los productos derivados de suero equino resulten más graves en los lactantes (CDC 1998; Vane- lla de Cuetos et al. 2011). Por otro lado, su cor to tiempo de vida media entrvida media, entre 5 y 7 días, se ha considerado inadecuado para un cuadro causado por la generación in situ de TB con absorción intestinal intermitente y sostenida en el tiempo (Hatheway et al. 1984; Fox et al. 2005; Ministerio de Salud 2012). Sin embargo, actualmente es la única opción dis ponible en Argentina, en forma bivalente A-B. Su eficacia para el tratamiento de BL no ha sido evaluada en ensayos clínicos controlados (Vanella de Cuetos et al. 2011). Todos los trabajos hallados evalúan la eficacia dentro de los primeros 5 días y no identificaron EA severos en lactantes. En 2011, Vanella de Cuetos et al. publicaron un estudio analítico observacional retrospectivo de pacientes con BL asistidos entre 1993 y 2007 en la provincia de Mendo za, Argentina. Se incluyeron 31 pacientes con BL grave confirmado, con menos de 5 días de evolución, tratados con AtBE vs 18 pacientes tratados con medidas de sostén. Los autores concluyen que el uso de AtBE resulta benefi cioso con resultados estadísticamente signifi cativos. Como EA, se describieron reacciones de hipersensibilidad leve, como rash cutáneo, que también se han reportado con el uso de BabyBIG® (Vanella de Cuetos et al. 2011). No hemos hallado reportes de EA graves en la bi bliografía revisada.
Algunos autores recomiendan considerar el uso de AtBE como opción terapéutica en pacientes con BL confirmado que requieran cui dados intensivos con soporte ventilatorio mecánico (Arnon et al. 1977; Vanella de Cuetos et al. 2011; Ministerio de Salud 2012). Su uso podría plantearse de utilidad aún cuando la TB no sea detectada en el suero del paciente, ya que la misma puede ser absorbida desde el tracto intestinal en forma intermitente o bien encontrarse en cantidades no detectables por las pruebas diagnósticas disponibles (Ministerio de Salud 2012). Si bien no se han hallado trabajos que evalúen la eficacia de AtBE pasados los 5 días, la neutralizacion de cualquier toxina circulante deberia ser beneficiosa (Rao et al. 2021). La evidencia revisada no indica un punto en el curso de la enfermedad más allá del cual, la administración de AtBE no proporcione algún beneficio. (Rao et al. 2021). En contexto de pacientes con diagnóstico de bo- tulismo sin tratamiento específico, la parálisis que progresa indicaría la presencia de TB circulante, por lo que dichos pacientes podrían beneficiarse al recibir AtB para proteger los músculos no afectados, independientemente de la cantidad de días de evolución del cuadro (Rao et al. 2021). Sin embargo, la AtB no revierte la parálisis ya instalada y la recuperación de la misma lleva semanas a meses, incluso después de la administración de la misma (Rao et al. 2021).
Respecto a las pruebas intradérmicas con AtBE previo a su administración, indicada rutinariamente a lo largo de los años, ya no se recomiendan. Esto es debido a que para su correcta realización se requiere capacitación especializada, mucho tiempo para realizar el procedimiento, presenta baja sensibilidad y especificidad y no proporciona una base fiable para predecir qué pacientes corren mayor riesgo de padecer enfermedad del suero o reacción anafiláctica (Black y Gunn 1980; Rao et al. 2021).
Conclusión
Coincidiendo con el trabajo de Vanella de Cuetos et al. (2011) nuestra paciente presentó evolución favorable luego de la administración de AtBE, con buena respuesta y sin presentar EA, aun habiendo sido administrada posterior a los 5 días de iniciado el cuadro.
Se remarca la importancia del tratamiento de sostén en BL grave con abordaje precoz y cuidados intensivos efectivos, junto a AVM de ser requerida. El uso de AtB, si bien no es fundamental, se ha asociado a la reducción del tiempo de permanencia hospitalaria y AVM, disminuyendo significativamente la probabilidad de complicaciones secundarias a éstos. En base a la bibliografía evaluada concluimos que la AtBE debe ser considerada como tra tamiento específico alternativo para el BL grave cuando la BabyBIG® no está disponible. Si bien no hemos encontrado indicación formal del uso de AtBE en lactantes más allá de los 5 días, tampoco hemos hallado evidencia de EA significativos que lo contraindiquen, pudiendo resultar beneficioso el uso de la misma en casos de BL grave confirmado en los que se sospeche la presencia de TB circulante, inde pendientemente del tiempo de evolución.
Para finalizar, se remarca la necesidad de contar con estudios clínicos controlados que demuestren la seguridad y eficacia de AtBE en BL más allá de los 5 días de inicio de los síntomas.












 uBio
uBio 


