Introducción
El botulismo del lactante (BL) es la forma más frecuente de botulismo humano en la actualidad, está dentro del grupo de enfermedades “raras” o “huérfanas” ya que afecta a menos de 5 de cada 10.000 individuos, es decir, a menos del 0,05 % de la población. (Ministerio Salud de la Provincia de Buenos Aires 2015).
El BL es una toxiinfección que afecta a niños menores de un año. Es producida por la germinación, colonización y toxinogénesis de clostridios productores de neurotoxina botulínica en el intestino de los lactantes.
El principal agente productor es Clostridium (C.) botulinum, bacteria formadora de esporas. El suelo, su hábitat natural, es el principal reservorio y fuente de contaminación. Las esporas pueden encontrarse también en el polvo ambiental, en la ropa de cama, en la ropa de vestir, en la miel de abeja, de caña y en algunas hierbas medicinales (Arnon et al. 1979; Hauschild et al. 1988; Nevas et al. 2005; Bianco et al. 2008, 2009; Wojtacka et al. 2017).
Clínicamente se manifiesta como una parálisis fláccida, simétrica y descendente, con déficit de los pares craneales, caracterizada por una fascie inexpresiva, con ptosis palpebral y oftalmoplejía (Spika et al. 1989; Midura 1996; Arnon 2004).
En el 95% de los casos de BL el primer síntoma es la constipación, que puede no ser suficientemente valorada por los padres.
Podemos describir como triada orientadora: la hipotonía, la constipación y el reflejo fotomotor lento o perezoso (Lentini et al. 1984). Tabla 1. Las toxinas botulínicas identificadas hasta la fecha son las correspondientes a los grupos serológicos A, B y E (las más relacionadas con enfermedad humana) y las toxinas C, D, F y G (Suen et al. 1988; Acha y Szyfres 2001). Si bien C. botulinum es el agente más frecuente, se han identificado casos producidos por otras especies, como C. baratii y C. butyricum (productores de neurotoxina F y E respectivamente) (Aureli et al. 1986; Acha y Szyfres 2011; Barash et al. 2005, Abe et al. 2008; Al-Sayyed 2009; Rao et al. 2021).
La enfermedad producida por toxina tipo A se ha relacionado con manifestaciones más graves que por los tipos B, E y F (Hall et al. 1985; Arnon 2004). La confirmación diagnóstica se realiza demostrando la presencia de toxina botulínica en contenido intestinal y/o en suero sanguíneo, y/o la presencia de C. botulinum en contenido intestinal, de los niños infectados (Arnon 2004)
El electromiograma (EMG) ayuda al diagnóstico. El signo característico en caso de intoxicación, es un incremento progresivo de los potenciales provocados con una estimulación nerviosa de alta frecuencia (20 a 50 Hz). Además, se observa un perfil característico de potenciales de acción motora francamente abundantes, de baja amplitud y breves. Un estudio inicial normal, no excluye el diagnóstico de BL (Ministerio de Salud 2012; Bernardor 2018; Rao et al. 2021).
El curso de la enfermedad es variable, puede manifestarse como una parálisis fulminante, semejante al Síndrome de Muerte Súbita Infantil (SMSI) o instalarse progresivamente. Los cuadros leves presentan pocos días de letargo, constipación y alimentación dificultosa, y no siendo siempre diagnosticados. Los casos moderados y graves deben ser hospitalizados, necesitando éstos últimos asistencia respiratoria mecánica (ARM) (Arnon 2004). Hasta 2006, todos los continentes habitados, excepto África, habían informado casos de botulismo del lactante. Casi todos los pacientes de América del Sur procedieron de nuestro país (Argentina: 366, Chile: 3, Venezuela: 1). Argentina es el segundo país en el mundo en incidencia de esta enfermedad, después de EE.UU. (2.419 casos) (Ministerio de Salud 2012).
Los primeros casos fueron registrados en EE.UU. en el año 1976, en que se reconoció como una toxiinfección, distinta de la clásica forma de intoxicación alimentaria. Los dos primeros casos reportados en Argentina datan del año 1982, casi simultáneamente en Mendoza y Buenos Aires (Lentini et al. 1984; Gianantonio et al. 1984; Long 1985).
En el año 1999 esta enfermedad se incorporó en el Sistema Nacional de Vigilancia en Salud (SNVS) como evento de notificación obligatoria inmediata. En los últimos años, se notificó al SNVS un promedio de 1 caso por semana, datos que probablemente sean menores a los reales. Esto sería, debido a muchas veces a la falta de sospecha de la enfermedad y al sub-registro por casos de muerte súbita, ya que en nuestro país no se investiga de rutina la presencia de C. botulinum en estos casos.
En Argentina, entre 1982 y 2013 se han notificado un total de 763 casos de BL. Las provincias con mayor número de casos fueron: Buenos Aires (223), Mendoza (171), Neuquén (69), Río Negro (51), San Luis (48) y Córdoba (47).
El BL es una enfermedad infrecuente, que requiere de un alto índice de sospecha para su correcto diagnóstico (Koepke et al. 2008).
Si bien existe una antitoxina constituida por inmu-noglobulinas humanas específicas (BabyBIG®) para su tratamiento, para muchos países es inaccesible debido a su elevado costo (US$ *45.000 por tratamiento) (Long 2007; California Department of Public Health 2009).
Presentamos un estudio multicéntrico, de cohorte (longitudinal) observacional, retrospectivo analizando las historias clínicas de los pacientes internados con diagnóstico de BL en 11 provincias de Argentina durante el período 1 de enero de 2010 hasta el 31 de diciembre de 2013.
Se evaluaron las historias clínicas de los pacientes internados en las Unidades de Cuidados Intensivos Pediátricos (UCIP) de Hospitales de Buenos Aires, Córdoba, Jujuy, La Pampa, Mendoza, Rio Negro, Neuquén, Salta, San Juan, San Luis y Tucumán. La confirmación del diagnóstico se realizó a través del Laboratorio de Botulismo del Área de Microbiología de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo (Mendoza) y/o del Servicio Bacteriología Sanitaria del Instituto Nacional de Enfermedades Infecciosas ANLIS -“Dr. Carlos G. Malbrán”.
Como factor de riesgo se analizaron las características climáticas (precipitaciones y vientos) y prevalencia de C. botulinum en muestras de suelos de todas las provincias que participaron del estudio.
Materiales y métodos
Metodología
Se analizaron las historias clínicas de pacientes con BL que ingresaron a UCIP, con ARM (asistencia respiratoria mecánica), con menos de siete días de evolución de la enfermedad, confirmada por laboratorio, desde 1 de enero de 2010 hasta 31 de diciembre de 2013.
Para la recolección de datos de las Historias Clínicas de los hospitales, se utilizó el mismo instrumento por parte de todos los investigadores. Los datos obtenidos no se utilizaron con fines distintos a los que motivaron su obtención y los investigadores preservaron la identidad de los titulares de los datos mediante mecanismos de anonimización.
Se consideraron para su análisis: edad, sexo, días de evolución previos al ingreso y el tiempo transcurrido hasta obtener el diagnóstico de laboratorio. Se evaluaron los días de permanencia en UCIP, días de ARM, días totales de internación y alimentación por sonda nasogástrica (SNG), en los pacientes que recibieron tratamiento específico con antitoxina botulínica equina (a-TBEq) respecto de los no tratados. Del mismo modo se consideraron las complicaciones y secuelas al alta. Para el análisis de los datos los pacientes se separaron en dos grupos: los que recibieron o no recibieron tratamiento con a-TBEq. Ambos grupos recibieron igual tratamiento de sostén (de acuerdo a Tseng-Ong y Mitchell 2007): rehidratación y compensación hemodinámica, alimentación en-teral por SNG (sonda nasogástrica) y/o parenteral, kinesioterapia, asistencia respiratoria mecánica, enemas evacuantes, inotrópicos, hemoderivados y antibióticos (cuando fueron necesarios por clínica o laboratorio).
Antitoxina:
La a-TBEq empleada fue bivalente (AB) elaborada por el Laboratorio Central de Salud Pública - Instituto Biológico “Dr. Tomás Perón” Provincia de Buenos Aires.
Previo a la administración de a-TBEq, por tratares de suero heterólogo se realizó previamente prueba de sensibilidad y desensibilización (Ministerio de Salud 2012). La dosis de a-TBEq fue de 500 UI/ kg de peso corporal, administrada por vía endovenosa, diluida 1/10 en solución fisiológica. La a-TBEq se administra a los pacientes en dosis única (Vanella et al. 2011).
Diagnóstico de laboratorio La confirmación del diagnóstico por laboratorio se realizó en el Laboratorio de Botulismo del Área de Microbiología de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo para todos los pacientes de Mendoza y San Juan, 3 de Córdoba y 1 de Tucumán; el resto de los pacientes fueron diagnosticados por el Servicio Bacteriología Sanitaria del Instituto Nacional de Enfermedades Infecciosas ANLIS “Carlos G. Malbrán”. Se realizaron los siguientes estudios:
- En materia fecal (obtenida por defecación o mediante enema salina evacuante): presencia de neurotoxina botulínica (NTBo) realizando el bioensayo en ratones (gold standard) y cultivo de C. botulinum por siembra en medio Medio Tarozzi. Las muestras fueron incubadas 4 días en anaerobiosis a 35°C para la posterior identificación de NTBo en el sobrenadante. La tipificación serológica de las NTBo se realizó por pruebas de neutralización con antitoxinas específicas poli y monovalentes (Área Microbiología. Dto. Patología. FCM, UNCuyo).
- En sangre: NTBoen suero sanguíneo por bioensayo en ratones (Área Microbiología. Dto. Patología. FCM, UNCuyo).
Aunque algunas muestras de suero pueden arrojar falsos negativos (*50%) debido a la presencia intermitente de toxina en sangre, y/o en nivel insuficiente para su detección es importante su estudio (Ministerio de Salud 2012).
Evaluación de características climáticas
Para evaluar las características climáticas se consideraron:
- Datos publicados por el Servicio Meteorológico Nacional-Argentina, con el fin de conocer características ambientales de precipitaciones, temperatura y vientos. (https://www.smn.gob.ar/ estadisticas).
- Estudios de suelos realizados por el Área de Microbiología de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo (Ministerio de Salud 2016).
Estadísticos:
El análisis estadístico fue realizado con Statis-tix 7.0; Analitical Software, Tallahassee, FL. Las diferencias estadísticas fueron evaluadas con el test Mann-Whitney, con un nivel de significación p< 0,05.
Resultados
En el periodo estudiado en el país se registraron 216 casos de BL. Se analizaron 79 historias clínicas de pacientes que ingresaron a UCIP con ARM con menos de siete días de evolución de la enfermedad.
Se excluyeron los pacientes que no cumplían con estos requisitos como es el caso de Jujuy.
Se separó a los pacientes procedentes de Bahía Blanca, del resto de los provenientes de Buenos Aires, a fin de resaltar la cantidad de casos de BL que se presentaron en esa ciudad. Tabla 2. De los 79 pacientes con ARM, 18 (de 6 provincias) recibieron antitoxina botulínica equina (a-TBEq) antes de los siete días del inicio de los síntomas neurológicos. Figura 1.

Figura 1: Pacientes por provincia con tratamiento con antitoxina botulínica equina (AT+) y sin tratamiento (AT-). Bahía Blanca separado del resto de Buenos Aires.
La edad promedio de los pacientes que ingresaron a UTIP con ARM fue 4 meses, 61% fueron varones y el 90% recibía alimentación materna. El promedio de días de enfermedad previos al ingreso fue 2 días en los pacientes tratados con a-TBEq y 4 días en los no tratados.
El diagnóstico de laboratorio se obtuvo a los 5 días del inicio de los síntomas neurológicos en los pacientes que recibieron a-TBEq, y a los 11,5 en los no tratados. En todas las muestras se identificó Toxina A de C. botulinum.
Se realizó EMG a 11 pacientes siendo los resultados compatibles con BL, 3 de estos recibieron a-TBEq.
Los pacientes tratados con a-TBEq tuvieron en promedio 30 días de internación frente 70 días en los no tratados (p=0,0001). El promedio de días de internación en UCIP fue de 20 días para los que recibieron tratamiento con a-TBEq y de 54 días (p=0,0001) en los no tratados. El promedio de días con ARM fue de 16 versus 43 (p= 0,0001) y el promedio de días de alimentación por SNG de 29 versus 70, en los tratados con a-TBEq y no tratados respectivamente (p=0,0001). Figura 2.
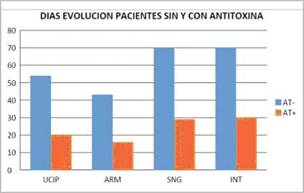
Figura 2: UCIP (días Terapia Pediátrica)-ARM (asistencia respiratoria mecanica) SNG (alimentación sonda nasogástrica) - INT (días totales de internación-pacientes sin tratamiento con antitoxina botulínica (AT-) o con tratamiento (AT+)
Los pacientes tratados con a-TBEq presentaron neumonía asociada a respirador en el 40% de los casos y sepsis en el 11%. Al alta, 6% de los pacientes prestó secuelas (hipotonía leve).
Los pacientes no tratados presentaron neumonía asociada a respirador en el 56 % de los casos (p=0,0038) y sepsis en el 34% (p=0,005). En el alta hospitalaria, 64% de los pacientes presentó (hipotonía marcada, estrabismo y estenosis laríngea (p=0,0001). Figura 3A y Tabla 3B.
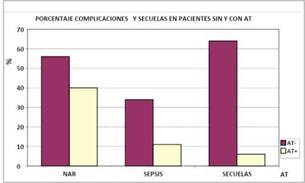
Figura 3: Porcentaje de complicaciones: NAR (neumonía asociada a respirador)-SEPSIS y SECUELAS al alta en pacientes sin (At-) y con (AT+) tratamiento con antitoxina botulínica
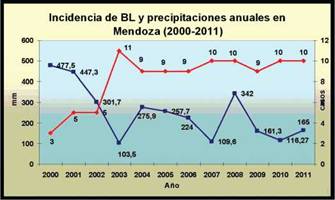
Figura 4: Relación entre el n° de casos de BL por año y las precipitaciones anuales en la provincia de Mendoza entre 2000 y 2011.
Por su gran extensión y diversidad de relieve, la Argentina tiene un clima muy variado: cálido, templado, árido y frío. El promedio anual de precipitaciones varía entre 1.200 mm en el Este y Noreste hasta menos de 100 mm en la cordillera. Las regiones Patagónica, Cuyo, Noroeste y Sierras Pampeanas están insertas en la diagonal árida y semiárida de Argentina, con clima seco y suelos áridos.
El estudio de presencia de esporas de C. botu-linum en suelos de Argentina reveló un 23,5% (472/2009) de muestras positivas. Las zonas áridas, presentaron un mayor hallazgo (29,5%, 265/899) respecto a muestras del resto del país (18,6%: 207/1.110) (p<0,05).
La transmisión del BL se produciría principalmente por deglución de esporas de C. botulinum a partir de su reservorio natural, el suelo. Las esporas son vehiculizadas en el aire como bioaerosoles, depositándose como polvo contaminante en el entorno del niño y la madre.
Relacionando presencia de esporas en suelos y frecuencia de BL por provincia, se observó que en provincias como Tucumán, que tiene alto porcentaje de positividad no hay muchos registros, probablemente debido a las características climáticas, microclimas variados y precipitaciones que pueden alcanzar los 1.800 mm/anuales en zonas elevadas y 600 mm/anuales en el llano oriental (Servicio Meteorológico Nacional Argentina 2022). En contraste por ejemplo con San Juan, provincia con clima seco árido, con precipitaciones que no superan los 200 mm anuales en los meses de verano y que sufre de los vientos del norte y del viento zonda (Servicio Meteorológico Nacional Argentina 2022). Esta provincia tiene baja positividad en suelo, sin embargo, los registros de BL son más frecuentes, tal vez por la aridez de la zona y los vientos.
Discusión
El BL es una enfermedad neuroparalítica grave que con frecuencia requiere hospitalización en unidades de cuidados intensivos y ventilación mecánica (Spika et al. 1989; Arnon 2004; Vane-lla et al. 2011)
Es considerada una enfermedad rara o huérfana, y no contaba con tratamiento pediátrico disponible, hasta octubre de 2003 con la aprobación de BabyBIG® por la Food and Drugs Administration (FDA) de EE.UU. Como enfermedad rara requiere esfuerzos especiales unificados para poder asistirla. Los medicamentos huérfanos (“orfan drugs”) son aquellos no desarrollados ampliamente por la industria farmacéutica por razones financieras, ya que están destinados a un reducido grupo de pacientes, y que, sin embargo responden a necesidades de Salud Pública (Arnon et al. 2006; Arnon 2007; California Department of Public Health 2009).
Arnon y sus colaboradores demostraron que el tratamiento del BL con BabyBIG® es seguro y eficaz, logrando la reducción de la severidad y la duración de la enfermedad, así como el costo de la hospitalización (Underwood et al. 2008; Payne et al. 2018).
Sin embargo, muchos países, entre ellos Argentina, no pueden asumir el costo de la BabyBIG® .Por estas razones, el uso de a-TBEq es una alternativa para el tratamiento específico de BL mientras no esté disponible una inmuglobulina botulínica humana (Fox et al. 2005; Vanella et al. 2011; Griese et al. 2017).
Estudios retrospectivos y observacionales demostraron que la administración temprana de a-TBEq a pacientes adultos con intoxicación alimentaria y botulismo por heridas se asoció con mejores resultados. Menos del 2% de los adultos con bo-tulismo por alimentos tuvo reacciones adversas cuando fueron tratados con los dos viales de a-TBEq. La administración de antitoxina equina a niños con botulismo del lactante redujo la mortalidad en un 76% y los eventos adversos asociados con la administración de antitoxina fueron poco frecuentes y en su mayoría menores (Griese et al. 2017; Rao et al. 2021)
La eficacia de a-TBEq para el tratamiento del BL nunca se ha evaluado en un ensayo controlado. Recientemente, en los Estados Unidos, un paciente con BL causado por C. baratii, productor de neurotoxina tipo F, fue tratado con a-TBEq heptavalente (A-B-C-D-E-F-G), sin que ningún efecto adverso a la a-TBEq fuera informado en este paciente (Al-Sayyed 2009).
En un estudio observacional realizado en Mendoza (1993- 2007), se vio que en 31 pacientes tratados precozmente con a-TBEq, dentro de los 5 días desde la aparición de los síntomas neurológicos, la severidad de la enfermedad disminuyó, así como la estancia media hospitalaria, la permanencia en UTIP y el requerimiento de ARM, al igual que el requerimiento de alimentación por SNG, respecto a los pacientes que no recibieron este tratamiento específico.
El tratamiento con a-TBEq no mostró efectos adversos (Vanella et al. 2011).
Sin embargo, es importante señalar, que unos pocos pacientes tratados con BabyBIG® experimentaron un transitorio rubor (como erupción eritematosa), tal vez relacionado con la inmuno-globulina humana (Arnon et al. 2006).
El tratamiento específico del BL se debe iniciar tan pronto como sea posible.
En los casos aquí presentados, la sospecha clínica temprana, la confirmación preliminar (dentro de las 48 h) por el laboratorio y disponibilidad de a-TBEq en el Hospital, hicieron posible el tratamiento específico dentro de los 7 días siguientes al inicio de los síntomas.
Se presenta el algoritmo consensuado por el Área de Microbiología de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo y el Servicio Bacteriología Sanitaria del Instituto Nacional de Enfermedades Infecciosas ANLIS “Dr. Carlos G. Malbrán”. Figura 5y Tablas 5 y 6.

Figura 5: Algoritmo consensuado Área de Microbiología de la Facultad de Ciencias Médicas de la Universidad Nacional de Cuyo y Servicio Bacteriología Sanitaria. Instituto Nacional de Enfermedades Infecciosas ANLIS -“Dr. Carlos G. Malbrán”.

Tabla 4: Frecuencia de esporas de C. botulinum en suelos de las provincias argentinas que participan del estudio multicéntrico.
Se debe planificar, para los hospitales con dificultad para obtener el diagnostico antes de los 5 días, optimizar los tiempos de recolección, el envío de muestras y la obtención del resultado de la tipificación preliminar para realizar el tratamiento específico con antitoxina.
En la última década, se ha logrado un progreso significativo en las tecnologías de detección de neurotoxina botulínica, pero ninguna ha reemplazado completamente el ensayo de letalidad en ratones, el estándar de oro actual (Dorner et al. 2013; Singh et al. 2013; Thirunavukkarasu et al. 2018). Se están investigando nuevos métodos diagnósticos “in vitro” de mayor sensibilidad y especificidad que lleve a prescindir del uso de animales, pero aún no se encuentran validados por la FDA. Estos serían más rápidos pero aún no están disponibles (Hill 2010; Rao et al.2021). Recientemente, los nuevos avances en robótica y la disponibilidad de nuevos reactivos han permitido el desarrollo de métodos para el análisis rápido de toxinas. Estas tecnologías, aunque prometedoras, necesitan aún un mayor refinamiento (Dorner et al. 2013; Singh et al. 2013;Thirunavukkarasuy y Jonhson 2018, Kalba 2020; Rao et al. 2021). Sería importante verificar la sensibilidad y especificidad de otro estudio diagnóstico como el EMG (Bernardor 2018; Rao et al. 2021).
A pesar de que el número de casos reportados en este estudio es pequeño, los resultados sugieren que a-TBEq, merece una cuidadosa consideración como una alternativa válida para el tratamiento de BL cuando la inmuglobulina botulínica humana no está disponible (Moneim 2018).
Una declaración definitiva sobre el papel de a-TBEq en el tratamiento del botulismo del lactante debe ser realizado por un ensayo prospectivo, comparando incluso, si fuera posible, a-TBEq con BabyBIG®.
También debe considerarse la utilización de la inmunoglobulina digerida por su menor antigenici-dad y eliminación de la porción de la molécula que genera reacciones adversas (cuando es tratada enzimáticamente pon pepsina para remover el fragmento Fc manteniendo el (Fab)2 activo) (Rao et al. 2021).
Con respecto a la influencia del medio ambiente para contraer la enfermedad, la sola presencia del patógeno en su ambiente natural no es el único factor de riesgo en la transmisión del BL, por lo que se estima que existiría una multiplicidad de factores asociados que favorecen la dispersión de las esporas de C. botulinum (McCroskey et al. 1986; de Jong et al. 2003; Lúquez et al. 2007; Dutta y Vallejo 2019)
Las condiciones ambientales, topográficas y climáticas (vientos, humedad y precipitaciones) son factores relevantes en la transmisión, ya que facilitan la volatilización de partículas a partir del suelo y hacen propicia la permanencia de polvo en suspensión cargado de esporas, que serían aerotransportadas y diseminadas por los vientos. Otros factores asociados en la transmisión son las actividades que implican movimientos de tierra permanente en la zona, entre ellas, la actividad agrícola, debiendo también considerarse tareas de edificación.
Comentarios
Para la prevención del BL es importante no suministrar miel y/o infusiones de hierbas medicinales, principalmente hierbas caseras (“yuyos”) o comercializadas “a granel”, debido a que tienen mayor contaminación que las que se expenden industrializadas “en saquitos” (Arnon et al. 1979. de Jong et al. 2003; Lúquez et al. 2007; Bianco et al. 2008, 2009).
Se debe promover medidas de higiene domiciliaria y peridomiciliaria para evitar o minimizar la contaminación con tierra o polvo ambiental, especialmente en zonas áridas, con vientos intensos y frecuentes y bajas precipitaciones (Spika et al. 1989; Satorres et al. 1999; Hauschild et al. 1988; Sagua et al. 2009). También es necesario priorizar en la limpieza del hogar la utilización de aspiradora o “trapos húmedos”, en vez de escoba y/o plumero. Es importante estimular la lactancia materna, al menos hasta el año de vida. Además se está discutiendo la administración de probióticos/ prebióticos al lactante, quizá desde su nacimiento (Uymaz et al. 2011; Fernandez et al. 2013).
Conclusiones
El BL es una enfermedad rara o huérfana, potencialmente mortal, que con frecuencia requiere admisión en UCIP y ARM durante semanas.
El tratamiento precoz con a-TBEq es una alternativa válida y asequible, hasta disponer de in-munoglobulina botulínica humana.
Los climas secos y ventosos favorecen la enfermedad.
Para su prevención se aconseja no suministrar miel, ni infusiones caseras a niños menores de 1 año. Promover medidas de higiene domiciliaria y perido-miciliaria, evitando la exposición al polvo ambiental. Estimular la lactancia materna.
Agradecimientos: Los autores agradecen a los siguientes por su colaboración a: la Dra. Susana I. García y la Dra. Adriana Haas, del Programa Nacional de Prevención Control de las Intoxicaciones del Ministerio de Salud de la Nación. Al Dr. Jorge San Juan, de la Terapia Intensiva - Hospital de Infecciosas “F.J. Muñiz” - Ministerio de Salud - GCBA. Al Dr. Jorge Zarzur, del Programa Nacional de Producción Pública de Medicamentos del Ministerio de Salud de la Nación. Al Dr. Jorge Citate y al Dr. Aníbal Mombiela, del Laboratorio Central de Salud Pública “Dr. Tomás Perón” de la Provincia de Buenos Aires. A la Sra. Luisa Castillo, del Vacunatorio Hospital “Dr. H. Notti” de Mendoza.












 uBio
uBio 






