Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) v.77 Vicente López ene./dic. 2008
ARTÍCULOS ORIGINALES
Colección y caracterización de Chile (Capsicum spp) en Tabasco, México1 (Con 3 Tablas y 3 Figuras)
Sampling and characterization of pepper chilli (Capsicum spp) in Tabasco, Mexico (With 3 Tables and 3 Figures)
Castañón-Nájera2 G, L Latournerie-Moreno3, M Mendoza-Elos4, A Vargas-López5 , H Cárdenas-Morales6
1 Parte del proyecto titulado: Exploración y Colecta de la Diversidad de Capsicum spp en Tabasco, México, Financiado por Fondos Mixtos-CONACYT, Clave proyecto TAB-2003-C03-11527.
2 Guillermo Castañón-Nájera. Fitomejorador, Profesor-Investigador, DACBiológicas, Universidad Juárez Autónoma de Tabasco, Villahermosa, Tabasco, México. Dirección Carretera Villahermosa-Cárdenas Km 0.5 Entronque Bosques de Saloya, Villahermosa, Tabasco, México. C. P. 86139. Tel y Fax. 01-933-3-58-15-79 y 01-933- 3-54-43-08. Address Correspondence to: e-mail: guillermo_corazon_valiente@hotmail.com.
3 Luis Latournerie-Moreno. Fitomejorador, Profesor-Investigador del Instituto Tecnológico Conkal, Conkal, Yucatán. Km. 16.5 Antigua Carretera Mérida-Motul. C. P. 97345.
4 Mariano Mendoza-Elos. Fitomejorador, Profesor-Investigador del Instituto Tecnológico Roque. Carretera Celaya-San Miguel de Allende. C. P. 38110.
5,6 Abdón Vargas-López, Hilario Cárdenas-Morales. Licenciado y Pasante de Biología. División Académica de Ciencias Biológicas (DACBiol). Universidad Juárez Autónoma de Tabasco (UJAT). Carretera Villahermosa-Cárdenas Km. 0.5 Entronque Bosques de Saloya, Villahermosa, Tabasco, México. C. P. 86139. Tel y Fax. 01-933-3-58-15-79 y 01-933- 3-54-43-08.
Recibido/Received 28.04.2007. Aceptado/Accepted 6.05.2008.
Resumen. Se realizó una caracterización morfológica in situ de Capsicum spp en 13 localidades del estado de Tabasco, México, durante 2004 y 2005. El objetivo fue colectar y conocer diferentes morfotipos de chile que crecen en forma silvestre y cultivada. Se encontraron 11 morfotipos de chile. La mayoría de ellos fueron silvestres (Amashito, Corazón de pollo, Muela, Garbanzo, Garbanzo raro y Desconocido) y correspondieron a C. annuum. Otro fue semisilvestre (Picopaloma)y correspondió a C. frutescens. El resto de los morfotipos fueron comerciales y pertenecieron a C. annuum y C. chinense Jacq. Los datos se analizaron mediante estadística multivariada. El análisis de componentes principales (ACP) indicó que con los primeros cuatro componentes principales se explicó el 88% de la variación morfológica total. Este análisis (ACP) agrupó a los morfotipos silvestres en un grupo y a los comerciales en otro. El análisis de conglomerados (AC) permitió clasificar a los morfotipos en grupos contrastantes; ese agrupamiento se dió principalmente por la forma en que se encontró creciendo (cultivado o silvestre) a cada morfotipo. Así, los morfotipos comerciales formaron un grupo aparte respecto a los silvestres. Es decir, en general, los morfotipos se agruparon como en el ACP. En ambos análisis, las variables que más participaron en la agrupación de los morfotipos fueron el color de las anteras, la posición de la flor y el ancho del fruto.
Palabras clave: Capsicum spp; Morfotipos de chile; Métodos multivariados; Diferencias morfológicas; Normalidad Multivariada.
Abstract. A morphological characterization in situ of Capsicum spp was made in 13 localities in the state of Tabasco, México, during 2004 and 2005. The objective was to sample and identify different morphotypes of chilli pepper which grow under wild and cultivated conditions. Eleven chilli pepper morphotypes were found. Most of them were wild (Amashito, Corazón de pollo, Muela, Garbanzo, Garbanzo raro and Desconocido) and corresponded to C. annuum. Another morphotype was half wild (Picopaloma) and corresponded to C. frutescens. The remaining morphotypes corresponded to C. annuum and C. chinenese. Data were analyzed with multivariate statistics. Principal component analysis (PCA) indicated that 88% of total morphological variation was explained with the four principal components. This analysis grouped the wild morphotypes in one group and the commercial morphotypes in another one. Cluster analysis (CA) allowed classification of the morphotypes in contrasting groups; clustering occurred primarily because of the manner in which morphotypes were growing under cultivated or wild conditions. As a result, commercial morphotypes formed a different group than wild morphotypes. In other words, in general, grouping of morphotypes was similar to that when PCA was used. Using either PCA or CA, Color of anthers, Flower position and Fruit width were the variables which most par-ticipated in clustering of the morphotypes.
Key words: Capsicum spp; Pepper chilli Morphotypes; Multivariate methods; Morphological differences; Multivariate Normality.
INTRODUCCIÓN
El centro de origen de Capsicum spp es América del Sur (Hunziker citado por Loaiza-Figueroa et al., 1983; Hernández et al., 1999; Milla, 2006). El número de especies silvestres que comprende el género Capsicum es de 20 a 23 (Eshbaugh, 1983; Morán et al., 2004; Milla, 2006). Otros señalan que son alrededor de 27 ó 30 (Loaiza-Figueroa et al., 1983; Hernández et al., 1999), y de ellas son solo cuatro o cinco las especies domesticadas de chile que se cultivan en el mundo.
México, como centro de domesticación, cuenta con las cinco especies cultivadas: C. annuum var. annuum, C. chinense, C. pubescens, C. baccatum var pendulum, y la semidomesticada C. frutescens, y la silvestre C. annuum var. glabriusculum (Loaiza-Figueroa et al., 1983; Morán et al., 2004; Milla, 2006). En la República Mexicana, es posible encontrar poblaciones silvestres de C. annuum y C. frutescens, que presentan gran variabilidad morfológica y genética (Hernández et al., 1999), y las especies C. ciliatum y C. lan-ceolatum. Capsicum ciliatum se encuentra en todo el país, con excepción del Noroeste, mientras que C. lanceolatum ha sido reportada únicamente en los estados de Chiapas y Veracruz (Hernández-Verdugo et al., 1998).
El estado de Tabasco se encuentra ubicado en el Sureste de la República Mexicana. Las condiciones edafoclimáticas de este estado permiten que el cultivo de chile prolifere en potreros, solares, jardines o como cultivo comercial durante cualquier época del año. Desde los años 90 a la fecha el cultivo de esta hortaliza ha aumentado en superficie por los agricultores tabasqueños debido a las condiciones favorables para su crecimiento y desarrollo. Por lo tanto, es mucha la diversidad morfológica y genética de Capsicum que se encuentra en el estado de Tabasco. Los estudios morfológicos, genéticos y ecológicos de materiales domesticados, semidomesticados y silvestres resultan entonces de gran importancia para el uso y conservación de este importante recurso genético (Hernández-Verdugo et al., 1999). A nivel nacional se han realizado algunas investigaciones al respecto (Loaiza-Figueroa et al., 1983; Hernández-Verdugo et al., 1998; Chávez y Castillo, 1999; Hernández-Verdugo et al., 2001; Latournerie et al., 2002; Oyama et al., 2006). Estos autores estudiaron las relaciones morfológicas y filogenéticas entre los diferentes tipos de chile encontrados en diversas áreas de México. Sin embargo, estudios sobre la morfología genética y ecología de especies de Capsicum domesticadas, semidomesticadas y silvestres son escasos en el estado de Tabasco.
En Tabasco, se encuentran en forma cultivada variantes de C. annuum y C. chinense, además de ejemplares semisilvestres de C. frutescens y C. annuum var aviculare y glabriusculum (Dunal) Heiser y Pickergill. Los últimos tres morfotipos presentan frutos deciduos, y la posición de éstos es erecta, contrariamente a lo observado en los tipos comerciales. Esto es el resultado de la selección que conciente o inconcientemente ha practicado el hombre (Chávez y Castillo, 1999).
También es de destacar el interés antropogénico del chile como condimento en la dieta de los pobladores tabasqueños. El objetivo del presente trabajo fue explorar y colectar morfotipos de chile en varias localidades del estado de Tabasco, y evaluar las diferencias que presentan los morfotipos colectados durante la exploración.
MATERIALES Y MÉTODOS
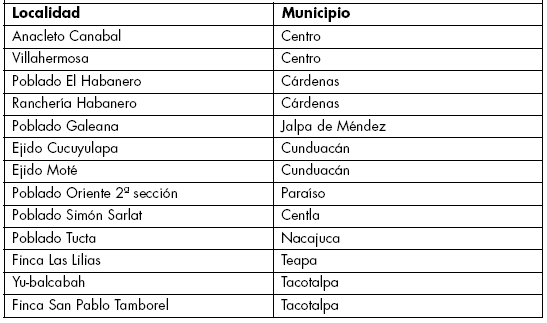
Área de estudio y material genético. El área de estudio se extendió en 13 comunidades vegetales pertenecientes a 9 municipios (Tabla 1) del Estado Tabasco, México. El material genético consistió del germoplasma de chile (Capsicum spp) que se encontró durante la exploración en dicho Estado.
Tabla 1. Localidades de exploración por municipio en el Estado de Tabasco, México.
Table 1. Exploration localities for Municipalitiy at the México Tabasco State.
El trabajo se desarrolló de Mayo 2004 a Diciembre 2005. Durante la exploración y colecta de las muestras de chile, se evaluaron in situ varios caracteres morfológicos en planta, flor y fruto (Tabla 2). Estas observaciones se efectuaron de acuerdo al manual de descriptores morfológicos para Capsicum propuesto por IPGRI, AVRDC y CATIE (1995). En general se visitaron al menos una comunidad vegetal en cada localidad. Cuando el sitio fue una siembra comercial, las variables se midieron en 20 plantas tomadas al azar dentro de la parcela. En solares o jardines se incluyó el total de plantas de cada morfotipo (n = 10 en promedio) que se encontraron al momento de realizar el estudio. De la siembra comercial se tomaron al menos 10 frutos maduros; en ellos se midieron las variables largo y ancho.
Tabla 2. Descripción de las Variables medidas in situ en los morfotipos de chile (Capsicum spp), en 13 localidades del Estado de Tabasco, México de acuerdo con los descriptores para Capsicum (IPGRI, AVRDC y CATIE 1995).
Table 2. Description of in situ measured variables in the pepper chilli morphotypes (Capsicum spp), at 13 localities of México Tabasco State in agreement with the Capsicum descriptors (IPGRI, AVRDC y CATIE 1995).

Análisis estadísticos utilizados. Los datos se analizaron en tres pasos. Primero se realizó la Prueba de Normalidad Multivariada (Mardia et al., 1979), con el programa desarrollado por Ramírez (1995) con un valor de a=0,05 y una X2 = 0,20; la información se corroboró con la obtenida de acuerdo a Khattree and Naik (2000). Posteriormente se llevó a cabo un primer análisis de componentes principales (ACP) con las 15 variables evaluadas y estandarizados a ^,=0 y 02=1. Este análisis permitió determinar los 12 caracteres que tuvieron mayor importancia en la descripción de la variabilidad del germoplasma colectado (Pla, 1986; Iezzoni y Pritss, 1991). Un segundo ACP se realizó con las 12 variables más importantes, y son los resultados que se presentan. Ambos análisis de componentes principales se realizaron con la matriz de correlaciones, con la finalidad que las variables involucradas en el análisis tuvieran la misma importancia (Manly, 1994; Crossa et al., 1995). La significancia de los eigenvalores y eigenvectores se determinó con la regla de Kaiser (1960). El tercer tipo de análisis fue el de conglomerados jerárquico (AC) mediante el método de ligamiento promedio (UPGMA) con datos estandarizados de las variables a ^,=0 y 02=1. La razón para usar datos estandarizados es que las unidades en que las mismas fueron medidas pueden afectar arbitrariamente la similaridad entre las entidades evaluadas. Además, la estandarización hace que los atributos medidos contribuyan de forma más equilibrada al cálculo de las similaridades (Lévy y Varela, 2003). La medida de disimilitud fue la distancia euclidiana. Los tres procedimientos estadísticos se realizaron en SAS (Sistema de Análisis Estadístico V8 2000).
RESULTADOS
La Prueba de Normalidad Multivariada (PNM) mostró que el valor de asimetría (Skewness) fue de B1=30,57, y el de B2=257,66 para la Kurtosis. Ambos parámetros señalan que las variables medidas en los morfotipos se distribuyeron como una normal multivariada.
El análisis de componentes principales (ACP) con las 15 variables medidas, indicó que los vectores propios de: diámetro de tallo (DT), margen de la lámina (ML) y color de la corola (CC), aportaron poco a este componente. Los resultados del nuevo análisis de componentes principales con las 12 variables restantes se presentan en la Tabla 3. Se observa que la varianza total explicada por los cuatro primeros componentes (CP1, CP2, CP3 y CP4) fue de 87,97%, y los valores característicos de estos componentes resultaron significativos (Kaiser, 1960).
Tabla 3. Valores y vectores característicos de los cuatro componentes principales en los 11 morfotipos de chile encontrados en 13 localidades de Tabasco, México.
Table 3. Characteristic values and vectors of the four principal components in the 11 pepper chilli morphotypes found in 13 localities of Tabasco, México.

La explicación de la variación morfológica por el primer componente principal (CP1) fue de 42,41%, y 5,08 su valor característico. Este componente principal estuvo determinado mayormente con signo positivo y significativo (Kaiser, 1960) según los vectores característicos en las variables color de la hoja (CH) y ancho y largo del fruto (AF y LF). Influyeron con signo negativo y significativamente en el mismo componente la altura de la planta (AP) y la posición de la flor (PF). El valor característico para el CP2 fue de 2,36 y explicó 19,69% de la variación morfológica. Las variables que mostraron influencia positiva y significativa en este componente fueron hábito de crecimiento (HC), color de la hoja (CH) y color de la antera (CA), en tanto que la forma del tallo (FT) y flores por axila (FA) influyeron en forma negativa. El valor característico fue de 1,96 para el CP3 y este componente contribuyó con un 16,37% a la explicación de la variación morfológica total. CP3 se relacionó principalmente en forma positiva y significativa con las variables densidad de ramificación (DR), color de la antera (CA), longitud del fruto (LF), forma del fruto (FF) y flores por axila (FA). En el cuarto componente principal (CP4) el valor característico fue de 1,14 y la varianza de 9,50%. En este componente las variables forma de la hoja (FH), color de las anteras (CA) y flores por axila (FA) contribuyeron con signo positivo, mientras que la altura de planta (AP) y el hábito de crecimiento (HC) lo hicieron con signo negativo.
En la Fig. 1 se muestra la distribución de los morfotipos y las variables que por su significancia determinaron a cada uno de los dos primeros componentes principales (CP1 y CP2). En el cuadrante I se ubicó habanero morado (HM), el cual es una variante en color del fruto, principalmente del tipo habanero (HA). Los morfotipos silvestres Desconocido (DE), Garbanzo raro (GR), Amashito (AM), Garbanzo (GA) y semisilvestre (PP), agrupados en el cuadrante II, y Ojo de cangrejo (Oc) y Corazón de pollo (CP), agrupados en el cuadrante III, son morfotipos que se caracterizan por presentar (1) frutos pequeños y erectos, (2) una flor por axila, (3) color de la antera y (4) hábito de crecimiento erecto. Estas características los hacen fácil de diferenciar de los morfotipos comerciales habanero (HA) y Blanco (BL), y del semisilvestre Muela (MU), que están en el cuadrante I V.

Fig 1. Variabilidad de 11 morfotipos de chile colectados en 13 localidades del estado de Tabasco en función del primer (CP1) y segundo (CP2) componentes principales, Habanero morado (HM), Desconocido (DE), Garbanzo raro (GR), Picopaloma (PP), Amashito (AM), Garbanzo (GA); Ojo de cangrejo (Oc); Corazón de pollo (CP), Blanco (BL), Muela (MU) y Habanero (HA).
Fig 1. Variability of 11 pepper chilli morphotypes collected in 13 localities of the Tabasco State based on the first (CP1) and the second (CP2) principal components, Habanero morado (HM), Desconocido (DE), Garbanzo raro (GR), Picopaloma (PP), Amashito (AM), Garbanzo (GA); Ojo de cangrejo (Oc); Corazón de pollo (CP), Blanco (BL), Muela (MU) y Habanero (HA).
En la Fig. 2 se puede observar que la distribución de los morfotipos fue algo similar a la mostrada por éstos en la Fig. 1, con alguna ligera variación en la posición de algunos de ellos. Así por ejemplo, los tipos habanero (HA) y Blanco (BL) continuaron en el lado derecho del eje Y, pero pasaron al cuadrante I. Habanero morado (HM) hizo lo propio, y se movió al cuadrante I V. Muela (MU) se mantuvo en el mismo cuadrante (IV) y varió poco su posición. Los morfotipos silvestres y semisilvestres tendieron a formar un solo grupo más compacto en los cuadrantes II y III. La excepción fue corazón de pollo (CP), que fue el que más cambió de posición, pero sin salirse del mismo cuadrante (III).
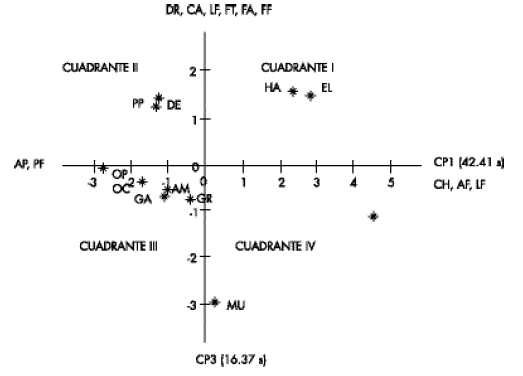
Fig 2. Variabilidad de 11 morfotipos de chile colectados en 13 localidades del estado de Tabasco en función del primer (CP1) y tercer (CP3) componentes principales, Blanco (BL), Habanero (HA), Desconocido (DE), Picopaloma (PP), Corazón de pollo (CP), Ojo de cangrejo (Oc); Amashito (AM), Garbanzo (GA); Garbanzo raro (GR), Habanero morado (HM) y Muela (MU).
Fig 2. Variability of 11 pepper chilli morphotypes collected in 13 localities of the Tabasco State based on the first (CP1) and third (CP3) principal components, Blanco (BL), Habanero (HA), Desconocido (DE), Picopaloma (PP), Corazón de pollo (CP), Ojo de cangrejo (Oc); Amashito (AM), Garbanzo (GA); Garbanzo raro (GR), Habanero morado (HM) y Muela (MU).
El dendograma (Fig. 3) permitió que se formaran seis grupos con los morfotipos. En el grupo uno, a 1,08 aproximadamente de distancia, lo formaron los morfotipos silvestres Amashito (AM), Garbanzo (GA), Picopaloma (PP), Garbanzo raro (GR) y Ojo de cangrejo (Oc).

Fig 3. Dendograma con 11 morfotipos de Capsicum spp (variedades silvestres y cultivadas) con base en 12 características agronómicas y con el método de UPGMA (ligamiento promedio), Amashito (AM), Garbanzo (GA); Picopaloma (PP), Garbanzo raro (GR), Ojo de cangrejo (Oc); Blanco (BL), Habanero (HA), Desconocido (DE), Muela (MU), Corazón de pollo (CP) y Habanero morado (HM), GI=Grupo I, GII=Grupo II, GIII=Grupo III, GIV=Grupo IV, GV=Grupo V y GVI=Grupo VI.
Fig 3. Dendogram with 11 Capsicum spp morphotypes (wild and cultivated varieties) based on 12 agronomic charactistics and with the UPGMA method (average linkage), Amashito (AM), Garbanzo (GA); Picopaloma (PP), Garbanzo raro (GR), Ojo de cangrejo (Oc); Blanco (BL), Habanero (HA), Desconocido (DE), Muela (MU), Corazón de pollo (CP) y Habanero morado (HM), GI=Group I, GII=Group II, GIII=Group III, GIV=Group IV, GV=Group V y GVI=Group VI.
Los morfotipos domesticados Blanco (BL) y Habanero (HA), que se cultivan para comercializarse, formaron el Grupo II a una distancia de 0,89. Ambos tipos se caracterizan por presentar la posición de la flor pendiente (PF), mayor ancho del fruto (AF) y el color de las anteras (CA) morado. Los tipos Desconocido (DE), Muela (MU), Corazón de Pollo (CP) y Habanero morado (HM) formaron cada uno de ellos grupos independientes.
DISCUSIÓN
En la actualidad es posible probar normalidad multivariada a los métodos multivariados que lo requieren, como el de conglomerados o cluster, pues existen reportados en la literatura al menos dos algoritmos que realizan esta prueba en forma rápida y confiable. En esta investigación, el haber encontrado que las variables medidas se distribuyeron como una normal mutivariada (Ramírez, 1995; Khattree y Naik, 2000) señala la variación y diferencias tanto morfológicas como genéticas del germoplasma colectado durante el estudio. Es evidente que al eliminar aquellas variables que tienen poco o nulo aporte a la explicación del primer componente principal (Pla, 1986; Manly, 1994; Anónimo, 2005), se mejora en forma general el análisis de componentes principales. Esto es debido a que una vez eliminadas las variables de poca importancia, se superó al 80,0% sugerido por Pla (1986) como límite para que el ACP explique en buen porcentaje de la variabilidad del material evaluado.
El método multivariado de componentes principales produjo grupos que en cierta medida coinciden con la clasificación comercial que se tiene de los morfotipos encontrados durante la etapa de exploración y colecta de esta investigación. Los valores característicos de los cuatro primeros componentes principales, al ser significativos (Kaiser, 1960), coinciden con los resultados presentados por Latournerie et al. (2002). Estos autores reportan en su trabajo que estos componentes explicaron 88,5% de la variación total; entre las variables que más contribuyeron a cada componente principal se encontraron el ancho del fruto (AF) y forma de la hoja (FH), concordando con nuestros resultados. Por otro lado, Chávez y Castillo (1999), en las poblaciones de chile manzano (C. pubescens R y P.), reportan que el diámetro del fruto fue la variable que mostró mayor valor descriptivo. Un resultado similar fue encontrado en nuestra investigación. En la especie hortícola pitahaya, Meza et al. (2005) encontraron que los tres componentes principales explicaron un 53,56% de la variación morfológica en los arquetipos evaluados. Este porcentaje es inferior al encontrado en nuestro trabajo. Las diferencias en ambos porcentajes es posible que se deba a que los autores citados midieron un menor número de variables. Al estudiarse la variación morfológica en Tagetes filifolia, Byrsonima crassifolia y Musa AAA, se reportó para el primer cultivo que con los dos primeros componentes (CP1 y CP2) se explicó el 70,0% de dicha variación (Serrato y Barajas, 2006). Para Byrsonima, Bayuelo-Jiménez et al. (2006) encontraron que los cuatro primeros componentes explicaron 83,0% de la variación total; para plátano, Karamura (1999) observó que con siete componentes sólo se pudo explicar el 53,0% de la variación total. En base a estos resultados, se puede establecer que no es conveniente tomar un cierto porcentaje como criterio para decidir con cuantos componentes se explica mejor la variación morfológica evaluada. Se debe tener en cuenta además la especie con que se está trabajando. Los resultados de nuestra investigación presentan cierta concordancia a los publicados por Chávez y Castillo (1999), quienes reportan que variables como largo, ancho y forma del fruto de Capsicum presentaron gran variación genética.
Los resultados obtenidos en esta investigación corroboran la diversidad tanto intra como interespecífica en Capsicum en el estado de Tabasco. Esto se sustenta en que los tipos Muela, Corazón de pollo, Desconocido y Garbanzo raro posiblemente son nuevas variantes de las ya conocidas. A la fecha, aunque los nuevos morfotipos son preferidos por su grado de pungencia para el consumo por la población (principalmente la que habita el área rural), éstos no habían sido reportados en la literatura. Sólo es posible observar el crecimiento de estas nuevas variantes en jardines o traspatios en forma semisilveste. Lo contrario sucede con los morfotipos Amashito, Garbanzo, Ojo de Cangrejo y Picopaloma; aunque éstos no se cultivan en forma comercial, sí existen reportes de los mismos en la literatura, y los agricultores los conservan en sus propiedades. De la diversidad que existe dentro de Habanero, sólo el tipo amarillo es el cultivado. Esto es debido a que los dos morfotipos (rojo y morado) no se han encontrado en siembras comerciales, tanto en Tabasco como en la Península de Yucatán, que es donde más se consume el chile Habanero.
El agrupamiento mostrado en las Figs. 1 y 2 entre los tipos silvestres se debe principalmente a que presentan cierta similitud en algunas de las variables medidas como por ejemplo la posición del fruto (PF), que en todos ellos es erecta. Contrariamente, dicha posición es oblicua en los tipos comerciales (Chávez y Castillo, 1999). El color de la hoja (CH), además, es más intenso en los tipos silvestres que en los comerciales. Por otra parte, los morfotipos silvestres presentan frutos de poca longitud y ancho, y muestran una flor por axila. El aglutinamiento de morfotipos de C. annumm y C. frutescens se debió principalmente a las características señaladas, y a que los mismos crecen en forma silvestre.
En las dos últimas décadas el análisis de agrupamientos ha llegado a ser un método muy popular en la comunidad científica para clasificar individuos (Karamura, 1999). El agrupamiento que se encontró de los morfotipos en esta investigación fue similar a lo informado por Hernández et al. (2006). Los investigadores mencionados reportaron que los tipos comerciales se agruparon en forma diferente en comparación con los silvestres. Esta diferenciación morfológica (relativamente alta) entre morfotipos silvestres y cultivados es posible que se deba a los cambios producidos por la domesticación, que han ocurrido en diferentes direcciones.
CONCLUSIONES
Se colectaron 11 morfotipos en las localidades exploradas. Los morfotipos que se encontraron con mayor frecuencia fueron el Amashito y Picopaloma. Es posible que en forma natural esté ocurriendo hibridación, principalmente entre los tipos Habanero y Garbanzo con cualquiera de los tipos silvestres o semisilvestre (Picopaloma), Posiblemente esto haya dado como resultado los morfotipos Muela y Amashito. Corazón de pollo (CP) se obtuvo quizás a partir del morfotipo semisilvestre Picopaloma. Los análisis de componentes principales y conglomerados agruparon a los morfotipos por especie y por tipo (silvestre o cultivado). Así, los que pertenecen a C. chinense se agrupan en forma directa. Lo mismo sucedió entre los que corresponden a C. annuum, y a éste se unió C. frutescens (Picopaloma), ya que también se encuentra en forma semisilvestre. Esta agrupación se dio principalmente por las diferencias que presentan los morfotipos en las características morfológicas evaluadas.
REFERENCIAS
1. Anónimo (2005). Métodos de Análisis Aplicados. http://www.eumed.net/tesis/jmc/capitulo4.pdf. Fecha de Consulta: 24-05-05. [ Links ]
2. Bayuelo-Jiménez, J.S., J.C. Lozano R. y E. Ochoa (2006). Caracterización morfológica de Byrsonima crassifolia (L.) Kunth nativa de Churumuco, Michoacán, México. Revista Fitotecnia Mexicana 29: 31-36. [ Links ]
3. Ben-Chaim, A. y I. Paran (2000). Genetic Analysis of Quantitative Traits in Pepper (Capsicum annuum). Journal of the American Society of Horticultural Sciences 125: 66-70. [ Links ]
4. Crossa, J., I.H. DeLacy y S. Taba (1995). The use of multivariate methods in developing a core collection. En: Hodgkin, T., Brown, A.H. van Hintum, Th. JL and Morales, E. A. V. , (eds), pp. 77-92. Core Collections of Plant Genetic Resources. John Wiley and Sons, IPGRI and Sayce Publishing [ Links ]
5. Chávez, S J.L. y F. Castillo G. (1999). Variabilidad en características morfológicas de colectas de chile manzano (Caspicum pubescens R. y P.) Revista Fitotecnia Mexicana 22: 27-41. [ Links ]
6. Eshbaugh, W.H. (1983). The genus Capsicum (Solanaceae) in Africa. Bothalia 14: 845-848. [ Links ]
7. Hernández, V.S., A. González R, P. Sánchez P, A. Casas y K Oyama (2006). Estructura y diferenciación genética de poblaciones silvestres y domesticadas de chile del noreste de México analizada con isoenzimas y RAPDs. Revista Fitotecnia Mexicana 29: 25-29. [ Links ]
8. Hernández-Verdugo, S., R.G. Guevara-Gónzalez, R.F. Rivera-Bustamante, C. Vázquez-Yanes y K. Oyama (1998). Los parientes silvestres del chile (Capsicum spp.) como recursos genéticos. Boletín de la Sociedad Botánica de México 62: 171-181. [ Links ]
9. Hernández, V. S., P. Dávila A. y K. Oyama (1999). Síntesis del Conocimiento Taxonómico, Origen y Domesticación del Género Capsicum. Boletín de la Sociedad Botánica de México 64: 65-84. [ Links ]
10. Hernández-Verdugo, S., R. Luna-Reyes y K. Oyama (2001). Genetic structure and differentiation of wild and domesticated populations of Capsicum annuum (Solanaceae) from Mexico. Plant Systematics and Evolution 226: 129-142. [ Links ]
11. Iezzoni, F.A. y M. Pritts (1991). Applications of principal component analysis to horticultural research. HortScience 26: 334-338. [ Links ]
12. IPGRI-AVRDC-CATIE (1995). Descriptores para Capsicum (Capsicum spp).En: Instituto Internacional de Recursos Fitogenéticos, Roma, Italia, Centro Asiático para el Desarrollo y la Investigación relativos a los Vegetales, Taipei, Taiwán y Centro Agronómico Tropical de Investigación y Enseñanza, Turrialba, Costa Rica. [ Links ]
13. Kaiser, H.F. (1960). The application of electronic computers to factor analysis. Educational andPhsychological Measurement 20: 141-151. [ Links ]
14. Karamura, D. A. (1999). Numerical taxonomic studies of the East African highland bananas (Musa AAA-East Africa) in Uganda. International Network for the Improvement of Banana and Platain (INIBAP-IPGRI), France. 192 p. [ Links ]
15. Khattree, K y D.N. Naik (2000). Multivariate Data Reduction and Discrimination with SAS Software. SAS Institute Inc., Cary, NC, USA. [ Links ]
16. Loaiza-Figueroa, F. , K. Ritland, J.A. Laborde-Cancino y S.D.Tanksley (1989). Patterns of genetic variation of the genus Capsicum (Solanaceae) in Mexico. Plant Systematics and Evolution 165: 159-188. [ Links ]
17. Latournerie, M,L., J.L. Chávez S, M. Pérez P. M., G. Castañón N, S.A. Rodríguez H, L.M. Arias R y P. Ramírez V (2002). Valoración in situ de la diversidad morfológica de chiles (Capsicumannuum L. y Capsicum chinenese Jacq.) en Yaxcabá, Yucatán. Revista Fitotecnia Mexicana 25: 25-33. [ Links ]
18. Legendre, P. (2000). Numerical Ecology. Developments in Environmental modelling. Elsevier, The Netherlands. 853 p. [ Links ]
19. Lévy, M.J.P. y J. Varela M (2003). Análisis multivariable para las ciencias sociales. Pearson Educación, S. A., Madrid. 896 p. [ Links ]
20. Manly, B.F.J. (1994). Multivariate Statistical Methods. Chapman & Hall. 215 p. [ Links ]
21. Mardia, K.V., J.T. Kent y J.M. Bibby (1979). Multivariate Analysis. Academic Press, London. 521 p. [ Links ]
22. Meza, R, M., D. Cituk Ch, R. Ortíz O y L. Borges B (2005). Identificación de arquetipos de pitahaya cv. roja (Hylocereus undatus) en Yucatán. En: Chávez-Servia, J.L., Tuxill, J., Jarvis, D.I. (eds), pp. 77-82. Instituto Internacional de Recursos Fitogenéticos. Cali, Colombia. [ Links ]
23. Milla, A. (2006). Capsicum de capsa, cápsula el pimiento. Pimientos, Compendios de Horticultura. Capitulo 2, pp. 21-31. Libro en línea. http://www.horticom.com/temati-cas/pimientos/pdf/capitulo1.pdf. Revisado 03-01-2007. [ Links ]
24. Morán, B. S.H., M. Ribero B, Y. García F. y P. Ramírez V. (2004). Patrones isoenzimáticos de chiles criollos (Capsicum annuum L.) de Yucatán, México. En: Chávez-Servia, J.L., Tuxill, J., Jarvis, D.I. (eds). pp. 83-89. Instituto Internacional de Recursos Fitogenéticos. Cali, Colombia. [ Links ]
25. Oyama, K., S. Hernández-Verdugo, C. Sánchez, A. González-Rodríguez, P. Sánchez-Peña, J.A. Garzón-Tiznado y A. Casas (2006). Genetic structure of wild and domesticated populations of Capsicum annuum (Solanaceae) from northwestern Mexico analyzed by RAPDs. Genetic Resources and Crop Evolution 53: 553-562. [ Links ]
26. Pla, E. (1986). Análisis Multivariado: Método de Componentes Principales. Secretaria General de la Organización de los Estados Americanos, Washington D. C. 94 p. [ Links ]
27. Ramírez, G.M.E. (1995). Prueba Estadística para probar normalidad multivariada. Comunicaciones en Estadística y Cómputo 14: 1-10. [ Links ]
28. SAS (2000). Sistema de Análisis Estadístico V8. North Carolina, Raleigh. USA. [ Links ]
29. Serrato, C., M.A. y J.S. Barajas P (2006). Poblaciones silvestres de Tagetes filifolia Lag. en el Centro-Sur de México. Revista Fitotecnia Mexicana 29: 7-12. [ Links ]














