Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Phyton (Buenos Aires)
versão On-line ISSN 1851-5657
Phyton (B. Aires) v.77 Vicente López jan./dez. 2008
ARTÍCULOS ORIGINALES
Caracterización de los ambientes asociados a poblaciones naturales de Pavonia cymbalaria (Malvaceae) pastizales de Sierra de la Ventana (Buenos Aires) (Con 4 Tablas y 3 Figuras)
Characterization of associated environments to natural populations of Pavon cymbalaria (Malvaceae) in rangelands of Sierra de la Ventana (Buenos Air (With 4 Tables & 3 Figures)
Torres1 Ya, Ma Long2, Sm Zalba1
1 GEKKO. Grupo de Estudios en Conservación y Manejo. Departamento de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur. San Juan 670 (8000). Bahía Blanca, Buenos Aires, Argentina. Address Correspondence to: yatorres@criba.edu.ar.
2Laboratorio de Plantas Vasculares. Departamento de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur. San Juan 670 (8000). Bahía Blanca, Buenos Aires, Argentina.
Recibido/Received 15.05.2008. Aceptado/Accepted 26.07.2008
Resumen. El objetivo de este trabajo es contribuir al conocimiento de la biología de Pavonia cymbalaria A. St. Hil & Naudin (Malvaceae), una especie nativa de las Sierras Australes Bonaerenses. Este conocimiento contribuirá a (1) promover su uso como especie ornamental, (2) su conservación y (3) estimular el interés y la valoración pública de la biodiversidad del sistema serrano. Se seleccionaron siete poblaciones de P. cymbalaria, dos de ellas creciendo bajo bosques de Pinus halepensis, para caracterizar distintos ambientes en donde se encuentra a la especie creciendo en forma silvestre. En cada población se estudiaron las características del ambiente inmediatamente asociado a seis ejemplares de la especie. Se midieron dieciséis parámetros ambientales, y dos índices estimativos de la cantidad y duración de los órganos florales desarrollados para este trabajo: el índice de intensidad floral y el índice de longitud del período floral. Mediante análisis de correlación pudo establecerse que las plantas ubicadas a la sombra y en el piso de los bosques presentaron en general una floración menos profusa y presentaron un follaje más deteriorado que las plantas que se encontraban a pleno sol, poniendo en evidencia el efecto negativo que ejerce, en este caso, la presencia de una especie exótica (Pinus halepensis) sobre la supervivencia y permanencia de ejemplares de P. cymbalaria.
Palabras clave: Pavonia cymbalaria; Plantas silvestres; Sierra de la Ventana; Argentina; Pinus halepensis; Ambientes asociados; Parámetros ambientales; Organos florales.
Abstract. The objective of this work is to contribute to the biology of Pavonia cymbalaria A. St. Hil & Naudin (Malvaceae), a native species of the Southern mountains of Buenos Aires Province. This knowledge will contribute to (1) promote its use as an ornamental species, (2) its conservation and (3) stimulate the interest and public valuation of mountain systems biodiversity. Seven populations of P. cymbalaria were selected. Two of them were growing under Pinus halepensis forests to characterize different environments were the herbaceous species is growing in the wild. Environmental characteristics immediately associated to six individuals of the species were studied on each population. Sixteen environmental parameters and two indexes, which estimate the quantity and duration of floral organs, were measured. These indexes included those of floral intensity and length of the floral period. Correlation analyses allowed to know that plants located in the shade and forest floor flowered less intensively and presented a more deteriorated foliage than those growing in the sun. This makes evident the negative effects of P. halepensis on the survival and persistence of P. cymbalaria individuals.
Key words: Pavonia cymbalaria; Wild plants; Sierra de la Ventana; Argentina; Pinus halepensis; Associated environments; Environmental parameters; Floral organs.
INTRODUCCIÓN
Los recursos genéticos nativos constituyen importantes componentes de la biodiversidad que pueden ser aprovechados con fines comerciales, educativos y científicos. Tal es el caso de las especies vegetales nativas con valor ornamental, cuyo estudio y cultivo, además de contribuir a la economía regional, pueden constituir medios idóneos para la valoración y conservación de la flora silvestre.
Con la reciente incorporación a la legislación argentina del Convenio sobre Diversidad Biológica, se presenta una posibilidad única para el desarrollo de nuevas áreas de investigación asociadas a la flora nativa. Al mismo tiempo, se fomenta el desarrollo de programas de educación y capacitación científica que contribuyan a la conservación y al uso sustentable y equitativo de los recursos biológicos (Ministerio de Salud y Ambiente de la Nación, 1994).
Con este propósito se eligió a Pavonia cymbalaria A. St. Hil & Naudin (Malvaceae) como posible candidata para su cultivo como especie ornamental. Es una especie subarbustiva, perenne, endémica de las sierras del sur de Uruguay y de la provincia de Buenos Aires (Ventania, Balcarce, Tandil y Olavarría) (Cabrera, 1965; Long y Grassini, 1997). Pavonia cymbalaria se caracteriza por la presencia de abundantes hojas y atractivas flores rosado-liliáceas, con nervaduras y mancha basal rojiza. Diversas especies del género ya son utilizadas con fines ornamentales, entre ellas P. lasiopetala en Estados Unidos; P. hastata en Australia; P. candida en México, y P. alnifolia, P. cauliflora, P. makoyana, P. multiflora (probablemente la especie más cultivada), P. strictiflora y P. tricalycaris en distintos jardines botánicos tropicales (Fryxell, 1999).
Estudios previos que evalúan el riesgo de extinción de los endemismos de la Sierra de la Ventana han catalogado a P. cymbalaria dentro de las especies con bajo grado de amenaza (Long y Grassini, 1997; Anderson, 2001). Aún así los esfuerzos destinados a su conservación no deben ser desestimados debido al alto grado de perturbación al que se encuentran expuestas las regiones serranas de la provincia de Buenos Aires: el sobrepastoreo, el turismo intensivo y el avance de especies leñosas invasoras que podrían amenazar su supervivencia (Frangi y Bottino, 1995).
Este trabajo aporta información del efecto de distintas variables ambientales y ecológicas sobre la fenología y el crecimiento de la especie en ambientes naturales. Este conocimiento contribuirá a identificar las condiciones más apropiadas para su cultivo tanto con fines ornamentales como de conservación ex-situ.
MATERIALES Y MÉTODOS
Área de estudio. El Sistema de Ventania o de las Sierras Australes Bonaerenses, ubicado en el sudoeste de la provincia de Buenos Aires, constituye un sistema de plegamiento de 170 km de longitud con dirección NO-SE, y una altura máxima de 1243 msnm (Cerro Tres Picos) (Kristensen y Frangi, 1995). Fitogeográficamente pertenece al Distrito Pampeano Austral (Cabrera, 1971), y se caracteriza por la presencia de suelos poco profundos, con rocas o con una capa de tosca dura a poca profundidad. La vegetación predominante es la estepa de gramíneas con predominio de los géneros Piptochaetium y Stipa. Parodi (1964), sin embargo, considera a Ventania como un distrito independiente dentro de la Estepa Pampeana: el Distrito Petrofítico.
El clima es templado, con una temperatura media anual de 14 ºC y una precipitación anual que varía desde 500 a 800 mm (Zalba y Villamil, 2002). El período más lluvioso es el primavero-estival. Las heladas son frecuentes en invierno y ocasionalmente nieva. Los vientos predominantes son del NE-SO, perpendiculares a las sierras. En invierno aumenta la frecuencia de los vientos provenientes del O y en verano, la de los del E y NE (Kristensen y Frangi, 1995).
Los afloramientos rocosos aparecen como pequeñas unidades discretas o como áreas de considerable extensión. En el sector occidental las formaciones geológicas dan lugar a la presencia de roquedales en bloques (fragmentos consolidados de roca madre), mientras que en el sector oriental, los afloramientos están constituidos por rocas esquistosas (con preponderancia de minerales laminares). Las pendientes serranas son variables y alcanzan valores mayores al 70% en los tramos superiores del flanco occidental de los cerros más altos (Frangi y Bottino, 1995).
Dentro de este sistema se encuentra ubicado el Parque Provincial Ernesto Tornquist (PPET), una de las pocas reservas naturales de la región pampeana destinada a la conservación de los últimos relictos de pastizal. En sus casi 7000 ha está representada más del 50% de la flora vascular nativa de las sierras, incluyendo 17 endemismos estrictos de Ventania y 20 endemismos de mayor distribución geográfica (Long y Grassini, 1997; Zalba y Long, 2003). Sin embargo, gran parte del área de la reserva se encuentra actualmente amenazada debido a la introducción, accidental o deliberada, de flora y fauna exótica (Zalba y Villamil, 2002). Se destacan especialmente las introducciones de especies vegetales leñosas como Pinus radiata, Pinus halepensis, Prunus mahaleb, Eucalyptus spp. y Acacia spp. (Zalba y Villamil, 2002; Amiotti et al., 2007).
Dentro de este sistema, las poblaciones de P. cymbalaria se encuentran bien representadas en sitios con suelo rocoso o con bloques muy someros y en grietas y fisuras insoladas de afloramientos rocosos (Frangi y Bottino, 1995).
Metodología. Entre noviembre 2004 y mayo 2005, se muestrearon siete poblaciones de P. cymbalaria ubicadas en el interior del PPET con el propósito de (1) caracterizar los ambientes naturales donde la especie se encuentra de modo silvestre y (2) registrar su crecimiento y períodos de floración y fructificación. Los muestreos se repitieron con una frecuencia aproximadamente mensual. Las poblaciones ubicadas en los sitios 1, 4 y 5 se encontraban en zonas de piedemonte, mientras que las correspondientes a los sitios 2 y 3 se hallaban sobre laderas rocosas (Tabla 1). Las poblaciones 6 y 7 se encontraban bajo ejemplares adultos de Pinus halepensis, que tenían una densidad de individuos de 200 a 600 pinos/ha y de más de 600 pinos/ha, respectivamente (Tabla 1). En cada población se seleccionaron al azar seis individuos de P. cymbalaria y se establecieron parcelas de muestreo de 2 x 2 m centradas en cada uno de ellos. Las variables estimadas incluyeron (1) tipo de sustrato: porcentaje de suelo desnudo, esquisto, bloque y piedras sueltas, (2) grado de exposición al sol: 0 sombra total, 1 sombra parcial y 2 exposición solar completa, (3) porcentaje de cobertura de la vegetación acompañante: porcentaje de gramíneas, de especies herbáceas no gramíneas y de plantas leñosas, (4) porcentaje de cobertura de la vegetación por estratos de altura (medidos desde el nivel del suelo): de 0 a 10 cm de altura, de 10 a 30 cm y de más de 30 cm, (5) longitud de tres ramas principales (las de mayor longitud) de la planta de P. cymbalaria en cm, (6) presencia y cantidad de flores y (7) abundancia de otros ejemplares de la especie (Tabla 1). La ubicación de cada planta se determinó empleando un GPS (Garmin 12 XL). En los casos en que las plantas se ubicaron sobre una ladera se estimó su pendiente y se registró la orientación con una brújula. También se evaluó la presencia de signos de enfermedades en las plantas. En las poblaciones ubicadas debajo de ejemplares de Pinus halepensis se midió la profundidad de la cubierta de acículas sobre el suelo (Tabla 1). Los muestreos se repitieron con una frecuencia aproximadamente mensual entre noviembre de 2004 y mayo de 2005.
Tabla 1. Descripción de los 7 sitios estudiados. En cada uno se muestrearon 6 plantas de Pavonia cymbalaria y se estimaron variables ecológicas y físicas del ambiente. Los porcentajes de vegetación acompañante y de cobertura por estratos corresponden a valores promedios. Referencias: PL: Planta, TS: Tipo de sustrato, S: Suelo desnudo, E: Esquisto, B: Bloque, PS: Piedra suelta, PV: Cantidad de ejemplares de P. cymbalaria en la parcela, AC: Profundidad de la cubierta de acículas del suelo en cm (solo para los sitios 6 y 7), P: Pendiente, O: Orientación de la pendiente, ES: Exposición solar, Plena: Sol pleno durante todo el día, Parcial: Exposición solar parcial, Sombra: Sombra total durante todo el día, VA: Porcentaje de vegetación acompañante, H: Herbáceas no gramíneas, G: Gramíneas, L: Leñosas, CE: Porcentaje de cobertura por estratos de altura (medidos desde el nivel del suelo), (1): Estrato de 0 a 10 cm de altura, (2): Estrato de 10 a 30 cm de altura, (3): Estrato de más de 30 cm de altura
Table 1. Description of the 7 study sites. Six plants of Pavonia cymbalaria were sampled, and ecological and physical environmental variables were estimated on each site. Percentages of companion vegetation and plant cover by strata represent mean values. References: PL: Plant, TS: Substrate type, S: Bare soil, E: Laminar layers on rocks, B: Block, PS: Loose stones, PV: Amount of individuals of P. cymbalaria in the plot, AC: Depth of acicules on the forest floor (cm; only for sites 6 and 7), P: Slope, O: Slope orientation, ES: Sun exposition, Full: Sun radiation during the whole day, Partial: Partial solar exposition, Shade: Total shade during the whole day, VA: Percentage of companion vegetation, H: Herbaceous, but not grasses, vegetation, G: Grasses, L: Woody vegetation, CE: Percentage cover per strata of height (measured from the soil level), (1): stratum 0 to 10 cm height, (2): stratum 10 to 30 cm height, (3): stratum greater than 30 cm height
Se registraron la época y longitud de la floración y se estimó la cantidad de flores por planta según las siguientes categorías: 0: ausencia completa de flores; 1: entre 1 y 10 flores; 2: entre 10 y 20; 3: entre 20 y 30 y 4: entre 30 y 40 (no se hallaron ejemplares con un número de flores mayor a 40). Cuatro de los cinco muestreos correspondieron al periodo de floración de la especie en el parque y con estos datos se confeccionaron dos índices. El índice de intensidad floral para cada planta se calculó sumando los valores obtenidos durante los 4 muestreos y dividiendo el total por la cantidad de veces que se encontró alguna flor en dichos muestreos. De esta forma el índice de intensidad floral puede variar entre los valores 0, si no se detectaron flores en ninguna de las visitas a la planta, y 4, si la planta mostraba una abundancia de entre 30 y 40 flores en todos los muestreos. El índice de longitud del período floral para cada planta se calculó dividiendo por cuatro la cantidad de veces en que se la observó con flores en esos 4 muestreos. Por lo tanto este índice puede tomar los valores: 0, 1/4, 2/4, 3/4 y 4/4. La longitud de las 3 ramas principales se tomó como una medida del crecimiento vegetativo en cada planta.
Con estos dos índices y el crecimiento vegetativo se realizaron análisis estadísticos para determinar si existían diferencias entre las distintas poblaciones. Para esto se empleó un ANOVA simple cuando los datos cumplían con el supuesto de normalidad y homocedasticidad o un test Kruskal Wallis cuando el primer supuesto no se cumplía. Para analizar las diferencias encontradas se emplearon el test de Bonferroni o de Nemenyi, según correspondiera (Zar, 1999). Con los datos obtenidos para cada uno de los parámetros estimados y los dos índices calculados se realizaron análisis de correlación para determinar la posible relación de las características del entorno inmediato a las plantas sobre su crecimiento vegetativo, la intensidad de floración, la longitud del período floral (los parámetros biológicos considerados de interés) y el resto de las variables.
RESULTADOS
Los datos de crecimiento vegetativo se analizaron por fecha, encontrándose mayores valores para las plantas del sitio 3 en las 5 fechas de estudio (Bonferroni: p<0,05; Fig. 1). Los demás sitios mostraron valores similares (p>0,05) durante toda la estación de crecimiento (Fig. 1). Las plantas pertenecientes a los sitios 6 y 7 (es decir, las que crecieron debajo de ejemplares de Pinus halepensis) mostraron menor cantidad de ramas y de hojas. Estas observaciones resultaron conspicuas a simple vista.

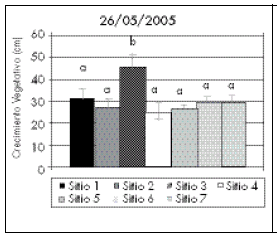
Fig. 1. Crecimiento vegetativo (cm) de ejemplares de Pavonia cymbalaria provenientes de siete poblaciones, muestreados entre noviembre de 2004 y mayo de 2005. Las columnas representan los valores medios ± 1 error estándar de seis plantas. Los sitios con igual letra no difieren significativamente (p>0,05). Ver Tabla 1 para una descripción de los sitios.
Fig. 1. Vegetative growth (cm) of Pavonia cymbalaria individuals coming from 7 populations, sampled between November 2004 and May 2005. Histograms represent mean ± 1 standard error of six plants. Sites with equal letter do not differ significantly (p>0.05). See Table 1 for a site description.
Las poblaciones del sitio 3 tuvieron un índice de intensidad floral significativamente mayor (Kruskal Wallis: X2=19,759, p=0,001; Nemenyi: p<0,05) que las demás poblaciones (Fig. 2). El sitio 6 no se incluyó en el análisis ya que no mostró floración en ninguno de los muestreos realizados.

Fig. 2. Índice de intensidad floral calculados para ejemplares de P. cymbalaria correspondientes a seis poblaciones. Las columnas representan el valor medio ± 1 error estándar de seis plantas. Los sitios con igual letra no difieren significativamente (p>0,05). Ver Tabla 1 para una descripción de los sitios.
Fig. 2. Index of floral intensity calculated for individuals of P. cymbalaria corresponding to six populations. Histograms represent the mean ± 1 standard error of six plants. Sites with equal letter do not differ significantly (p>0.05). See Table 1 for a site description.
El período de floración en las plantas silvestres se produjo en los meses más cálidos, desde noviembre hasta fines de marzo, mientras que la aparición de frutos comenzó en el mes de enero.
El índice de longitud del período floral mostró diferencias significativas entre los sitios muestreados, exhibiendo el sitio 7 un período de floración significativamente más corto (Bonferroni: p<0,05) que el sitio 3 (Fig. 3). Para el análisis no se consideró a la población 6 ya que no presentó floración en ninguno de los muestreos.
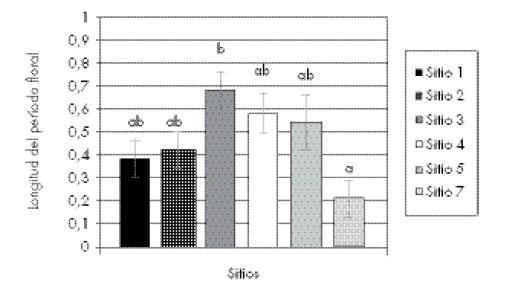
Fig. 3. Índice de longitud del período floral para ejemplares de P. cymbalaria correspondientes a seis poblaciones. Las columnas representan el valor medio ± 1 error estándar de seis plantas. Los sitios con igual letra no difieren significativamente (p>0,05). Ver Tabla 1 para una descripción de los sitios.
Fig. 3. Index of the floral period length for individuals of P. cymbalaria corresponding to six populations. Histograms represent the mean ± 1 standard error of six plants. Sites with equal letter do not differ significantly (p>0.05). See Table 1 for a site description.
El crecimiento vegetativo no mostró correlaciones significativas con ninguna de las variables consideradas en los muestreos (p>0,05) (Tabla 2).
Tabla 2. Coeficientes de correlación (r), estadísticos t y grado de significancia (p) entre las variables estimadas y el crecimiento vegetativo.
Table 2. Correlation coefficients (r), t statistics and degree of significance (p) between the estimated variables and vegetative growth.
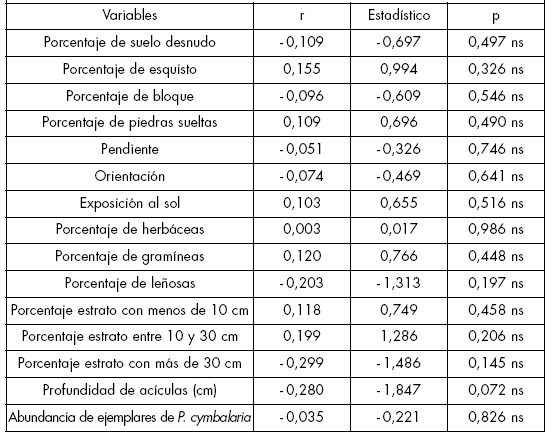
Para el índice de intensidad floral se encontró una correlación negativa, altamente significativa, con las variables profundidad de la cubierta de acículas en el suelo (en el caso de las poblaciones creciendo debajo de pinos), porcentaje de especies leñosas acompañantes y porcentaje de especies pertenecientes al estrato de más de 30 cm de altura (p<0,01); no se encontraron correlaciones significativas con el resto de las variables (p>0,05) (Tabla 3).
Tabla 3. Coeficientes de correlación (r), estadísticos t y grado de significancia (p) entre las variables estimadas y el crecimiento de intensidad floral.
Table 3. Correlation coefficients (r), t statistics and degree of significance (p) between the estimated variables and the index of floral intensity.

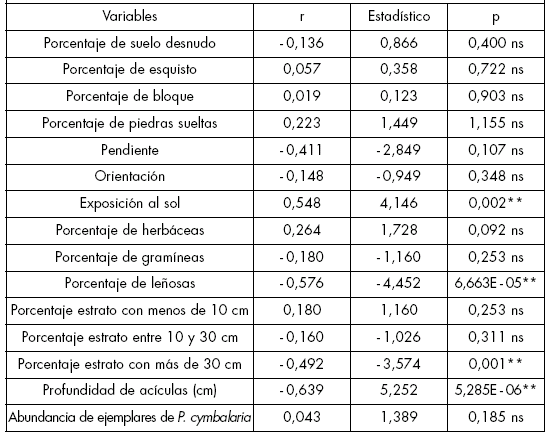
El índice de longitud del período floral mostró correlaciones negativas altamente significativas con las variables porcentaje de especies leñosas acompañantes, porcentaje de especies pertenecientes al estrato de más de 30 cm de altura y profundidad de la cubierta de acículas en el suelo (p<0,01; Tabla 4). Al mismo tiempo, la correlación fue positiva con la exposición al sol (p<0,01; Tabla 4). No se encontraron correlaciones significativas con el resto de las variables analizadas (p>0,05; Tabla 4).
Tabla 4. Coeficientes de correlación (r), estadísticos t y grado de significancia (p) entre las variables estimadas y el índice de longitud del período floral.
Table 4. Correlation coefficients (r), t statistics and degree of significance (p) between the estimated variables and the index of floral intensity.
En cuanto a la presencia de signos de enfermedades en las plantas silvestres se pudo observar la aparición de pequeñas manchas en la superficie dorsal de las hojas en la mayoría de las plantas, síntoma que posiblemente esté asociado a alguna infección por hongos.
DISCUSIÓN
Los resultados obtenidos demostraron que ninguna de las variables estudiadas parece afectar de modo significativo el crecimiento vegetativo de la especie. Más allá de este resultado, la observación directa de los ejemplares permitió detectar diferencias notables entre las plantas de los sitios 6 y 7, que crecieron bajo ejemplares de Pinus halepensis, y las restantes. Las plantas que se encuentran en el piso del bosque mostraron menor vigor y menor cantidad de ramas y hojas, llegando algunas plantas a poseer una única rama. Las especies adaptadas a ambientes expuestos a la luz solar directa muestran una reducción en la capacidad fotosintética, y un menor vigor y resistencia a los patógenos, cuando son expuestas a condiciones de sombra (Parodi, 1964; Boardman, 1977; Naumburg et al., 2001). En el caso del Parque Tornquist, la casi total inexistencia de especies arbóreas indígenas en la zona, determina la escasez de hierbas o arbustos nativos adaptados a tolerar la sombra (Zalba, 1994). Debido a esto se puede pensar que P. cymbalaria podría ser una especie adaptada a ambientes con exposición solar plena. Esto coincide con lo expuesto por Frangi y Bottino (1995), que asocian a las poblaciones de P. cymbalaria con sitios rocosos bien insolados. La interferencia que ejercen los árboles de gran porte sobre el grado de insolación podría estar afectando el crecimiento de las plantas de P. cymbalaria, aunque esto no llegó a detectarse en los análisis de correlación realizados. Sin embargo, los individuos de la población 3, que se hallaban expuestos en su totalidad a luz solar directa durante todo el día y alejados de especies arbóreas, tuvieron un mayor crecimiento. Las plantas de este sitio presentaban además un mayor vigor, y mayor porte, que en los demás sitios estudiados.
La posibilidad de cultivar una especie nativa con fines ornamentales depende en gran medida de la abundancia y persistencia de sus flores. Este es el caso de P. cymbalaria, razón por la cual se utilizaron los índices de intensidad floral y longitud del período floral, como variables de interés a la hora de detectar parámetros ambientales que pudieran resultar claves para su adecuado cultivo. Ambos índices florales mostraron una correlación negativa con las variables porcentaje de cobertura del estrato de más de 30 cm, porcentaje de especies leñosas y profundidad de la cubierta de acículas del suelo. La correlación negativa con la vegetación de más de 30 cm podría deberse a la sombra parcial que producen estas plantas sobre los individuos de P. cymbalaria, que en general son de bajo porte y de naturaleza postrada. El porcentaje de especies leñosas hace referencia casi exclusivamente a la presencia de pinos en el sitio de muestreo, ya que rara vez se halló alguna otra especie leñosa en las parcelas. La vegetación nativa de un lugar puede cambiar significativamente como consecuencia directa de la presencia de especies arbóreas introducidas. Esto puede ser debido a procesos de competencia por luz, agua o nutrientes, o efectos indirectos que suelen alterar los ciclos biogeoquímicos y los ritmos y la intensidad de los disturbios a que está expuesto el ecosistema (Zalba, 1994). Entre los efectos negativos comúnmente asociados a la presencia de pinos se han reportado la acidificación del suelo, una disminución en la actividad biológica, acumulación de materia orgánica superficial, lixiviación de cationes y presencia de compuestos alelopáticos (compuestos fenólicos y terpenos) tanto en las acículas como en la corteza (Peltier et al, 2001, Turtola et al, 2002, Núñez et al, 2003, Maestre et al, 2004, Amiotti et al., 2007). Estas condiciones podrían estar afectando la producción de flores en P. cymbalaria, ya que la población 6 no presentó floración en ninguno de los muestreos, y la población 7 mostró una longitud del período floral reducida.
Por otra parte, se encontró una correlación positiva entre la longitud del período floral y la exposición al sol. Uno de los factores ambientales que determina el paso del estado vegetativo al reproductivo es la longitud del período de luz (Salisbury, 1963; Thomas et al., 2006). Es habitual que las especies perennes alternen el crecimiento vegetativo con el reproductivo, con beneficios asociados a la competencia con otras especies de la comunidad (Leopold, 1964). Se ha observado un retraso en la antesis y una disminución en el tamaño y número de flores, en plantas adaptadas a altos niveles lumínicos creciendo bajo condiciones de sombra, debido a cambios en la distribución de los fotoasimilados que retrasarían o anularían la floración (Salisbury, 1963; Fitter y Ashmore, 1974; Smith, 1982; Naumburg et al., 2001). En el caso de P. cymbalaria, la luz pareciera ser necesaria para la producción de flores. Los mayores valores para la intensidad floral y longitud del período floral que presentó la población 3 podrían deberse a una mayor exposición solar, que resultó ser plena durante todo el día para todas las plantas estudiadas en este sitio.
Anderson (2001) informó no haber encontrado organismos fúngicos sobre ejemplares de P. cymbalaria durante sus estudios en el Parque Tornquist. Esto sugiere que sus poblaciones estarían fuera de peligro en cuanto a este aspecto. Sin embargo, en el presente trabajo se encontró evidencia de una posible infección por hongos en las hojas de la mayoría de las plantas muestreadas. Aun así, esto no pareció influir de modo negativo en la producción de flores, aunque sí alteró de modo significativo el aspecto general y la estética de las plantas.
Las poblaciones de P. cymbalaria se desarrollaron y reprodujeron mejor en ambientes expuestos a luz solar directa. La presencia de bosques de Pinus halepensis dentro del Parque ejerció un efecto negativo sobre los ejemplares que crecieron bajo su sombra. Esto puede ser debido a efectos alelopáticos causados por la acumulación de acículas en el suelo.
REFERENCIAS
1. Amiotti, N.M., O. Bravo, P. Zalba, y N. Peinemann (2007). Effect of landscape position on the acidification of loess-derived soils under Pinus radiata. Austral Ecology 32: 534-540. [ Links ]
2. Anderson, F.E. (2001). Enfermedades de plantas endémicas o raras de la región de Bahía Blanca: estudios etiológicos y epidemiológicos. Tesis Doctoral en Biología. Universidad Nacional del Sur, Bahía Blanca. 252 p. [ Links ]
3. Boardman, N.K. (1977). Comparative photosynthesis of sun and shade adapted plants. AnnualReview of Plant Physiology 28: 355-377. [ Links ]
4. Cabrera, A.L. (1965). Flora de la provincia de Buenos Aires. Colección Científica del INTA, Tomo 4: 174-176. [ Links ]
5. Cabrera, A.L. (1971). Fitogeografía de la República Argentina. Boletín de la Sociedad Argentina de Botánica. Buenos Aires. 43 p. [ Links ]
6. Fitter, A.H., y C.J. Ashmore (1974). Response of two Veronica species to a simulated woodland light climate. New Phytologist 73: 997-1001. [ Links ]
7. Frangi, J. y O. Bottino (1995). Comunidades vegetales de la Sierra de la Ventana, provincia de Buenos Aires, Argentina. Revista de la Facultad de Agronomía de La Plata 71: 93-133. [ Links ]
8. Fryxell, P.A. (1999). Pavonia cavanilles (Malvaceae). The Organization for Flora Neotrópica. Flora Neotrópica Monograph 76: 108-109. [ Links ]
9. Kristensen, M.J. y J.L. Frangi (1995). Mesoclimas de pastizales de la Sierra de la Ventana. Ecología Austral 5: 55-64. [ Links ]
10. Leopold, C.A. (1964). Plant growth and development. McGraw-Hill, Inc. New York. 466 p. [ Links ]
11. Long, M.A. y C.M. Grassini (1997). Actualización del conocimiento florístico del Parque Provincial Ernesto Tornquist. Informe Final del Convenio de Colaboración Recíproca Ministerio de Asuntos Agrarios Provincia de Buenos Aires y Universidad Nacional del Sur. 257 p. Inédito. [ Links ]
12. Maestre, F.T., J. Cortina y S. Bautista (2004). Mechanisms underlying the interaction between Pinus halepensis and the native late-successional shrub Pistacia lentiscus in a semiarid planta-tion. Ecography 27: 776-786. [ Links ]
13. Ministerio de Salud y Ambiente de la Nación y Secretaría de Ambiente y Desarrollo Sustentable (1994). Ley Nacional 24.375: Aprobación del Convenio sobre la Diversidad Biológica. http://www2.medioambiente.gov.ar/mlegal/tratados/ley24375.htm. Consultado en enero 2006. [ Links ]
14. Naumburg, E., L.E. DeWald, y T.E. Kolb (2001). Shade responses of five grasses native to south-western U.S. Pinus ponderosa forests. Canadian Journal of Botany 79: 1001-1009. [ Links ]
15. Núñez, M.R., F. Bravo y L. Calvo (2003). Predicting the probability of seed germination in Pinussylvestris L. and four competitor shrub species after fire. Annals of Forest Science 60: 75-81. [ Links ]
16. Parodi, L.R. (1964). Enciclopedia Argentina de Agricultura y Jardinería. Vol. 2. Parte I. Editorial Acme. Buenos Aires. 706 p. [ Links ]
17. Peltier, A., J.F. Ponge, R. Jordana y A. Ariño (2001). Humus forms in Mediterranean shrublands with Aleppo Pine. Soil Science Society of America Journal 65: 884-896. [ Links ]
18. Salisbury, F.B. (1963). The flowering process. International Series of Monographs on Pure and Applied Biology. Vol. 4. Pergamon Press. New York. 234 p. [ Links ]
19. Smith, H. (1982). Light quality, photoreception, and plant strategy. Annual Review of Plant Physiology 33: 481-518. [ Links ]
20. Thomas, B., I. Carré, y S. Jackson (2006). Photoperiodism and flowering. En: The molecular biology of flowering. 2º Edición. Jordan, B.R (ed). Lincoln University. Canterbury, New Zealand, 416 p. [ Links ]
21. Turtola, S., A.M. Manninen, J.K Holopainen, T. Levula, H. Raitio y P. Kainulainen (2002). Secondary metabolite concentrations and terpene emissions of Scots Pine xylem after long-term forest fertilization. Journal of Environmental Quality 31: 1694-1701. [ Links ]
22. Zalba, S.M. (1994). Plantas leñosas exóticas en el Parque Provincial Ernesto Tornquist (Buenos Aires): Evaluación de impacto y propuesta de control. Tesis de Maestría en Manejo de Vida Silvestre. Universidad Nacional de Córdoba. Córdoba. 125 p. [ Links ]
23. Zalba, S. M. y C.B. Villamil (2002). Woody plant invasion in relictual grassland. Biological Invasions 4: 55-72. [ Links ]
24. Zalba, S.M. y M.A. Long (2003). Jardín Botánico del Parque Provincial Ernesto Tornquist: Una experiencia para la conservación de la flora nativa. Resúmenes 29º Jornadas Argentinas de Botánica. 19 al 23 de Octubre, San Luis. p. 74. [ Links ]
25. Zar, J. H. (1999). Biostatistical Analysis. 4º Edición. Editorial Prentice-Hall. Upper Saddle River, New Jersey. 663 p. [ Links ]














