Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.78 no.2 Vicente López jul./dic. 2009
ARTÍCULOS ORIGINALES
Respuesta de Lilium sp. al fósforo y su relación con Glomus fasciculatum y Bacillus subtilis
Lilium sp. response to phosphorus and its relationship with Glomus fasciculatum and Bacillus subtilis
Rubí Arriaga1 M, A González Huerta2, AM Castillo González3, V Olalde Portugal4, BG Reyes Reyes5, LI Aguilera Gómez6
1 Programa de Maestría y Doctorado en Ciencias Agropecuarias y Recursos Naturales, Campus Universitario El Cerrillo, Universidad Autónoma del Estado de México (UAEMEX). Toluca, Estado de México, Km. 15 Carretera Toluca-Ixtlahuaca, México.
2 Facultad de Ciencias Agrícolas, Centro de Investigación y Estudios Avanzados en Fitomejoramiento, UAEMEX.
3 Universidad Autónoma Chapingo. Km 36.5 Carretera México-Texcoco.
4 Laboratorio de Bioquímica Ecológica, CINVESTAV, IPN-Unidad Irapuato.
5 Instituto de Ciencias Agropecuarias y Rurales (ICAR), UAEMEX, México
6 Facultad de Ciencias, UAEMEX.
Address Correspondence to: Martín Rubí Arriaga, e-mail: m_rubi65@yahoo.com.mx. Teléfono + 52 (723) 1451083 y (722) 29 65518. Ext. 148.
Recibido-Received 25.02.2009.
Aceptado/Accepted 08.07.2009.
Resumen. Entre las plantas comerciales utilizadas en la floricultura del Estado de México, las especies de Lilium sp. generan volúmenes de producción importantes, con problemas asociados a grandes cantidades de fertilizantes químicos, salinidad de suelo y contaminación de mantos freáticos. Se requieren estrategias sustentables para minimizar el impacto sobre el ecosistema sin disminuir la calidad del producto. En condiciones de invernadero se evaluaron los efectos principales y las interacciones de fósforo, Glomus fasciculatum y Bacillus subtilis. Se estudiaron 12 tratamientos bajo un arreglo factorial 2x3x2 con diferente número de repeticiones por tratamiento para las diferentes variables. Los resultados indicaron que el tratamiento que combinó Glomus fasciculatum con 22 μg/ml de fósforo y Bacillus subtilis mostró correlación positiva con (1) colonización en raíz, (2) peso seco de raíz, (3) diámetro de tallo, (4) peso seco de la parte aérea vegetativa, (5) período de floración, (6) diámetro de la flor, (7) ancho de pétalo, (8) peso seco y (9) vida de la flor, (10) tasa fotosintética y (11) concentración de Zn, Cu y Fe en tallos. Estos resultados muestran que los microorganismos rizósfericos utilizados pueden interactuar positivamente en promover el crecimiento y desarrollo de la planta para mejorar la calidad de Lilium sp. con 22 μg/ml de fósforo.
Palabras clave: Lilium; Calidad de flor; Bacillus subtilis; Fósforo; Glomus fasciculatum.
Abstract. Among commercial plants utilized in floriculture in Mexico State, Lilium species have a great production volume, with problems associated with high use of chemical fertilizers, soil salinity and water pollution. Sustainable strategies are required to minimize impacts on the ecosystem without diminishing quality products. Main effects and the interactions of phosphorous, Glomus fasciculatum and Bacillus subtilis were evaluated under greenhouse conditions. Twelve treatments arranged in a 2x3x2 factorial with 10 replications by treatment were studied. Results showed that G. fasciculatum combined with 22 μg/ml P and B. subtilis had a positive correlation with root colonization, root dry weight, stem diameter, shoot dry weight, flowering period, flower diameter, petal width, flower dry weight, flower lifespan, net photosynthetic rate and tissue contents of Zn, Cu and Fe. Results indicate that study rhizospheric microorganisms can positively interact to promote growth and development of Lilium plants, thus improving commercial flower quality, saving chemical fertilizers and protecting soil resources.
Key words: Lilium; Flower quality; Bacillus subtilis; Phosphorus; Glomus fasciculatum.
INTRODUCCIÓN
En la plantación de especies ornamentales, como Lilium spp. en el Estado de México, México, la mayoría de los productores aplican dosis excesivas de fertilizantes, por lo que se incrementan los costos de producción en el cultivo y se contaminan el subsuelo y los mantos acuíferos (Simmonne y Hutchinson, 2005). Esto causa una mayor susceptibilidad a enfermedades, desbalance nutrimental y menor vida postcosecha (Gaur y Adholeya, 2005). Por lo tanto, es necesario un desarrollo sustentable en la producción de ornamentales basado en la búsqueda de alternativas eficientes y económicas de fertilización (Jeffries et al., 2003). Las rizobacterias promotoras del crecimiento de la planta (PGPR) y los hongos simbióticos formadores de micorrizas (HMA) (Boophander et al., 2005) actúan de manera mutualista con las plantas e inciden en la absorción de nutrimentos (Jeffries et al., 2003; Vessey, 2003), en el metabolismo secundario (Maier et al., 2000) y en la arquitectura de la raíz (Jiménez-Delgadillo, 2004), por lo que su utilización ha contribuido notablemente en la nutrición mineral de los cultivos (Artursson et al., 2006). La información sobre coinoculación con PGPR y HMA en ornamentales y, particularmente en Lilium spp. es escasa, aún cuando esta asociación influye en una mayor producción y calidad de flor, reducción en días a cosecha e incrementos en materia seca y en absorción de nutrientes (Scagel, 2004; Cárdenas-Flores et al., 2007). La asociación hongo micorrízico-rizobacteria-Lilium abre perspectivas de importancia económica nacional e internacional, debido a que esta ornamental se ha convertido en uno de los cultivos de mayor expansión (Anónimo, 2007). Es una planta geófita formada por un bulbo que posee brácteas escamosas que sirven de almacenamiento de sustancias de reserva necesarias para el desarrollo de la planta antes de la emergencia del sistema radical, el cual está compuesto por raíces carnosas que nacen del disco basal, y raíces adventicias del tallo ubicadas en la porción superior del bulbo. Estas últimas tienen la función de absorber nutrientes y agua (Bañón et al., 1993). No obstante lo anterior, el bulbo y sus raíces son insuficientes para obtener flor de calidad comercial, lo que hace necesaria una óptima fertilización química para disminuir los costos de producción y daños al medio. La asociación positiva entre HMA, PGPR y fósforo, y de éstos con las variables registradas, podría evaluarse e interpretarse por medio del análisis de componentes principales descrito por Sánchez (1995) y por González et al. (2007). Esto permitiría determinar si existen patrones entre estos tres factores (tratamientos) como resultado de los valores de las variables, qué variables separan a los grupos definidos y qué relación existe entre las variables. El objetivo del presente trabajo fue analizar el efecto de la aplicación de fósforo y su relación con Bacillus subtilis y Glomus fasciculatum en la producción y calidad comercial de Lilium, híbrido oriental, ‘Showwinner'.
MATERIALES Y MÉTODOS
El experimento se desarrolló de agosto 2006 a enero 2007, en un invernadero establecido en el municipio de Coatepec Harinas, Estado de México, México. Esta municipalidad se ubica a una altitud de 2169 m (18° 54' 26'' N, 99° 47' 03' O). La temperatura promedio dentro del invernadero fue de 35°C en el día y 10°C en la noche.
En contenedores de plástico se plantaron bulbos vernalizados, importados de Holanda, calibre 16/18 de Lilium, híbrido oriental, ‘Showwinner', lavados y desinfectados previamente con Cloramina T al 2% durante 5 min y enjuagados con agua estéril. Como sustrato se utilizó una mezcla 1:1 de suelo con arena de río, con pH de 5,9; 2,1% de materia orgánica, y 18,4 μg/ml de P, esterilizado a una presión de 120 kg/cm2 por una hora en tres días consecutivos.
La inoculación micorrízica se realizó al plantar el bulbo. Se utilizaron 100 g de inóculo constituido de un suelo limoso con 73 esporas/g de Glomus fasciculatum y fragmentos de raíz con 50% de colonización. En cada contenedor se colocaron 250 g de sustrato y se aplicaron 50 g de inóculo; el bulbo, al cual se le retiraron las raíces primarias para evitar la presencia de hongos micorrízicos nativos, se plantó a 10 cm de la superficie y se cubrió con 500 g de sustrato. El resto del inóculo se depositó a la profundidad en que se produce el sistema radical secundario y finalmente se adicionaron 250 g del sustrato. La rizobacteria se aplicó a los 30 días de la plantación utilizando 1 ml de una suspensión con 1x107 ufc/ml de B. subtilis BEB-lSbs (BS-13) (absorbancia 0,1 a 535 nm) por contenedor, donada por el Laboratorio de Bioquímica Ecológica del CINVESTAV IPN, Unidad Irapuato, que ha demostrado inducir el desarrollo de la planta (Cárdenas-Flores et al., 2007). Las plantas fueron regadas con 100 ml de agua destilada cada cuatro días a partir de la plantación y fertilizadas semanalmente con 200 ml por maceta de la solución nutritiva Long Ashton (LANS), la cual se ajustó al nivel de fósforo según el tratamiento (Hewitt, 1966).
Los 12 tratamientos (combinación de cada nivel de los tres factores en estudio) fueron evaluados en un diseño experimental completamente al azar, con arreglo factorial 2x3x2; en el factor A se consideraron plantas con y sin G. fasciculatum, en el factor B se evaluaron tres niveles de fósforo en LANS (0,22 y 44 μg/ml) y en el factor C se incluyeron plantas con y sin B. subtilis. Para altura de planta y diámetro del tallo se utilizaron 10 repeticiones por tratamiento, y cada contenedor con una planta fue una unidad experimental.
Las variables evaluadas fueron: altura de planta (cm), diámetro del tallo (mm), días a antesis (siete repeticiones), período de floración (días, 10 repeticiones), vida de la flor (días, 15 repeticiones), diámetro de la flor (cm, 10 repeticiones), ancho de pétalo (cm, 30 repeticiones), colonización de raíz por G. fasciculatum (se determinó en porcentaje en una muestra de raíces constituida por tres repeticiones por tratamiento con base en el método descrito por Phillips y Hayman, 1970) y B. subtilis Beb-13 se cuantificó al final del experimento por el método de dilución decimal de vaciado en placa, y se expresó en ufc/g de suelo. Para ello, antes del experimento se realizó una suspensión del sustrato, el cuál se calentó 20 min a 70°C. Se realizaron diluciones decimales seriadas y se sembraron en un medio papa dextrosa agar que se incubó a 37°C durante 48 h. Después de esto se verificó la no existencia de colonias productoras de un pigmento negro, el cual es característico de la cepa B. Subtilis Beb-13. Al final del experimento se cuantificó el B. Subtilis Beb-13, de la misma manera que el sustrato, para lo cual se muestreó suelo de la rizósfera. Se realizaron diluciones decimales seriadas hasta 10-7 y se sembraron por la técnica de dispersión en la superficie en cajas de petri que contenían agar papa dextrosa. Las mismas se incubaron a 37°C por 48 h para después cuantificar las ufc.
También se determinó la concentración en ppm de P, K, Ca, Mg, Fe, Cu, Zn, Mn y B en la parte aérea vegetativa (Alcántar y Sandoval, 1999); la de N se determinó con el método micro Kjeldahl. Para este grupo de variables se utilizaron tres repeticiones por tratamiento. Con un espectrofotómetro de esfera XRite, modelo SP 62 se obtuvieron los valores de tres repeticiones por tratamiento de cromatividad (c) y ángulo Hue o matiz (h) para determinar el color de la flor (Kabelka et al., 2004). La tasa fotosintética, estimada por tres repeticiones por tratamiento, se registró en μmol/m2 s con el sistema portátil (SPF) LI-6400 (LI-COR), a los 115 días de la plantación en horario de 10 am a 12 pm, en tres repeticiones por tratamiento. A los 170 días de plantado el bulbo, después de secarse a 75°C por 72 horas en un horno de circulación forzada (Ríos Rocha, Mod. HSCF), se determinaron los pesos secos de raíz, parte aérea vegetativa y flores empleando siete repeticiones por tratamiento.
Los datos para cada variable se sometieron a un análisis de varianza según el diseño experimental citado previamente. También, para cada variable se compararon las medias de los factores A (G. fasciculatum), B (fósforo) y C (B. subtilis) con la prueba de la diferencia mínima significativa (DMS) a un nivel de significancia del 5%. Los datos de colonización (%) se transformaron a arc sen y los de macroelementos a ppm (Martínez, 1988). Además se usó el análisis de componentes principales, descrito por Sánchez (1995) y por González et al. (2007). Esta metodología multivariada permite la inspección de una matriz de datos para el cálculo de varianzas y correlaciones aproximadas; los tratamientos fueron asignados a las hileras y las variables a las columnas. Su propósito fue reemplazar gráficas individuales de tratamientos, variables o cuadros de coeficientes de correlación, por una gráfica del biplot donde se representó simultáneamente, en no más de dos dimensiones, el mayor porcentaje de la variación de los datos originales. La representación gráfica de los datos permite determinar visualmente si existen patrones entre los tratamientos como resultado de los valores de las variables, qué variables separan los grupos definidos y qué relación existe entre las variables. El análisis de componentes principales y la gráfica del biplot se obtuvieron con el programa desarrollado por Sánchez (1995), escrito en el lenguaje matricial del Sistema de Análisis Estadístico (SAS/IML), desarrollado para computadoras personales que usan sistema operativo DOS.
RESULTADOS
Crecimiento de la planta. Glomus fasciculatum favoreció significativamente la altura de la planta (AP), el diámetro del tallo (DT) y el peso seco de la parte aérea vegetativa (PT) (Tabla 1). En PT, las plantas inoculadas superaron en 16,5% a las no inoculadas. En peso seco de la raíz (PR) también se detectó un efecto significativo y las plantas inoculadas superaron en 67,4% a las no inoculadas. La relación peso seco de raíz/parte aérea (RT) fue significativa y las plantas inoculadas presentaron 36,5% más que el control (Tabla 3). Los efectos del fósforo fueron significativos en PT, PR y RT en dosis de 22 μg/ml (Tabla 4). El mayor valor para DT y PT se encontró en plantas sin B. subtilis Beb-13 (Tabla 5).
Tabla 1. Cuadrados medios, significancia estadística de los valores de F, media aritmética y coeficiente de variación (CV) para las variables vegetativas y de esfuerzo reproductivo.
Table 1. Mean squares, statistical significance of F values, arithmetic mean and coefficient of variation (CV) for the vegetative and flowering traits.

Tabla 3. Efecto de Glomus fasciculatum (Factor A) sobre las variables evaluadas.
Table 3. Effect of Glomus fasciculatum (Factor A) on study variables.

Tabla 4. Efecto del fósforo (Factor B) sobre las variables evaluadas.
Table 4. Effect of phosphorus (Factor B) on study variables.

Tabla 5. Efecto de Bacillus subtilis (Factor C) sobre las variables evaluadas.
Table 5. Effect of Bacillus subtilis (Factor C) on study traits.

Esfuerzo reproductivo. Bacillus subtilis Beb-13 y/o G. fasciculatum afectaron significativamente los días a antesis (A); las interacciones G. fasciculatum x fósforo, fósforo x B. subtilis, y la de los tres factores también fueron significativas (Tabla 1). Se observó una reducción de dos días para alcanzar dicha etapa fenológica. El período de floración (F) también fue afectado estadísticamente por G. fasciculatum x fósforo, y fósforo x B. subtilis. El diámetro de flor (DF) dependió estadísticamente de la aplicación de fósforo, y de G. fasciculatum x fósforo, y fósforo x B. subtilis. El ancho de pétalo (PE) fue la variable más afectada por los tres factores de estudio y por la mayoría de sus interacciones, sólo la interacción entre ambos microorganismos no presentó significancia.
El peso seco de flor (PF) se modificó significativamente por la presencia de la micorriza, del fósforo, G. fasciculatum x fósforo, fósforo x B. subtilis, y por la interacción entre ambos microorganismos. La vida de la flor (VF) estuvo influenciada significativamente por G. fasciculatum, fósforo, B. subtilis, y por las interacciones del fósforo con ambos microorganismos. En la determinación del color de flor, el ángulo Hue o h (CH) estuvo influenciado significativamente por la micorriza, el fósforo, fósforo x B. subtilis, y por la interacción entre ambos microorganismos (Tabla 1).
Colonización. Para la micorriza, los tres factores y las interacciones G. fasciculatum x fósforo y la de ambos microorganismos afectaron significativamente a esta variable (Tabla 1). El tratamiento con micorrizas (CM, 41,2%) superó estadísticamente al de plantas sin inocular (SM, 0%). En fósforo, la dosis de 0 μg/ml (24,5%) superó estadísticamente a las dosis con 22 y 44 μg/ml (22,1 y 15,1%, respectivamente) (Tabla 4). La inoculación con B. subtilis (23,8 %) superó estadísticamente al control (17,4%) (Tabla 5).
Bacillus subtilis fue afectada significativamente por los tres factores y por las cuatro interacciones entre éstos. Las plantas inoculadas presentaron una población de 6,64 x 10-5 ufc por gramo de suelo.
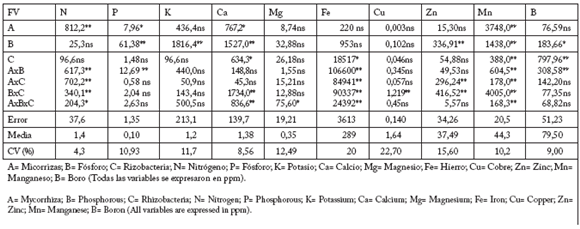
Tasa fotosintética y concentración nutrimental en tallos. Las plantas con G. fasciculatum presentaron una tasa fotosintética neta 19,4% mayor que en las plantas sin inocular, y la interacción micorrizas por fósforo también afectó significativamente a esta variable. La concentración de nitrógeno (N) se relacionó significativamente con la ausencia de la micorriza y con las cuatro interacciones entre los tres factores. La concentración significativa de fósforo en tallos (P) se atribuyó a G. fasciculatum, fósforo, y a la interacción entre éstos, pero hubo menor concentración de N y P en plantas con G. fasciculatum. Para potasio (K) sólo la aplicación de fósforo tuvo un efecto significativo. Para calcio (Ca), los tres factores, fósforo x B. subtilis, y G. fasciculatum x fósforo x B. subtilis tuvieron efectos significativos. Para magnesio (Mg) sólo G. fasciculatum x fósforo x B. subtilis fue significativa. En hierro (Fe) hubo un efecto significativo de B. subtilis y de las cuatro interacciones entre los tres factores. Fósforo x B. subtilis produjo un efecto significativo sobre la concentración de cobre (Cu). La concentración del zinc (Zn) fue afectada significativamente por la aplicación de fósforo y por las interacciones entre B. subtilis con G. fasciculatum y con fósforo. El manganeso (Mn) fue afectado estadísticamente por cada uno de los tres factores y por sus cuatro interacciones (Tabla 2). Las plantas sin inocular superaron estadísticamente a las no inoculadas (Tabla 3). Con relación a B. subtilis, la concentración de Mn en plantas inoculadas fue diferente estadísticamente al de las plantas control (Tabla 5). También hubo un efecto significativo del fósforo, B. subtilis y G. fasciculatum x fósforo en la concentración de boro (B) (Tabla 5).
Tabla 2. Cuadrados medios, significancia estadística de los valores de F. media aritmética y coeficiente de variación (CV) para las variables de concentración nutrimental.
Table 2. Mean squares, statistical significance of F values, arithmetic mean and coefficient of variation (CV) for the nutrient concentration.
Análisis de componentes principales (tratamiento x variable). Esta metodología multivariada explicó el 51,1% de la variación original en los componentes principales 1 (CP1; 35,8%) y 2 (CP2; 15,3%); el CP3 contribuyó con 10,2% (Tabla 6). Los tratamientos T10 (sin G. fasciculatum, 22 μg/ml de P, sin B. subtilis) y T11 (sin G. fasciculatum, 44 μg/ml de P, con B. subtilis), con valores negativos, y T3 (G. fasciculatum, 22 μg/ml de P, con B. subtilis) con valores positivos, explicaron la mayor variabilidad asociada al CP1. La variabilidad representada en el CP2 se asoció negativamente con T1 (G. fasciculatum, 00 μg/ml de P, con B. subtilis), T6 (G. fasciculatum, 44 μg/ml de P, sin B. subtilis) y T8 (sin G. fasciculatum, 00 μg/ml de P, sin B. subtilis), y positivamente con T12 (sin G. fasciculatum, 44 μg/ml de P, sin B. subtilis) y T9 (sin G. fasciculatum, 22 μg/ml de P, con B. subtilis) (Fig. 1).
Tabla 6. Valores característicos de algunos de los componentes principales, y su contribución a la variabilidad total original.
Table 6. Characteristic values of some of the main components and their contribution to total original variability.

Fig. 1. Interrelación entre los 12 tratamientos asociados a la aplicación de G. fasciculatum, fósforo y B. subtilis y las 25 variables registradas en Lilium cv Showwinner.
Fig. 1. Interrelationship among 12 treatments associated with the application of G. fasciculatum, phosphorus, and B. Subtilis in relation to 25 study traits in Lilium sp. cv Showwinner.
En el biplot también se detectó correlación positiva entre vida de la flor (VF), peso seco de raíz (PR), ancho de pétalo (PE), relación peso seco de raíz/peso seco de la parte aérea vegetativa (RT), diámetro de la flor (DF), y Ca, Cu, Mg, B, K y P, con valores positivos en los CP1y CP2. Nitrógeno (N), días a antesis (A) y color de la flor croma (CC), con correlaciones positivas, presentaron valores negativos en la CP1 y positivos en la CP2. En ambas coordenadas negativas de los CP1 y CP2 sólo se identificó a manganeso (Mn). Tasa fotosintética (TF), diámetro del tallo (DT), peso seco de la flor (PF), peso seco de la parte aérea vegetativa (PT), color de la flor ángulo Hue (CH), colonización en raíz por G. fasciculatum (C), Fe, Zn, altura de planta (AP) y período de floración (F), con correlaciones positivas, tuvieron coordenadas positivas en el CP1 y negativas en el CP2 (Fig. 1).
El tratamiento T3 (G. fasciculatum, 22 μg/ml de P, con B. subtilis) mostró correlación positiva con la mayoría de las variables y con T4 (G. fasciculatum, 22 μg/ml de P, sin B. subtilis), T5 (G. fasciculatum, 44 μg/ml de P, con B. subtilis) y T6 (G. fasciculatum, 44 μg/ml de P, sin B. subtilis); T4 interaccionó positivamente con K, P, Mg, Cu, Ca DF, RT, VF, PE y PR, mientras que T5 y T6 se correlacionaron positivamente con Fe, CH, AP, C, F, DT, Zn, TF, PF y PT. Los tratamientos T2 (G. fasciculatum, 00 μg/ml de P, sin B. subtilis), T9, T10, T11 y T12 se correlacionaron positivamente con A, CC y N. También hubo correlación positiva entre T7 (sin G. fasciculatum, 00 μg/ml de P, con B. subtilis), T1 y T8 con Mn (Fig. 1).
DISCUSIÓN
Indicadores de crecimiento. La promoción del crecimiento originada por G. fasciculatum, coincide con los resultados de Ames y Linderman (1978) y Anushri et al. (2002), quienes señalaron que los hongos MA favorecen el crecimiento en Lilium sp. El mayor peso seco de raíz que se registró podría estar relacionado con el incremento que los hongos MA provocan en el sistema radical de las plantas, y que en conjunto con el abundante micelio intra y extraradical que desarrollan, constituye un enlace entre las plantas y el suelo (Barea et al., 2005). Se ha comprobado que la inoculación de las plantas con hongos MA incrementa la absorción y movilización de agua y algunos nutrientes como P, N, Mg, Ca y Zn (Azcón et al., 2008; Capellazo et al., 2008), y la síntesis de reguladores de crecimiento (Artursson et al., 2006). Debido a esto, con la micorrización es factible la sustitución, al menos parcial, de los fertilizantes minerales. El efecto causado por B. subtilis coincide con lo reportado por Mena-Violante y Olalde-Potugal (2007), quienes no detectaron diferencias en parámetros biométricos de la parte aérea en Lycopersicon esculentum Mill. Sin embargo, dicho efecto difiere del informado por Cárdenas-Flores et al. (2007), quienes demostraron la capacidad de promoción de crecimiento de B. subtilis Beb-13, en Tagetes erecta L, por su participación en la síntesis de auxinas y en la secreción de pequeños péptidos de actividad deaminasa (ACC) (Jiménez-Delgadillo, 2004). Esta respuesta podría deberse a una marcada diferencia del efecto de los HMA y las PGPR, dependiendo de la cepa del microorganismo utilizado, la especie vegetal inoculada y las condiciones del clima y suelo (Marulanda et al., 2009).
Esfuerzo reproductivo. Los resultados mostraron que las plantas de Lilium, híbrido oriental, ‘Showwinner' tuvieron efectos positivos en el ancho de pétalo, peso seco de la flor, color de la flor (ángulo Hue) y vida de la flor (PE, PF, CH, VF), cuando fueron inoculadas con G. fasciculatum. Estos resultados pueden atribuirse a un mejoramiento del estado nutrimental, pero Aboul-Nasr (1996) encontró que independientemente de esto, G. etunicatum incrementó en 34% el número de flores producidas por T. erecta, lo cual podría deberse a cambios en la actividad fotosintética. En el presente trabajo las plantas inoculadas tuvieron una tasa fotosintética 19% mayor que la de las plantas no inoculadas, y adicionalmente, se infiere que hubo un estímulo en la síntesis de hormonas ( Jiménez-Delgadillo, 2004). Lo anterior demuestra que la calidad se mejoró por diferentes vías: el ancho de pétalo permite una mayor vistosidad en flores totalmente abiertas y el incremento en peso seco se asocia a flores de mayor tamaño. El valor superior del ángulo Hue indica mayor intensidad del color rosa, relacionado con mayor concentración de antocianinas (Schwinn y Davies, 2004). La mayor vida de la flor causada por G. fasciculatum se traduce en un mayor tiempo para la comercialización de Lilium, híbrido oriental, ‘Showwinner'. Bacillus subtilis favoreció el ancho de los pétalos y la vida de la flor, efectos que podrían atribuirse a su modo de acción ( Jiménez-Delgadillo, 2004). Ambos microorganismos interactuaron favorablemente sobre la fenología de la planta, al reducir su tiempo de estancia en invernadero, logrando un nivel de producción y calidad adecuado con menor suministro de fertilizantes minerales. Cárdenas-Flores et al. (2007) trabajaron en T. erecta con ambos microorganismos y obtuvieron respuesta favorable a B. subtilis, mientras que Mena-Violante y Olalde-Portugal (2007) trabajaron con el mismo microorganismo en Lycopersicon esculentum Mill. y concluyeron que hubo mejoras en calidad del fruto e incrementos en rendimiento.
Colonización. La colonización en raíz de Lilium, híbrido oriental, ‘Showwinner' causada por G. fasciculatum fue influenciada por el fósforo y por B. subtilis; estos resultados coinciden con los de Ames y Linderman (1978), quienes estudiaron Lilium longiflorum thumb y encontraron que la fertilización afectó esta variable. Anushri et al. (2002) evaluaron tres hongos MA en cuatro niveles de P en plantas micropropagadas de Lilium sp., y detectaron que la colonización micorrizica disminuyó al incrementarse la concentración de P. Esto fue debido al estrés que altera el número de esporas, el desarrollo del tubo germinativo, la ramificación y longitud de hifas extraradicales y la cantidad de hifas que penetran la raíz (Gaur y Adholeya, 2005).
Concentración nutrimental. La diversidad en funciones que presentan ambos microorganismos podría ser responsable de las diferencias que se observaron en la concentración nutrimental en tallos de Lilium híbrido oriental, ‘Showwinner'. Las plantas inoculadas con B. subtilis Beb-13 con mayores concentraciones de Mn y B, podrían explicarse por una mayor afinidad entre la bacteria y los exudados de la planta, como lo sugirieron Vivas et al. (2003). La menor concentración de Ca y Fe que hubo en plantas inoculadas podría estar relacionada con su participación en la mayor vida de la flor y en la producción de sideróforos (Vessey, 2003; Artursson et al., 2006). Con relación a la concentración significativa de N, P, Ca, y Mn que se observó en plantas inoculadas con G. fasciculatum, para Ca se detectaron concentraciones mayores que en el control y en el resto hubo un comportamiento inverso. Estos resultados podrían atribuirse a un mayor consumo de estos elementos en plantas inoculadas durante el crecimiento vegetativo y reproductivo, o bien a su empleo para la formación de nuevos bulbillos. Scagel (2004) trabajó con Sparaxis y señaló que una cantidad importante de K, N y P son destinados a la formación e incremento en el tamaño de bulbos hijos. La rizobacteria también favorece la micorrización e incrementa la capacidad de absorción de la raíz (Vessey, 2003; Marulanda et al., 2009); esto explica la interacción G. fasciculatum x B. subtilis significativa que se observó en N, Fe, Zn y Mn. Estos resultados sugieren la existencia de simbiosis entre ambos microorganismos en la asimilación de estos elementos.
Análisis de componentes principales (tratamiento por variable). En el biplot (Fig. 1) se aprecia que el mejor tratamiento fue T3 (G. fasciculatum, 22 μg/ml de P, con B. subtilis), seguido de T4 (G. fasciculatum, 22 μg/ml de P, sin B. subtilis), T5 (G. fasciculatum, 44 μg/ml de P, con B. subtilis) y T6 (G. fasciculatum, 44 μg/ml de P, sin B. subtilis), que contribuyeron a la mejor expresión de 20 de las 25 variables evaluadas; las variables y los tratamientos del mismo sector tienen una estrecha relación.
De las 25 variables analizadas, el peso seco (PF), la vida (VF) y color de la flor (CH), y el período de floración (F) están vinculadas a una mejor calidad comercial; a mayor tamaño de flor mayor peso seco de este órgano. Una mayor intensidad en el color se refleja en flores con mayor pigmentación; a mayor vida de la flor, se amplía el rango en que las flores presentan condiciones aceptables para su comercialización. El incremento en el período de floración señala mayor tiempo en que las plantas florecen. Los resultados observados en el presente estudio concuerdan con los de Cárdenas-Flores et al. (2007) quienes trabajaron con los mismos inóculos en T. erecta y detectaron mejoras significativas en la calidad de la flor. La micorrización favorece una mayor superficie y capacidad de absorción y ambos constituyen un importante mecanismo para el uso de nutrimentos; la rizobacteria favorece un mayor grado de micorrización, solubiliza nutrimentos como P (Artursson et al., 2006), secreta pequeños péptidos de actividad deaminasa (ACC) y sintetiza auxinas (Jiménez-Delgadillo, 2004). Estos resultados se explican por las estrechas correlaciones que se observaron entre las variables señaladas con peso seco de raíz y peso seco de raíz/parte aérea vegetativa. Estas correlaciones también sugieren una mayor colonización por G. fasciculatum en presencia de B. subtilis, y una mejora en la tasa fotosintética, como lo indicó Aboul-Nasr (1996).
La mayor colonización (56,1%) se asoció a G. fasciculatum con 00 μg/ml de P y con B. subtilis, seguido por G. fasciculatum con 22 μg/ml de P y con B. subtilis (51,2%). Estos resultados coinciden con los de Ames y Linderman (1978) y Anushri et al (2002), quienes señalaron que una mayor colonización se asoció a niveles medios de P. La interacción favorable entre ambos microorganismos, en ausencia de P, podría relacionarse con la habilidad de B. subtilis para solubilizar P del suelo (Artursson et al., 2006). Estos resultados asociados a la coinoculación con ambos microorganismos, sugieren un efecto de sinergismo, o de interacción benéfica, ya que la colonización de las raíces por los hongos estimula el flujo de carbohidratos desde el follaje hasta la raíz, los que por exudación pueden constituirse en fuente de carbono para el crecimiento de la bacteria (Barea et al., 2005). Las hormonas y péptidos producidos por la bacteria (Jiménez-Delgadillo, 2004) pueden estimular la germinación y el crecimiento hifal de los HMA, favoreciendo la incorporación del P solubilizado por la bacteria (Barea et al, 2005; Artursson et al., 2006).
La estrecha correlación entre Zn con variables de crecimiento y calidad de flor y con los mejores tratamientos (T3 y T5), puede atribuirse a su participación como componente esencial y activador de numerosas enzimas y proteínas, además de mantener la integridad estructural de biomembranas, presentar actividad antioxidante, y participar en la producción de ácido indolacético y en la biosíntesis de clorofila (Clark y Zeto, 2000). Estos efectos favorecen una mayor tasa fotosintética. Los resultados obtenidos destacan la importancia de este elemento en la producción de Lilium sp., y dejan abierta la posibilidad de otros estudios para verificar estas interrelaciones en este cultivo, o para iniciar investigaciones similares en otras especies ornamentales.
REFERENCIAS
1. Aboul-Nasr, A. (1996). Effects of vesicular-arbuscular mycorrhiza on Tagetes erecta and Zinnia elegans. Mycorrhiza 6: 61-64. [ Links ]
2. Alcántar, G.G. y M.V. Sandoval (1999). Manual de análisis químico de tejido vegetal. Publicación Especial 10. Sociedad Mexicana de la Ciencia del Suelo, A. C. Chapingo, México. [ Links ]
3. Ames, R.N. y R. G. Linderman (1978). The growth of Easter lily (Lilium longiflorum) as influenced by vesicular-arbuscular mycorrhizal fungi, Fusarium oxisporum and fertility level. Canadian Journal of Botany 56: 2773-2780. [ Links ]
4. Anónimo (2007). Lily picture book cut flower & potted lilies. Second Edition. International Flower Bulb Centre. Hillegom-Holand. 159p. [ Links ]
5. Anushri, V., M.P Sharma, A. Adholeya, V. Dhawan y P.S. Srivastava (2002). Enhanced growth of micropropagated bulblets of Lilium sp. inoculated with arbuscular mycorrhizal fungi at different P fertility levels in an alfisol. Journal of Horticultural Science & Technology 77: 258-263. [ Links ]
6. Artursson, V., R.D. Finlay y J.K. Jansson (2006). Interaction between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environmental Microbiology 8: 1-10. [ Links ]
7. Azcón, R., R. Rodríguez., E. Amora-Lazcano y E. Ambrosano (2008). Uptake and metabolism of nitrate of mycorrhiza plants as affected by water availability and N concentration in soil. European Journal of Soil Science 59: 131-138. [ Links ]
8. Bañón, A.S., R.D. Cifuentes., B.G. González. y H.I. Fernández (1993). Lilium. In: pp. 71-158. Gerbera, Lilium, Tulipán y Rosa. Segunda edición. Ediciones Mundi Prensa. Madrid, España. 412 p. [ Links ]
9. Barea, J.M., J.M. Pozo, R. Azcón y C. Azcón-Aguilar (2005). Microbial co-operation in the rhizosphere. Journal of Experimental Botany 56: 1761-1778. [ Links ]
10. Bhoopander, G., G.P. Huong, R. Kumari, R. Prasad y A. Varma (2005). Microbial diversity in soils. In: Buscot, F. and Varma, A. (eds), pp.19-55. Microorganisms in soils: Roles in Genesis and functions. Springer. Germany. 419 p. [ Links ]
11. Cappellazzo, G., L. Lanfranco, M. Fitz, D. Wipf y P. Bonfante (2008). Characterization of an amino acid permease from the endomycorrhizal fungus Glomus mosseae. Plant Physiology 147: 429-437. [ Links ]
12. Cárdenas-Flores, A., A. Estrada-Luna y V. Olalde-Portugal (2007). Yield and quality enhancement of marigold flower by inoculation with Bacillus subtilis and Glomus fasciculatum. Journal of Sustainable Agriculture 31: 21-31. [ Links ]
13. Clark, R.B. y S.K Zeto (2000). Mineral acquisition by arbuscular mycorrhizal plants. Journal of Plant Nutrition 23: 867-902. [ Links ]
14. Gaur, A. y A. Adholeya (2005). Diverse response of five ornamental plant species to mixed indigenous and single isolate arbuscular mycorrhizal inocula in marginal soil attended with organic matter. Journal of Plant Nutrition 28: 707-723. [ Links ]
15. González, H.A., L.M. Vázquez G., J. Sahagún C., J.E. Rodríguez P. y D.J. Pérez L. (2007). Rendimiento del maíz de temporal y su relación con la pudrición de mazorca. Revista Agricultura Técnica en México 33: 33-42. [ Links ]
16. Hewitt, E.J. (1966). Sand and water culture methods used in the study of plant nutrition. Agricultural Bureaux of Horticulture. Technical Communication. 2 nd edition. No. 22. Commonwealth, London. [ Links ]
17. Jeffries P., S. Gianinazzi, S. Perotto, K. Rutnau y J.M. Barea (2003). The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and Fertility of Soils 37: 1-16. [ Links ]
18. Jiménez-Delgadillo, R (2004). Péptidos secretados por Bacillus subtilis que modifican la arquitectura de la raíz de Arabidopsis thaliana. Ph. D. Thesis. CINVESTAV- Irapuato, Irapuato, Gto, Méx. [ Links ]
19. Kabelka, E., W. Yang y D.M. Francis (2004). Improved tomato fruit color within an inbred backcross line derived from Lycopersicum sculentum and L. hirsutum involves the interaction of loci. Journal of the American Society for Horticultural Science 129: 250-257. [ Links ]
20. Maier, W., J. Schmidt, M. Nimtz, V. Wray y D. Strack (2000). Secondary products in micorrhyzal roots of tobacco and tomato. Phytochemistry 54: 473-479. [ Links ]
21. Martínez, G.A. (1988). Diseños experimentales, métodos y elementos de teoría. 1ª ed. Trillas, México. 756p. [ Links ]
22. Marulanda, M., J.M. Barea y R. Azcón (2009). Stimulation of plant growth and drought tolerance by native microorganism (AM fungi and bacteria) from dry environment. Mechanism related to bacterial effectiveness. Journal of Plant Growth Regulation 28: 115-124. [ Links ]
23. Mena-Violante, H.G. y V. Olalde-Portugal (2007). Alteration of tomato fruit quality by root inoculation with plant growth-promoting rhizobacteria (PGPR): Bacillus subtilis BEB-13bs. Scientia Horticulturae 113: 103-106. [ Links ]
24. Phillips, J.M. y D.S. Hayman (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of interaction. Transactions of the British Mycological Society 55: 158-161. [ Links ]
25. Sánchez G., J.J. (1995). El análisis biplot en clasificación. Revista Fitotecnia Mexicana 18: 188-203. [ Links ]
26. Scagel, C.F. (2004). Inoculation with vesicular arbuscular mycorrhizal fungi and rhizobacteria alters nutrient allocation and flowering of harlequin flower. Hortechnology 14: 39-47. [ Links ]
27. Schwinn, K. y K.M. Davies (2004). Flavonoids In: Kevin Davies (ed), pp. 92-107. Plant pigment and manipulation. Annual Plant Reviews vol 14. Edit Board. New Zealand 410 p. [ Links ]
28. Simmonne, E.H. y C.M. Hutchinson (2005). Controlled released fertilizer for vegetable production in the Era of best management practices. Hortechnology 15: 36-46. [ Links ]
29. Vessey, J.K. (2003). Plant growth promoting rhizobacteria as biofertilizers. Plant and soil 255: 571-586. [ Links ]
30. Vivas, A., A. Marulanda, J.M. Ruíz-Lozano, J.M. Barea y R. Azcón (2003). Influence of a Bacillus sp. on physiological activities of two arbuscular mycorrhyzal fungi on plant responses to PEGinduced drought stress. Mycorrhyza 13: 249-256. [ Links ]















