Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Phyton (Buenos Aires)
versão On-line ISSN 1851-5657
Phyton (B. Aires) vol.79 no.1 Vicente López jan./jun. 2010
ARTÍCULOS ORIGINALES
Anatomía vegetativa comparativa entre Chloridoideae (Poaceae) halófilas de importancia forrajera
Comparative vegetative anatomy between halophytic Chloridoideae (Poaceae) with forage importance
1 Laboratorio de Plantas Vasculares. Departamento de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur. San Juan 670. 8000. Bahía Blanca, Buenos Aires. Argentina.
Address Correspondence to: Vanesa Pérez Cuadra, e-mail: vperezcuadra@uns.edu.ar
Recibido - Received 29.III.2010.
Aceptado - Accepted 19.IV.2010.
Resumen. Trichloris crinita y Pappophorum phillippianum vegetan en zonas donde forrajeras tradicionales no pueden hacerlo. No son recursos alimenticios por excelencia, pero poseen cierto valor nutricional para la alimentación animal. Hojas y tallos de estas especies, colectados en un ambiente halófilo natural, fueron tratados bajo técnicas corrientes para la descripción de sus características epidérmicas y anatómicas. Las láminas de ambas especies presentan epidermis adaxiales papilosas, solo la abaxial de T. crinita también lo es. Se observan cuerpos silíceos en forma de hache o doble hache. Ambas especies presentan tricomas foliares glandulares y eglandulares, aguijones sólo T. crinita. Anatómicamente las dos especies poseen paquetes de fibras hacia adaxial y abaxial, que pueden interrumpir las vainas de los haces. Los haces vasculares de primer orden poseen vaina mestomática y parenquimática, mientras que los de segundo orden sólo vaina parenquimática. El clorénquima es radiado. T. crinita presenta una costilla media hacia abaxial con parénquima incoloro, P. phillippianum no la posee. Los tallos, de sección circular, poseen costillas, más notorias en P. phillippianum. Las epidermis caulinares presentan cuerpos silíceos de diferentes formas y sólo P. phillippianum tricomas bicelulares. Se observan paquetes de fibras subepidérmicos, más importantes en T. crinita, que alternan con clorénquima. Hacia el interior, ambas especies presentan una banda de parénquima esclerosado, donde se localiza un anillo de haces vasculares con media vaina parenquimática externa. Dos anillos más de haces se encuentran hacia el interior en el parénquima, que completa la estructura caulinar. La cantidad de tejidos esclerosados en láminas y tallos reducirían la digestibilidad de estas especies. Sin embargo, la posibilidad de utilizarlas como forrajeras, donde otras no pueden vegetar, destaca su importancia económica.
Palabras clave: Chloridoideae; Poaceae; Halófilas; Especies forrajeras.
Abstract. Pappophorum phillippianum and Trichloris crinita grow in areas where traditional forages cannot establish. They are not food resources for excellence, but have some nutritional value to domestic livestock. Leaves and stems collected in a natural halophytic field were treated using current techniques for describing their epidermic and anatomical characteristics. Blades of both species have papillose adaxial epidermis, and it is also the case for the abaxial epidermis in T. crinita. Silica bodies are double-axe shaped or cross shaped. Both species show foliar glandular and eglandular trichomes. Only T. crinita shows prickles. Anatomically, both species show groups of fibers in the adaxial and abaxial sides. This can interrupt the sheaths of the vascular bundles. The first-order vascular bundles have a mestome and a parenchymatic sheath, while the second order ones only show the parenchymatic sheath. The chlorenchyma is radiated. Trichloris crinita has a middle rib towards the abaxial side with colorless parenchyma. Pappophorum phillippianum does not have it. The stems, which are circular, have ribs that are more important in P. phillippianum. The stem epidermis has silica bodies of different shapes, and P. phillippianum shows bicellular trichomes. There are subepidermic groups of fibers, more important in T. crinita, which alternate with chlorenchyma. Both species have a band of sclerenchymatic parenchyma within an inner position. This is where a ring of vascular bundles, with an outer half parenchymatic sheath, is located. Two more rings of bundles are found in the inner parenchyma, which complete the stem structure. The amount of sclerenchyma in leaves and stems reduces the digestibility of these species. However, the possibility of using them as forage, where other species cannot vegetate, enhances their economic importance.
Keywords: Chloridoideae; Poaceae; Halophyte; Forage species.
INTRODUCCIÓN
El hombre ha mejorado genéticamente algunas especies vegetales por la necesidad de contar con plantas que se adapten a distintas condiciones ambientales y produzcan una mayor cantidad y calidad de forraje. Esto ha separado a las plantas forrajeras en dos grandes grupos: las cultivadas y las espontáneas (Bianco et al., 2004). La mayor parte de las plantas utilizadas como forraje para el ganado corresponden a las Fabaceae y Poaceae. En este último caso, la masa de forraje que consume el ganado, dependiendo del estado fenológico del vegetal, está compuesta principalmente por láminas y vainas foliares (Bianco et al., 2004; Saint Pierre et al., 2004; Saint Pierre y Busso, 2006).
Dentro de las Poaceae, la subfamilia Chloridoideae Rouy incluye una gran cantidad de especies de distribución mundial, especialmente en ambientes xerófilos propios de sabanas o campos salitrosos (Nicora y Rúgolo de Agrasar, 1987; Peterson et al., 2007). En Argentina, Brasil, México y USA se encuentran más del 20% de las especies de Chloridoideae del Nuevo Mundo, con gran cantidad de endemismos (Peterson et al., 2007).
Las especies de la Tribu Chlorideae Kunth son plantas anuales o perennes, cespitosas, estoloníferas o rizomatosas, de láminas planas, convolutas o conduplicadas, con inflorescencias formadas por una o varias espigas o racimos espiciformes unilaterales. Se caracterizan por presentar una anatomía foliar de tipo cloridoide, células silíceas en forma de hache, hacha, doble hacha o halterio, y pelos bicelulares. Son comunes en regiones tropicales, subtropicales o templado-cálidas, en general de tierras secas o con suelos altos o salobres. Las especies del género Trichloris Fourn. Ex Benth. son plantas perennes, cespitosas o robustas (Nicora y Rúgolo de Agrasar, 1987). Trichloris crinita (Lag.) Parodi es común en el sur de USA, México, Paraguay, Bolivia y la Argentina. Vegeta en campos abiertos o en montes más o menos cerrados, en general en suelos arcillosos e inundables, siendo de ciclo estival (Burkart et al., 1969; Cabrera, 1970). Es una especie bien apetecida por el ganado y considerada buena forrajera (Giorgetti et al., 1997), habiéndose ensayado su cultivo (Nicora y Rúgolo de Agrasar, 1987).
Las especies de la Tribu Pappophoreae Kunth son plantas anuales o perennes, de hojas con láminas planas o convolutas, con inflorescencias en forma de panojas laxas o contraídas, a menudo espiciformes. Presentan anatomía foliar tipo cloridoide. Habitan regiones tropicales, subtropicales y templado-cálidas. Las especies del género Pappophorum Schreber son plantas que forman matas de cañas erectas (Nicora y Rúgolo de Agrasar, 1987). Estas especies vegetan en regiones cálido-secas, siendo forrajeras de reducido valor pero de interés en regiones semiáridas y de suelos salobres (Burkart et al., 1969). Pappophorum phillippianum Parodi se encuentra en sabanas y bosques abiertos, prefiriendo suelos arcillosos y salobres, es de ciclo estival y apetecida por el ganado, (Burkart et al., 1969, Cabrera, 1970; Nicora y Rúgolo de Agrasar, 1987).
Los estudios anatómicos en especies vegetales de importancia forrajera son importantes como punto de partida al momento de evaluar sus condiciones de digestibilidad, ya queésta depende, en parte, de las características estructurales de los tejidos foliares (Bianco et al., 2004).
Trichloris crinita y P. phillippianum son especies capaces de vegetar en regiones donde las forrajeras cultivadas usuales no siempre pueden hacerlo y por lo tanto son utilizadas como forraje ocasional. Por esto resulta de interés el estudio anatómico de las mismas, como inicio de futuros ensayos de mejoramiento y utilización como posibles forrajeras cultivadas, aprovechando su capacidad natural de vegetar en ambientes hostiles.
MATERIALES Y MÉTODOS
Las especies estudiadas habitan en el Salitral de la Vidriera (Part. de Villarino), situado aproximadamente a 30 kilómetros de la ciudad de Bahía Blanca, Prov. Buenos Aires, Rep. Argentina. Éste es un ambiente halófilo natural donde ambas especies vegetan espontáneamente. Los muestreos fueron realizados durante marzo y mayo de 2009.
Se tomaron muestras de la parte media de hojas de innovación estéril (Ellis, 1976) y de la zona media del entrenudo de tallos maduros. Todas las muestras fueron fijadas en formolácido acético-alcohol (FAA).
Se utilizó la técnica de Metcalfe (D´Ambrogio de Argüeso, 1986) para obtener ambas epidermis foliares y la caulinar; se agregó glicerina fenolada para caracterizar los cuerpos silíceos y se montó en gelatina glicerinada.
Para la descripción anatómica, las muestras fueron deshidratadas en una serie de concentración creciente de alcohol etílico-alcohol butílico terciario, infiltradas en parafina e incluidas en Paramat. Se realizaron cortes transversales de 10 μm de espesor con micrótomo rotativo. Se tiñeron con safraninafast green y se montaron con bálsamo de Canadá.
Todas las observaciones se efectuaron con microscopio óptico y se registraron mediante microfotografías.
RESULTADOS
HOJA
Epidermis adaxial vista en superficie
Trichloris crinita
Presenta células largas de paredes delgadas y onduladas (Fig. 1 A), con algunas papilas sólo en la región intercostal. Las células silíceas, en forma de doble hacha, pueden ser solitarias o estar apareadas con células suberosas (Fig. 1 A). Los estomas, con células anexas triangulares, se ubican en las zonas intercostales donde también se observan tricomas glandulares bicelulares y eglandulares unicelulares de extremo agudo. Los últimos presentan un cojinete basal de células redondeadas a ovaladas, de paredes lisas y de similar grosor que las células largas. En las zonas costales se encuentran aguijones de variados tamaños (Fig. 1 A), de paredes levemente esclerosadas y cuya barba, en los de mayor tamaño, puede superar el largo de la base del mismo, o ser más corta en los más pequeños.
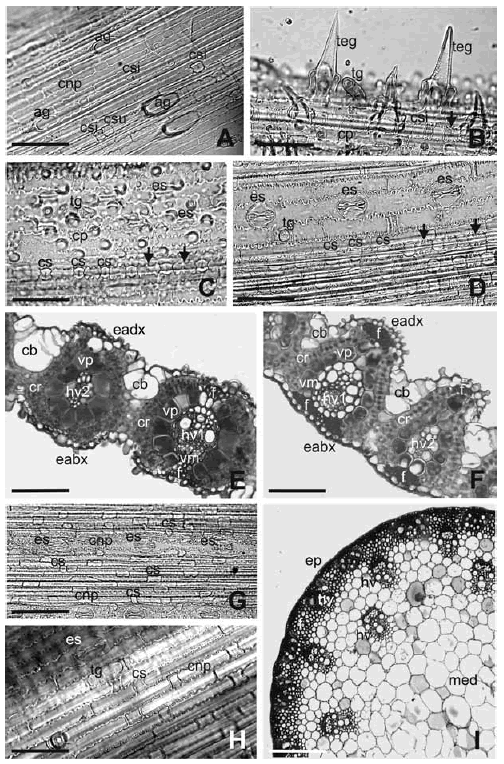
Fig. 1. Anatomía vegetativa comparativa entre T. crinita y P. phillippianum.
A-F Hoja. A-B, Epidermis adaxial vista en superficie; C-D, Epidermis abaxial vista en superficie; E-F, Sección transversal. G-I Tallo. G-H, Epidermis vista en superficie; I, Sección transversal. A, C, E, G e I T. crinita; B, D, F y H P. phillippianum. A: 57,4 μm; B: 42,3 μm; C: 37,7 μm; D: 53 μm; E: 58,2 μm; F: 72,1 μm; G: 57,5 μm; H: 48,1 μm; I: 121,5 μm.
Abreviaturas: ag: aguijón; cb: células buliformes; cnp: célula epidérmica no papilosa; cp: célula epidérmica papilosa; cr: clorénquima radiado; csi: célula silícea; csu: célula suberosa; eabx: epidermis abaxial; eadx: epidermis adaxial; ep: epidermis; es: estoma; f: fibras; hv: haz vascular; hv1: haz vascular de primer orden; hv2: haz vascular de segundo orden; med: médula; tg: tricoma glandular; teg: tricoma eglandular; vm: vaina mestomática; vp: vaina parenquimática.
Las flechas indican células epirdérmicas que acompañan a las silíceas.
Fig. 1. Comparative vegetative anatomy between T. crinita and P. phillippianum.
A-F Leaf. A-B, Adaxial epidermis in surface view; C-D, Abaxial epidermis in surface view; E-F, Transversal section. G-I Stem. G-H, Epidermis in surface view; I, Transversal section. A, C, E, G and I T. crinita; B, D, F and H P. phillippianum. A: 57,4 μm; B: 42,3 μm; C: 37,7 μm; D: 53 μm; E: 58,2 μm; F: 72,1 μm; G: 57,5 μm; H: 48,1 μm; I: 121,5 μm.
Abbreviations: ag: prickles; cb: bulliform cells; cnp: non papillose epidermic cell; cp: papillose epidermic cell; cr: radiate chlorenchyma; csi:silica cell; csu: cork cell; eabx: abaxial epidermis; eadx: adaxial epidermis; ep: epidermis; es: stoma; f: fibers; hv: vascular boundle; hv1: first order vascular boundle; hv2: second order vascular boundle; med: pith; tg: glandular trichoma; teg: eglandular trichoma; vm: mestomatic sheath; vp: parenchymatic sheath.
Arrows indicate epidermic cells accompanying silica cells.
Pappophorum philippianum
Posee células largas de paredes delgadas, levemente onduladas en las zonas costales y más notoriamente onduladas en las intercostales; en ambos casos las células son papilosas (Fig. 1 B). Las células silíceas son en forma de hache (Fig. 1 B) o de doble hacha. No se observan células suberosas, siendo las células epidérmicas que acompañan a las silíceas de menor longitud que las que se ubican en los valles (Fig. 1 B, flechas). En las zonas intercostales se encuentran estomas, que poseen células anexas triangulares. En las zonas costales se observa una gran cantidad de tricomas eglandulares unicelulares de paredes algo engrosadas y extremos agudos (Fig. 1 B). Las células epidérmicas que rodean la base de los mismos presentan grandes papilas que tienen aproximadamente un tercio de la longitud del tricoma (Fig. 1 B). Además de este tipo de tricoma, en zonas costales e intercostales, se observan tricomas glandulares bicelulares (Fig. 1 B), los que son menos abundantes.
Epidermis abaxial vista en superficie
Trichloris crinita
Presenta células largas de paredes onduladas y delgadas, siendo las de la región intercostal notablemente papilosas (Fig. 1 C). Se encuentran células silíceas costales solitarias en forma de doble hacha (Fig. 1 C), las células epidérmicas que las acompañan cumplen lo descripto para la epidermis adaxial de P. phillippianum (Fig. 1 C, flechas). En las zonas intercostales se encuentra una gran cantidad de estomas y tricomas eglandurales unicelulares y glandulares bicelulares similares a los de la cara adaxial. En las zonas costales se observan aguijones de paredes esclerosadas, donde la barba, en general, no supera la longitud de la base del mismo.
Pappophorum philippianum
Posee células largas de paredes levemente engrosadas y onduladas, no papilosas (Fig. 1 D). Se observan células silíceas solitarias en las zonas costales en forma de doble hacha (Fig. 1 D) acompañadas, como ya se mencionó, por células epidérmicas menores en longitud que las restantes (Fig. 1 D, flechas). Los estomas se ubican en las zonas intercostales (Fig. 1 D), presentando iguales características que para la cara adaxial de la lámina. Solo existen tricomas glandulares bicelulares (similares a los ya descriptos), en las zonas intercostales (Fig. 1 D).
Anatomía
Trichloris crinita
La lámina presenta forma de V abierta con una costilla media saliente hacia abaxial y otras menores adaxiales y abaxiales; sus márgenes son redondeados presentando un pequeño paquete de fibras asociado. Todas las costillas son romas (Fig. 1 E). La epidermis adaxial es uniestratificada, formada por células redondeadas a piriformes, cuya pared tangencial externa está engrosada (Fig. 1 E) y presenta una cutícula delgada y lisa. Algunas de las células epidérmicas poseen papilas grandes; observándose una por célula (Fig. 1 E). Los tricomas y aguijones han sido descriptos en el estudio epidérmico. Las células buliformes también presentan un engrosamiento aunque leve en la pared tangencial externa (Fig. 1 E); las paredes radiales son en algunos casos lobadas. Estas células se encuentran, en general, en número de cinco superiores (la central es considerablemente mayor en tamaño llegando a ocupar la mitad del espesor de la lámina) (Fig. 1 E) y una inferior notablemente más pequeña (no siempre presente) ubicada por debajo de la superior central. Los estomas se ubican a nivel epidérmico a los lados de las células buliformes. Las células oclusivas presentan sus paredes tangenciales externas engrosadas. La cámara subestomática es pequeña. En posición subepidérmica hacia adaxial, se observan pequeños paquetes de fibras asociados a las zonas costales; estos paquetes en algunos casos se prolongan hacia la vaina del haz, interrumpiéndola únicamente en los haces vasculares de primer orden (Fig. 1 E). Se observan aproximadamente veintisiete haces vasculares en la lámina, de los cuales siete son de primer orden (seis trabados y uno semitrabado), dieciocho de segundo orden (libres) y dos de tercer orden (libres). Todos los haces vasculares presentan una vaina parenquimática externa formada por células grandes, de paredes delgadas y con cloroplastos dispersos por todo el lumen celular (Fig. 1 E). Sólo los de primer orden poseen, además, una vaina mestomática interna (Fig. 1 E) que presenta engrosamientos muy notorios en la zona que rodea al floema; algunos haces de segundo orden desarrollan una media vaina mestomática en contacto con la región floemática. Se observa clorénquima radiado (Fig. 1 E). La epidermis abaxial es similar a la adaxial solo que en general posee más papilas (Fig. 1 C) que la primera. También los estomas presentan las mismas características citadas para los adaxiales.
La estructura de la costilla media posee algunas diferencias con respecto al resto de la lámina. Debajo de la epidermis adaxial, se observan cinco capas de células parenquimáticas redondeadas, de paredes lobadas e irregularmente engrosadas. Ubicándose hacia abaxial cinco haces vasculares, el central de primer orden y los laterales de segundo orden. El haz central es el único de primer orden semitrabado, como ya se mencionó. Las células buliformes asociados a esta costilla son particularmente de mayor tamaño y presentan características similares a las ya descriptas.
Pappophorum philippianum
La lámina posee forma de U abierta y sus márgenes son redondeados presentando un pequeño paquete de fibras asociado. Se observan costillas adaxiales bien definidas y abaxiales muy poco marcadas (Fig. 1 F). Las costillas asociadas a los haces vasculares de primer orden son romas (Fig. 1 F) mientras que, las asociadas a los de segundo orden, son de extremos agudos. La epidermis adaxial es uniestratificada y está formada por células redondeadas a piriformes que presentan la pared tangencial externa notablemente engrosada (Fig. 1 F), con una cutícula delgada y lisa. Las células epidérmicas presentan papilas (Fig. 1 F) que pueden llegar a ser casi tan anchas como la misma célula y su longitud, también variable, puede alcanzar similar dimensión que la célula que la presenta (células epidérmicas de las costillas de extremos agudos); se encuentra, en general, una por célula, y hasta dos en las regiones costales. Los tricomas presentes se han descripto en el estudio epidérmico. Las células buliformes (que en algunos casos pueden ser también papilosas) presentan un pequeño engrosamiento en la pared tangencial externa (Fig. 1 F); las paredes radiales pueden ser lisas o presentar algunos lóbulos. En general se observan cuatro a siete células buliformes superiores y de una hasta tres inferiores ubicadas por debajo de la célula central superior (la de mayor tamaño) formando una columna uniseriada que se extiende dos tercios del espesor de la lámina hacia abaxial (Fig. 1 F). Los estomas se ubican a nivel epidérmico a los lados de las células buliformes. Las células oclusivas presentan sus paredes tangenciales externas engrosadas. Frecuentemente las papilas de las células anexas forman una cámara epiestomática, siendo la cámara subestomática pequeña. Hacia adaxial, a nivel subepidérmico se observan paquetes de fibras en las zonas costales (Fig. 1 F), que se prolongan hasta las vainas parenquimáticas de cada haz vascular, sin interrumpirlas (Fig. 1 F). El clorénquima es de disposición radiada (Fig. 1 F). Se observan aproximadamente treinta y dos haces vasculares colaterales: nueve de primer orden (semitrabados), veintiuno de segundo orden (libres) y dos de tercer orden (libres). Todos los haces vasculares presentan una vaina parenquimática externa formada por células grandes de paredes delgadas con cloroplastos que llenan el lumen celular (Fig. 1 F). Esta vaina se prolonga hacia adaxial formando una columna bi o triseriada en los haces de primer orden (Fig. 1 F), y uni o biseriada y de mayor longitud en los de segundo orden (Fig. 1 F). Sólo los haces vasculares de primer orden poseen, además, una vaina mestomática interna (Fig. 1 F), cuyas células presentan un escaso engrosamiento parietal. Hacia abaxial la vaina parenquimática está interrumpida por la extensión de paquetes de fibras sólo en los haces vasculares de primer orden (Fig. 1 F). Los haces vasculares de tercer orden, en general no presentan tejido esclerenquimático asociado; eventualmente, pueden observarse unas pocas fibras hacia abaxial. Las células de la epidermis abaxial, de características similares a las de la epidermis adaxial, son no papilosas (Fig. 1 F). Los estomas se encuentran levemente hundidos y sus células oclusivas son de características similares a las de los estomas adaxiales.
TALLO
Epidermis vista en superficie
Trichloris crinita
Presenta células largas de paredes onduladas (Fig. 1 G), siendo las células más angostas en las zonas costales que en las intercostales. En las zonas costales se observan células silíceas solitarias rectangulares con las paredes lisas u onduladas (Fig. 1 G) o en forma de doble hacha típica (Fig. 1 G). En las zonas intercostales se encuentran células silíceas redondeadas solitarias (Fig. 1 G) y estomas similares a los foliares (Fig. 1 G). No se observan tricomas ni aguijones.
Pappophorum philippianum
Presenta células largas de paredes onduladas y engrosadas (Fig. 1 H), siendo las que se encuentran en las zonas costales más angostas que las de las zonas intercostales. Se observan pares sílico-suberosos, tanto en las zonas costales como intercostales, pudiendo encontrarse células silíceas solitarias (Fig. 1 H). Los cuerpos silíceos de las zonas costales son en forma de doble hacha (Fig. 1 H) mientras que los de las intercostales son ovalados o redondeados. Las suberosas son siempre en forma de media luna. Se encuentran estomas en las zonas intercostales (Fig. 1 H), similares a los foliares. Se observan tricomas eglandulares unicelulares de extremos agudos y glandulares bicelulares en las zonas intercostales y sólo glandulares en las zonas costales (Fig. 1 H), encontrándose conjuntamente con aguijones en esta última zona.
Anatomía
Trichloris crinita
El tallo es de sección circular y presenta costillas levemente marcadas (Fig. 1 I). Las células epidérmicas, generalmente cuadrangulares, tienen sus paredes radiales y tangencial externa esclerosadas, cutícula delgada y lisa. Los estomas, en pequeñas depresiones, presentan células oclusivas con la pared tangencial externa engrosada; poseen una cámara subestomática reducida. Se observan paquetes de fibras subepidérmicos, formados por cuatro a cinco capas de fibras. Alternando con ellos se encuentran pequeños paquetes de clorénquima. Hacia el interior y por debajo existe una banda continua de fibras, formada por cuatro a cinco capas de células (Fig. 1 I). Esta vaina en determinados puntos se conecta con los paquetes de fibras subepidérmicos. Inmersos en este tejido esclerenquimático se observan haces vasculares pequeños (Fig. 1 I), con una vaina completa de fibras y una media vaina parenquimática externa (rodeando la región xilemática del haz) (Fig. 1 I) formada por células redondeadas, de paredes delgadas y con cloroplastos centrípetos. Esta vaina está siempre interrumpida por la proyección del paquete de fibras subepidérmico que se enfrenta al haz. A continuación y hacia el interior se encuentra una banda de parénquima levemente esclerosado formado por aproximadamente cuatro a cinco capas de células redondeadas, de paredes lisas o con algunas lobulaciones; las células aumentan de tamaño de manera centrípeta, y presentan espacios intercelulares. En esta zona hay otro anillo de haces vasculares que poseen vaina de fibras y un casquete de fibras hacia el xilema y en algunos casos también hacia el floema (Fig. 1 I). Luego se encuentra una banda de parénquima no esclerosado (Fig. 1 I) formado por células redondeadas de paredes lisas, que, al igual que las del parénquima esclerosado, aumentan de tamaño de manera centrípeta y presentan espacios intercelulares. En esta zona se encuentra un tercer (Fig. 1 I) y, en ocasiones, un cuarto anillo de haces vasculares, de similares características que los que forman el anillo anterior (Fig. 1 I). El parénquima no esclerosado completa la parte central del tallo, constituyendo la médula (Fig. 1 I).
Pappophorum philippianum
El tallo de esta especie sólo presenta algunas diferencias con respecto al de la especie anterior. Los estomas se ubican a igual nivel que las células epidérmicas restantes. Los paquetes de fibras subepidérmicos están formados por dos capas de células mientras que la banda contínua de fibras está formada por seis a siete capas. Las células de las medias vainas parenquimáticas de los haces vasculares más cercanos a la epidermis poseen los cloroplastos dispersos, dicha vaina está interrumpida sólo en algunos casos por una extensión del paquete de fibras que se enfrenta al haz. La banda de parénquima esclerosado está formado por aproximadamente diez capas de células.
DISCUSIÓN
Algunas de las características epidérmicas (tricomas bicelulares glandulares, cuerpos silíceos doble hacha, estomas con células subsidiarias triangulares) y de la anatomía foliar (células buliformes de gran tamaño, clorénquima radiado, endodermis y vaina parenquimática rodeando los haces vasculares mayores) permitieron reconocer a las especies estudiadas como miembros de la tribu Chloridoideae. Sin embargo, es la suma de los caracteres anatómicos encontrados en cada una de ellas lo que permite identificarlas cuando se encuentran en estado vegetativo, momento en el que la morfología externa no resulta suficiente para su determinación taxonómica.
Para una rápida diferenciación entre las especies estudiadas debe enfatizarse la observación de los tricomas eglandulares, que sólo son considerados como caracteres diagnósticos importantes si presentan características particulares poco frecuentes entre las Gramíneas (Ellis, 1979), como el cojinete de la base de los de T. crinita y el "cushion hair" (Ellis, 1979) de los de P. phillipiianum. Los aguijones también resultaron aquí de valor diagnóstico por su restricción a las zonas costales de las hojas de T.crinita.
La existencia y forma de los tricomas glandulares son características de considerable valor sistemático para las Poaceae, siendo especialmente importantes dentro de la subfamilia Chloridoideae (Taleisnik y Anton, 1989). Sin embargo en las Pappophoreae existe cierta controversia sobre la morfología y caracterización de sus tricomas glandulares, ya que algunos autores consideran que en estas especies los tricomas descriptos como glandulares son, en realidad, eglandulares (Ellis, 1979). Stewart (1964) sostiene que algunas especies, como las del género Pappophorum no poseen tricomas glandulares. Según Liphschitz y Waisel (1974) las estructuras secretoras de sal en Poaceae son abundantes cuando la planta está sometida a condiciones salinas, mientras que cuando crecen en condiciones libres de sal (por su carácter de halófitas facultativas) no necesitan secretar ni acumular sal, por lo cual las estructuras secretoras pueden ser confundidas, por ejemplo, con tricomas no secretores. Esta explicación podría colaborar a aclarar la controversia y se aplica a lo que ocurre con las dos especies aquí estudiadas que crecen en condiciones de salinidad (actúan como halófitas estrictas) y por lo tanto poseen tricomas bicelulares glandulares bien diferenciados. En este trabajo se hallaron tricomas glandulares (en hojas de T. crinita y P. phillippianum y en el tallo sólo de la segunda) de características similares a los descriptos por Taleisnik y Anton (1989), pero a diferencia de lo citado por éstas autoras no se observó que la célula apical de éstos se colapsara en ninguna de las dos especies. El estudio de los tricomas secretores es de gran utilidad, ya que en algunos casos, como para ciertas especies de Eragrostis, es posible relacionar el tipo de tricoma glandular presente con las características anatómicas de las vainas parenquimáticas de los haces y la ruta fotosintética que siguen. Sin embargo, las relaciones no siempre son claras existiendo puntos intermedios (Amarasinghe y Watson, 1990). Por otro lado, la existencia de tricomas glandulares en tribus emparentadas posee connotaciones evolutivas ya que implicaría poseer antepasados en común que habitaran en regiones con alta salinidad en el suelo (Liphschitz y Waisel, 1974). De todas maneras este concepto se debe tomar con cuidado, ya que en Dicotiledoneae existen estructuras secretoras de sal en diversas familias no emparentadas, producto de una evolución convergente.
Ambas especies presentaron papilas en al menos una de sus epidermis foliares; en este trabajo se consideró papila a toda proyección epidérmica que no supera un tercio de la longitud de los tricomas no glandulares o que alcanza una longitud máxima equivalente al triple de la altura de la célula que la porta. Las papilas de las células epidérmicas son estructuras particulares y características de determinados grupos de Poaceae, siendo las esclerosadas típicas de pastos de regionesáridas o de hábitats salinos (Ellis, 1979). Se trata de una estrategia adaptativa al ambiente relacionada con una disminución de la pérdida de agua por evaporación. Tanto T. crinita como P. phillipiianum presentaron papilas esclerosadas.
Las células silíceas encontradas (hache o doble hacha) son las típicas de las Chloridoideae (Twiss et al., 1969), por lo que no pueden ser consideradas como caracteres diagnósticos a nivel de género (Madella et al., 2005). La epidermis caulinar de T. crinita presenta cuerpos silíceos rectangulares, considerados atípicos para su tribu y por lo cual podrían tener valor diagnóstico.
Las diferencias en la anatomía foliar más relevantes fueron: la morfología de la sección transversal de la lámina foliar, de las costillas adaxiales y de las células buliformes. Otras diferencias menores fueron: la prolongación de la vaina parenquimática en una columna hacia adaxial, diferencia en el número de haces vasculares, etc.
Las características morfológicas de las células buliformes (ordenamiento, tamaño relativo y forma) han sido reconocidas como caracteres de interés taxonómico especialmente a nivel de especie (Ellis, 1976); en las especies estudiadas mostraron diferencias significativas.
Ambas especies coincidieron en poseer anatomía de tipo cloridoide (clorénquima radiado y haces vasculares primarios con vaina parenquimática externa y mestomática interna), característica típica de las especies que habitan suelos áridos donde el grado de exposición a la luz solar y la intensidad de la misma son elevados. Este tipo anatómico es uno de los más evolucionados y eficientes dentro de las Poaceae (Brown, 1958; Nicora y Rúgolo de Agrasar, 1987).
El estudio caulinar no mostró diferencias significativas para diferenciar ambas especies, excepto por los tricomas que se observaron sólo en la epidermis de P. phillippianum.
Las descripciones epidérmicas resultan de gran utilidad en el análisis de dieta, ya que colaboran con la correcta identificación de las especies, así como también ayudan a realizar estimaciones del consumo de un determinado pasto dentro del total de forraje ingerido. Si bien, en general, el mayor volumen consumido por el ganado lo constituyen láminas y vainas foliares (Bianco et al., 2004), la caracterización de las epidermis caulinares también resulta de importancia, ya que dependiendo de la época del año, los fragmentos de tallos pueden ser una parte importante de la dieta de los herbívoros (Lindström et al., 1998).
Trichloris crinita y P. phillipiianum presentaron una cantidad moderada de tejidos lignificados; estas especies no están citadas como gramíneas tóxicas para el ganado (Parodi, 1950) y pueden vegetar en regiones en las cuales, por las condiciones climáticas y del suelo, otras forrajeras comúnmente cultivadas no pueden hacerlo (Ramos et al., 2004). Esto resalta la importancia de ampliar estudios sobre especies de este tipo, ya que además de poseer características propias que las hacen aprovechables, podrían ser seleccionadas y mejoradas a fin de incrementar sus virtudes y utilidades como cultivos de importancia forrajera y económica. En 1989, Taleisnik y Antón, destacaron el valor de la utilización de especies que son componentes naturales de las pasturas en lugares áridos y semiáridos, como parte de la incorporación de áreas salinas para una utilización agrícola-ganadera sustentable. Más de 10 años después, esta propuesta no solo no ha perdido vigencia sino que se ha revalorizado aún más como consecuencia de las alteraciones en los ciclos de lluvias y elevación de la temperatura, condiciones que convierten zonas productivas en regiones áridas, que comienzan a perder su potencial para actividades agropecuarias.
Estudios recientes (Cavagnaro y Trione, 2007), han demostrado que T. crinita vegeta naturalmente en ambientes abiertos completamente expuestos a la radiación solar, no posee limitaciones de crecimiento, produciendo la misma cantidad y calidad de materia seca que bajo intensidades moderadas de luz. Esto es muy importante ya que se está investigando la posibilidad de usar este tipo de especies en programas de revegetación en regiones áridas, de praderas asociadas con árboles y que estén altamente afectadas por procesos erosivos (Cavagnaro y Trione, 2007).
Los estudios sobre especies vegetales de ambientes hostiles revisten especial importancia en la actualidad debido a los profundos cambios ambientales a los que se enfrenta el hombre; este conocimiento permitiría encontrar aplicaciones y/o utilidades impensadas hasta el momento para estos especimenes.
REFERENCIAS
1. Amarasinghe V. y L. Watson (1990). Taxonomic significance of microhair morphology in the genus Eragrostis Beauv. (Poaceae). Taxon 39: 59-65. [ Links ]
2. Bianco, C.A., T.A. Kraus y A.C. Vegetti (2004). La hoja: morfología externa y anatomía. Universidad Nacional de Río Cuarto, Río Cuarto. 199p. [ Links ]
3. Brown, W.V. (1958). Leaf anatomy in grass systematics. Botanical Gazette 119: 170-178. [ Links ]
4. Burkart, A., J.A. Caro, K.A. Okada, R.A. Palacios, Z.E. Rúgolo de Agrasar, E. Sánchez de García, M. Toursarkissian y N.S. Troncoso de Burkart (1969). Parte II: Gramíneas. La Familia botánica de los pastos. En: Burkart, A. (ed.), pp 1-551. Flora Ilustrada de Entre Ríos (Argentina). Colección Científica del I.N.T.A., Buenos Aires, Argentina. 551 p. [ Links ]
5. Cabrera, A.L., J. Camara Hernández, J.A. Caro, G. Covas, H.A. Fabris, J.H. Hunziker, E.G. Nicora, Z. Rúgolo, E. Sánchez y M.A. Torres (1970). Parte I: Gramíneas. En: Cabrera, A.L. (ed.), 1-624. Flora de la Provincia de Buenos Aires. Colección Científica del I.N.T.A., Buenos Aires, Argentina. 624 p. [ Links ]
6. Cavagnaro, J.B. y S.O. Trione (2007). Physiological, morphological and biochemical responses to shade of Trichloris crinita, a forage grass from the arid zone of Argentina. Journal of Arid Environments 68: 337-347. [ Links ]
7. D´Ambrogio de Argüeso, A. (1986). Manual de técnicas en histología vegetal. Editorial Hemisferio Sur, Buenos Aires. 83 p. [ Links ]
8. Ellis, R.P. (1976). A procedure for standaridizing comparative leaf anatomy in the Poaceae. I. The leaf blade as viewed in transverse section. Bothalia 12: 65-109. [ Links ]
9. Ellis, R.P. (1979). A procedure for standaridizing comparative leaf anatomy in the Poaceae. II. The epidermis as seen in surface view. Bothalia 12: 641-671. [ Links ]
10. Giorgetti, H., O.A. Montenegro, G. Rodríguez, C.A. Busso, T. Montani, M.A. Burgos, A.C. Flemmer, M.B. Toribio y S.S. Horvitz (1997). The comparative influence of past management and rainfall on range herbaceous standing crop in east-central Argentina: 14 years of observations. Journal of Arid Environments 36: 623- 637. [ Links ]
11. Lindström, L.I., M.B. Mujica y R.M. Bóo (1998). A key to identify perennial grasses in central Argentina based on microhistological characteristics. Canadian Journal of Botany 76: 1467-1475. [ Links ]
12. Liphschitz, N. y Y. Waisel (1974). Existence of salt glands in various genera of the Gramineae. New Phytologist 73: 507-513. [ Links ]
13. Madella, M., A. Alexandre y T. Ball (2005). International code for phytolith nomenclature 1.0. Annals of Botany 96: 253-260. [ Links ]
14. Nicora, E.G. y Z.E. Rúgolo de Agrasar (1987). Los géneros de Gramíneas de América Austral. Editorial Hemisferio Sur, Buenos Aires. 611 p. [ Links ]
15. Parodi, L. (1950). Las Gramíneas tóxicas para el ganado en la República Argentina. Revista Argentina de Agronomía 17: 163- 229. [ Links ]
16. Peterson, P.M., J.T. Columbus y S.J. Pennington (2007). Classification and biogeography of New Wordl grasses: Chloridoideae. Aliso 23: 580-594. [ Links ]
17. Ramos, J.C., M.G. Perreta, J.C. Tivano y A.C. Vegetti (2004). Variaciones anatómicas en la raíz de Pappophorum philippianum inducidas por la salinidad. Phyton, International Journal of Experimental Botany 73: 103-109. [ Links ]














