Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.79 no.2 Vicente López jul./dic. 2010
ARTÍCULOS ORIGINALES
Evaluación de métodos de cuantificación de proteínas en Tetranychus urticae para su uso potencial en la detección de resistencia a plaguicidas
Assessment of protein quantification methods in Tetranychus urticae, as a potential tool for resistance detection to pesticides
Cerna1 E, Y Ochoa2, R Mendoza1, MH Badii3, G Gallegos1, J Landeros1
1 Universidad Autónoma Agraria Antonio Narro. Departamento de Parasitología. Buenavista, Saltillo, Coahuila, México. C.P. 25315.
2 Universidad Autónoma de Aguascalientes, Centro de Ciencias Agropecuarias, Departamento de Fitotecnia, Posta Zootécnica, Jesús María, Aguascalientes, México C.P. 20900.
3 Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León A. Postal 391 San Nicolás de los Garza, Nuevo León, México C.P. 66450.
Address Correspondence to: Dra. Yisa María Ochoa Fuentes. Universidad Autónoma de Aguascalientes. Avenida Universidad No 940. Col. Ciudad Universitaria C.P. 20100. Aguascalientes, Aguascalientes, México. Tel.: (449) 965-00-62. e-mail: yisa8a@yahoo.com; ymochoa@correo.uaa.mx
Recibido - Received 29.IV.2008.
Aceptado - Accepted 3.VIII.2010.
Resumen. Se determinó un método de cuantificación de proteínas, como un método potencial para determinar resistencia a plaguicidas, para la especie Tetranychus urticae Koch. Éste es un ácaro fitófago de una gran variedad de plantas tanto cultivadas como silvestres. Para el desarrollo del experimento se utilizó una línea susceptible de T. urticae, así como tres líneas de campo. La cuantificación de proteínas se realizó por colorimetría, a través del Kit-II de Bio-Rad, utilizando Albúmina Sérica Bovina (BSA) como proteína de referencia. Para la preparación de las soluciones homogéneas se manejaron series de 10, 30, 50, 100, 300, 500 y 800 ácaros, cada una con 30 repeticiones. La linealidad obtenida para la curva estándar en cada uno de los diferentes métodos mostró valores de r2 entre 0,877 a 0,985. El mejor método de cuantificación fue el de Bradford modificado por Brogdon, que mostró los valores de proteína más altos para las series de 10, 30 y 50 ácaros, además de ser rápido y versátil. La línea de ácaro susceptible (de laboratorio) presentó 0,2148 μg de proteína por cada μg de peso del ácaro. Al mismo tiempo, las de campo de fresa, rosal variedad Royalty y Rafaela mostraron valores de 0,2059, 0,1703 y 0,1550 μg de proteína por cada μg de peso del ácaro, respectivamente. Hembras adultas de T. urticae mostraron una mayor cantidad de proteína a los ocho días de edad.
Palabras clave: Arañita de dos manchas; Linealidad; Absorbancia; Colorimetría; Proteína.
Abstract. Protein assays were conducted on Tetranychus urticae Koch, as potential resistance detection tools to plaguicides. This is a phytophagous mite that feeds on a large variety of plants. Experiments were carried out using a pesticide susceptible and three field crop strains of T. urticae. Protein was measured by colorimetric assays, using Kit-II from Bio-Rad, with bovine serum albumin (BSA) as standard. Homogenates were prepared using 10, 30, 50, 100, 300, 500 and 800 mites, with 30 replicates each. Linearity was obtained for the standard curve of the different methods, and r2 values ranged from 0.877 to 0.985. The Bradford method modified by Brogdon gave the highest protein values for homogenates of 10, 30 and 50 mites. The susceptible laboratory strain showed 0.2148 μg protein per μg weight of mite; values showed by the field crop strains were 0.2059, 0.1703 and 0.1550 for the strawberry, Royalty rose and Rafaela rose mites, respectively. Adult females of T. urticae showed a higher amount of protein when they were 8 days old.
Keywords: Two-spotted spider mite; Linearity; Absorbance; Colorimetry; Protein.
INTRODUCCIÓN
El registro de la resistencia a un plaguicida es esencial en su manejo. Debido a esto, se han desarrollado metodologías para detectar este fenómeno (Dennehy y Granett, 1984): por ej., pruebas de concentraciones múltiples, expresadas en términos de concentración letal media (CL50); perfiles de ADN que muestran a los genes responsables de la resistencia a plaguicidas (Keiding, 1986), y pruebas bioquímicas que determinan la actividad y cantidad de las enzimas responsables de este fenómeno. Éstas últimas son las que muestran una mayor explicación del origen y de las fuentes de resistencia a insecticidas y acaricidas. El principio básico consiste en determinar el contenido de proteínas que presentan las muestras (Hemingway, 1986). La determinación y cuantificación de proteínas contenidas en tejidos y fluidos puede ser usada como referencia para cuantificar diversos componentes en el sistema biológico (Lee et al., 2003). Al respecto, Chareonviriyaphap et al. (1999) encontraron que la cantidad de proteína y la actividad de las enzimas detoxificativas estuvieron en una relación de 0,554 mg/ mL de proteína en el mosquito Anopheles albimanus; en este caso, se produjeron actividades enzimáticas en α-esterasas de 0,585, y en β-esterasas de 0,711 moles/min/mg de proteína, respectivamente. Charoenviriyaphap et al. (2003) informaron que una línea susceptible del mosquito Anopheles minimus (proveniente del departamento de salud de Tailandia) presentó un contenido de proteína de 0,781 mg/mL por mosquito, con una actividad enzimática para oxidasas de 4,255 mMol/ min/mg de proteína. Sin embargo, existe una gran variedad de métodos para determinar la cantidad de proteína presente en tejidos y fluidos: los métodos de Lowry (1951), Biuret (Layne, 1957) y Bradford (1976). Éste último es el más estable y utilizado en los estudios de determinación de proteína en insectos tales como A. albimanus (Brogdon, 1984a) y Plutella xylostella (Maa y Liao, 2000). Sin embargo, este tipo de insectos son de tamaño medio, y se puede utilizar hasta un individuo por muestra, para cuantificar la cantidad de proteína y su actividad enzimática. Se obtiene lo contrario con especies de tamaño pequeño como son los ácaros, cuyo número de individuos puede rebasar en ocasiones el centenar de ejemplares por muestra. Por tal motivo, el presente estudio tiene como objetivos (1) determinar un método de cuantificación de proteína más sensible, que permita trabajar con muestras pequeñas de ácaros, y (2) relacionar peso, edad y presión de selección de los ácaros con el contenido de proteínas.
MATERIALES Y MÉTODOS
La cuantificación de proteínas se realizó por colorimetría, a través del Kit-II de Bio-Rad (Azul Brillante de Comassie G-250 como colorante). Se utilizó la Albúmina Serica Bovina (BSA) como proteína de referencia. Las lecturas de absorbancia se realizaron mediante un lector de microplacas Stat-Fax 2100 (Awareness Technology, Palm City, Florida); se utilizaron pipetas multicanales Rainin (Rainin Instrument Co. Inc., Emervylle, California) y microplacas de 96 pozos de fondo plano (Bio-Rad México).
Se utilizó la BSA como proteína de referencia para la formación de una curva estándar para cada método de determinación de proteína. Además se utilizó el buffer de fosfato (pH: 7,2) como diluyente. Para trazar la curva de referencia se utilizaron cinco concentraciones de BSA para cada método que variaron de 0,005 a 0,7 mg/mL de proteína, según el rango lineal de cada método. Obtenidas las curvas de referencia con SBA, se procedió a correr las pruebas con la arañita de dos manchas. Para la preparación de soluciones homogéneas se utilizó el mismo diluyente (buffer fosfato de potasio). Estas soluciones consistieron en siete concentraciones diferentes en relación al número de ácaros (10, 30, 50, 100, 300, 500 y 800 ácaros), cada una con 30 repeticiones. Cada repetición se colocó en tubos Eppendorf de 1,5 mL agregándole 100 µL del solvente y triturándolos con un homogenizador de tejidos; se aforó a 1 mL con la adición de 900 µL diluyente, según correspondiera.
Los métodos que se compararon fueron: Método de Bradford (1976) para muestras con alto contenido de proteína (Bradford-Alto); Método de Bradford (1976) para muestras con bajo contenido de proteína (Bradford-Bajo); Método de Bradford modificado por Brogdon-Dickinson (1983), y Método de Bradford modificado por Brogdon (1984a). Para el método de Bradford-Alto, se tomaron 10 µL de BSA para formar la curva estándar, ó 10 µL de la solución homogénea para realizar la cuantificación. Estos se colocaron por triplicado en una placa, se les agregó 200 µL de colorante diluido (1:4 v/v colorante: agua); se mezcló a 120 vibraciones/minuto y se obtuvo la lectura a T5 con filtro de 595 nm. En el caso del método de Bradford-Bajo se cambiaron la cantidad de BSA y de la solución homogénea a 160 µL y la cantidad del colorante a 40µL. Para el método de Brogdon-Dickinson, se tomaron 100 µL de BSA o de la solución homogénea. La muestra se colocó por triplicado en la placa, se agregaron 200 µL de colorante diluido (1:4 colorante: agua), se mezcló a 120 vibraciones/minuto y se obtuvo la lectura a T10 con filtro de 595 nm. Por último, para el método de Brogdon se usaron 20 µL de BSA o de la solución homogénea, se colocó por triplicado en la placa, se agregaron 80 µL de buffer de fosfato, y 200 µL de colorante diluido (1:4 colorante: agua), mezclándose la suspensión a 120 vibraciones/ minuto. La lectura se efectuó a T0 con filtro de 630 nm.
Para la comparación de los diferentes métodos de cuantificación de proteínas se utilizó la línea susceptible a plaguicidas de T. urticae (L-Ns), proveniente de la Universidad Autónoma Agraria Antonio Narro. Una vez obtenidos los resultados de la comparación de los métodos, y seleccionado uno de éstos, se procedió a determinar la relación entre el peso de la muestra, la cantidad de proteína y la reproducibilidad del procedimiento a intervalos de siete días. Además, se determinó la edad más adecuada para la cuantificación de proteína. Cada serie de evaluaciones estaba formada por 30 ácaros hembra (con 30 repeticiones), y las edades evaluadas fueron de 2, 4, 8 y 16 días. Por último, se determinó y comparó el contenido de proteína de las tres líneas de campo resistentes a plaguicidas. De las tres líneas de campo utilizadas en este estudio, una de ellas es proveniente del cultivo (1) de fresa variedad Suit Charly del estado de Guanajuato, otra (2) de rosal variedad Royalty del Estado de México, y por último una línea (3) de rosal variedad Rafaela proveniente de Coahuila.
El análisis estadístico para el coeficiente de determinación (r2) de cada uno de los métodos fue una prueba de X2. Asimismo, estos coeficientes se compararon mediante una prueba de"z". Por otro lado, se comparó la cantidad de proteína con el peso, edad, reproductibilidad del método y la presión de selección de los ácaros mediante un análisis de varianza completamente al azar. Finalmente, se realizó una correlación entre el peso y la cantidad de proteína. Para todos los análisis se utilizó el paquete STATISTICA 6.0.
RESULTADOS
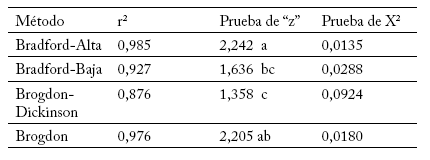
En la Tabla 1 se registran los resultados obtenidos para la obtención de la curva estándar, al utilizar BSA para cada uno de los métodos en estudio. En todos los casos se presentó un r2 adecuado, lo cual indica alta linealidad. El método de Brogdon-Dickinson fue el que presentó el valor más bajo (r2= 0,876), mientras que el valor más alto se obtuvo con el método de Bradford-Alto (r2= 0,985). Al analizar los coeficientes de determinación de los métodos de cuantificación de proteína mediante la prueba de "z" por el método de comparación múltiple de Tukey (Tabla 1), se formaron tres grupos en relación a los valores transformados de r2. El método de Bradford-Alta, con valores de r2: 0,985, y el método de Brogdon, con una r2: 0,976, registraron los mejores resultados.
Tabla 1. Coeficientes de determinación de la curva estándar para cada uno de los métodos de determinación de proteína. Números seguidos por la misma letra no son significativamente diferentes (p≥0,05).
Table 1. Determination coefficients of the standard curve for each of the protein determination methods. Numbers followed by the same letter are not statistically different (p≥0.05).
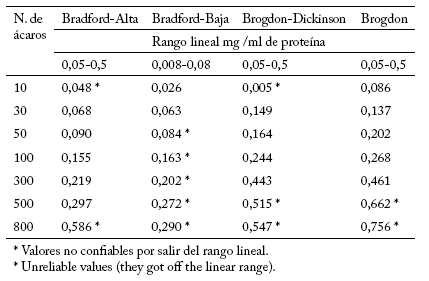
En relación al contenido de proteína de las soluciones homogéneas de la línea susceptible de T. urticae, comparando todos los métodos de cuantificación (Tabla 2), se puede observar que en todos los casos se presentaron valores no confiables por estar fuera del rango lineal; sin embargo, el método más adecuado de acuerdo a las condiciones de nuestro estudio es el método de Brogdon, por presentar buena sensibilidad a las muestras pequeñas en relación al número de ácaros, mostrando los valores de proteína más altos para las muestras de 10, 30 y 50 ácaros en comparación con los otros métodos, además de la rapidez y versatilidad.
Tabla 2. Concentración de proteína de soluciones homogéneas en la línea susceptible de Tetranychus urticae Koch en diluyente buffer de fosfato (pH: 7,2).
Table 2. Protein concentration of homogeneous solutions in the susceptible line of Tetranychus urticae Koch in phosphate buffer (pH: 7.2).
En la Tabla 3 podemos observar que el método de Brogdon-Dickinson presentó los valores más altos de absorbancia; el método de Brogdon modificado registró altos valores de absorbancia para las muestras de 300, 500 y 800 ácaros. Asimismo, los métodos que presentaron las lecturas más bajas fueron los métodos de Bradford alto y bajo. Los valores de absorbancia para trasformarlos en contenido de proteína están en relación a la curva estándar de cada método. Esto indica que se puede cometer el error que a mayor absorbancia, mayor sea el contenido de proteína.
Tabla 3. Absorbancias de soluciones homogéneas de la línea susceptible de Tetranychus urticae Koch en diluyente buffer de fosfato (pH: 7,2). Cada valor es el promedio ± 1E.E.
Table 3. Absorbance of homogeneous solutions in the susceptible line of Tetranychus urticae Koch in phosphate buffer (pH: 7.2). Each value is the mean ± 1S.E.

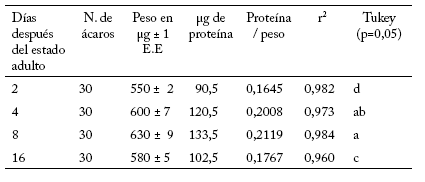
Una vez que se determinó el método más adecuado (Brogdon), se buscó la relación entre el peso de la muestra y la cantidad de proteína. Al respecto, el análisis de regresión reveló una alta correlación entre el peso y el contenido de proteína de hembras adultas de diferentes edades de T. urticae, con una r2 que varió de 0,960 a 0,984 (Tabla 4). El contenido de proteína fue mayor en hembras adultas con 8 días de edad (0,2119 μg de proteína por cada μg de peso), lo que indica que esta edad es la más adecuada para llevar a cabo este tipo de experimentos.
Tabla 4. Relación entre el peso de la muestra y la cantidad de proteína para diferentes edades de la línea susceptible (L-Ns) de Tetranychus urticae Koch. Números de r2 seguidos por la misma letra no son significativamente diferentes (p=0,05).
Table 4. Relationship between the sample weight and the protein amount for different ages of the susceptible strain (L-Ns) of Tetranychus urticae Koch. r2 numbers followed by the same letter are not statistically different (p=0.05).
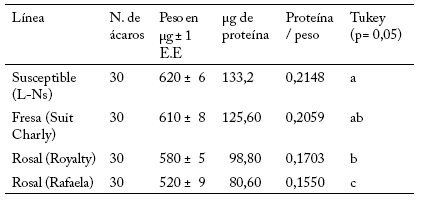
Al relacionar la cantidad de proteína a intervalos de siete días, para evaluar la confiabilidad del método, se observó que la línea susceptible de T. urticae se mantuvo estable en el contenido de proteína (Tabla 5). Esto mostró que los niveles de proteína son iguales para todas las fechas de muestreo, con un promedio de 0,21 μg de proteína. Esto indica que el método de Brogdon utilizado es confiable. Las líneas susceptible, línea de fresa, en rosal variedad royalty y en rosal variedad Rafaela de T. urticae tuvieron 0,2148; 0,2059; 0,1703 y 0,1550 μg de proteína por cada μg de peso, respectivamente (Tabla 6). Esto indica que las poblaciones sujetas a presión de selección por algún insecticida muestran tamaños más pequeños, y por lo tanto una menor cantidad de proteína.
Tabla 5. Comparación de los niveles de proteína para la línea susceptible (L-Ns) de Tetranychus urticae Koch a intervalos de siete días. Números seguidos por la misma letra no son significativamente diferentes (p≥0,05).
Table 5. Comparison of protein levels for the susceptible line (L-Ns) of Tetranychus urticae Koch at seven-day intervals. Numbers followed by the same letter are not statistically different (p≥0.05).
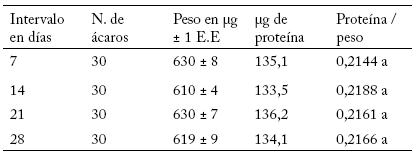
Tabla 6. Regresión entre el peso de la muestra y la cantidad de proteína para cuatro líneas de Tetranychus urticae Koch. Números de la relación proteína/peso seguidos por la misma letra no son significativamente diferentes ((p≥0,05).
Table 6. Regression analysis between sample weight and protein quantity for four Tetranychus urticae Koch lines. Numbers of the relationship protein/ weight followed by the same letter are not statistically different (p≥0.05).
DISCUSIÓN
El valor más alto de r2 fue obtenido con el método de Bradford para muestras con alto contenido de proteína (r2=0,985), y el valor más bajo de r2 se presentó con el método de Brogdon-Dickinson (r2=0,876). Hartree (1972) mencionó las ventajas del método de Bradford (1976) y sus modificaciones sobre el método de Lowry (1951). Estas ventajas incluyeron una alta estabilidad, sensibilidad y una respuesta altamente lineal, encontrando valores de coeficientes de determinación de 0,994, similares a los reportados en este trabajo.
En relación a la comparación de los diferentes métodos en estudio, el mejor método fue el de Brogdon debido a que registró las lecturas más altas de proteína en las muestras con bajo número de ácaros. Por lo tanto, presentó una mayor sensibilidad en relación al número de individuos por muestra. Al respecto, Stoscheck (1990) mencionó que el criterio para seleccionar un método de cuantificación de proteínas está basado usualmente en la conveniencia, el rango de sensibilidad, la cantidad de muestra necesaria para hacer las pruebas, y los detalles del procedimiento. Estos parámetros se cumplen al emplear esta metodología.
Por otro lado, el análisis de regresión reveló una alta correlación al relacionar el peso de la muestra y la cantidad de proteína. Se determinó que la edad más adecuada para cuantificación de proteínas es entre 4 y 8 días después de haber alcanzado el estado adulto, siendo menores los valores para las edades 2 y 16 días. En ese sentido, Champ y Dyte (1976) mencionaron que algunas características inherentes a la biología de los organismos (como fase de desarrollo, edad, peso y sexo), influyen definitivamente sobre la respuesta de los mismos. Brogdon (1984b), trabajando con el mosquito A. albimanus determinó que hembras de 3 días de edad presentaron los niveles más altos de proteína (140 µg de proteina/ mosquito), bajando los mismos drásticamente a los 11 días de edad (40 µg de proteina/mosquito). Resultados similares fueron reportados por Lang et al. (1965). Estos autores mencionaron que la cantidad de proteína se mantuvo estable entre las edades de 3 y 6 días en adultos de Aedes aegypti. En relación a la alta correlación obtenida entre el peso y la cantidad de proteína, Brogdon (1984a) mencionó que dichos valores se pueden utilizar como referencia para comparar organismos de otras líneas.
La comparación del peso y la cantidad de proteína de las cuatro líneas de T. urticae indica que el peso de los individuos (de las cuatro líneas) está influenciado por el tipo de sustrato alimenticio. Al respecto, Mothes y Seits (1981) mencionaron que la arañita de dos manchas, a diferencia de otros organismos fitófagos, es muy selectiva para alimentarse. La misma ingiere solamente pequeños compuestos subcelulares.
Algunas de las especies huésped de estos ácaros pueden generar metabolitos secundarios que dañan al ácaro, alterando su sistema fisiológico (Mullin y Croft, 1983). Jeppson et al. (1975) mencionaron que el mejor sustrato para el desarrollo de ácaros en laboratorio es el frijol Phaseolus vulgaris var. Lima, tanto por su contenido de nutrientes como por la facilidad y el tamaño de las plantas. Otro aspecto importante en relación a las diferencias de proteínas entre las líneas susceptible, de fresas y rosal, está en relación a que estas tres líneas de campo estuvieron sujetas a presión de selección por plaguicidas. Entonces, no se descarta la posibilidad que presenten variantes genéticas en cuanto al peso y tamaño, lo que está relacionado con el desarrollo de mecanismos de resistencia. Georghiou y Taylor (1977) citaron que el desarrollo de resistencia en poblaciones de campo (como resultado del proceso de evolución) está dado por factores genéticos, biológicos y de manejo, afectando ciclos biológicos, reproductivos, y el peso y tamaño de los individuos. Del mismo modo, Charoenviriyaphap et al. (2003) reportaron una disminución en el contenido de proteína a medida que colonias de líneas susceptibles del mosquito A. minimus estuvieron sujetas a presión de selección con deltametrina; estos autores informaron el contenido de proteína de la F0 fue de 0,7818 mg/mL por mosquito, reduciéndose hasta 0,6885 mg/mL de proteína en la F14. Por lo tanto, la determinación de un método de cuantificación de proteína estable y sensible (menor número de insectos por muestra) es crítica en los estudios realizados en base a pruebas bioquímicas en insectos de tamaño pequeño. Esto se debe a que estas pruebas determinan la resistencia o el efecto de los insecticidas en el desarrollo y comportamiento de los insectos, tomando como base la cantidad de muestra de insectos en base a proteína.
REFERENCIAS
1. Bradford, M. M (1976). A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principles of protein-dye binding. Analytical Biochemistry 72: 248-254. [ Links ]
2. Brogdon, W.G. (1984a). Mosquito protein microassay-I, protein determination from small portions of single-mosquito homogenates. Comp. Biochemistry and Physiology 79B: 457-460. [ Links ]
3. Brogdon, W.G. (1984b). Mosquito protein microassay-II, modification for potential field use. Comp. Biochemistry and Physiology 79B: 457-460. [ Links ]
4, Brogdon, W.G. y C.M. Dickinson (1983). A microassay system for measuring esterase activity and protein concentration in small samples and in high-pressure liquid chromatography evaluate fractions. Analytical Biochemistry 131: 499-503. [ Links ]
5. Chareonviriyaphapa, T., C. F. Golendab., D.R. Roberts y R.G. Andrec (1999). Identification of elevated esterase activity in a pyrethroid-resistant population of Anopheles albimanus Wiedemann. Science Asia 25:153-156. [ Links ]
6. Chareonviriyaphap, T., P. Rongnoparut., P. Chantarumporn y M.J. Bangs (2003). Biochemical detection of pyrethroid resistance mechanisms in Anopheles minimus in Thailand. Journal of Vector Ecology 28: 108-116. [ Links ]
7. Champ, B.R. y C.E Dyte (1976). Informe de la prospección mundial de la FAO sobre la susceptibilidad a insecticidas de las plagas de granos almacenados. Colección FAO; Producción y Protección Vegetal, N. 5. 63 p. [ Links ]
8. Dennehy, T.J. y J. Granett (1984). Monitoring dicofol-resistance spider mites (Acari: Tetranychidae) in California cotton. Journal of Economic Entomology 77: 1386-1392. [ Links ]
9. Georghiou, G.P. y C.E. Taylor (1977). Genetic and biological influences in the evolution of insecticide resistance. Journal of Economic Entomology 70: 319-323. [ Links ]
10. Hartree, E.F. (1972). Determination of protein: a modification of the Lowry method that gives a linear photometric response. Analytical Biochemistry 48: 422-427. [ Links ]
11. Jeppson, L.K., H.M. Keifer y E.N. Baker (1975). Mites injurius to economic plants. University of California Press. 614 p. [ Links ]
12. Keiding, J. (1986). Prediction or resistance risk assessment. In: Pesticide Resistance: Strategies and Tactics for Management. National Academy Press. Washington D.C. pp: 279-297. [ Links ]
13. Lang, C.A., H.Y. Lau y D.J. Jefferson (1965). Protein and nucleic acid changes during growth and aging in the mosquito. Biochemistry Journal 95: 372-377. [ Links ]
14. Layne, E. (1957). Spectrophotometric and turbidimetric methods for measuring proteins. Methods in Enzymology 10: 447-455. [ Links ]
15. Lee, S.H., J.K. Suh y M. Li (2003). Determination of bovine serum albumin by its enhancement effect of Nile blue flourescence. Bulletin of the Korean Chemical Society 24: 45-48. [ Links ]
16. Lowry, O.H., N.J. Rosborough, A.L. Farr y R.J. Randall (1951). Protein measurement with the folin phenol reagent. The Journal of Biological Chemistry 193: 265-275. [ Links ]
17. Maa, W.C.J. y S.C. Liao (2000). Culture-dependent variation in esterase isozymes and malathion susceptibility of diamondback moth Plutella xylostella L. Zoological studies 39: 375-386. [ Links ]
18. Mothes, U. y K.A. Seitz (1981). Functional microscopic anatomy of the digestive system of Tetranychus urticae (Acari: Tetranychidae). Acarología 22: 257-270. [ Links ]
19. Mullin, C.A. y B.A. Croft (1983). Host-related alterations of detoxications enzymes in Tetranychus urticae (Acari: Tetranychidae). Environmental Entomology 12: 1278-1281. [ Links ]
20. STATISTICA 6.0 (1998). For windows (Computer program manual). StatSoft, Inc. [ Links ]
21. Stoscheck, C.M. (1990). Quantitation of protein. Methods in Enzymology 182: 50-69. [ Links ]














